Похожие презентации:
Галогены
1.
ПЕРЕЧЕНЬ РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫа) основная
• 1. Ахметов, Н.С. Общая и неорганическая химия / Н.С.
Ахметов. – 5-е изд., перераб и доп. – М.: Высшая школа,
2003. – 744 с.
• 2. Карапетьянц, М.Х. Общая и неорганическая химия: учеб.
для вузов / М.Х. Карапетьянц, С.И.Дракин. – 4-е изд.,
стереотип. – М.: Химия, 2000. – 592 с.
• 3. Неорганическая химия. В 3-х т. Под ред. Ю.Д. Третьякова.
М.: Академия, Т.1-2004, 240с.; Т.2-2004, 368с.; Т.3-2007, 352 с.
• 4.
Ю.Д.Третьяков,
Л.И.Мартыненко,
А.Н.Григорьев,
А.Ю.Цивадзе. Неорганическая химия. Химия элементов. В 2-х
томах. М.: Академкнига, 2007. 1216 с.
2.
• 5. Шрайвер, Д. Неорганическая химия: учеб. в 2 т. /Д. Шрайвер, П.Эткинс; пер. с англ. – М.: Мир, 2004.
– Т.2. – 680 с.
• 7. Угай, Я.А. Общая и неорганическая химия: учеб.
для вузов / Я.А. Угай. – 3-е изд., перераб и доп. – М:
Высшая школа, 2004. – 528 с.
• 8. Суворов, А.В. Общая химия / А.В. Суворов,
А.Б.Никольский. – СПб: Химия, 1997. – 624 с.
• 9. Волков, А.И. Большой химический справочник /
А.И. Волков, И.М.Жарский. – Минск: Современная
школа, 2005. – 608 с.
3.
• 10. Малашонок И.Е., Курило И.И., Хмылко Л.И.:«Свойства p-элементов V и VI групп Периодической
системы Д.И. Менделеева» по дисциплине
«Неорганическая химия» для студентов химикотехнологических специальностей. Минск: БГТУ,
2013. -124с.
• 11. Арэхава С.Я., Ашуйка В.А. Неарганічная хімія.
Метадычныя ўказанні для самастойнай работы.
Мінск БДТУ. 1999. -19 с.
4.
б) дополнительная• 1.Реми, Г. Курс неорганической химии: в 2 т. / Г. Реми; пер. с нем. А.И.Григорьева. –
М.: Мир, 1972. – Т.1. – 824 с. – Т.2. – 1974. – 775 с.
• 2. Реми, Г. Курс неорганической химии: в 2 т. / Г. Реми; пер. с нем. А.И.Григорьева. –
М.: Мир, 1974. – Т.2. – 775 с.
• 3. Хьюи, Дж. Неорганическая химия. Строение вещества и реакционная способность /
Дж.Хьюи. – М.: Химия, 1987. – 696 с.
• 4. Общая химия в формулах, определениях, схемах / И.Е.Шиманович [и др.]; ред.
В.Ф.Тикавый. – Мн.: Універсітэцкае, 1996. – 528 с.
• 5. Воробьев, А.Ф. Общая и неорганическая химия: учебник для вузов по
направлениям и специальностям химико-технологического профиля в 2 т. / А.Ф.
Воробьев [и др.]. – М.: Академкнига, 2007. – Т.2: Химические свойства
неорганических веществ. – 543 с.
• 6. Пиментел, Дж. Возможности химии сегодня и завтра / Дж. Пиментел, Дж. Кунрод. –
М.: Мир, 1992. – 288 с.
5.
Галогеныэлектронное строение
• 9F: 1s22s22р5;
• 17Cl: 1s22s22р63s23р5;
• 35Br: 1s22s22р63s23р63d104s24р5;
• 53I: 1s22s22р63s23р63d104s24р64d105s25р5
• …ns2np5
6.
Основные характеристики р-элементов VIIA группыF
Cl
Br
I
0,071
0,099
0,114
0,133
Энергия ионизации 1681,0
I1, кДж/моль
5
1251,19
1139,86
1008,40
324,538
295,149
2,9
2,6
–1, +1, +3,
+5, +7
–1, +1, +3,
+5, +7
Ковалентный
радиус атома, нм
Сродство к
328,16
электрону Ее_,
348,575
6
кДж/моль
Электроотрицатель
4,0
3,1
ность (по шкале
Полинга)
Характерные
–1, +1, +3,
степени
+4, +5, +6,
–1
окисления в
+7
7.
Свойства простых веществДлина связи в Г2, нм
Энергия связи в Г2,
кДж/моль
Температура
плавления, оС
Температура
кипения, оС
Стандартный
электродный
F2
Cl2
Br2
I2
0,141
0,199
0,228
0,267
158,78
242,58
192,81
151,09
–219,66
–101,5
–7,2
113,7
–188,12
(газ)
–34,04
(газ)
58,8 (ж) 184,4 (т)
2,866
1,358
1,066
0,536
8.
F2, Cl2 в соответствии с методом ВС3s
F
3d
3p
Cl
2s
2p
Cl
F
3d
Энергия
связи
F2
Cl2
Br2
I2
3p
3s
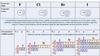
9.
F2 в соответствии с методом МОМО ( F2 )
АО ( F )
АО ( F )
разр
2p
разр
2p
св
2p
2p
2p
св
2p
2sразр
2s
св
2s
2s
10.
Межмолекулярное взаимодействие• Между молекулами галогенов в конденсированном
состоянии осуществляется слабое ван-дер-ваальсово
взаимодействие (межмолекулярное взаимодействие
между
неполярными
молекулами
называется
дисперсионным)
• С увеличением размеров атомов возрастает
поляризуемость молекул и усиливается способность
к межмолекулярному взаимодействию, что приводит к
повышению температур плавления и кипения. Для
твердого
состояния
галогенов
характерна
молекулярная кристаллическая решетка.
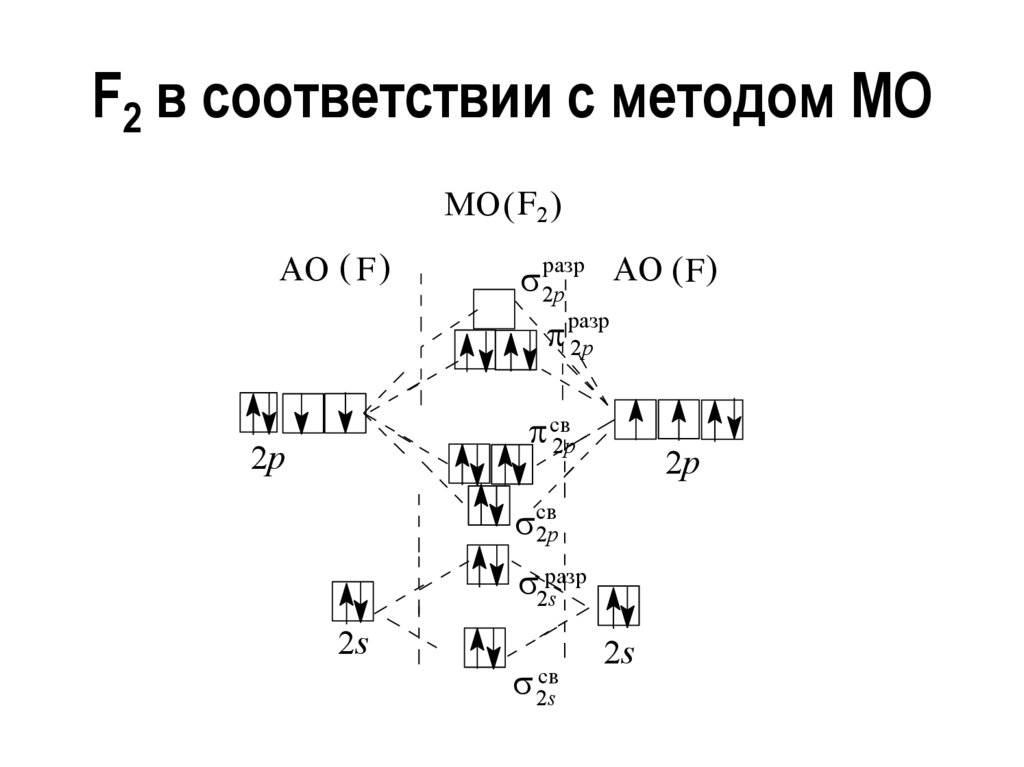
11.
Кристаллическая решетка I2 молекулярнаяВозгонка иода
12.
Нахождение в природеF: CaF2 – плавиковый шпат;
Na3[AlF6] – криолит;
Ca5(PO4)3F – фторапатит.
Cl: NaCl – поваренная (каменная) соль;
KCl ∙ NaCl – сильвинит;
KCl ∙ MgCl2 ∙ 6H2O – карналлит.
Br: в нефтяных скважинах, в морской воде, в отложениях
хлоридов (в виде бромидов NaBr, KBr, MgBr2).
I: в подземных буровых водах, в воде океанов, в морских
водорослях, в залежах
селитры (иодиды и иодаты).
13.
минералыфлюорит
галит
сильвинит
14.
получение галогенов• F2 в промышленности получают электролизом
расплава гидрофторида калия KНF2 или
фторида калия в безводной плавиковой кислоте
KНF2 = KF + НF;
• катод : 2HF + 2e– = H2 + 2F–;
• Анод 2F– – 2e– = F2
15.
Cl2 в промышленностиэлектролиз концентрированных водных растворов
хлорида натрия:
электролиз
2NaCl + 2H2O
2NaOH + H2 + Cl2 ;
• Катод
2Н2О + 2е– = Н2 + 2ОН–;
• Анод
2Сl– – 2е– = Сl2
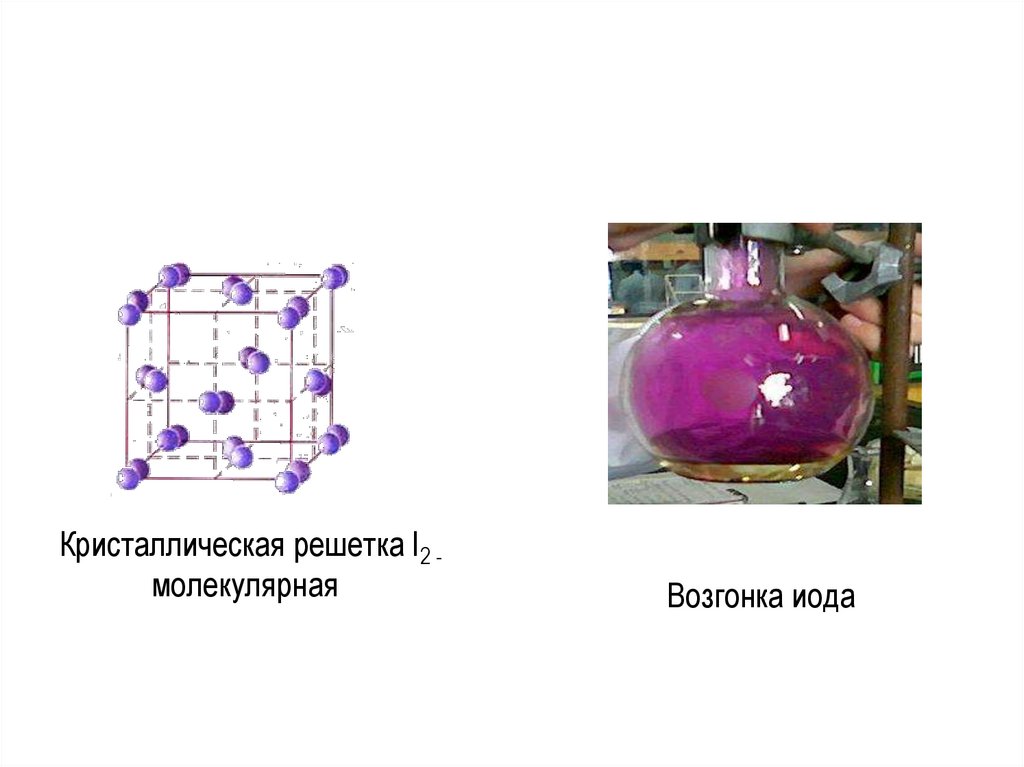
16.
Cl2 в лаборатории• Действие концентрированной соляной кислоты на
окислители (KMnO4, MnO2, PbO2 и др.)
• Разложение некоторых хлоридов
• 16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O;
• MnO4- + 8Н+ + 5е– = Mn2+ + 4Н2О, Eo = 1,51 В;
• Cl2 + 2е– = 2Сl–; Eo= 1,36 В;
• 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O;
• PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O;
• 2AuCl3 = 2Au + 3Cl2
17.
Бром и иод в промышленности• Галогены, расположенные выше в подгруппе,
вытесняют из галогенидов расположенные ниже
галогены:
• 2KBr + Cl2 = 2KCl + Br2
• 2KI + Cl2 = 2KCl + I2
• Электролиз:
• 2NaI + 2H2O электролиз 2NaOH + H2 + I2
18.
Br2 и I2 в лаборатории• K2Cr2O7 + 6KBr + 7H2SO4 = 2Cr2(SO4)3 + 4K2SO4 +
3Br2 + 7H2O;
• 8NaI + 5H2SO4(конц) = Na2SO4 + 4I2 + H2S + 4H2O;
• 4KI + 2СuSO4 = 2СuI + I2 + 2K2SO4
19.
Химические свойства галогенов• 2Na + F2 = 2NaF (на холоде);
• 2Au + 3F2 = 2AuF3
• 2P + 5F2 = 2PF5;
• 3F2 + S = SF6
• 3F2 + Xe = XeF6
• 2Fe + 3Cl2 = FeCl3
• 2P + 3Cl2(недост) = 2PCl3; 2P + 5Cl2(изб) = 2PCl5
• 2Cl2 + S = SCl4 (SCl2, S2Cl2);
• 2Аl + 3I2 = 2АlI3 (Н2О – катализатор);
• 2P + 3Br2 = 2PBr3;
• 2P + 3I2 2PI3
20.
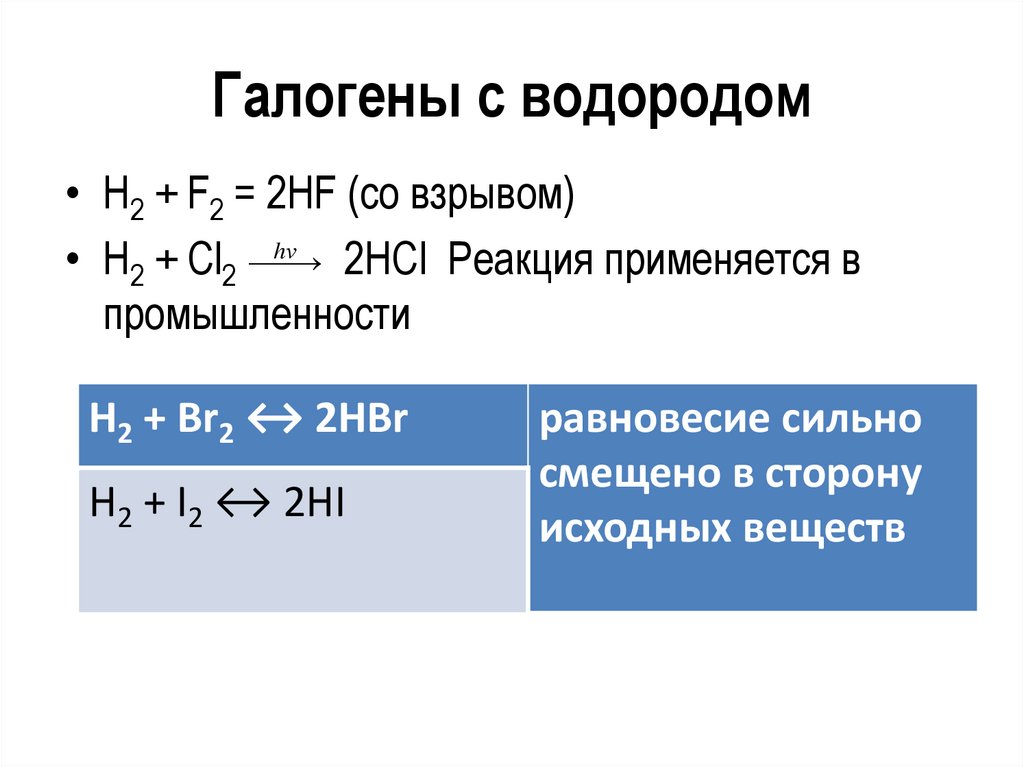
Галогены с водородом• Н2 + F2 = 2НF (со взрывом)
• Н2 + Сl2 hν 2НCl Реакция применяется в
промышленности
Н2 + Br2 ↔ 2НBr
Н2 + I2 ↔ 2НI
равновесие сильно
смещено в сторону
исходных веществ
21.
Взаимодействие с водой• (H2O) + F2 = 2HF + 0,5O2 (t > 90ºС, с водяным паром – со
взрывом);
• {2Н2О} + 4F2 = 4НF + 2ОF2↑ (при t = 0‒90ºС)
• Растворы хлора и брома в воде носят название
хлорной и бромной воды, обладают всеми свойствами
хлора и брома
• Cl2 + Н2О ⇄ НClО + НCl
• Растворимость I2 в воде можно повысить, если
добавить к ней KI:
• nI2 + KI = KI2n+1 (n = 1÷7)
22.
Взаимодействие со щелочами• 2F2 + 2NaOH(разб) = 2NaF + OF2 + H2O
• 2F2 + 4NaOH(конц) = 4NaF + O2 + 2H2O
• Сl2 + 2KОН = KСlО + KСl + Н2О
• 3Сl2 + 6KОН KСlО3 + 5KСl + 3Н2О
• C12 + Ca(OH)2 = CaOCl2 + H2O (хлорка, хлорная
известь, белильная известь)
OCl
Ca
• 6I2 + 12NaOH = 10NaI + 2NaIO3 + 6H2O
Cl
23.
Другие важные реакции• H2S + Br2 = S + 2HBr
• CH4 + Cl 2 hν CH3Cl + HCl (на свету)
• C2H4 + Cl2 = C2H4Cl2
• I2 + 10HNO3(конц) = 2HIO3 + 10NO2 + 4H2O
• I2 + AgNO3 = AgI + INO3(в эфире)
• (С6Н10 O5)n + I2 ⇄ (С6Н10 O5)n·I2
белый
Синий
24.
Особые свойства фтора• самый электроотрицательный элемент, сильный
окислитель;
• малая длина связи F–F;
• малая энергия связи в молекуле F2, сильное
отталкивание электронных пар;
• большая прочность образуемых связей;
• низкая энергия активации реакций с участием
фтора;
• SiO2 + 2F2 = Si+4F4 + O2
25.
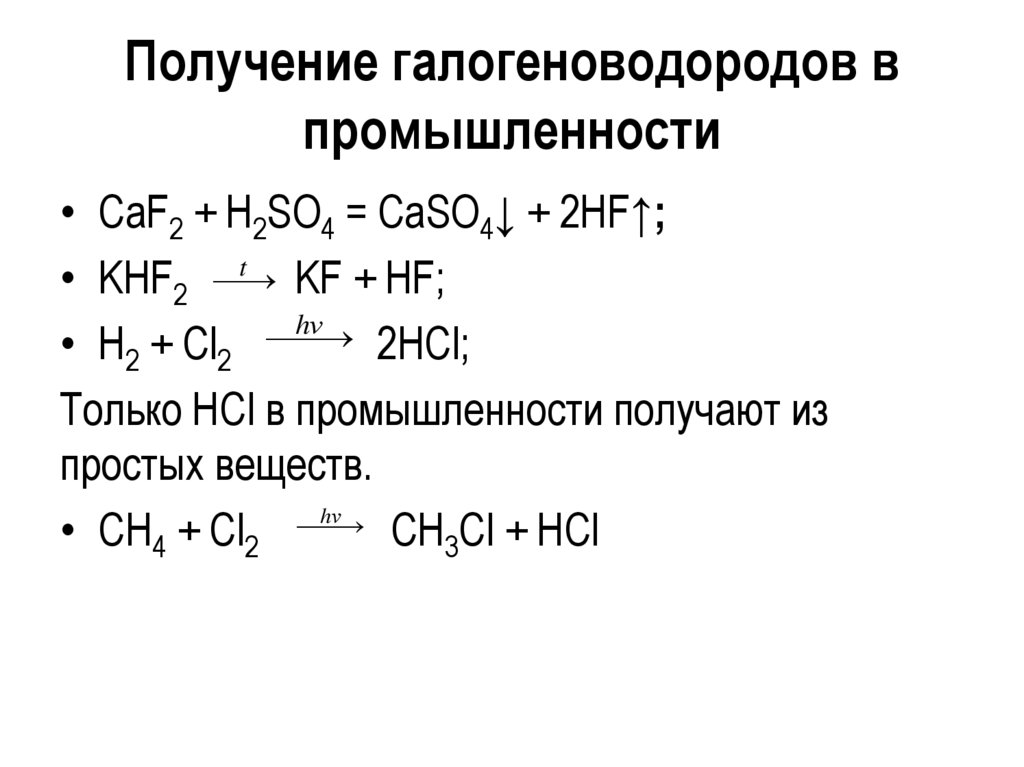
Получение галогеноводородов впромышленности
• СaF2 + H2SO4 = CaSO4↓ + 2HF↑;
t
• KHF2
KF + HF;
hν
• Н2 + Сl2 2НCl;
Только НCl в промышленности получают из
простых веществ.
hν
• CH4 + Cl2 CH3Cl + НСl
26.
HГ в лабораторииNaCl(тверд) + Н2SO4(конц)
NaНSO4 + НСl↑
2NaBr + 2H2SO4(конц)= Br2 + SO2 + Na2SO4+ 2H2O
8NaI + 5H2SO4(конц) = 4I2 + H2S + 4Na2SO4 + 4H2O
гидролиз кислотных галогенидов:
• BCl3 + 3H2O = H3BO3 + 3HCl↑
HBr и HI получают гидролизом галогенидов фосфора:
• PBr3 + 3H2O = 3HBr↑ + H3PO3
• PI3 + 3H2O = H3PO3 + 3HI
t
27.
Характеристика
HF
HCl
HBr
HI
Длина связи
H‒Г, нм
0,092
0,128
0,141
0,160
Энергия связи,
кДж/моль
565
431
304
297
Кдис в водных
растворах
6,61∙10−4
Температура
плавления, °С
–83,35
–114,17
–86,8
–50,76
Температура
кипения, °С
20
–85
–66,38
–35,55
сильные
28.
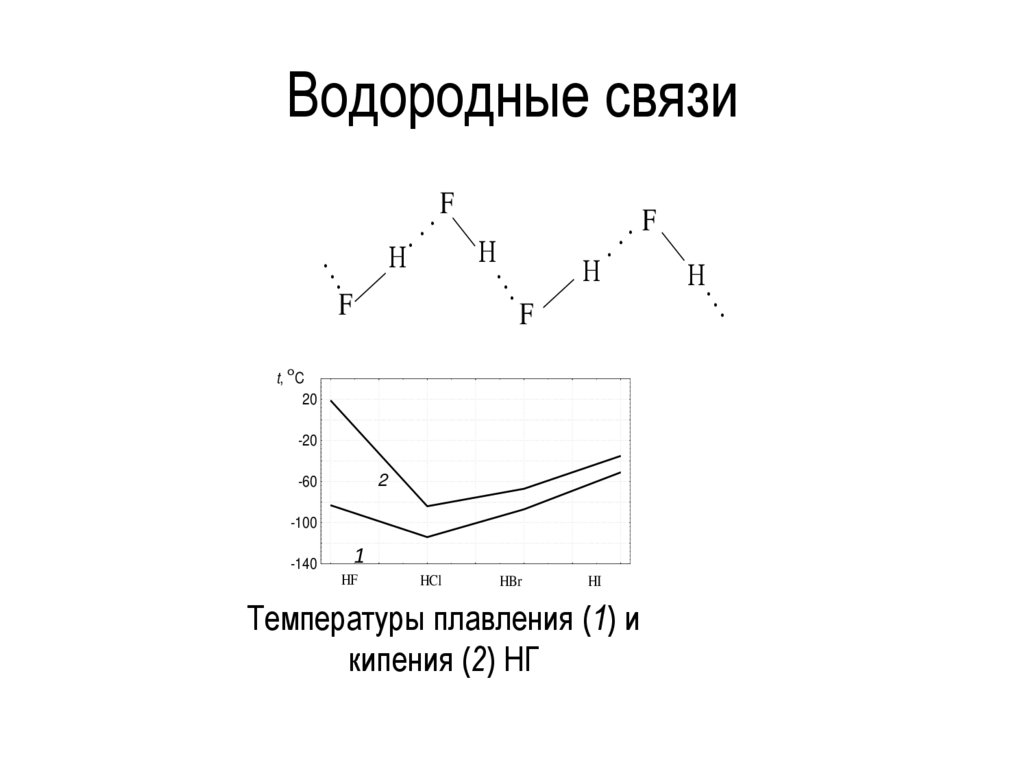
Водородные связи..
.
Н
.
.. F
F
Н
..
.
Н
.. . F
F
o
t, C
20
-20
2
-60
-100
-140
1
HF
HCl
HBr
HI
Температуры плавления (1) и
кипения (2) НГ
Н.
..
29.
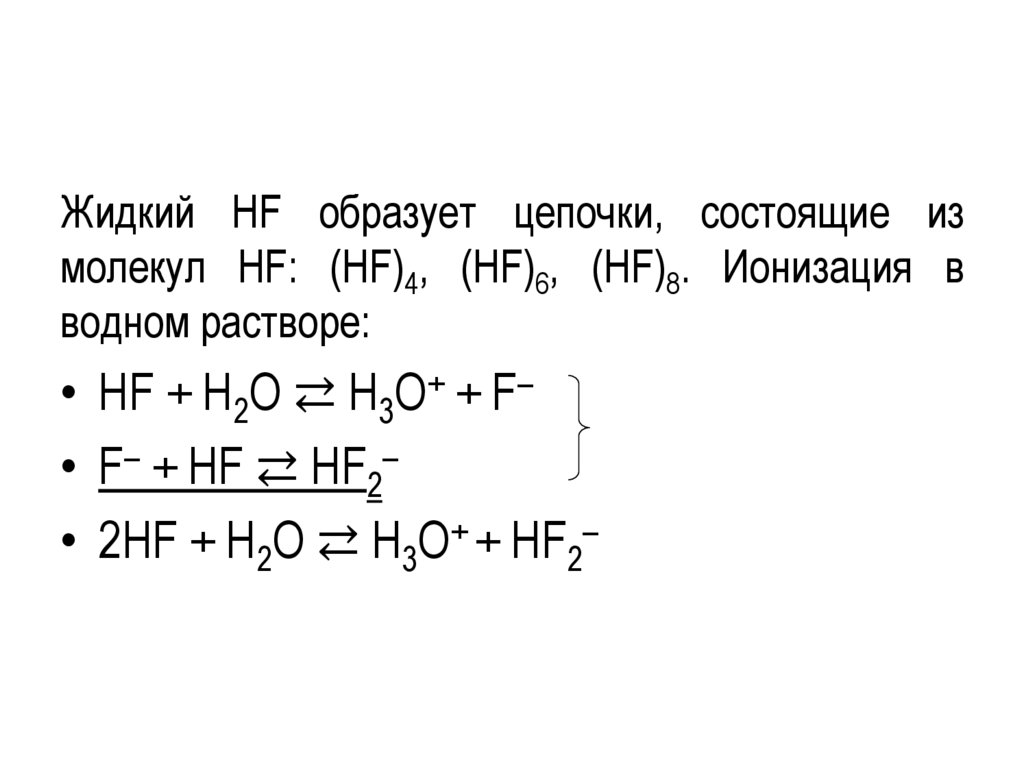
Жидкий HF образует цепочки, состоящие измолекул HF: (HF)4, (HF)6, (HF)8. Ионизация в
водном растворе:
• HF + H2O ⇄ H3O+ + F–
• F– + HF ⇄ HF2–
• 2HF + H2O ⇄ H3O+ + HF2–
30.
Свойства HFSiO2 + 4HF = SiF4 + 2H2O
(реакция травления стекла)
В избытке плавиковой кислоты образуется
гексафторокремниевая кислота:
SiF4 + 2HF = H2[SiF6]
HF хранят в сосудах из платины или полиэтилена.
В стеклянном сосуде плавиковую кислоту хранить
нельзя.
31.
процесс Дикона4HCl + O2 ⇄ 2H2O + 2Cl2
∆Hof , 298 , кДж/моль
–91,
0
–241,82
0
So298 , Дж/(моль К) 186,8 205,04 188,72
222,9
• ∆Ho298 = –116,44 кДж; ∆So298 = –129 Дж/К;
• ∆Go298 =∆Ho298 – 298 · ∆So298 = –77998 Дж.
При обычных условиях кислород не взаимодействует с HCl с
заметной скоростью, для ускорения реакции смесь
хлороводорода и кислорода необходимо нагревать и
использовать катализатор (хлориды меди(II) и железа(III)).
Ранее процесс Дикона использовали для получения хлора.
32.
Восстановительные свойства НГусиливаются
• HCl + H2SO4(конц) ‒ реакция не идет;
• 2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O;
• 8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
НCl окисляется сильными окислителями:
• PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O.
33.
свойства соляной кислоты• 2HCl + Mg = MgCl2 + H2 ;
• 2HCl + Fe = FeCl2 + H2
• 2HCl + CuO = CuCl2 + H2O
• 2HCl + Cu(OH)2 = CuCl2 + 2H2O;
• 3HCl + Fe(OH)3 = FeCl3 + 3H2O
• HCl + NH3 = NH4Cl
• 2HCl + Na2CO3 = 2NaCl + CO2↑ + H2O;
• HCl + AgNO3 = AgCl↓ + HNO3;
• 2HCl + K2SiO3 = 2KCl + H2SiO3
34.
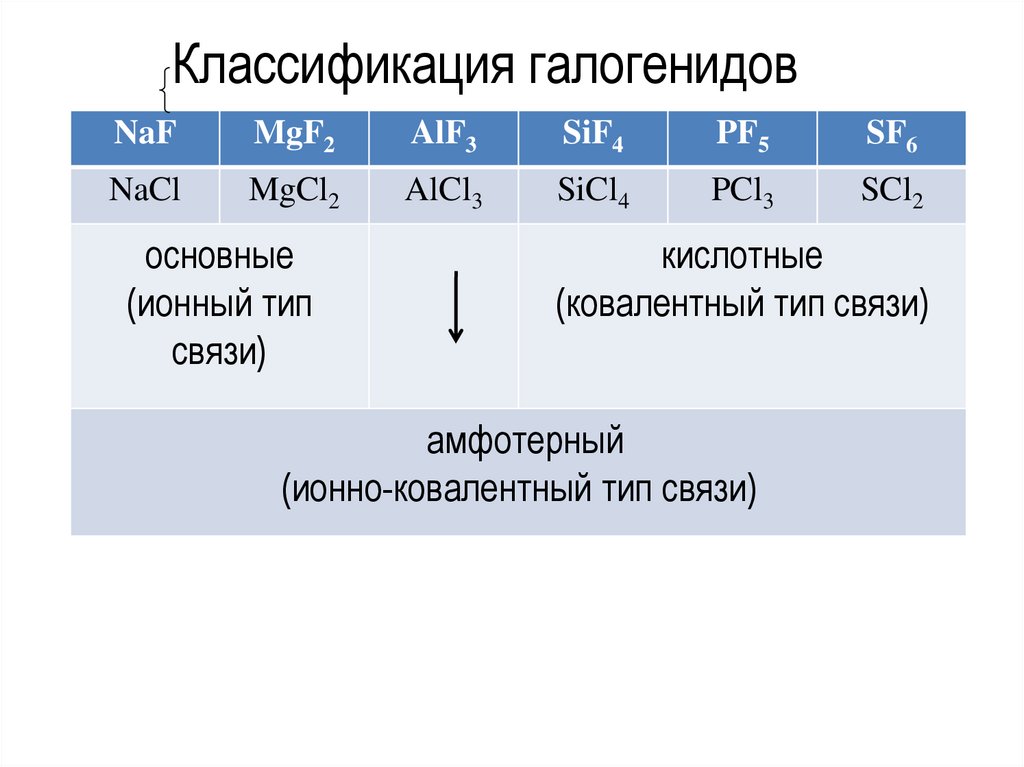
Классификация галогенидовNaF
MgF2
AlF3
SiF4
PF5
SF6
NaCl
MgCl2
AlCl3
SiCl4
PCl3
SCl2
основные
(ионный тип
связи)
кислотные
(ковалентный тип связи)
амфотерный
(ионно-ковалентный тип связи)
35.
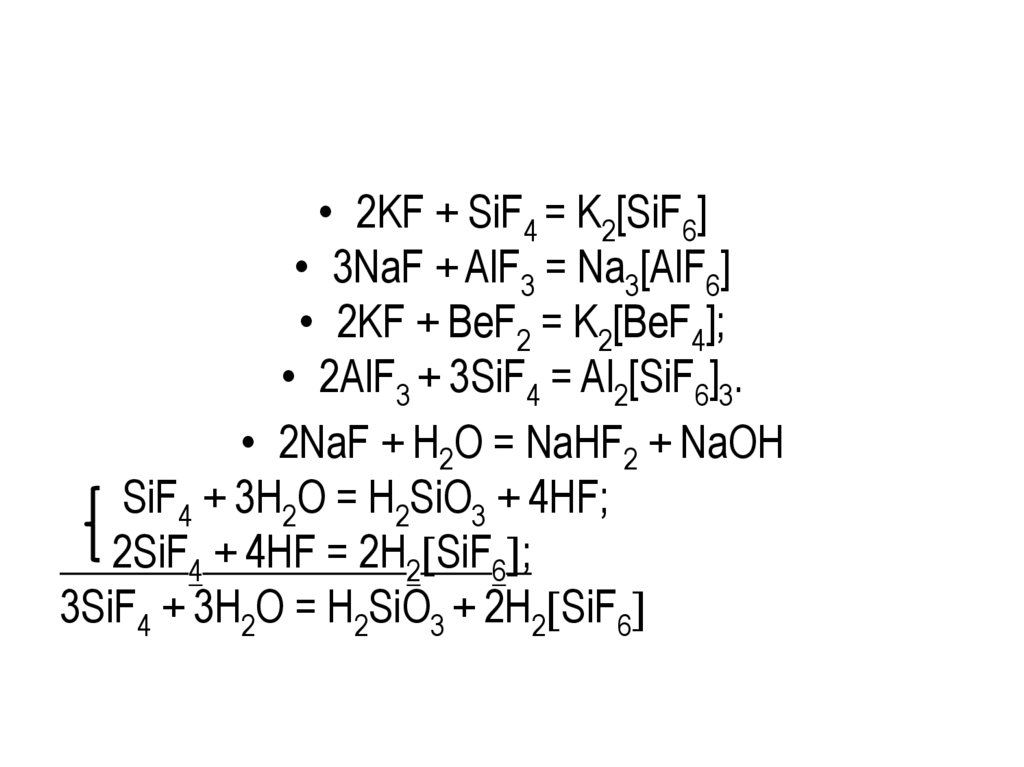
• 2KF + SiF4 = K2[SiF6]• 3NaF + AlF3 = Na3[AlF6]
• 2KF + BeF2 = K2[BeF4];
• 2AlF3 + 3SiF4 = Al2[SiF6]3.
• 2NaF + H2O = NaHF2 + NaOH
SiF4 + 3H2O = H2SiO3 + 4HF;
2SiF4 + 4HF = 2H2 SiF6 ;
3SiF4 + 3H2O = H2SiO3 + 2H2 SiF6
36.
Гидролиз галогенидовосновные хлориды, бромиды, иодиды гидролизуют по
катиону:
• MgCl2 + HOH ⇄ MgOHCl + HCl
Кислотные галогениды гидролизуют с образованием двух
кислот:
• PCl5 + 4H2O → H3PO4 + 5HCl;
• PI3 + 3H2O → H3PO3 + 3HI;
• BCl3 + 3H2O = H3BO3 + 3HCl
• SF6, СCl4, CF4 не подвергаются гидролизу (кинетические
факторы) SF6: G298 = –301,2 кДж
37.
Качественная реакция на галогенид-ионыKCl + AgNO3 = AgCl↓ + KNO3
AgCl - осадок белого цвета
• AgBr - осадок светло-желтого цвета
• AgI - осадок желтого цвета
38.
Кислородсодержащие соединенияГалогены непосредственно с кислородом не
взаимодействуют
Cl2 + 2O2 = 2ClO2
• Н , кДж/моль 0
0
104,6
• S , Дж/(моль К) 223 205,04 251,3
f , 298
298
• Н 298 = 209,2 кДж; S 298= –130,48 Дж/К;
• G
= Н – 298 · S298 = 226 220 Дж.
298
298
39.
фториды кислорода:Пропуская тлеющий разряд через смесь фтора с
кислородом при определённых давлении и температуре
получают смеси фторидов кислорода
2F2 + 2NaOH(разб) = OF2 + 2NaF + H2O
OF2 ‒ бесцветный газ
Tпл ‒224 °С Tкип ‒145°С
40.
Оксид хлора (I)Cl2O Желто-коричневый газ с резким запахом
2HgO + 2Cl2 = HgO · HgCl2 + Cl2O
2HClO + P2O5 = Cl2O + 2HPO3
41.
Оксид хлора (IV)Бурый газ с резким запахом
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + 2ClO2
2KClO3 + H2C2O4 + 2H2SO4 = 2KНSO4 +
+2ClO2 + 2H2O + 2СО2
sp2-гибридизациия
42.
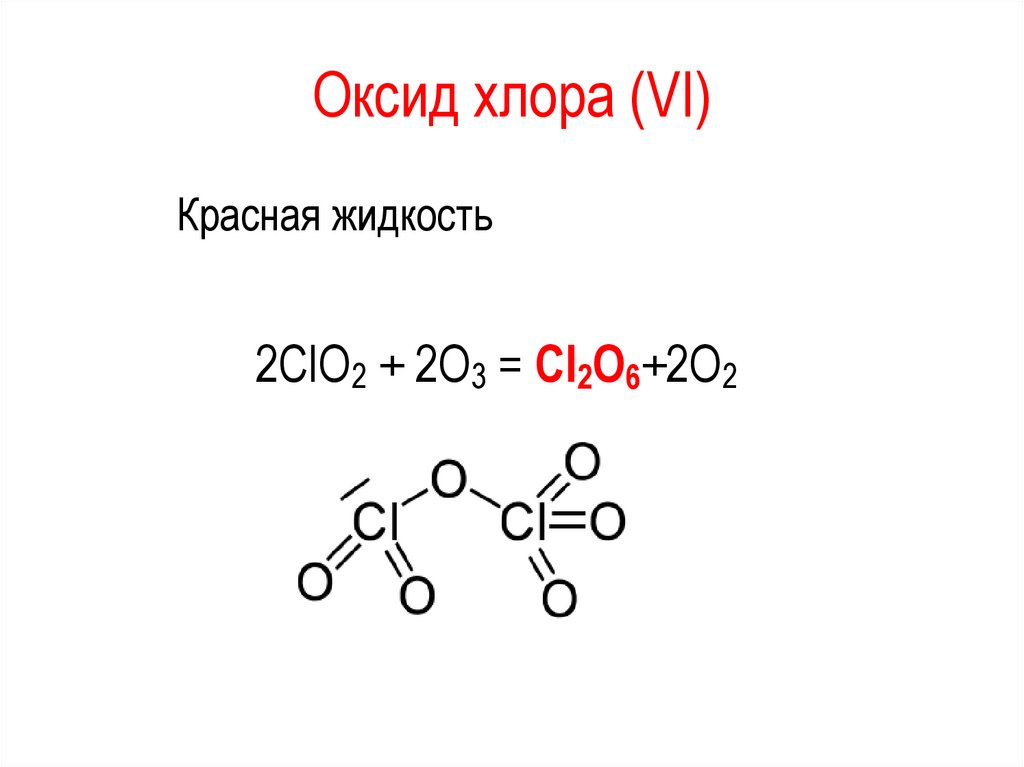
Оксид хлора (VI)Красная жидкость
2ClO2 + 2O3 = Cl2O6+2O2
43.
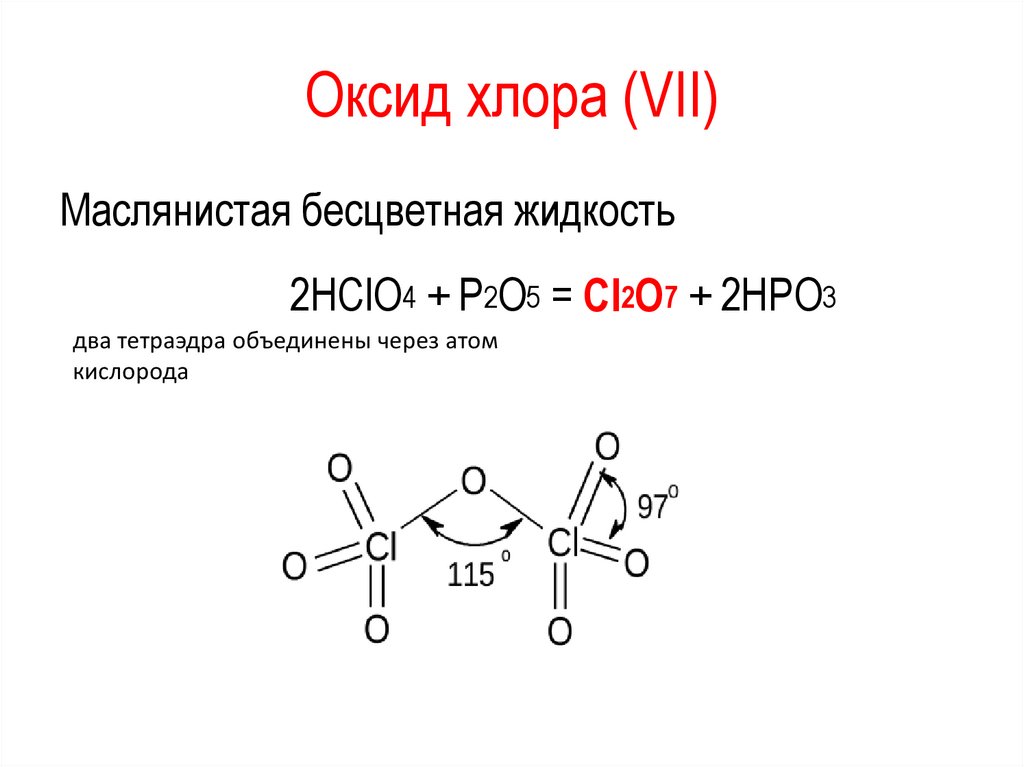
Оксид хлора (VII)Маслянистая бесцветная жидкость
2HClO4 + P2O5 = Cl2O7 + 2HPO3
два тетраэдра объединены через атом
кислорода
44.
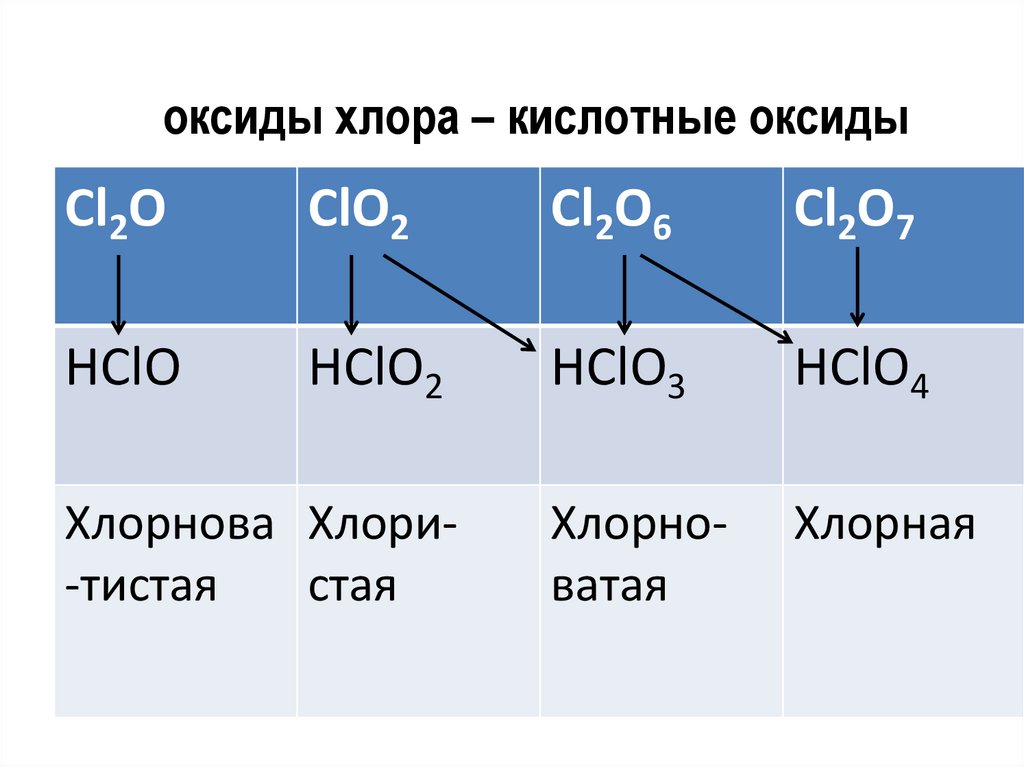
оксиды хлора – кислотные оксидыСl2О
СlО2
Сl2О6
Сl2О7
HClO
HClO2
HClO3
HClO4
Хлорноватая
Хлорная
Хлорнова Хлори-тистая
стая
45.
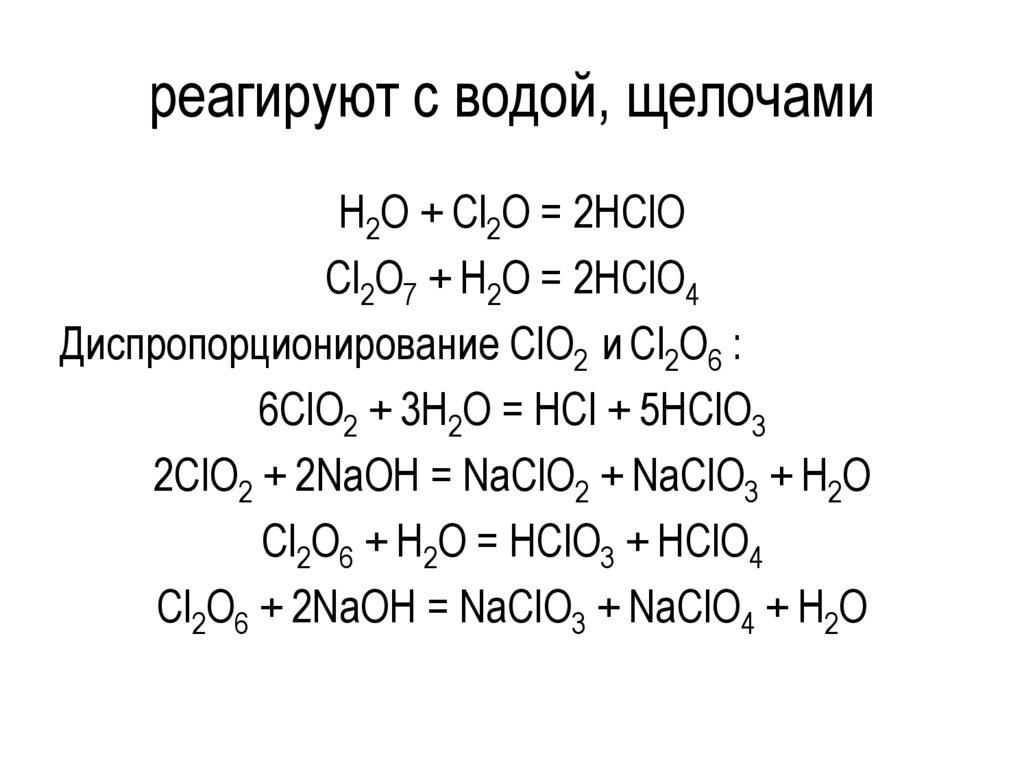
реагируют с водой, щелочамиH2O + Cl2O = 2HClO
Cl2O7 + H2O = 2HClO4
Диспропорционирование ClO2 и Cl2O6 :
6ClO2 + 3H2O = HCl + 5HClO3
2ClO2 + 2NaOH = NaClO2 + NaClO3 + H2O
Cl2O6 + H2O = HClO3 + HClO4
Cl2O6 + 2NaOH = NaClO3 + NaClO4 + H2O
46.
I2O5Н f , 298
= –184,5 кДж/моль
• Термодинамически устойчив. Бесцветные
кристаллы. Получение:
t
2HIO3
I2O5 + H2O
• Разлагается при нагревании:
t 2I + 5О
2I2O5
2
2
применение I2O5 – определение содержания
оксида углерода (II):
5СО + I2O5 = I2 + 5СО2
47.
Кислородсодержащие кислоты галогенов:Степень
окисления
галогена
+1
+3
+5
+7
Галогены
Cl
HClO
HClO2
HClO3
HClO4
Br
HBrO
‒
HBrO3
HBrO4
I
HIO
‒
HIO3
H5IO6
48.
Пространственная конфигурация кислоторбитали хлора находятся в состоянии sp3гибридизации
H
O
Cl
H
O
O
Cl
O
H
O
Cl
H
O
O
Сила кислот возрастает
Окислительные свойства кислот возрастают
Cl
O
O
O
49.
Сравнение свойств кислот хлораHClO
HClO2
HClO3
HClO4
Ослабление связи O‒H
Увеличение силы и устойчивости кислот
Самым сильным окислителем является HClO,
самой устойчивой кислотой является HClO4
50.
окислительные свойства НГО• НСlО + Н+ + 2е– = Сl– + Н2О, Ео = 1,482 В;
• НBrО + Н+ + 2е– = Br– + Н2О, Ео = 1,331 В;
• НIО + Н+ + 2е– = I– + Н2О, Ео = 0,987 В.
Самая высокая окислительная способность у
хлорноватистой кислоты, за счет атомарного
кислорода,
который
достаточно
быстро
выделяется в результате ее разложения:
HСlO = HCl + O.
51.
Схемы разложения HСlOзависят от условий протекания процесса.
На свету:
2HCl + O2.
2HClO свет
В
присутствии
H2SO4(конц)):
водоотнимающих
средств
PO
2HClO
Cl2O + H2O.
2
5
При нагревании:
t
3HClO
2HCl + HClO3
(P2O5,
52.
Все кислоты НГО – слабые кислоты• в ряду НСlО – НBrО – НIО их сила уменьшается:
Кислота
Кдис
НС1О
НBrО
НIО
3,98 ∙ 10–8 2,82 ∙ 10–9 3,16 ∙ 10–11
• НIО диссоциирует как по типу кислоты:
НIО ⇄ Н+ + IО–,
• так и по типу основания:
НIО ⇄ ОН– + I+.
53.
Соли кислот НГОСоли более устойчивы, чем кислоты
• в растворе при комнатной температуре они
медленно диспропорционируют:
3KСlО = KСlО3 + 2KСl.
• Гипохлорит калия термически разлагается также
с выделением кислорода:
t
2KClO
2KCl + O2.
• Гипогалогениты в растворах гидролизуются:
KСlО + Н2О ⇄ НСlО + KОН (рН > 7)
54.
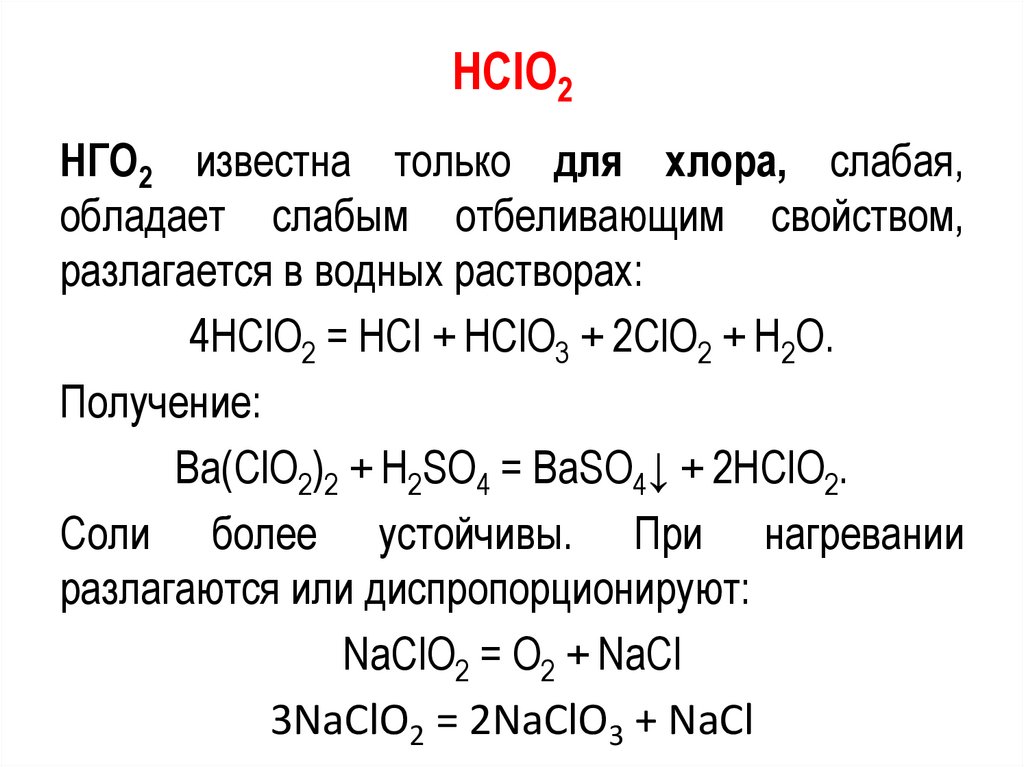
HClO2НГО2 известна только для хлора, слабая,
обладает слабым отбеливающим свойством,
разлагается в водных растворах:
4НСlО2 = НСl + НСlО3 + 2СlО2 + H2O.
Получение:
Ва(СlО2)2 + H2SO4 = ВаSO4↓ + 2НСlО2.
Соли более устойчивы. При нагревании
разлагаются или диспропорционируют:
NaСlО2 = О2 + NaСl
3NaСlО2 = 2NaСlО3 + NaСl
55.
HClO3НСlО3 более устойчива, по силе напоминает HNO3.
НСlО3 и НВrО3 существуют только в растворах:
3НСlО3 = НСlО4 + 2СlО2 + H2O;
Получение:
6Ва(ОН)2 + 6Сl2
5ВаСl2 + Ва(СlО3)2 + 6H2O;
Ва(СlО3)2 + H2SO4 = ВаSO4↓ + 2НСlО3
6СlО2 + 3Н2О = 5НСlО3 + НСl
t
56.
НIО3• В ряду НСlО3 – НВrО3 – НIО3 сила кислот и
окислительная способность уменьшаются, а
устойчивость кислот и солей увеличивается.
• НIО3 – иодноватая кислота – устойчивое
кристаллическое соединение, разлагается при
нагревании с образованием оксида иода (V) и
воды:
t
2НIО3
I2О5 + H2О
57.
НIО3• НIО3 можно выделить из ее солей действием
серной кислоты при нагревании:
t
Ва(IО3)2 + H2SO4
ВаSO4↓ + 2НIО3
• Иодноватую
кислоту
получают
также
окислением иода азотной кислотой:
3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2O
58.
Соли кислот НГО3• получают при пропускании хлора (брома, йода) в
горячий раствор щелочи:
t
3Cl2 + 6KOH
KClO3 + 5KCl + 3H2O.
• Хлорат калия (бертолетова соль) KClO3 плохо
растворим в холодной воде, в отличие от
хлорида калия KСl. При охлаждении раствора
хлорат калия выпадает в осадок в виде
бесцветных кристаллов. Хлораты ядовиты.
59.
• При нагревании в сухом виде хлорат калияотщепляет кислород и окисляет многие
вещества:
t
2KСlО3
2KCl + 3O2 (в присутствии MnO2)
• При осторожном нагревании преимущественно
протекает диспропорционирование:
t
4KСlО3
3KСlО4 + KСl
60.
Применение KСlО3• В производстве спичек (основной компонент
головки – бертолетова соль):
5KСlО3 + 6P = 5KСl + 3P2О5
2KСlО3 + 3S = 2KСl + 3SО2
KСlО3 взрывоопасен.
61.
Соединения НГО4наиболее устойчивыми и используемыми
являются хлорная и иодная кислоты.
НClО4 представляет собой дымящую на воздухе
жидкость. Безводная хлорная кислота и ее сухие
соли – сильные окислители. НСlО4 разлагается со
взрывом (иногда даже при стоянии в темноте):
4НСlО4 = 4СlО2↑ + 3О2↑ + 2Н2O.
62.
В водных растворах НСlО4 вполне устойчива. Вразбавленных растворах НСlО4 и перхлораты не
проявляют окислительных свойств.
При обезвоживании хлорной кислоты получают оксид
хлора (VII):
2НСlО4 + Р2О5 = Сl2О7 + 2НРО3
Кислоту можно получить реакцией обменного
взаимодействия с концентрированной серной
кислотой:
KClO4 + H2SO4(конц) → HClO4 + KHSO4
63.
НГО4• НВrО4 – бромная кислота – неустойчивая,
существует только в водных растворах.
• НIО4 – иодная кислота – бесцветное
кристаллическое вещество, выделяется обычно
в виде кристаллогидрата
НIО4 · 2Н2О или H5IO6
64.
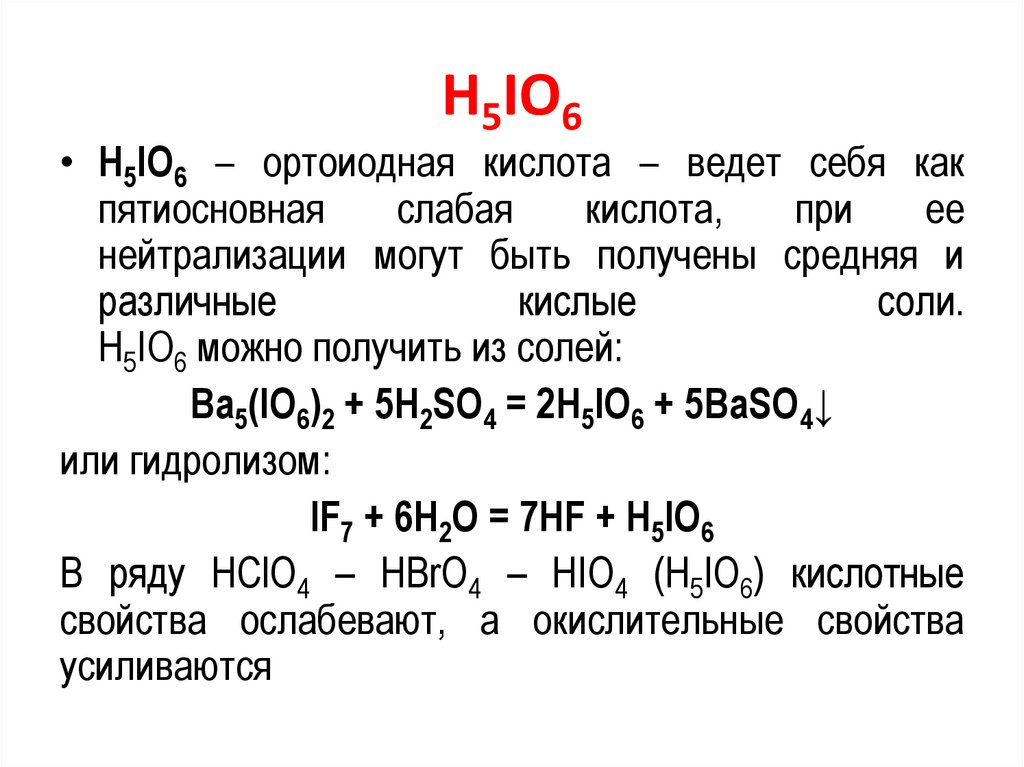
H5IO6• H5IO6 – ортоиодная кислота – ведет себя как
пятиосновная
слабая
кислота,
при
ее
нейтрализации могут быть получены средняя и
различные
кислые
соли.
H5IO6 можно получить из солей:
Ва5(IО6)2 + 5H2SO4 = 2Н5IО6 + 5ВаSO4↓
или гидролизом:
IF7 + 6H2O = 7HF + H5IO6
В ряду НСlО4 – НВrО4 – НIО4 (Н5IО6) кислотные
свойства ослабевают, а окислительные свойства
усиливаются
65.
Межгалогенные соединения• Межгалогенные соединения делят на фториды
(ClF, ClF3, ClF5, BrF, BrF5, IF, IF3, IF7),
• хлориды (BrCl, ICl, ICl3)
• бромиды (IBr). Получают их прямым синтезом:
Br2 + Сl2 = 2BrСl
Br2 + 5F2 = 2BrF5
66.
• Межгалогенные соединения являются сильнымиокислителями по отношению к разнообразным
неорганическим и органическим веществам. Они
относятся к высокотоксичным веществам.
Межгалогенные соединения подвергаются
гидролизу:
ClF + H2O → HClO + HF
BrСl + Н2О → НСl + НBrО
BrF5 + 3Н2О → 5НF + НBrО3
67.
Биогенная роль р-элементов VII А группыФтор в организме человека содержится главным образом в
костях и эмали зубов. Избыток солей фтора в организме
вызывает остеохондроз, а затем огрубление суставов и их
неподвижность. Под действием кислот растворяется
минеральная основа зубных тканей – гидроксилапатит
Са5(РО4)3ОН
NаF(паста) + Са5(РО4)3ОН = NаОН + Са5(РО4)3F
(зубная эмаль)
Природное соединение фтора криолит Na3[AlF6] применяется при получении алюминия.
68.
Хлор - получение соляной кислоты, ворганическом синтезе при производстве
пластмасс
и
синтетических
волокон,
каучуков, красителей, растворителей и др.
Хлорсодержащие соединения - для борьбы с
вредителями в сельском хозяйстве.
Хлор и его соединения - для обеззараживания
питьевой воды ( лучше использовать озон).
Бром, иод и их соединения
-в
фармацевтической
и
химической
промышленности.
69.
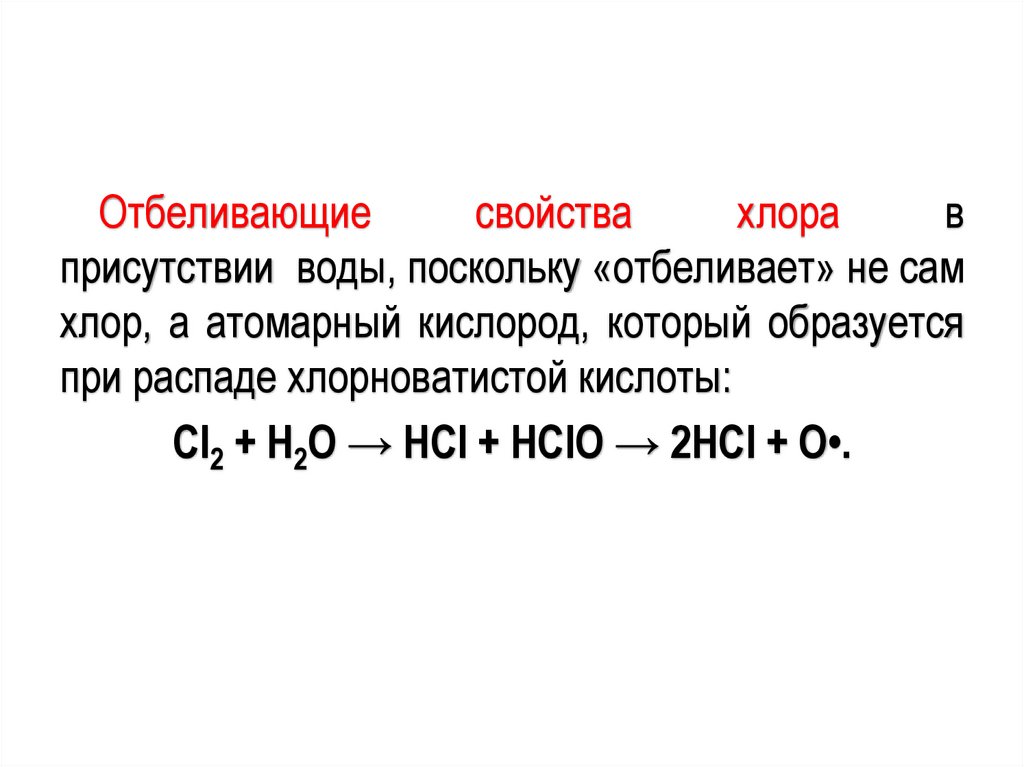
Отбеливающиесвойства
хлора
в
присутствии воды, поскольку «отбеливает» не сам
хлор, а атомарный кислород, который образуется
при распаде хлорноватистой кислоты:
Cl2 + H2O → HCl + HClO → 2HCl + O•.
70.
Фтор и некоторые его соединения являютсясильными
окислителями,
поэтому
могут
применяться в качестве окислителя даже
в ракетных топливах. Однако продукты горения с
фторсодержащими
окислителями
токсичны.
Поэтому топлива на основе фтора не получили
распространения в современной ракетной технике.
Фторированные
углеводороды
(напр.,
перфтордекалин) применяются в медицине как
кровезаменители. Существует множество лекарств,
содержащих фтор в структуре (фторотан,
фторурацил, флуоксетин, галоперидол)
71.
Газообразный фтор служит для фторированияUF4 в UF6, применяемого для изотопов разделения
урана, а также для получения трехфтористого
хлора ClF3 (фторирующий агент), шестифтористой
серы
SF6(газообразный
изолятор
в
электротехнической промышленности), фторидов
металлов (например, W и V).
Широкое применение получили многочисленные
соединения фтора - фтористый водород, фторид
алюминия, кремнефториды, фторсульфоновая
кислота (растворитель, катализатор, реагент для
получения органических соединений, содержащих
группу
SO2F),
BF3
(катализатор),
фторорганические соединения и другие.
72.
Вещества на основе брома широко применяются в основноморганическом синтезе.
«Бромная вода» (водный раствор брома) применяется как
реагент для качественного определения непредельных
органических соединений.
Бромид серебра AgBr применялся в фотографии как
светочувствительное вещество.
Используется для создания антипиренов — добавок, придающих
пожароустойчивость пластикам, древесине, текстильным
материалам.
Пентафторид брома иногда используется как очень мощный
окислитель ракетного топлива.
73.
Растворы бромидов используются в нефтедобыче.Растворы бромидов тяжёлых металлов используются как
«тяжёлые жидкости» при обогащении полезных
ископаемых методом флотации.
Многие броморганические соединения применяются как
инсектициды и пестициды.
В медицине бромид натрия и бромид калия применяют
как успокаивающие средства.
Со времен Первой мировой войны бром используется
для производства боевых отравляющих веществ.
74.
Соединения KBr и NaBr применялись в медицинекак успокаивающие средства
Иод играет важную роль в процессах обмена
веществ, являясь регулятором их скорости,
концентрируется главным образом в щитовидной
железе.
Иод является антисептиком, который оказывает
антибактериальное, противовирусное, фунгицидное
действие.
Недостаток иода, кроме базедовой болезни или
отклонений в умственном развитии, может вызывать
изменения в хромосомах и способствовать
возникновению раковых заболеваний.
75.
• После взрыва на ЧАЭС в 1986г в атмосферубыло выброшено огромное количество изотопов
йода-131, которые, уже практически распались,
что связано со сравнительно небольшим
периодом полураспада – 8,5 суток. Однако
остались также стронций-90 и цезий -137.
76.
• Известны 33 изотопа астата, а также23
метастабильных
возбуждённых
состояния ядер астата. Все они радиоактивны.
Самые устойчивые из них (от 207At до 211At)
имеют период полураспада порядка часа
(наиболее стабилен 210At, T1/2=8,3 часа); однако
у трёх природных изотопов период полураспада
не превышает минуты .
• Астат используют в лечении опухолей.
77.
78.
• Тетрафторэтиленв
результате
полимеризации дает ценный полимер –
тефлон, устойчивый к химическим
реагентам
и
незаменимый
для
изготовления различной аппаратуры при
производстве веществ особой чистоты.
Фторопроизводные
материалы
применяются в медицине как заменители
кровеносных сосудов и сердечных
клапанов.
79.
• В холодильной технике применяют фреоны –фторо- и хлорзамещенные углеводородов
(ССl3F, CCl2F2 и др.). Фреоны не принадлежат к
огнеопасным веществам, не взаимодействуют с
металлами.
80.
• BaCl2 – ядовитое вещество. Используется дляборьбы с вредителями в сельском хозяйстве.
• CaCl2 – для осушения газов (образуется CaCl2 ∙
6Н2О).
• HgCl2 – сулема – сильный яд, разбавленные
растворы используются для протравливания
семян.
• .
81.
• AgBr – в медицине для успокоения нервнойсистемы.
• Хлораты NaClO3, Mg(ClO3)2, Ca(ClO3)2 –
гербициды сильного действия, т. е. уничтожают
все растения. В меньших дозах действуют как
дефолианты.
• Раствор I2 в водном растворе KI: I2 + KI –
раствор Люголя в медицине – используется при
лечении ангины
































































 Химия
Химия