Похожие презентации:
Процессы и аппараты химической технологии
1.
Химическая технология.Часть 1. Процессы и аппараты
химической технологии
Тема 6. Массообменные процессы
Канд. хим. наук, доцент кафедры ВМС и ОХТ Базунова Марина
Викторовна
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
Правило фаз13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
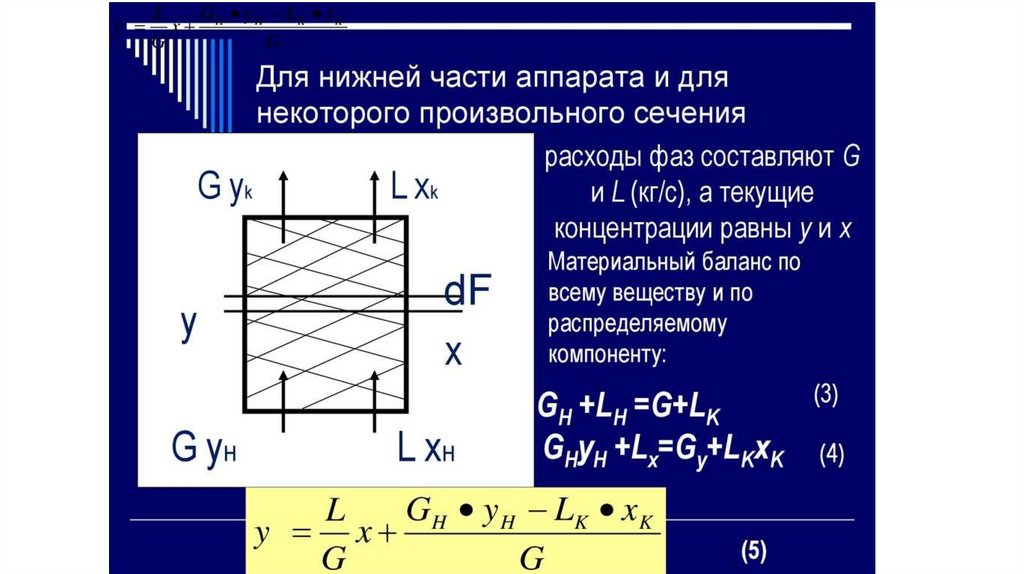
Материальный баланс и уравнение рабочей линии припротивотоке
Пусть в процессе массопередачи из фазы в фазу, например из газовой фазы в жидкую, переходит только один
распределяемый компонент. Сверху в аппарат поступает Lн кг/сек жидкой фазы, содержащей хн мас. долей
распределяемого компонента, а снизу из аппарата удаляется Lк кг/сек той же фазы, содержащей хк мас. долей
распределяемого компонента. Снизу в аппарат поступает Gн кг/сек другой фазы (газовой) концентрацией ун и сверху
удаляется Gк этой фазы, имеющей концентрацию ук мас. долей распределяемого компонента. Тогда материальный
баланс по всему веществу Gн + Lн = Gк + Lк, и материальный баланс по распределяемому компоненту Gн ун + Lн хн
= Gкук + Lкхк.
Теперь напишем уравнения материального баланса для части аппарата от его нижнего конца до некоторого
произвольного сечения, для которого расходы фаз составляют G и L кг/сек, а их текущие концентрации равны у и х
соответственно.
По всему веществу Gн + L = G + Lк, по распределяемому компоненту Gн ун + Lх = Gу + Lкхк.
Решая это уравнение относительно у, получим:
G н у n Lк х к
L
x
−
у=
(7.1) .
G
G
G
Обычно расходы фаз постоянны по высоте аппарата или мало изменяются. Поэтому, с достаточной для
практических целей точностью можно считать, что Gн = Gк = G = const, Lн = = Lк = L = const и уравнение
принимает вид:
L
y= Gх
y н−
L
x
G к
Обозначим L/G = A и
(7.2).
y н−
L
x
G к = В, получаем у = Ах + В. Таким образом, рабочая линия представляет
собой прямую, которая наклонена к оси абсцисс под углом, тангенс которого равен А, и отсекает на оси ординат
отрезок, равный В.
Аналогично, для части аппарата от некоторого произвольного сечения до верхнего конца материальный баланс
L
имеет вид G у + Lнхн = Gкук + Lх, а уравнение рабочей линии: y = G х
yк−
L
x
G н (7.3).
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
Перегонка – это процесс, включающий испарение разделяемой смеси и последующую конденсациюобразующихся паров. Этот процесс можно осуществить однократно или многократно. В результате конденсации
получают жидкость, состав которой отличается от состава исходной смеси.
В основе перегонки лежит различная летучесть составляющих смесь компонентов, т.е. разная склонность их к
переходу из жидкой фазы в паровую или в обратном направлении. Пусть, например, в колбе находиться жидкая
смесь метанола и воды с концентрацией метанола 40 %. Если эту смесь нагреть до кипения и подвести некоторое
дополнительное количество теплоты, то образовавшаяся (в небольшом количестве) паровая фаза, находящаяся в
контакте с оставшейся жидкой смесью, будет содержать ≈73 % метанола, т.е. обогатится метанолом.
Пусть теперь от парообразной смеси бензола и толуола, содержащей 40 % бензола и находящейся при
температуре конденсации, отводится некоторое количество теплоты. Тогда образовавшийся (в небольшом
количестве) конденсат, находящийся в контакте с оставшейся паровой фазой, будет содержать ≈19 % бензола, т.е.
обогатится толуолом.
Разная склонность компонентов смесей к переходу в парообразное (либо жидкое) состояние обусловлена
разницей их температур кипения. Так, температура кипения метанола 64,5 0С, а температура кипения воды 100 0С.
Очевидно, что метанол будет проявлять большее стремление перейти из жидкой фазы в паровую.
Температура кипения бензола 80,2 0С, а температура кипения толуола 110,6 0С, значит толуол проявляет
большее стремление перейти из паровой фазы в жидкую.
Различают два вида процессов перегонки: дистилляцию и ректификацию. Основное между ними различие
состоит в следующем: дистилляция – процесс непротивоточный (процессы парообразования и конденсации
разделены в пространстве и во времени), а ректификация – процесс принципиально противоточный.
40.
Получаемый при испарении бинарной смеси пар обогащён, т.е. содержит большее количество легколетучегоили низкокипящего (НК) компонента, чем исходная смесь. Следовательно, в процессе перегонки жидкая фаза
обедняется, а паровая фаза обогащается НК. Неиспарившаяся жидкость, естественно, имеет состав, более богатый
труднолетучим, или высококипящим (ВК) компонентом.
Неиспарившаяся жидкость называется кубовым остатком, а жидкость, полученная в результате конденсации
паров – дистиллятом или ректификатом.
Простая перегонка (дистилляция) – это процесс однократного частичного испарения жидкой смеси и
конденсации образующихся паров. Она применяется для разделения смесей, состоящих из сильно различающихся
по температурам кипения компонентов. Обычно простую перегонку применяют для предварительного грубого
разделения жидких смесей и для очистки смесей от нежелательных примесей.
41.
42.
Фазовое равновесие бинарных систем в процессах перегонки.Фазовые диаграммы
Если система состоит из двух компонентов (К=2) и между ними не происходит химического взаимодействия,
то при наличии жидкой и паровой фаз число фаз Ф=2. Согласно правилу фаз, число степеней свободы такой системы
составляет: С = К + 2 – Ф = 2 + 2 – 2 = 2
Следовательно, из трёх независимых параметров, полностью определяющих состояние системы, температуры, давления и концентрации одной из фаз – можно произвольно выбрать любые два; при этом
определится значение третьего параметра, которое уже не может быть произвольным. Однако при анализе и расчёте
процессов перегонки жидкостей одну из переменных обычно закрепляют и строят так называемые фазовые
диаграммы в плоской системе координат. При этом возможны следующие варианты фазовых диаграмм: Р – t
(x=const); P – x (t=const); t – x (P=const). Вид этих зависимостей определяется взаимной растворимостью
компонентов жидкой смеси и другими их свойствами. Смеси с неограниченной взаимной растворимостью
компонентов делятся на идеальные и реальные. Идеальными называются растворы, подчиняющиеся закону Рауля.
При смешивании компонентов идеального раствора тепловой эффект отсутствует и объём смеси практически не
изменяется.
43.
Для технических расчётов наиболее важной является диаграммаt – x,y, т.к. обычно процессы перегонки
в промышленных аппаратах протекают при P=const, т.е. в изобарных условиях. На этой диаграмме по оси абсцисс
отложены концентрации жидкой х и паровой у фаз, отвечающие разным температурам.
Рис. 29. Зависимость температур
кипения и конденсации от состава
фаз (диаграмма t – x,y)
Для построения зависимости температур кипения и конденсации соответственно от состава жидкости или
пара, т, е. диаграммы t – x,y, (рис. 29), откладывают на оси ординат при постоянном внешнем давлении, температуры
кипения t1, t2, t3, соответствующие составам жидких смесей х1, х2, х3, отложенным на оси абсцисс. Через полученные
точки и точки, отвечающие температурам кипения чистых компонентов tA и tB, откладываемых на крайних ординатах
диаграммы, проводят линию кипения АА1А2А3В.
Затем на оси абсцисс откладывают определенные по закону Рауля равновесные составы паров у1*, у2*, у3* и
проводят из соответствующих им точек прямые до пересечения с изотермами, отвечающими температурам t1, t2, t3.
Соединив точки пересечения В1, В2, В3 . . ., с точками А и В плавной кривой, получают линию конденсации А В1В2В3В.
При пользовании диаграммой на оси абсцисс откладывают состав жидкой смеси и проводят из
соответствующей точки вертикаль до пересечения с линией кипения. Далее из точки пересечения проводят
горизонталь вправо до пересечения с линией конденсации. Абсцисса точки пересечения указывает состав
равновесного пара.
44.
На фазовой диаграмме у—х (рис. 30) наносится линия равновесия выражающая в данном случае зависимостьмежду равновесными составами (по низкокипящему компоненту) жидкой (хА) и паровой (уА*) фаз. Процессы
перегонки осуществляют обычно при постоянном внешнем давлении. Поэтому диаграмма строится при Р = соnst, т.
е. для переменных температур кипения, изменяющихся в зависимости от изменения состава жидкой смеси.
Рис. 30. Диаграмма равновесия пар –
жидкость (диаграмм у – х).
45.
Разновидности простой перегонкиОбычно процесс простой перегонки проводят периодически, хотя в принципе этот процесс можно
организовать и непрерывным.
При периодической перегонке жидкость постепенно испаряется, и образующиеся при этом пары непрерывно
удаляются из системы и конденсируются с получением дистиллята (иногда этот способ называют простой
дистилляцией). При этом содержание НК в кубовой (исходной) жидкости уменьшается, что приводит к снижению
содержания НК в дистилляте в начале процесса содержание НК максимально, а в конце - минимально.
Простую перегонку можно проводить при атмосферном давлении или под вакуумом (для снижения
температуры перегонки).
Для получения нужных фракций (или разного состава дистиллята) применяют фракционную, или дробную,
перегонку (рис. 31, а). Исходную смесь загружают в куб 1, имеющий змеевик для нагревания и кипячения этой
смеси. Образующиеся пары конденсируются в теплообменнике-конденсаторе 2, дистиллят в нем же охлаждается до
заданной температуры и поступает в один из сборников 3. После окончания процесса перегонки остаток сливают из
куба 1 и вновь загружают в него исходную смесь.
При простой перегонке образующийся пар отводится из аппарата и в каждый данный момент времени
находится в равновесии с оставшейся жидкостью.
Рис. 31. Схема установок для простой перегонки (а) и перегонки с дефлегмацией (б): 1 - кубы-кипятильники; 2 - конденсаторыхолодильники; 3 - сборники; 4 -дефлегматор
46.
Перегонка с водяным паром. Когда смешаны две взаимонерастворимые жидкости, то каждая из нихполностью сохраняет свои свойства. Такая смесь легко может быть разделена на составные части отстаиванием.
Система состоит из двух компонентов и трех фаз (двух жидких и одной паровой) и, следовательно, обладает одной
степенью свободы: С = К - Ф + 2 = 2 - 3 + 2 = 1. Это указывает на то, что каждой определенной температуре кипения
смеси соответствует вполне определенное давление. При этом каждый из компонентов будет вести себя так, как
будто он находится один в чистом виде, т.е. в этом случае парциальное давление каждого компонента не зависит от
его содержания в смеси и равно давлению паров чистого компонента при той же температуре, т.е. температура
кипения не зависит от соотношения компонентов: рА = РА, рВ = РВ и Р = рА + рВ = РА + Рв. Температура кипения
такой смеси всегда ниже температуры кипения чистых компонентов, что используется для перегонки с паром
нерастворимых в воде жидкостей. Эта температура постоянна независимо от состава жидкой смеси, пока в жидкости
присутствуют хотя бы следы второго компонента. По исчезновении его температура возрастает скачкообразно до
температуры кипения компонента, оставшегося в жидкой фазе. До этого момента в 1 м 3 пара над смесью содержится
такое количество каждого компонента, какое заключалось бы в нем, если бы каждый из компонентов находился
порознь при той же температуре.
Если в жидкость, не смешивающуюся с водой, добавить воду, температура кипения такой смеси при атмосферном
давлении будет ниже 100 °С. Действительно, так как при одной и той же температуре Р = РА + Рв, то при
нормальном давлении Рнорм РВ = Р – РА < Р, т.е. РВ < Рнорм, а насыщенному водяному пару давлением меньше Рнорм
соответствует температура ниже 100°С. Эти же соотношения сохраняются и при любом другом давления. Обычно
температуру кипения определяют по кривым давления паров. Перегонку с водяным паром ведут обычно в кубах 1,
снабженных паровой рубашкой и барботером для ввода острого пара (рис. 32)
Рис.
32.
Схема
установки
для
перегонки с водяным
паром: 1 – куб; 2 –
конденсатор;
3
–
отстойник
Иногда по аналогичному принципу проводят перегонку с инертным газом (азот, диоксид углерода и др.),
47.
Общая оценка процессов дистилляцииЧаще дистилляцию применяют в промышленности в тех случаях, когда не требуется высокой чистоты
продукта. Высокие концентрации низкокипящего компонента можно получить лишь при большой разнице в
температурах кипения компонентов разделяемой смеси. Правда, многократная дистилляция или парциальная конденсация позволяют получать достаточно чистые компоненты. Однако помимо очень низких выходов чистых
продуктов эти процессы крайне невыгодны энергетически. Здесь приходится многократно испарять уже однажды
испаренную жидкость, затрачивая большое количество теплоты и теплоносителя. Одновременно приходится
затрачивать хладоагент на повторную конденсацию паров. Т.к. процессы парообразования разделены во времени и
пространстве, дистилляция – очень длительный процесс.
48.
49.
50.
51.
52.
53.
Анализ работы ректификационных колонн и их расчётИзвестно 2 основных метода анализа работы и расчёта ректификационных колонн: графоаналитический
(графический) и аналитический. Графический метод проще и нагляднее, поэтому проведём анализ с его помощью.
Допущения, принятые при расчёте ректификационных колонн
1. Молярные теплоты испарения компонентов при одной и той же температуре приблизительно одинаковы (правило
Трутона), поэтому каждый киломоль пара при конденсации испаряет один киломоль жидкости. Следовательно,
количество поднимающихся паров (в киломолях) в любом сечении колонны одинаково.
2. В дефлегматоре не происходит изменение состава пара. Следовательно, состав пара, уходящего из колонны, равен
составу дистиллята, т.е. ур = хр.
3. При испарении жидкости в кипятильнике не происходит изменение её состава. Следовательно, состав пара,
образующегося в кипятильнике соответствует составу кубового остатка, т.е. уw = xw.
4. Теплоты смешения компонентов разделяемой смеси равны 0.
54.
Материальный баланс ректификационной колонныСогласно схеме установки ректификации непрерывного действия (рис. 34 ), в колонну поступает F кмоль
исходной смеси, состав которой хF моль. долей НК. Сверху из колонны удаляется G кмоль паров, образующих после
конденсации флегму и дистиллят. Количество получаемого дистиллята Р кмоль, его состав хР моль. долей НК. На
орошение колонны возвращается флегма в количестве Ф моль, причём её состав равен составу дистиллята (хФ = хР
моль. долей). Снизу из колонны удаляется W кмоль остатка состава xW моль. долей НК.
Тогда уравнение материального баланса колонны будет:
F + Ф = G + W (10.1)
Поскольку G = P + Ф, то F = P + W
Соответственно материальный баланс по НК:
F·xF = P·xP + W·xW (10.2)
55.
56.
57.
58.
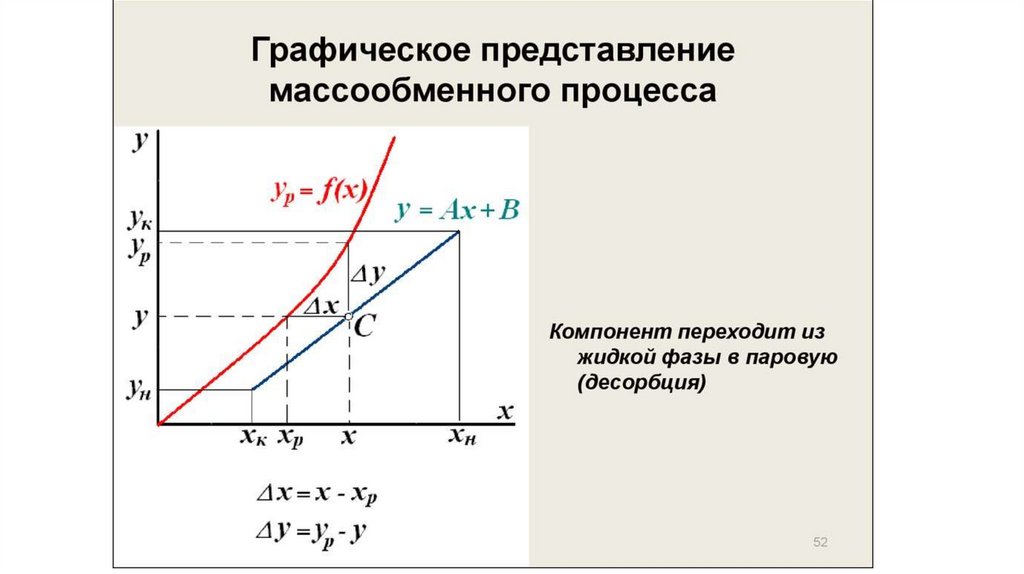
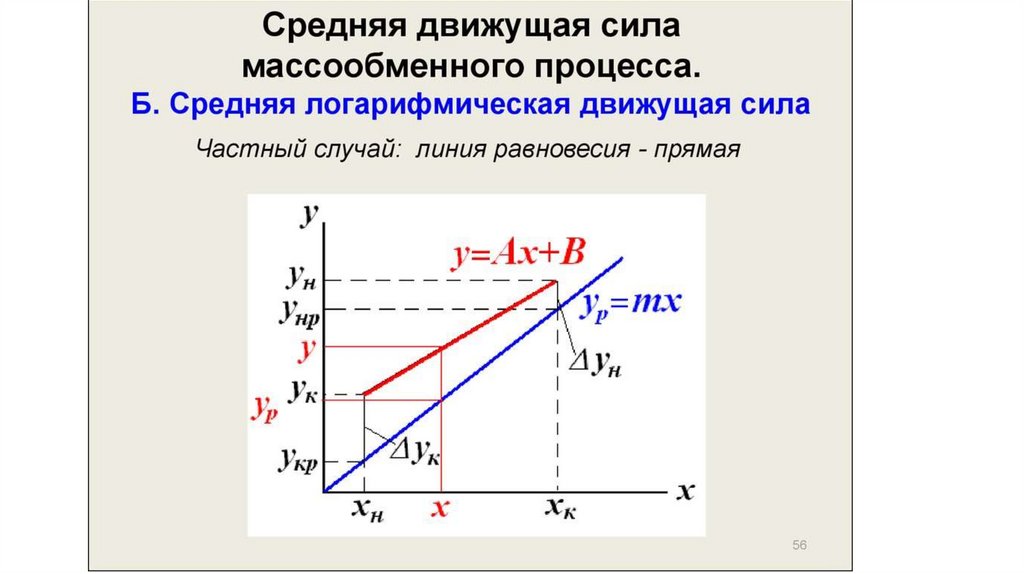
Минимальное и действительное (рабочее) флегмовое числоПри заданном составе дистиллята хр величина отрезка В (см. рис. 45), отсекаемого рабочей линией
хр
укрепляющей части колонны на оси ординат, зависит только от флегмового числа R, т.к. В =
R 1 . С
уменьшением R отрезок В увеличивается и рабочая линия как бы поворачивается вокруг точки а по часовой стрелке,
занимая последовательно положения аd, аb" и т. д. Однако величину R можно уменьшать только до некоторого
предела, определяемого движущей силой процесса массопередачи между жидкой и паровой фазами.
Движущая сила, выраженная в концентрациях паровой фазы, изображается на диаграмме у—х вертикальным
отрезком между данной точкой на рабочей линии и линией равновесия. Например, при рабочей линии аb в точке
ввода питания хF движущая сила равна уF* — уF и изображается отрезком b” .
Рис. 45. Построение рабочих
линий
укрепляющей
и
исчерпывающей частей колонны
ректификации
непрерывного
действия
При этом рабочая линия аb’’’отсекает на оси ординат максимальный B”’ = Bmax, которому при заданном хр
соответствует минимальное флегмовое число Rmin. При Rmin, когда рабочие линии пересекаются с линией равновесия,
в точке пересечения движущая сила процесса равна нулю. Значит, для того, чтобы достигнуть концентраций фаз,
соответствующим их составам на питающей тарелке, потребовалась бы бесконечно большая поверхность контакта
фаз, т.е. бесконечно большое число «ступенек» - теоретическое число ступеней разделения. Таким образом, при Rmin
разделение возможно только в гипотетической колонне бесконечно большой высоты. При этом расход греющего
пара, который при прочих равных условиях пропорционален флегмовому числу, т.к. G = P(R+1), будет наименьший.
59.
С увеличением R отрезки В уменьшаются и рабочая линия поворачивается вокруг точки а против часовой стрелки.Очевидно, нижнее предельное положение рабочих линий должно соответствовать совпадению точки их
пересечения с диагональю диаграммы (точка b’ ). При этом угол наклона рабочих линий к оси абсцисс равен 450,
А=А’=1 и B=B’=0, что возможно, как следует из выражений для В и B’, только при бесконечно большом
флегмовом числе (R=∞). При R=∞ рабочие линии совпадают с диагональю диаграммы и движущая сила процесса
у = у* - у или
х = =х* - х является наибольшей, а необходимое число теоретических ступеней разделения
- наименьшим.
Таким образом, при R=∞ потребовалась бы наименьшая рабочая высота колонны. Однако флегмовое число R
Ф
= Р может стать бесконечно большим только при Р=0. Это означает, что при R=∞ отбора дистиллята нет, и вся
жидкость, полученная в результате полной конденсации паров в дефлегматоре, возвращается в колонну в виде
флегмы. В данном случае колонна работает «на себя», без выдачи продукта, что в нормальных производственных
условия исключается.
С увеличением R возрастает количество жидкости, которое необходимо испарить в кипятильнике. При R=∞
требуется испарить максимально возможное количество жидкости. Следовательно, в этом случае расход греющего
пара наибольший.
Действительное (рабочее) флегмовое число Rраб, при котором работает колонна, должно находиться в
пределах Rmin и R=∞. При проведении технико-экономического расчёта выбор рабочего флегмового числа часто
проводят приближённо. Так, при расчётах задаются отношением рабочего флегмового числа к минимальному. Это
отношение носит название коэффициента избытка флегмы: =Rраб/Rmin. В большинстве случаев значения этого
коэффициента колеблются ориентировочно в пределах =1,04-1,5. Однако, если отсутствуют данные о величинах
коэффициента избытка флегмы для систем, близких по свойствам к разделяемой, то выбор определяется главным
образом инженерной интуицией и является грубо приближённым.
Для определения Rmin из точки b’’’ (см. рис. 45) проведём горизонтальный отрезок b’’’e до пересечения с
абсциссой точки а. Тангенс угла наклона рабочей линии укрепляющей части колонны при Rmin равен отношению
катетов ае и b’’’е треугольника а b’’’е, причём катет
ае = уР –
уF* = xP - уF*, а катет b’’’е = xP - хF.
Следовательно tg α = =
х Р− у
F¿
(А)
xP − x F
R min
Вместе с тем, согласно уравнению (10.4), при минимальном флегмовом числе tg α = А = R
min
Сопоставляя выражения (А) и (Б), получим
х Р− у
Rmin =
F¿
у F − xF
¿
=
yP− yF
yF − x F
¿
¿
1
(Б)
60.
Графический метод определения числа теоретических тарелокОдной из основных целей расчета колонны является определение числа тарелок, необходимых для разделения
данной смеси, состава а на ректификат и остаток заданных качеств (ур и хw).
Теоретическая ступень (или тарелка) – это такая ступень, которая соответствует некоторому
гипотетическому участку аппарата, на котором жидкость полностью перемешивается, а концентрации жидкой и
паровой фаз являются равновесными.
Число тарелок может быть определено графическим или аналитическим путем. В первом случае необходимо
иметь кривую равновесия фаз и рабочие линии для верхней и нижней частей колонны (рис. 46, а).
Рассмотрим определение числа тарелок для верхней части колонны. Пусть на нижнюю тарелку (на рис. 46, б,
тарелка III) концентрационной части колонны поступают пары состава ут. Тогда состав жидкости x2, стекающей с
нижней (III) тарелки укрепляющей части колонны, определится абсциссой точки а1, лежащей на рабочей линии и
имеющей ординату ут. При идеальном контакте пары уIII, поднимающиеся с тарелки III, будут находиться в
состоянии равновесия с жидкостью состава x2, и поэтому точка, характеризующая эти потоки, лежит па кривой
равновесия фаз. Для нахождения её положения необходимо из точки а1 провести вертикаль до пересечения с
кривой равновесия фаз в точке b1. Ордината этой точки и будет равна составу паровой фазы уIII. Состав встречных
потоков паров и жидкости определяется рабочей линией, поэтому состав жидкости хII, стекающей с тарелки II,
определится точкой пересечения горизонтали, проведенной из точки b1, с рабочей линией в точке а2. Абсцисса
точки а2 и определяет состав жидкости хII, стекающей со второй (II) тарелки
61.
Продолжая аналогичные построения ломаной a1b1a2b2a3b3 и т. д., получим составы паров, поднимающихся слюбой тарелки концентрационной части колонны, которые определяются ординатами точек b1, b2, b3 и т. д.; абсциссы
же этих точек определяют составы жидкости, стекающей с тарелок III, II и I. Очевидно, такое построение ломаной
линии необходимо проводить до тех пор, пока горизонталь её но достигнет значения ординаты, равной составу ректификата ур.
В примере (рис. 46) требуемая концентрация паров ур достигается после четырех идеальных контактов,
следовательно, в этом частном случае число теоретических тарелок в концентрационной части колонны должно
быть равно четырем.
Таким образом, проведя ступенчатую линию между кривой равновесия фаз и рабочей линией от точки с
ординатой ут до точки К, ордината которой ур соответствует составу ректификата, получим необходимое число
теоретических тарелок, равное числу ступеней (на рис. 46, а, они заштрихованы). При этом ордината каждой
горизонтали соответствует составу паров, поднимающихся с той или иной тарелки, а абсцисса каждой вертикали
определяет состав жидкости, стекающей с тарелки.
62.
При графическом построении числа тарелок последняя горизонталь b5 — a6 может занять положение вышеточки К. Это свидетельствует о том, что пары, уходящие из колонны, будут содержать НК больше, чем это было
принято для ректификата. При практических расчетах в этих случаях поступают по-разному. Можно несколько
изменить количество орошения, тогда изменится положение линии концентрации и соответственно изменится число
тарелок; можно оставить найденное число тарелок и не производить соответствующих перерасчетов, учитывая, что
при этом получается некоторый запас.
Из проведенного графического определения числа тарелок видно, что это число зависит от положения
рабочей линии. При увеличении количества орошения рабочая линия приближается к диагонали, а необходимое
число тарелок уменьшается, и, наоборот, при уменьшении количества орошения рабочая линия приближается к
кривой равновесия фаз, а необходимое число тарелок увеличивается. Очевидно, что минимальному числу тарелок в
концентрационной части колонны будет соответствовать бесконечно большое количество орошения, рабочая линия
при этом сольется с диагональю ОВ. На рис. 46, а, такое построение выполнено пунктирной линией.
При уменьшении веса орошения необходимое число теоретических тарелок будет увеличиваться и достигнет
бесконечно большого значения.
63.
Построение числа тарелок в укрепляющей части колонны можно вести, начиная от состава паров ут,поступающих на нижнюю тарелку концентрационной части; тогда построение заканчивается в точке К,
определяющей состав ректификата. Можно начинать построение от точки К и закончить в точке а1 соответствующей
составу паров ут.
Число теоретических тарелок в исчерпывающей части колонны определяется аналогично. Для этого
определяют состав жидкости хт, поступающей па верхнюю тарелку I исчерпывающей части колонны. Жидкость
состава хт представляет собой смесь флегмы g2, стекающей из укрепляющей части колонны, и жидкой части
неиспарившегося сырья g0.
Рис. 47. Графическое определение числа тарелок для нижней части колонны.
Отложив на оси абсцисс значение величины хт, проводим из этой точки вертикаль до пересечения ее с рабочей
линией Мс1 в точке с1 (рис. 47, а). Ордината точки с1 определяет состав паров у2, поднимающихся с верхней (I)
тарелки отгонной части колонны (рис. 47 б). Жидкость, стекающая с тарелки I, находится в равновесии с этими
парами, и поэтому ее состав х1 определяется точкой d1, в которой горизонталь, проведённая из точки с1, пересекается
с кривой равновесия фаз (Т2 = tI; TII = tII; TIII = t3).
Для определения состава паров yII, поднимающихся с тарелки II, проводим из точки d1 вертикаль до
пресечения с рабочей линией в точке с2. Ордината этой точки и определит пары состава yII.
Проводя аналогичные построения, получим ступенчатую линию c1d1c2d2c3d3 и т.д., у которой ординаты
горизонтальных участков характеризуют составы паров, поднимающихся с той или иной тарелки, а абсциссы
вертикалей определяют концентрацию потока жидкости. Построение ступенчатой линии следует продолжать до тех
пор, пока вертикаль, проведенная из точки d4, не пройдёт через точку М, лежащую на диагонали и характеризующую
состав уходящего из колонны жидкого остатка хR. В примере, показанном на рис. 47, для изменения концентрации
жидкости от величины xm до xR требуются четыре теоретические тарелки.
64.
65.
66.
67.
68.
Кожухотрубчатые теплообменники, применяемые при большой разноститемператур между кожухом и трубами: а – с линзовым компенсатором; б – с Uобразными трубами; в – с плавающей головкой. 1 – линзовый компенсатор; 2 –
U-образные трубы; 3 – подвижная трубная решетка; 4 – продольная
перегородка в межтрубном пространстве
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
79.
Алгоритм расчёта80.
81.
Особенности ректификации многокомпонентных смесейДля разделения n-компонентной смеси требуется (n — 1) колонн, однако число возможных вариантов
технологических схем с расчетом числа продуктов и способов их получения увеличивается экспоненциально. На
рис. 48 показано, что для разделения смеси компонентов ABCD, расположенных в порядке возрастания температур
кипения, возможны 5 вариантов схем деления; для смеси из 10 компонентов число возможных схем составляет 4862.
Рис. 48. Возможные варианты схем разделения компонентов смеси ABCD.
82.
Периодическая ректификация бинарных смесейРис. 49. . Ректификационная
установка
периодического
действия: 1 -куб; 2 -колонна; 3 дефлегматор;
4
-делитель
потоков; 5 - холодильник; 6, 7 сборники.
83.
Установки для периодической ректификации подразделяются на агрегаты, работающие при постоянномфлегмовом числе (R = const), и агрегаты, функционирующие при переменном R и постоянном составе дистиллята
(хР=const). Наиболее широко распространены в промышленности установки первого типа. Для этого случая
изменение составов кубовой жидкости и дистиллята показано на рис. 50. В начале ректификации концентрация НК
в кубовой жидкости равна xF, а в дистилляте – xw. По мере течения процесса концентрация НК в кубе будет
уменьшаться и принимать значения x1, x2 и т. д. Соответственно понизятся концентрации НК в дистилляте, принимая
значения x'p, х''p и т.д. В результате дистиллят получают в виде различных по составу фракций, отбираемых в
отдельные сборники или будет получен дистиллят среднего состава в пределах xp-xpw и остаток в кубе состава xW. Из
рис. следует, что при R.= const наклон всех рабочих линий, равный R/(R—l), не зависит от концентрации НК,
поэтому линии смещаются параллельно своему первоначальному положению.
Рис. 50. Рабочие линии периодической
ректификации
флегмовым числом.
с
постоянным
84.
Проведение процесса с получением дистиллята постоянного (начального) состава хР=const возможно путемпостепенного увеличения во времени количества возвращаемой в колонну флегмы или при работе с постепенно
возрастающим флегмовым числом R.
Осуществление процесса таким способом связано с автоматическим (программированным) регулированием
количества флегмы, возвращаемой в колонну, или количества пара, поступающего из кипятильника, что усложняет
установку.
Для этого случая изменение составов кубовой жидкости и положение рабочих линий показано на рис. 51.
Рис. 51. Изображение рабочих линий
процесса периодической ректификации
при хР=const
Предельным случаем работы колонны в режиме с постоянным составом дистиллята является работа колонны
«на себя».



















































































 Химия
Химия








