Похожие презентации:
Основные понятия органической химии. Лекция № 1
1. Лекция № 1
Основные понятияорганической химии
2. Курс органической химии
8 лекций, 8 семинарских занятий,из них 2 лабораторные работы.
2 контрольные работы по темам:
1)Углеводороды
2)Кислородсодержащие производные (спирты,
альдегиды, карбоновые кислоты)
Мини-контроли на семинарах и лекциях
Экзамен
3. Курс органической химии
Литература1) Артеменко А.И. Органическая химия. М.:
Высшая школа, 2002.
2) Кривоносов А.И. «Органическая химия и
окружающая среда». М.: МИИТ, 1999.
3) Химия. Пособие-репетитор для
поступающих в ВУЗы. Под ред. А.С. Егорова.
4. Курс органической химии
Этапы развития органической химииПериод практической химии
5. Литература
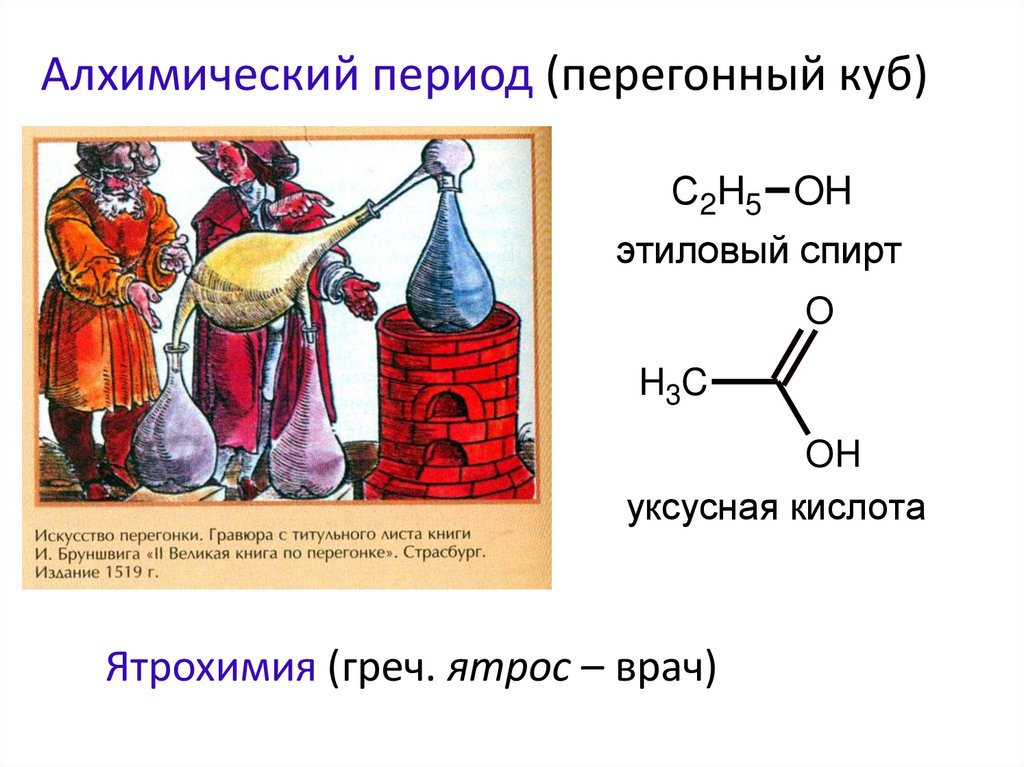
Алхимический период (перегонный куб)С2H5 OH
этиловый спирт
O
H3C
OH
уксусная кислота
Ятрохимия (греч. ятрос – врач)
6. Этапы развития органической химии
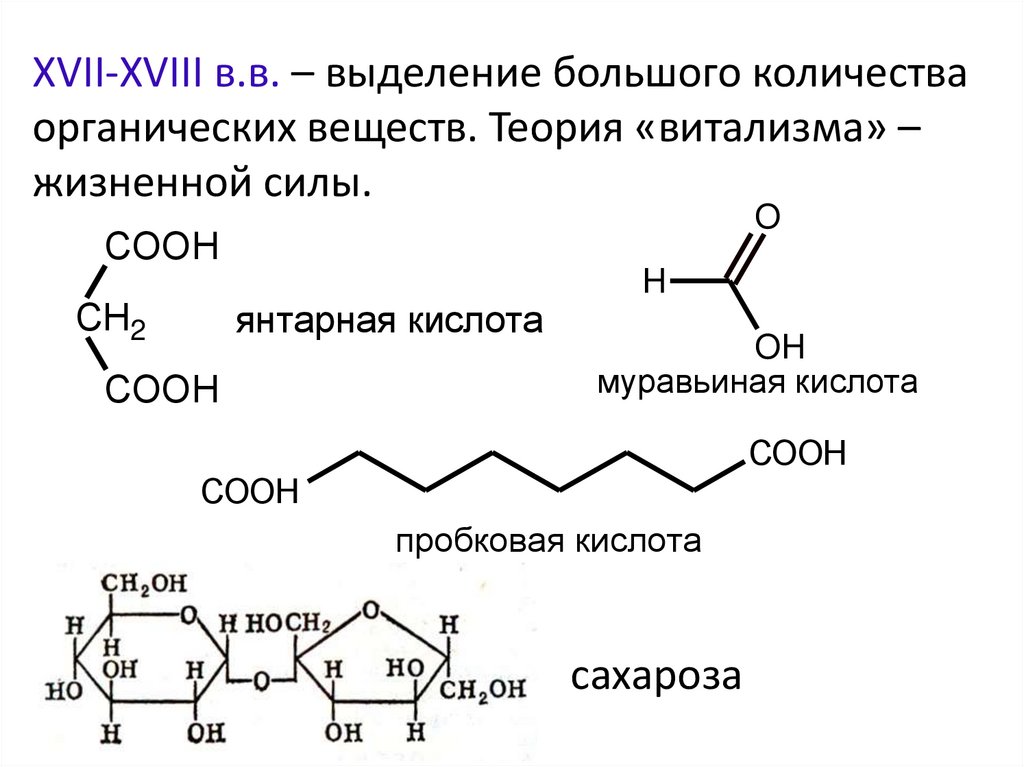
XVII-XVIII в.в. – выделение большого количестваорганических веществ. Теория «витализма» –
жизненной силы.
O
СООН
СН2
янтарная кислота
СООН
H
OH
муравьиная кислота
СООН
СООН
пробковая кислота
сахароза
7.
Карл Шееле (1742-1786):СООН
НООС
OH
яблочная кислота
НООС
СООН
СООН COOH
HO
лимонная кислота
H3C
СООН
OH
молочная кислота
галловая кислота
HO
OH
OH
8.
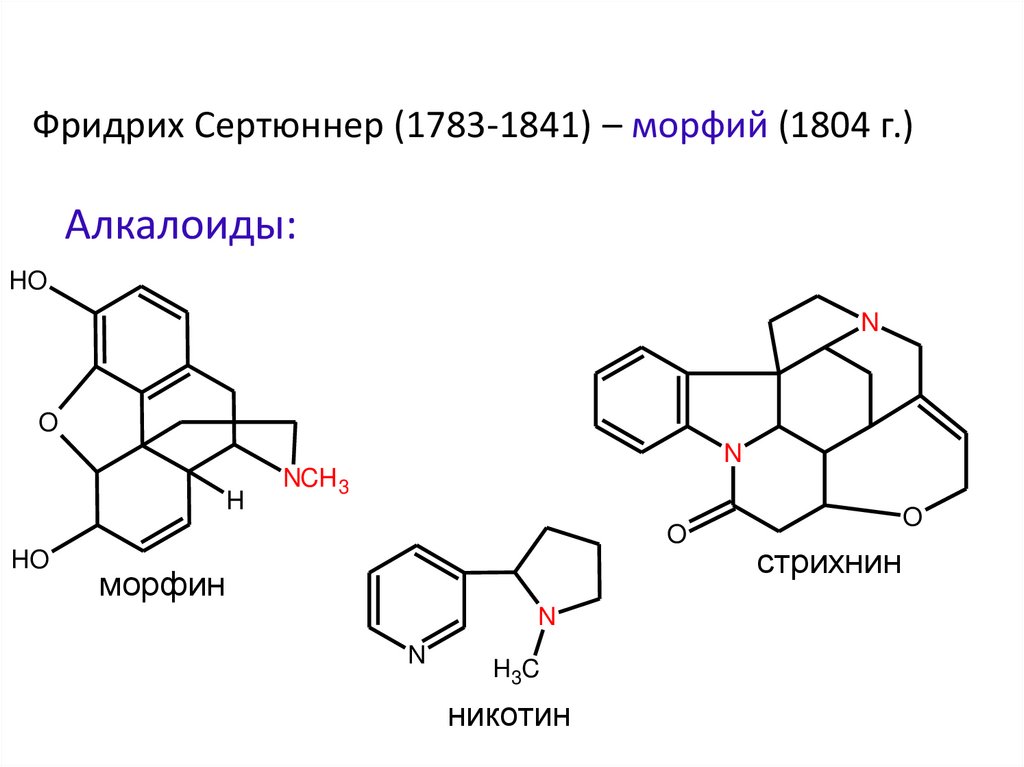
Фридрих Сертюннер (1783-1841) – морфий (1804 г.)Алкалоиды:
HO
N
O
N
H
NCH 3
O
HO
морфин
N
N
H 3C
никотин
O
стрихнин
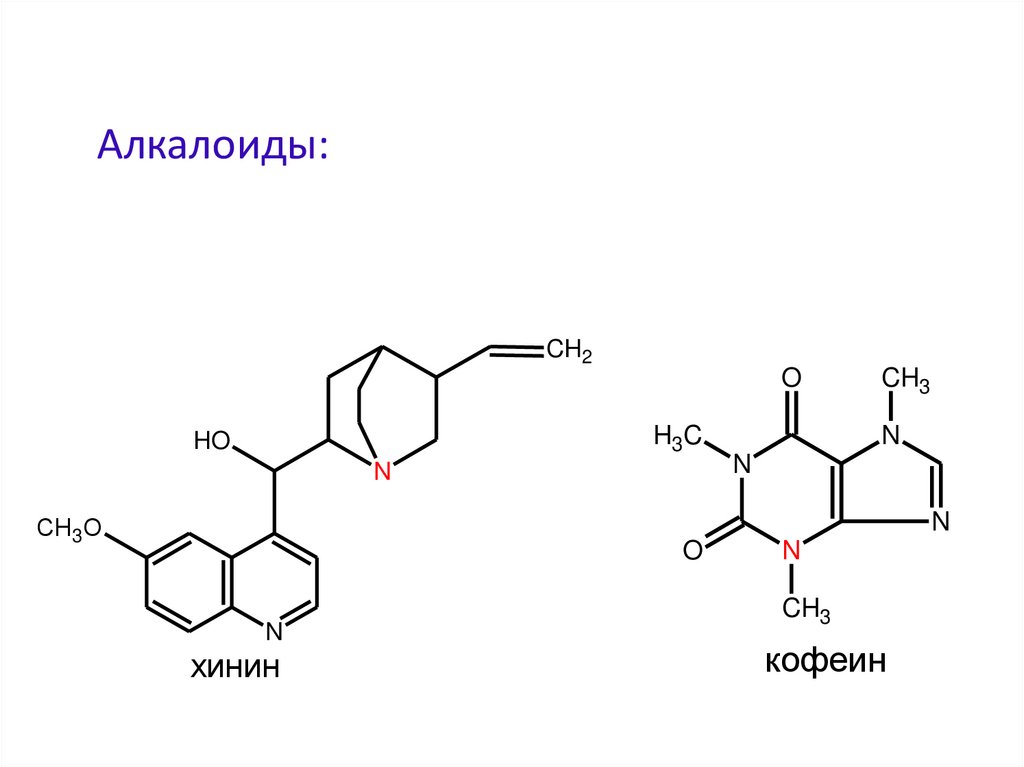
9.
Алкалоиды:CH2
O
H3C
HO
N
CH3
N
N
N
СН3О
O
N
хинин
N
CH3
кофеин
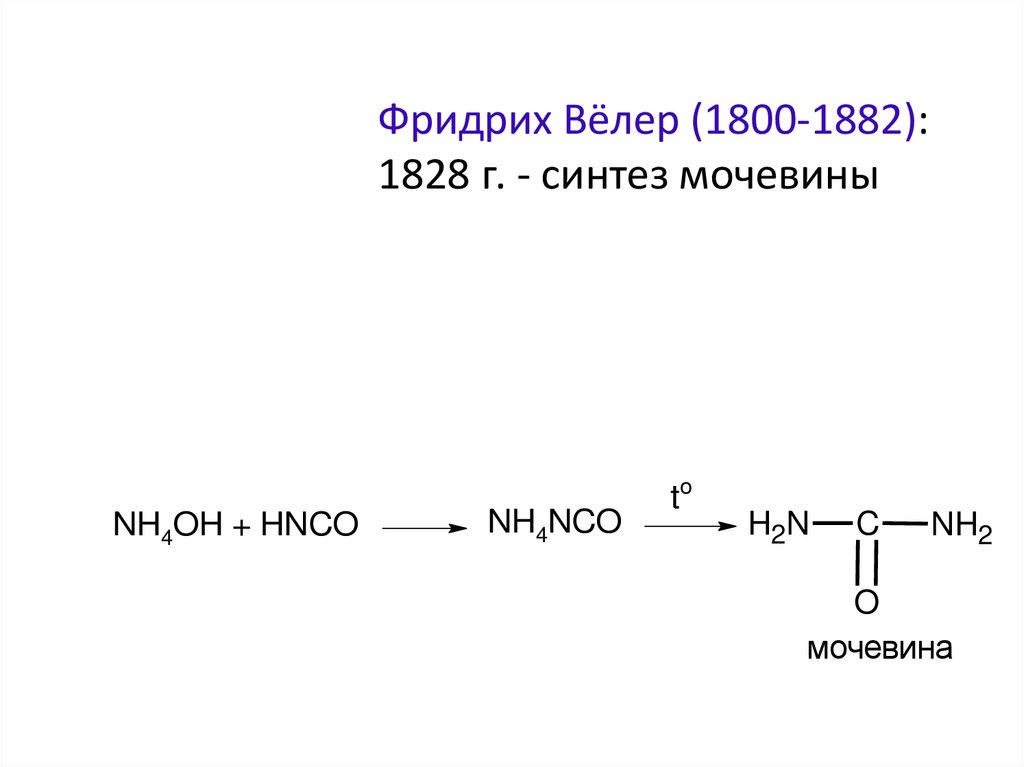
10.
Фридрих Вёлер (1800-1882):1828 г. - синтез мочевины
NH4OH + HNCO
NH4NCO
to
H2N
C
NH2
O
мочевина
11.
Александр МихайловичБутлеров (1828 - 1886)
1861 г. Теория строения
органических веществ
12.
Марселен Бертло (1860 г.):«Химия создала свой предмет. Эта творческая
способность, подобная искусству, коренным
образом отличает химию от остальных
естественных и гуманитарных наук»
13.
Количество химических соединенийОрганическая химия
основной источник
получения:
новых материалов,
лекарств,
средств защиты растений,
красителей,
топлив
2013 г. Неорганических веществ 500 000,
Органических веществ 27 млн.
14.
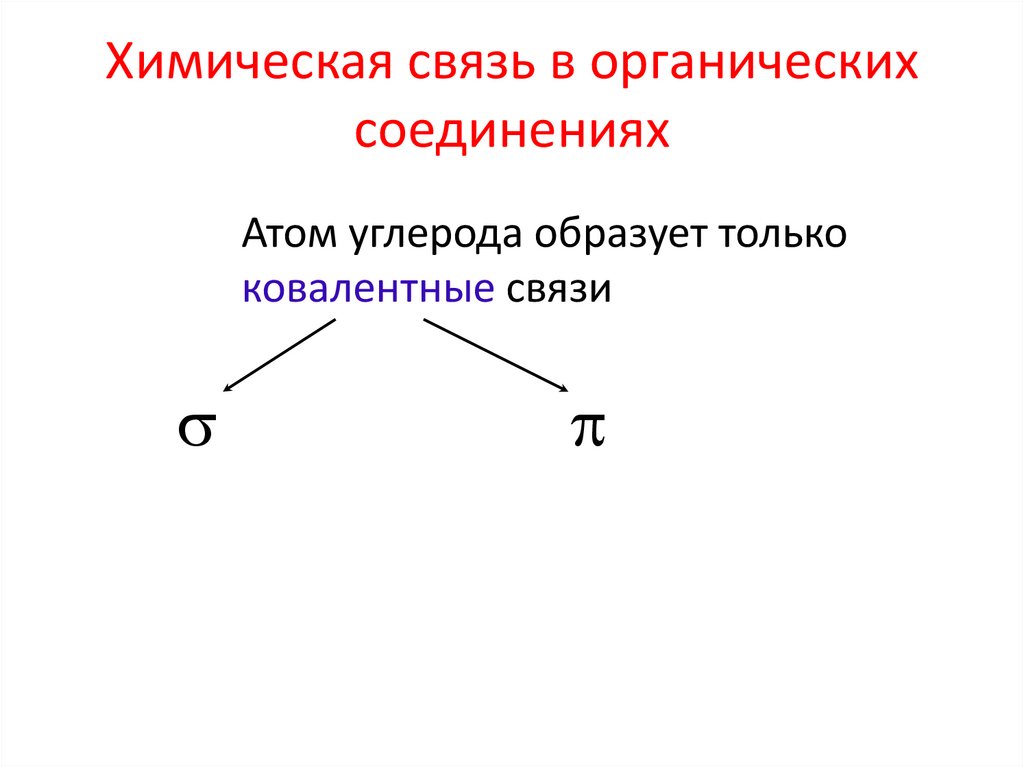
Химическая связь в органическихсоединениях
Атом углерода образует только
ковалентные связи
15. Количество химических соединений
Гибридизация – выравниваниеэлектронных облаков по форме и
энергии при образовании связи с
другими атомами
sp3
sp2
sp
16. Химическая связь в органических соединениях
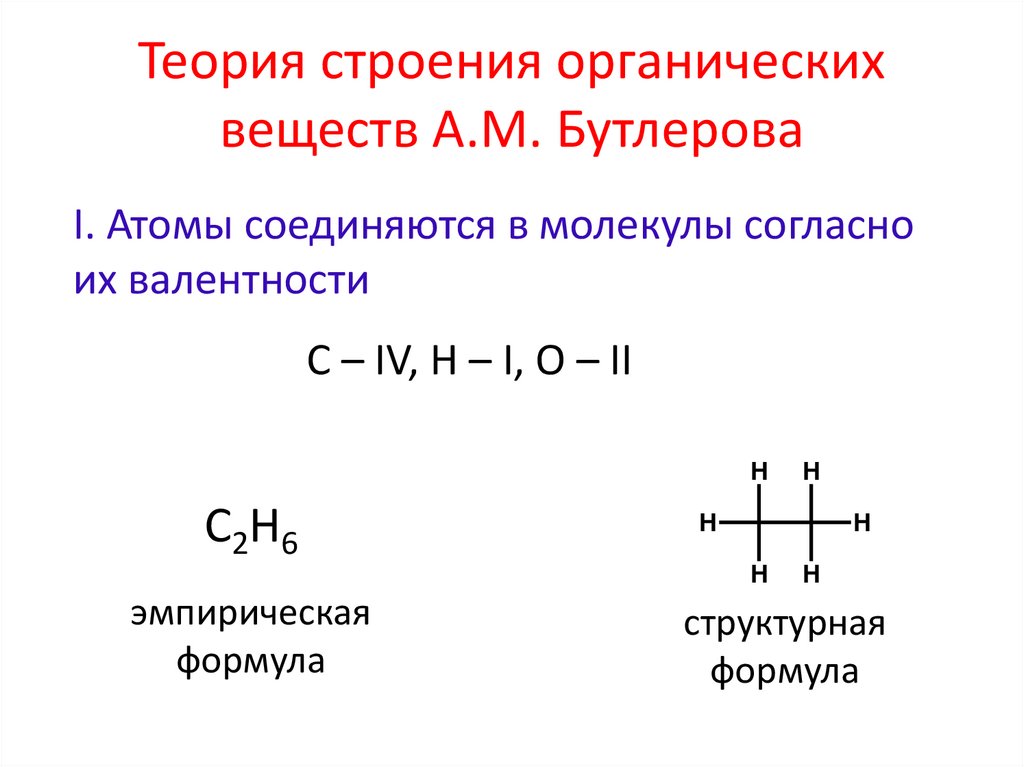
Теория строения органическихвеществ А.М. Бутлерова
I. Атомы соединяются в молекулы согласно
их валентности
С – IV, H – I, O – II
H
C2H6
H
H
H
эмпирическая
формула
H
H
структурная
формула
17.
II. Свойства вещества зависят не только отсостава, но и от строения молекул
Вещества, имеющие одинаковый состав, но
различное строение – изомеры
С2Н6О
С2Н5-ОН
этанол
СН3-О-СН3
диметиловый
эфир
18. Теория строения органических веществ А.М. Бутлерова
Типы изомерии1.Структурная
А) Изомерия цепи
Б) Изомерия положения кратных связей
В) Изомерия положения функциональных
групп
2. Пространственная (цис-, транс-)
3. Межклассовая
19.
III. В молекулах органических веществ атомыи группы атомов влияют друг на друга. Это
взаимное влияние определяет свойства
веществ.
20. Типы изомерии
Электронные эффекты – смещениеэлектронной плотности в молекуле под
влиянием заместителей
Индуктивный эффект – смещение электронной
плотности по -связям
+I
I
(доноры эл. плотности)
(акцепторы эл. плотности)
алифатические у.в.
радикалы (СН3, С2Н5…)
Hal, NH2, OH, CHO, COOH
21.
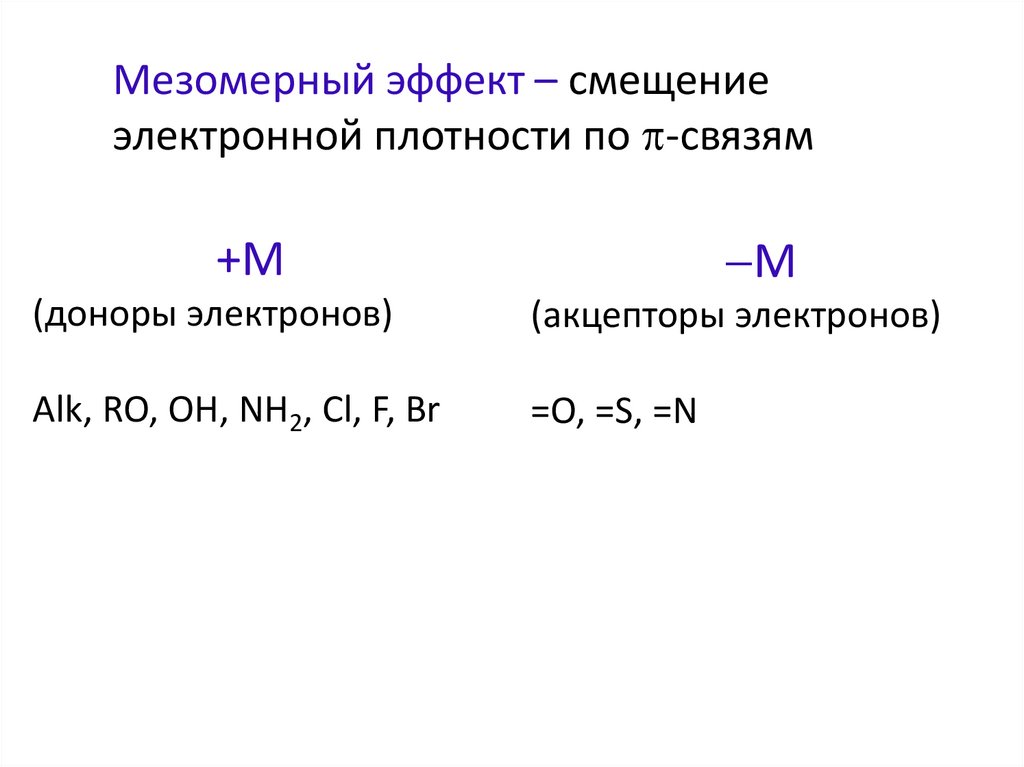
Мезомерный эффект – смещениеэлектронной плотности по -связям
М
+М
(доноры электронов)
(акцепторы электронов)
Alk, RO, OH, NH2, Cl, F, Br
=O, =S, =N
22.
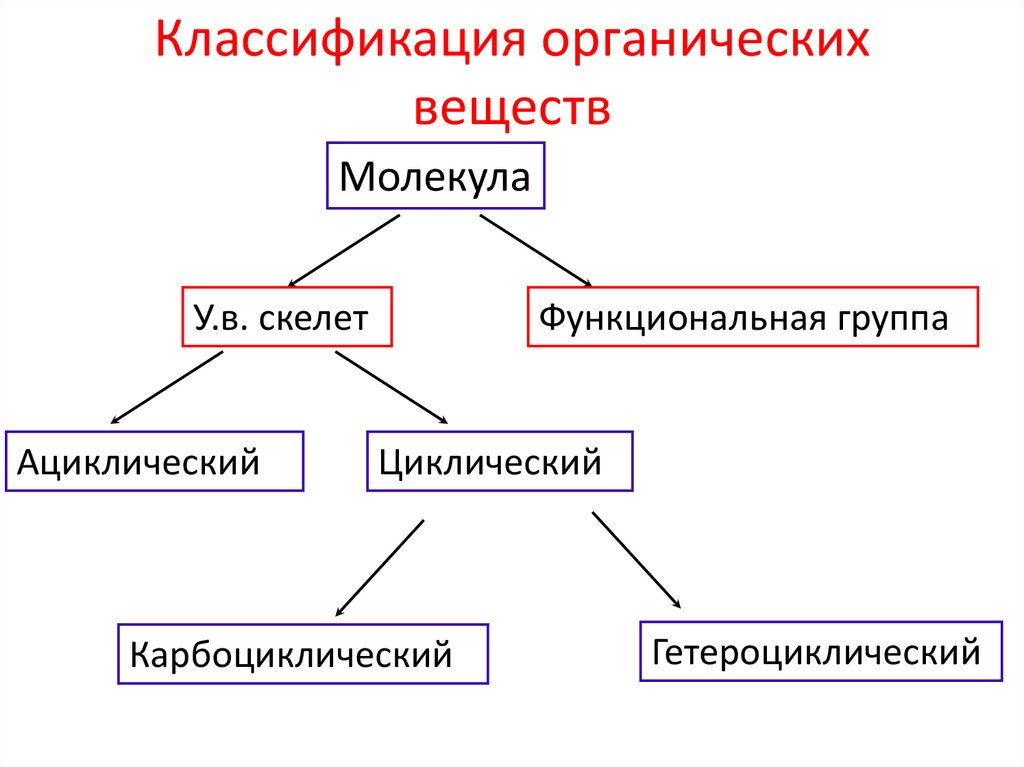
Классификация органическихвеществ
Молекула
У.в. скелет
Ациклический
Функциональная группа
Циклический
Карбоциклический
Гетероциклический
23.
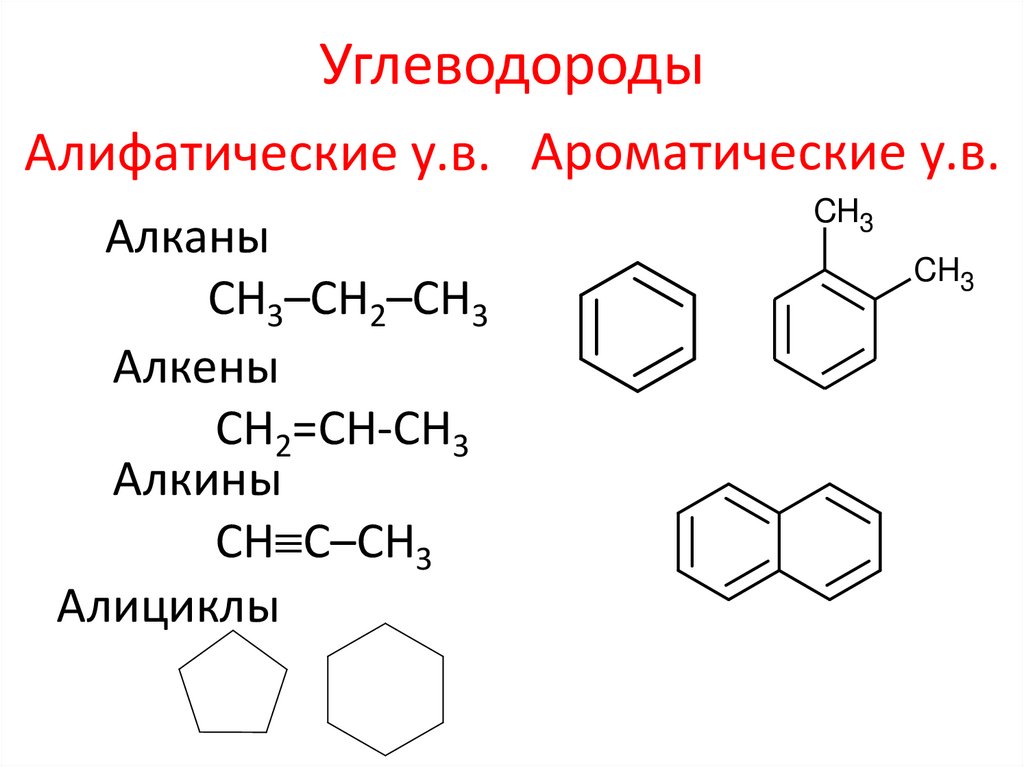
УглеводородыАлифатические у.в. Ароматические у.в.
Алканы
СН3–СН2–СН3
Алкены
СН2=СН-СН3
Алкины
СН С–СН3
Алициклы
CH3
CH3
24. Классификация органических веществ
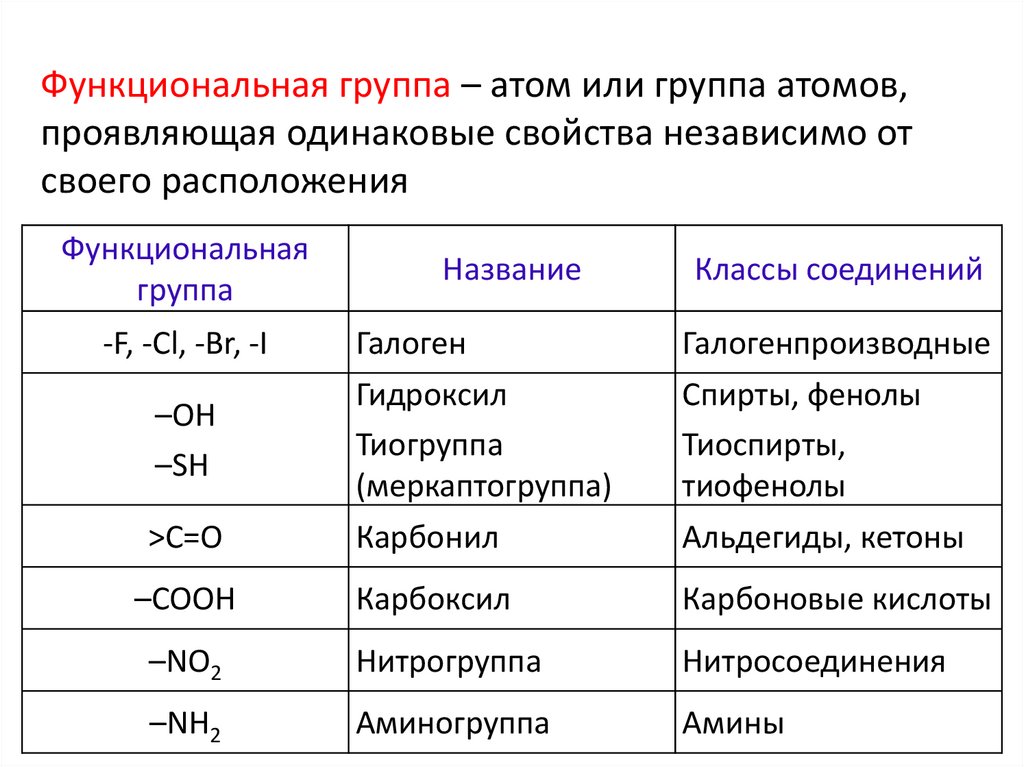
Функциональная группа – атом или группа атомов,проявляющая одинаковые свойства независимо от
своего расположения
Функциональная
группа
-F, -Cl, -Br, -I
Название
Классы соединений
Галоген
Галогенпроизводные
–OH
–SH
Гидроксил
Тиогруппа
(меркаптогруппа)
Спирты, фенолы
Тиоспирты,
тиофенолы
>C=O
Карбонил
Альдегиды, кетоны
–COOH
Карбоксил
Карбоновые кислоты
–NO2
Нитрогруппа
Нитросоединения
–NH2
Аминогруппа
Амины
25. Углеводороды
ГалогенпроизводныеF
CH3-I
Cl
Cl
F
Cl
F
F
H
F
H
F
Фреон-113
F
Фреон-134
H2 C
CH3
Cl
Cl
Cl
Cl
Cl
Cl
ПВХ
F
F
F
F
F
F
F
H3C
CH3
F
F
F
F
F
F
F
Политетрафторэтилен (тефлон)
26.
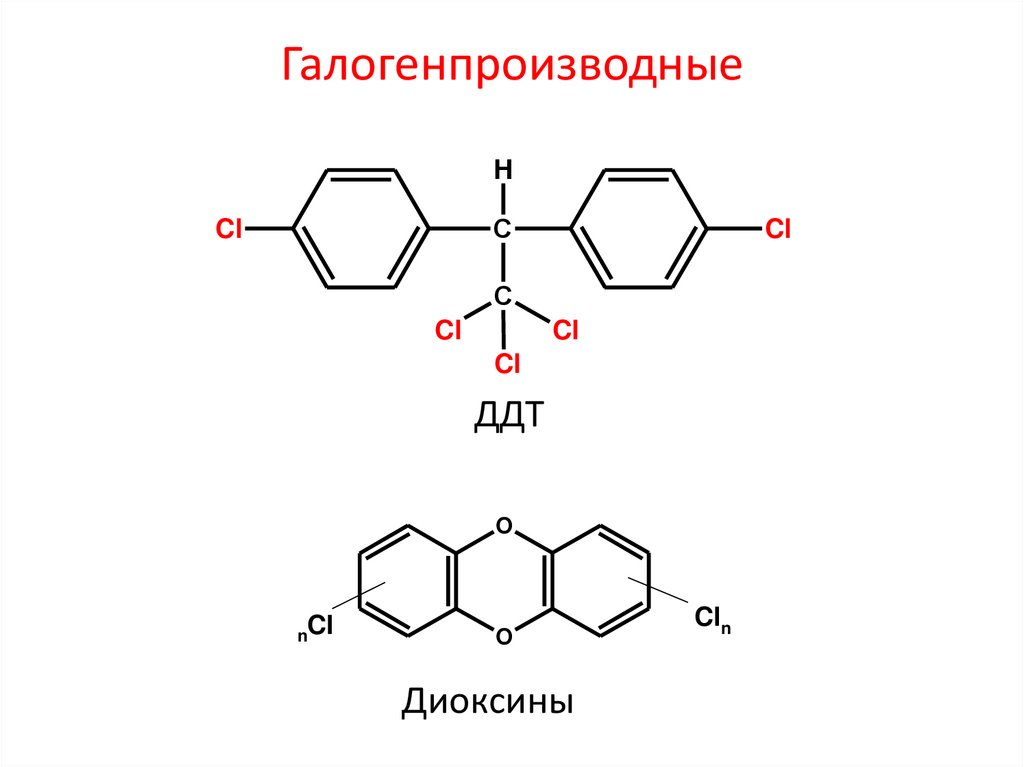
ГалогенпроизводныеH
С
Cl
Cl
С
Cl
Cl
Cl
ДДТ
O
nCl
O
Диоксины
Cln
27. Галогенпроизводные
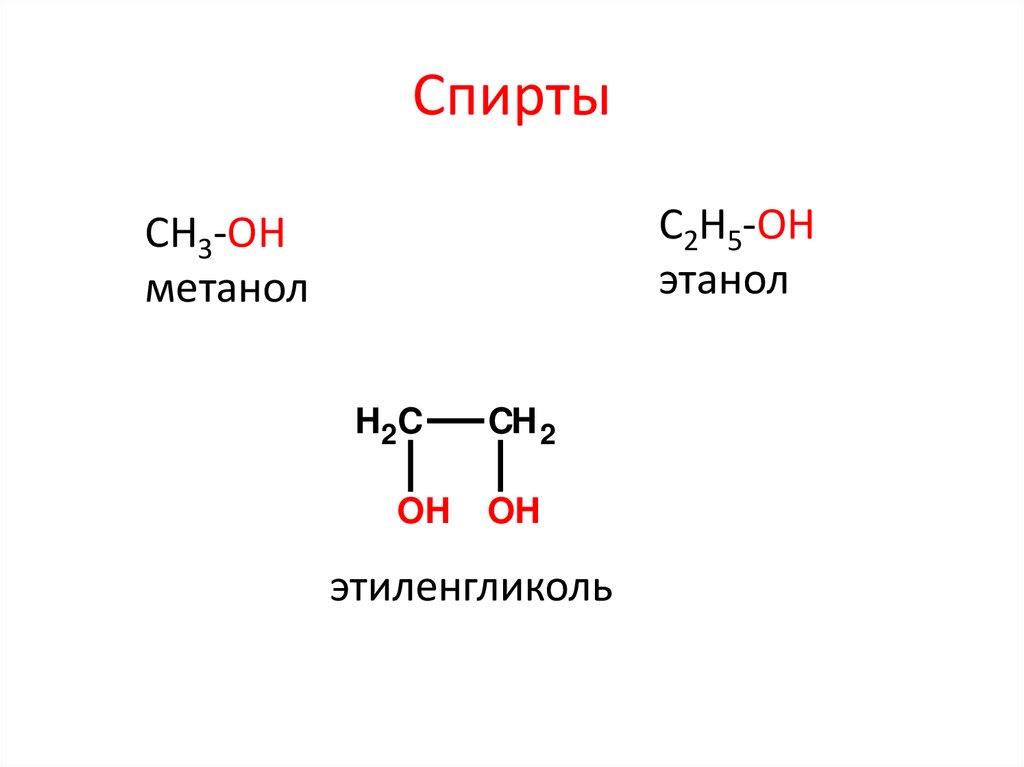
СпиртыС2Н5-ОН
этанол
CH3-OH
метанол
H 2C
OH
CH 2
OH
этиленгликоль
28. Галогенпроизводные
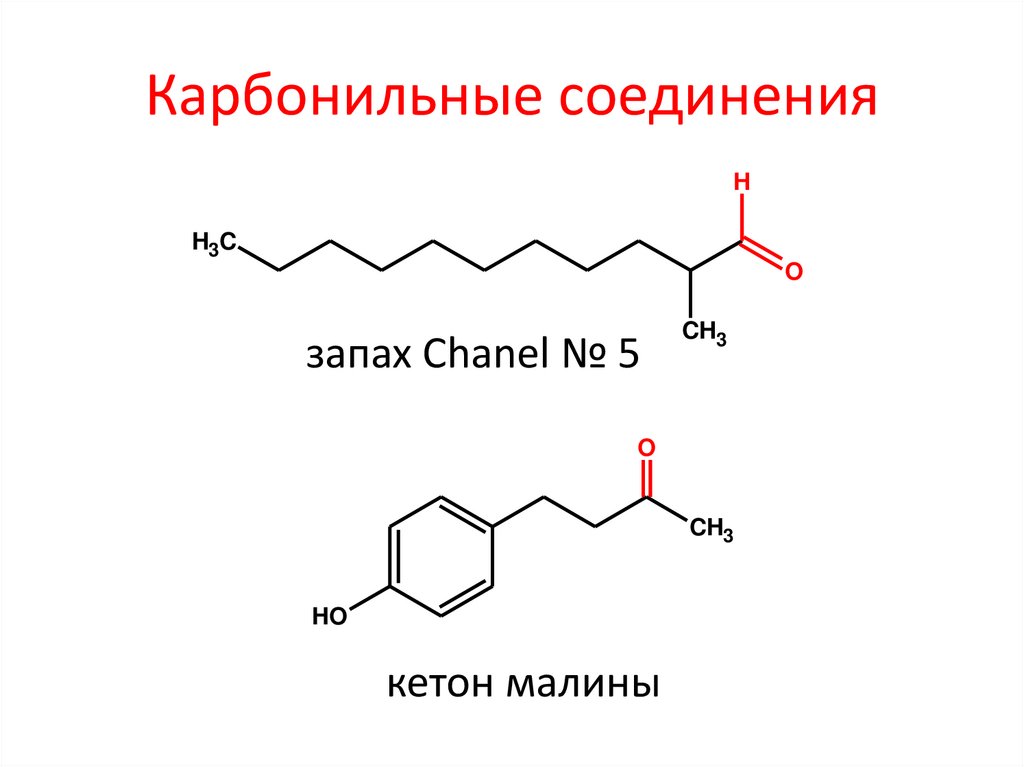
Карбонильные соединенияH
H3C
O
запах Chanel № 5
CH3
O
CH3
HO
кетон малины
29. Спирты
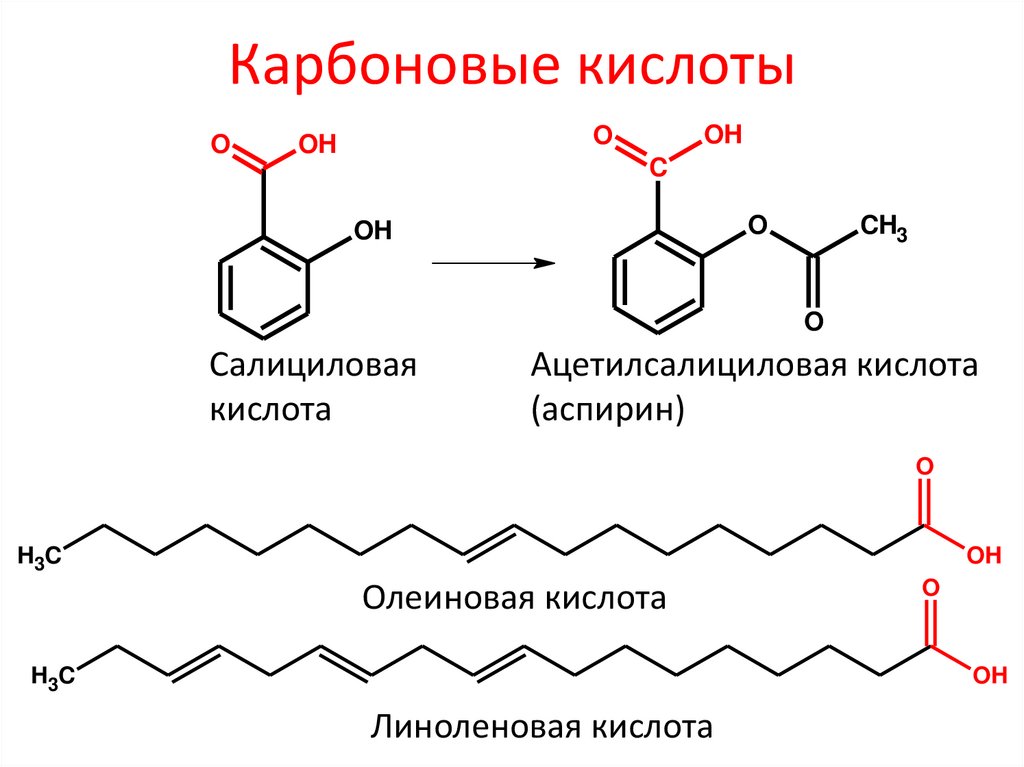
Карбоновые кислотыO
OH
O
OH
C
O
OH
CH3
O
Салициловая
кислота
Ацетилсалициловая кислота
(аспирин)
O
H3C
OH
Олеиновая кислота
H3C
O
OH
Линоленовая кислота
30. Карбонильные соединения
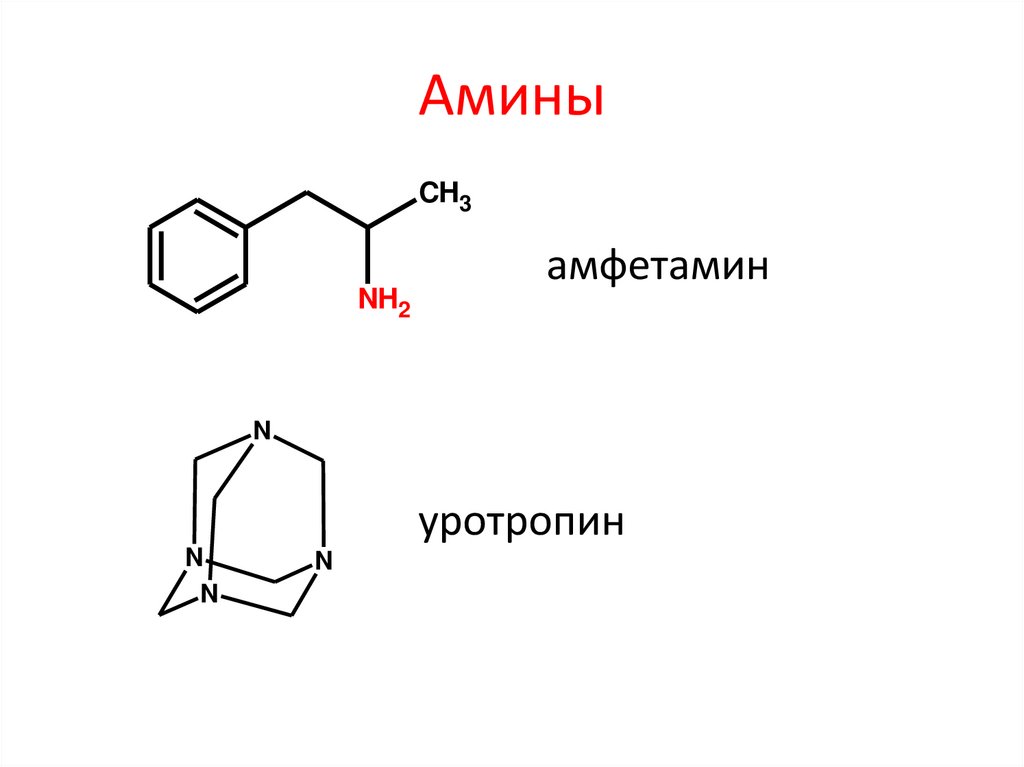
АминыCH3
NH2
амфетамин
N
уротропин
N
N
N
31. Карбоновые кислоты
НитросоединенияCH3
O 2N
NO2
Н2 С
O NO2
НС
O NO2
Н2 С
ONO2
нитроглицерин
NO2
ТНТ
32. Амины
Типы органических реакцийI. По способу разрыва связей
Радикальные: гомолитический разрыв с
образованием свободных радикалов
СН3 СН3 СН3 + СН3
Ионные: гетеролитический разрыв с
образованием ионов
СН3: СН3 СН3 + СН3
33. Нитросоединения
Типы органических реакцийII. По структурному признаку
1) Замещение (S)
2) Присоединение (Ad)
3) Отщепление (элиминирование) (E)
4) Полимеризация
5) ОВР
34. Типы органических реакций
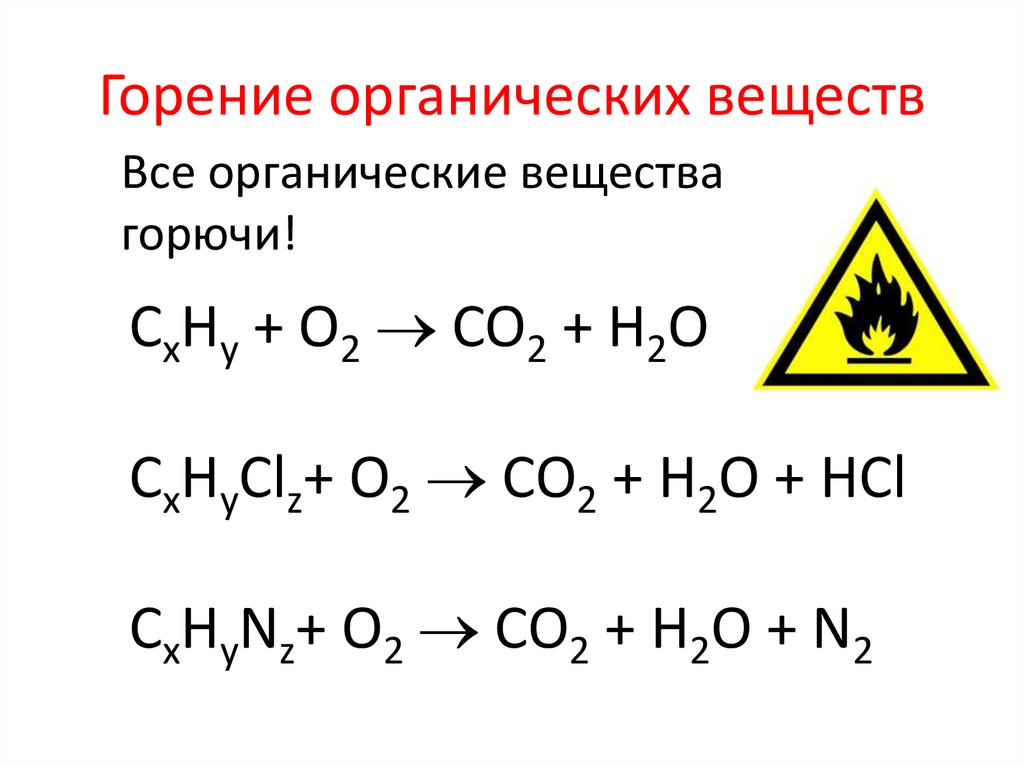
Горение органических веществВсе органические вещества
горючи!
СхHy + O2 CO2 + H2O
СхHyClz+ O2 CO2 + H2O + HCl
СхHyNz+ O2 CO2 + H2O + N2
35. Типы органических реакций
Газовые плитыметан СН4
Газовые баллоны
пропан С3Н8
Автогаз
пропан С3Н8
+ бутан С4Н10
Газовая сварка
ацетилен С2Н2
36. Горение органических веществ
37.
Удельная теплота сгоранияколичество теплоты, выделяющейся при
сгорании 1 кг жидкого или твердого
вещества и 1 м3 газообразного вещества
H 1000
Q
M
H 1000
Q
22,4
38.
Задачи (Д/з)1. При сгорании ацетилена развивается очень
высокая температура, что обусловлено высокой
теплотой сгорания ацетилена. На этом основана
ацетилено-кислородная сварка металлов.
Рассчитайте стандартную теплоту и удельную
теплоту сгорания ацетилена.
2. В бытовом газовом баллоне осталось 130 г
пропана. Хватит ли такого запаса, чтобы
вскипятить 1 л воды для приготовления чая, если
на это требуется около 420 кДж теплоты?
Рассчитайте стандартную теплоту и удельную
теплоту сгорания пропана (сравните с данными
для ацетилена).





















 Химия
Химия