Похожие презентации:
Аминокислоты
1. Аминокислоты.
Курский государственный медицинский университетКафедра биоорганической химии
Аминокислоты.
Пептиды и белки
2. Цель:
Получить представление овзаимосвязи химического строения и
биологической роли аминокислот,
пептидов и белков
3. План лекции
1. Медико-биологическое значение аминокислот, пептидов ибелков;
2. Строение, классификация аминокислот
3. Стереоизомерия α-аминокислот
4. Способы получения аминокислот
5. Общие и специфические химические свойства аминокислот
6. Химические свойства α-аминокислот in vitro;
7. Реакции α-аминокислот in vivo;
8. Первичная структура пептидов и белков;
9. Пространственное строение молекул белков.
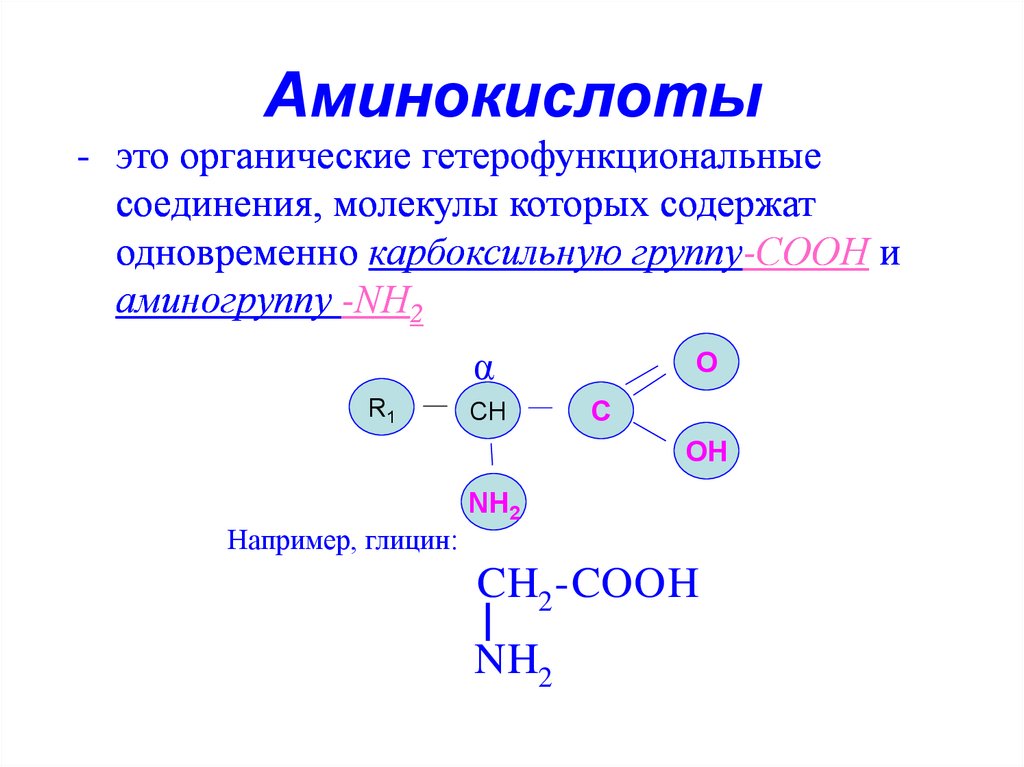
4. Аминокислоты
- это органические гетерофункциональныесоединения, молекулы которых содержат
одновременно карбоксильную группу-СООН и
аминогруппу -NН2
α
R1
СH
O
C
OH
NH2
Например, глицин:
CH2 -COOH
NH2
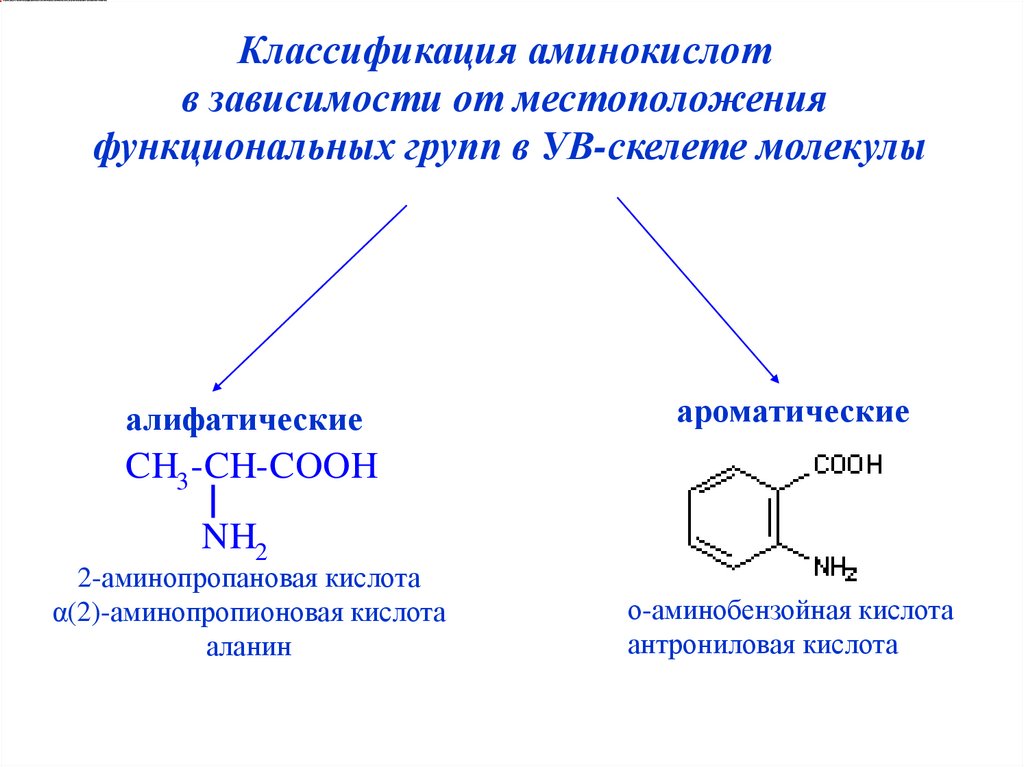
5.
Классификация аминокислотв зависимости от местоположения
функциональных групп в УВ-скелете молекулы
алифатические
ароматические
CH3 -CH-COOH
NH2
2-аминопропановая кислота
α(2)-аминопропионовая кислота
аланин
о-аминобензойная кислота
антрониловая кислота
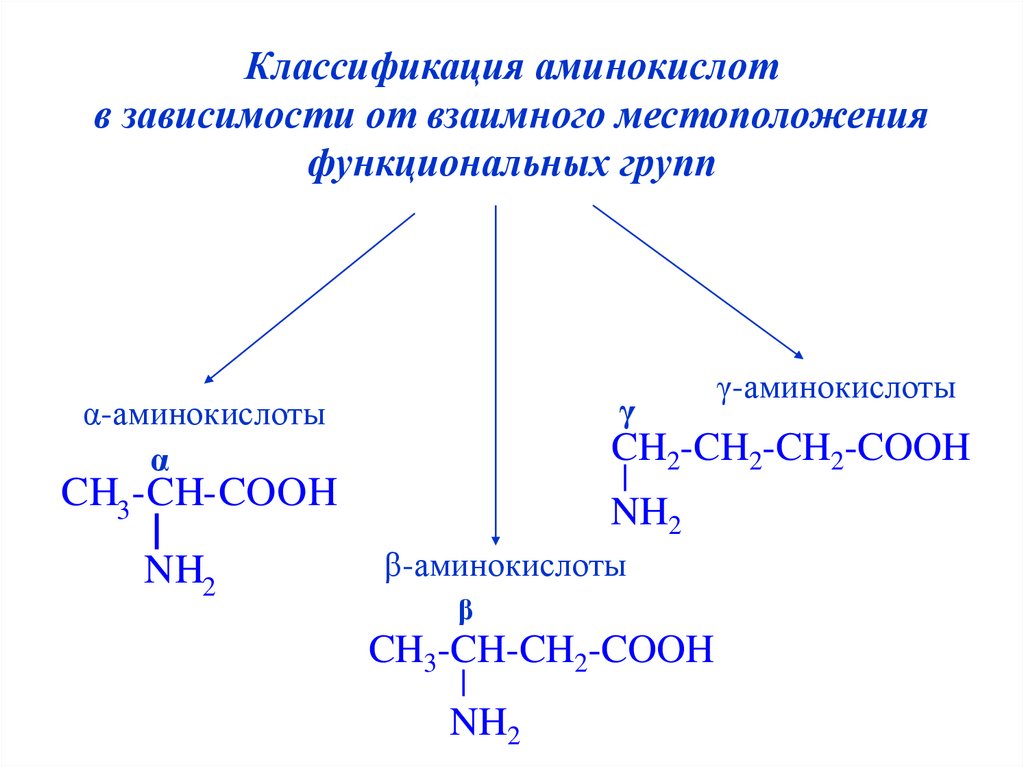
6.
Классификация аминокислотв зависимости от взаимного местоположения
функциональных групп
γ
α-аминокислоты
α
CH2-CH2-CH2-COOH
CH3 -CH-COOH
NH2
γ-аминокислоты
NH2
β-аминокислоты
β
CH3-CH-CH2-COOH
NH2
7. Принципы классификации α-аминокислот
Природа радикалаПо возможности синтеза
Число функциональных групп
(-СООН; -NH2)
8. Классификация
в зависимости от природы радикала R:R-CH-COOH
NH2
1 алифатические CH3 -CH-COOH
NH2
Аланин
2 ароматические
CH2 -CH-COOH
Фенилаланин NH2
3 гетероциклические N
N
H
CH2 -CH-COOH
NH2 Гистидин
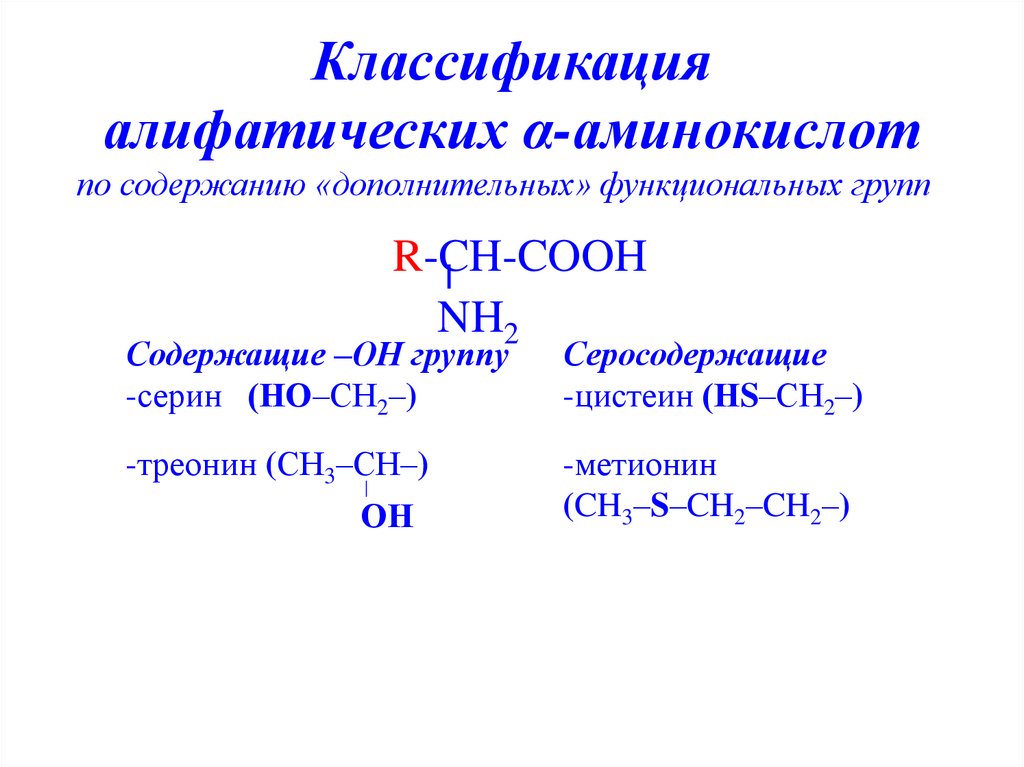
9. Классификация алифатических α-аминокислот
по содержанию «дополнительных» функциональных группR-CH-COOH
NH2
Содержащие –ОН группу
-серин (НО–СН2–)
Серосодержащие
-цистеин (НS–СН2–)
-треонин (СН3–СН–)
-метионин
(CH3–S–CH2–CH2–)
ОН
10. Классификация
в зависимости отчисла карбоксильных и аминогрупп
- Нейтральные – одна NH2 и одна СООН группы
Моноаминомонокарбоновые
CH3 -CH-COOH
Аланин
NH
2
- Основные – две NH2 и одна СООН группы
Диаминомонокарбоновые
H2 N-CH2 -CH2 -CH2 -CH2 -CH-COOH
Лизин
NH2
- Кислые - одна NH2 и две СООН группы
Моноаминодикарбоновые
HOOC-CH2 -CH-COOH
Аспарагиновая кислота
NH2
11. Классификация α-аминокислот по возможности синтеза
Заменимыесинтезируются в
организме
Незаменимые
не синтезируются в
организме
-валин
-лейцин
-изолейцин
-лизин
-треонин
-метионин
-фенилаланин
-триптофан
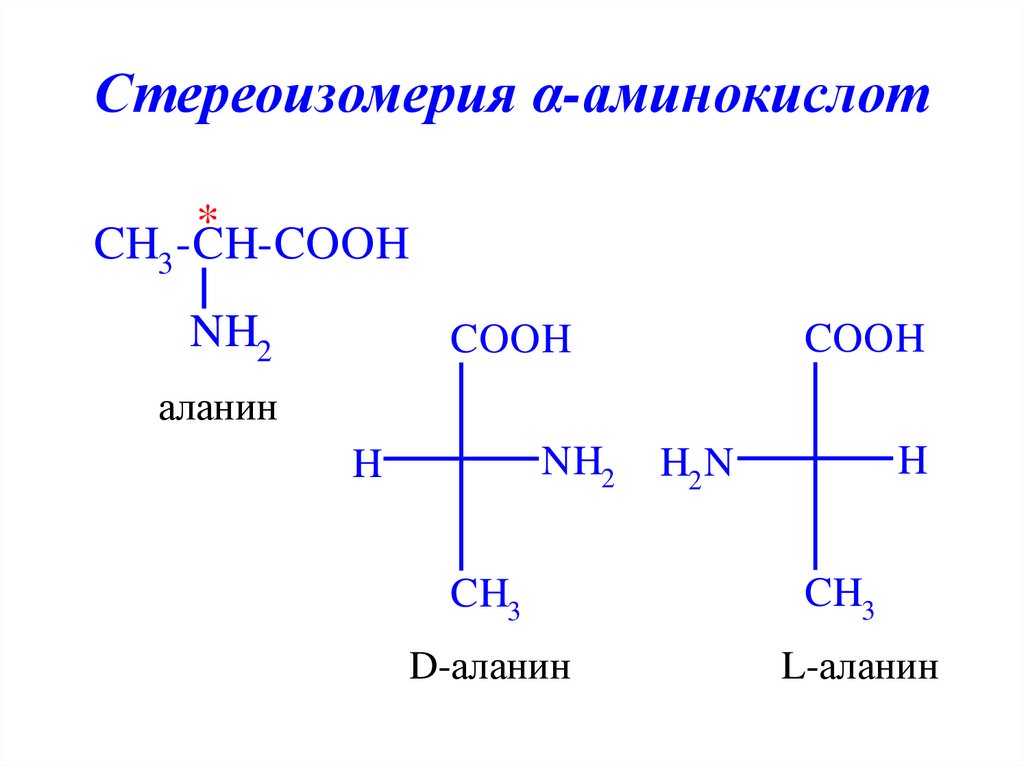
12. Стереоизомерия α-аминокислот
*CH3 -CH-COOH
NH2
COOH
COOH
аланин
NH2
H
CH3
D-аланин
H
H2 N
CH3
L-аланин
13. Получение аминокислот
Физические свойстваАминокислоты:
бесцветные кристаллические
вещества
сладкие на вкус
хорошо растворяются в воде
0
имеют температуру плавления 220 0
315 С.
14. Физические свойства
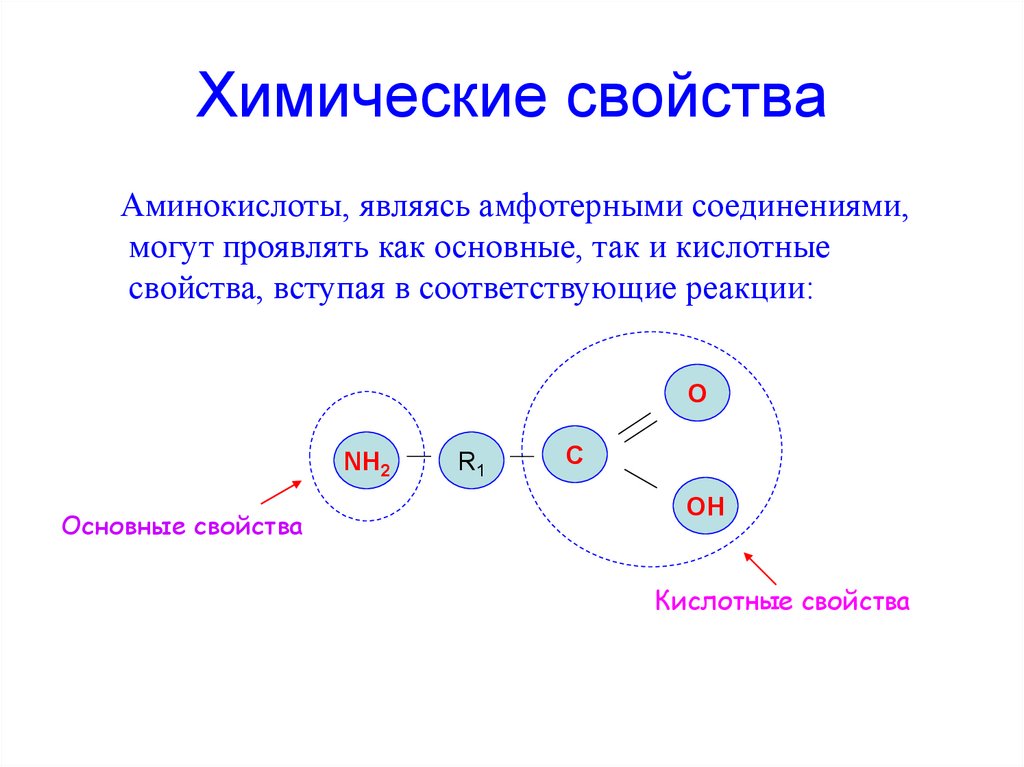
Химические свойстваАминокислоты, являясь амфотерными соединениями,
могут проявлять как основные, так и кислотные
свойства, вступая в соответствующие реакции:
О
NH2
Основные свойства
R1
C
OH
Кислотные свойства
15. Химические свойства
Основные свойства..
NH2
О
CH2
H+
C
Cl-
OH
О
NH3+
CH2
Cl-
C
OH
гидрохлорид
16. Основные свойства
Кислотные свойстваO
NH2
CH2
Na
C
OH
OH
О
NH2
CH2
H
C
ONa
OH
17. Кислотные свойства
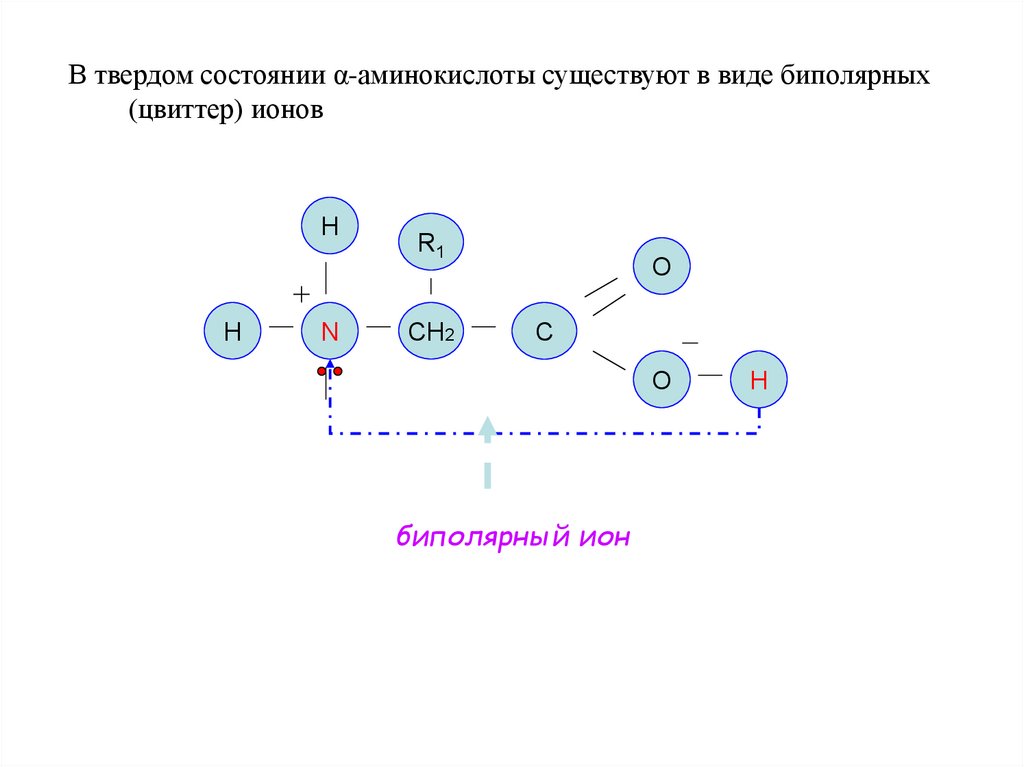
В твердом состоянии α-аминокислоты существуют в виде биполярных(цвиттер) ионов
H
H
N
R1
СН2
O
C
O
биполярный ион
H
18.
В водном растворе α-аминокислоты существуют в видеравновесной смеси
биполярного иона, катионной и анионной форм.
Положение равновесия зависит от pH среды
pH 1,0
сильнокислая среда
R-CH-COOH
+
NH3
катион
H
pH 7,0
+
R-CH-COO+
NH3
цвиттер-ион
pH 11,0
сильнощелочная среда
OH
R-CH-COONH2
анион
19.
Изоэлектрическая точка α-аминокислоты – это тозначение pH раствора, при котором большинство
молекул существуют в виде биполярных ионов, а
концентрации катионной и анионной форм
минимальны и равны.
20.
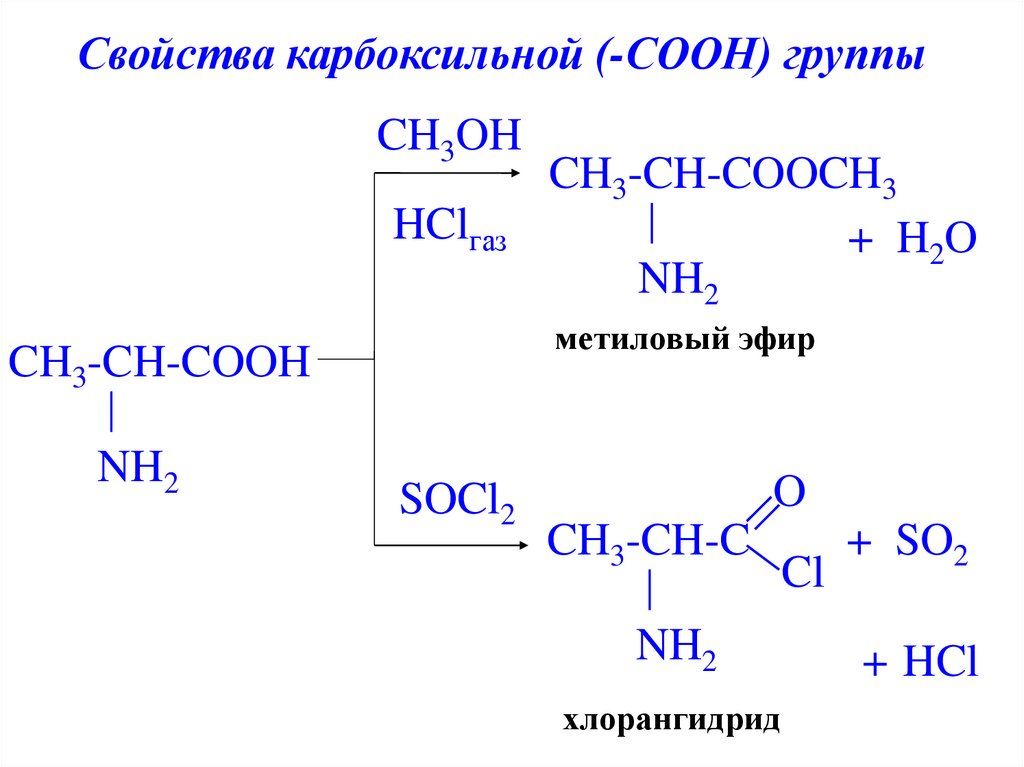
Свойства карбоксильной (-СООН) группыCH3OH
HClгаз
метиловый эфир
CH3-CH-COOH
NH2
CH3-CH-COOCH3
+ H 2O
NH2
SOCl2
O
CH3-CH-C
NH2
хлорангидрид
Cl
+ SO2
+ HCl
21.
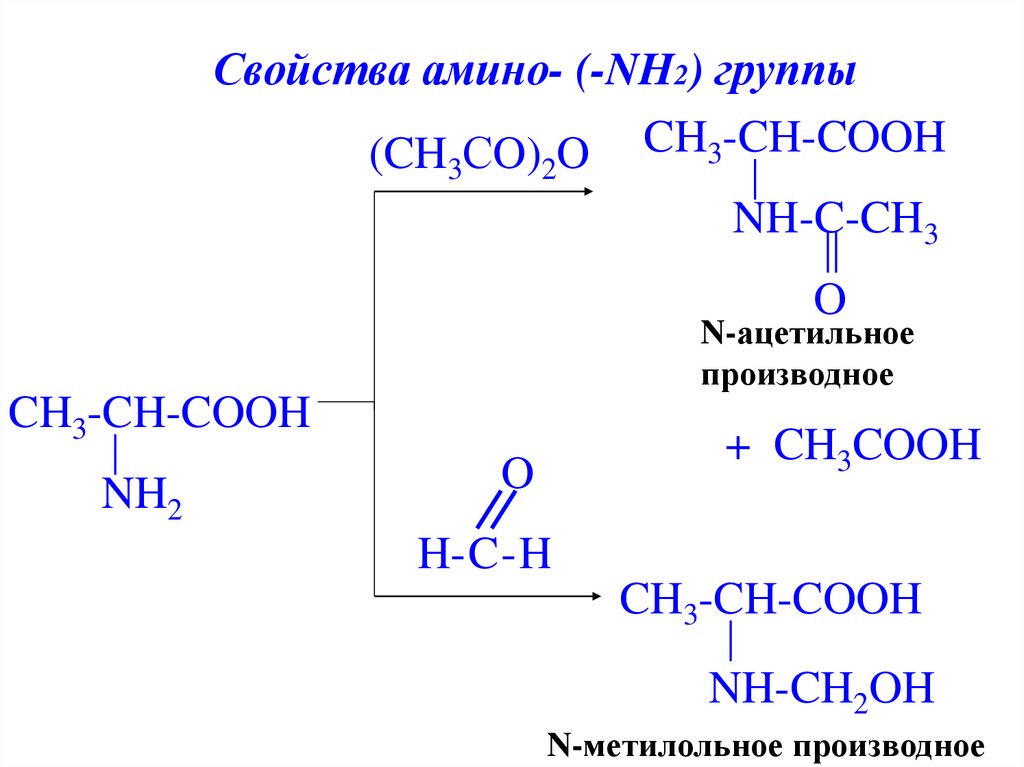
Свойства амино- (-NH2) группы(CH СO) O CH3-CH-COOH
3
2
NH-C-CH3
O
N-ацетильное
производное
CH3-CH-COOH
NH2
+ CH3COOH
O
H-C-H
CH3-CH-COOH
NH-CH2OH
N-метилольное производное
22.
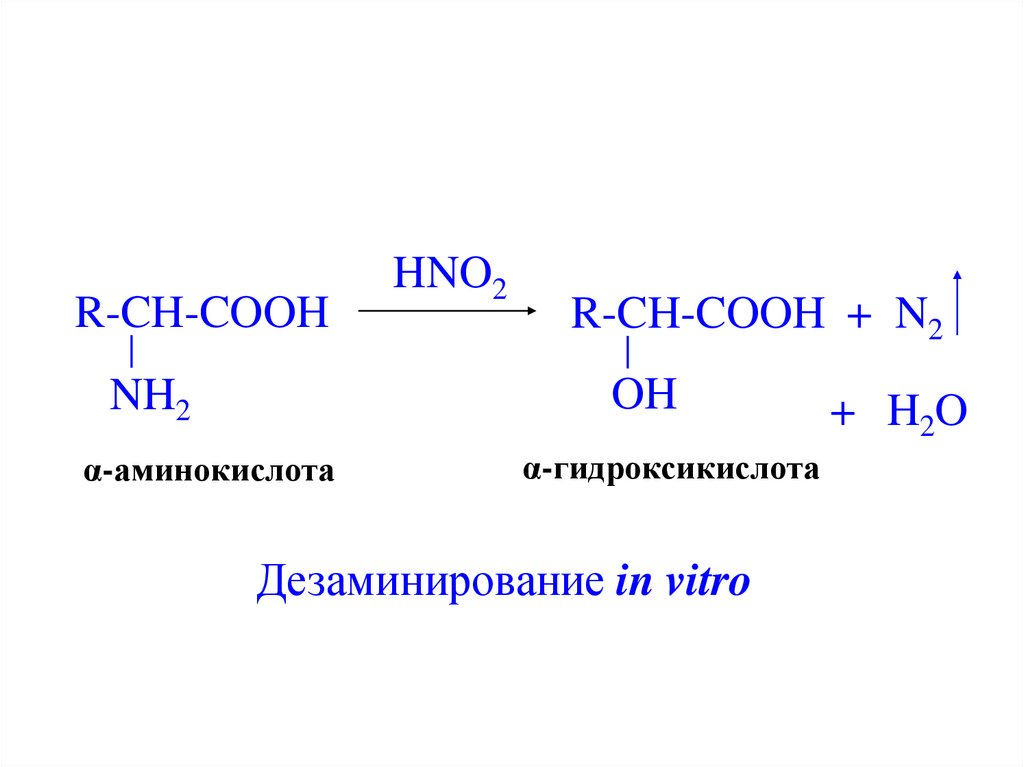
R-CH-COOHHNO2
R-CH-COOH + N2
OH
NH2
α-аминокислота
α-гидроксикислота
Дезаминирование in vitro
+ H 2O
23.
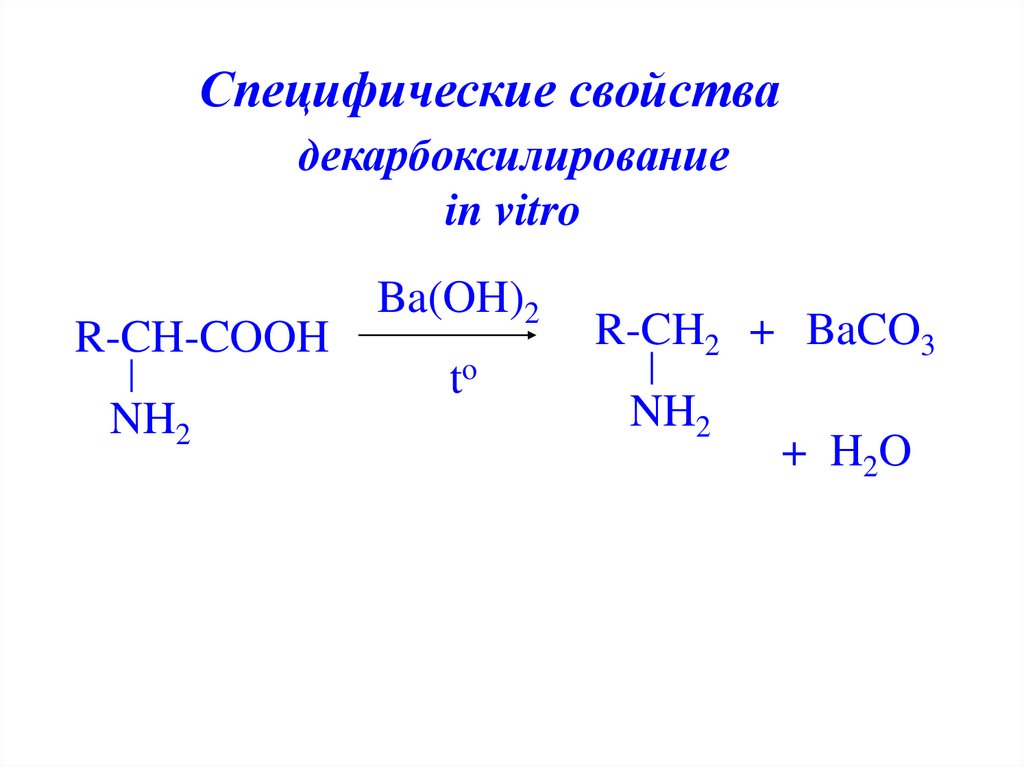
Специфические свойствадекарбоксилирование
in vitro
R-CH-COOH
NH2
Ba(OH)2
to
R-CH2 + BaCO3
NH2
+ H 2O
24. декарбоксилирование in vitro
Специфические свойстваα-аминокислот
O
CH3-CH-C
OH
HN
H +
H
NH
HO
C-CH-CH3
O
to
H3 C
HC
HN
C
NH
C
O
O
+ 2 H2O
CH
CH3
дикетопиперазин
25. Специфические свойства α-аминокислот
Качественные реакции на α-аминокислотыO
H2 N
C
R-CH
OH
+ Cu2+ +
NH2
CH-R
HO
C
O
O
C
R-CH
H2N
O
NH2
Cu
O
O
CH-R
C
комплексная медная соль α-аминокислоты
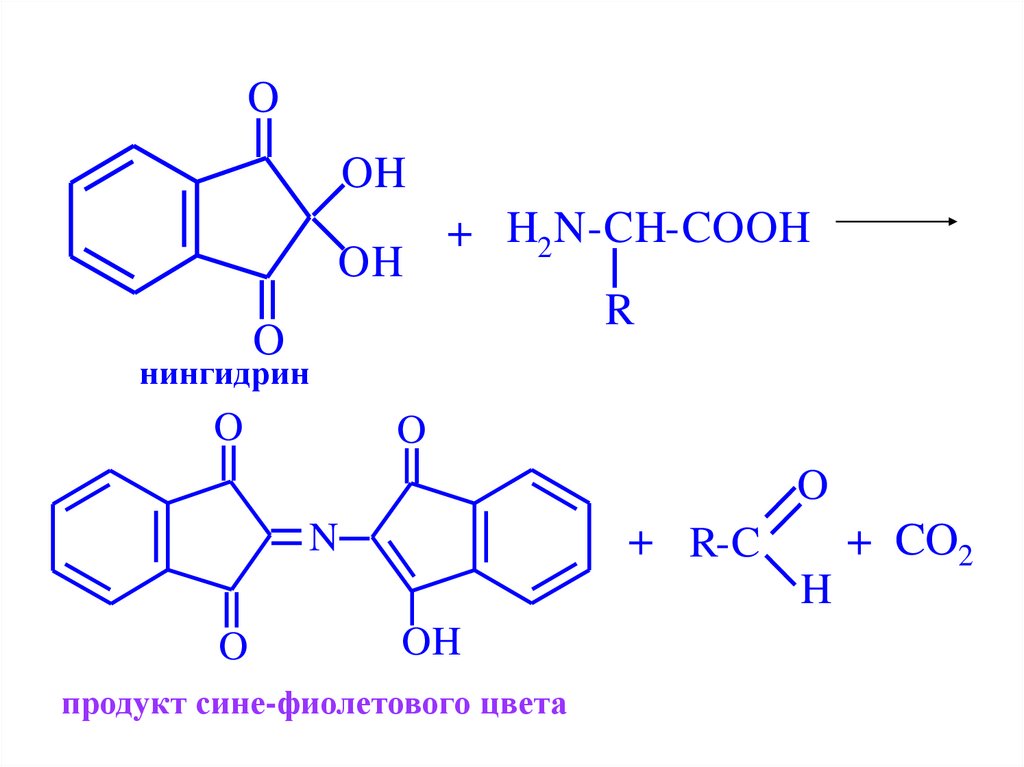
26.
OOH
OH
+ H2 N-CH-COOH
R
O
нингидрин
O
O
O
N
+ R-C
+ CO2
H
O
OH
продукт сине-фиолетового цвета
27.
Качественная реакция на ароматическиеα-аминокислоты (ксантопротеиновая)
HNO3
CH2 -CH-COOH
HO
тирозин
to
NH2
NaOH
HO
O2 N
CH2 -CH-COOH
NH2
продукт нитрования
продукт
оранжевого
цвета
28. Качественная реакция на ароматические α-аминокислоты (ксантопротеиновая)
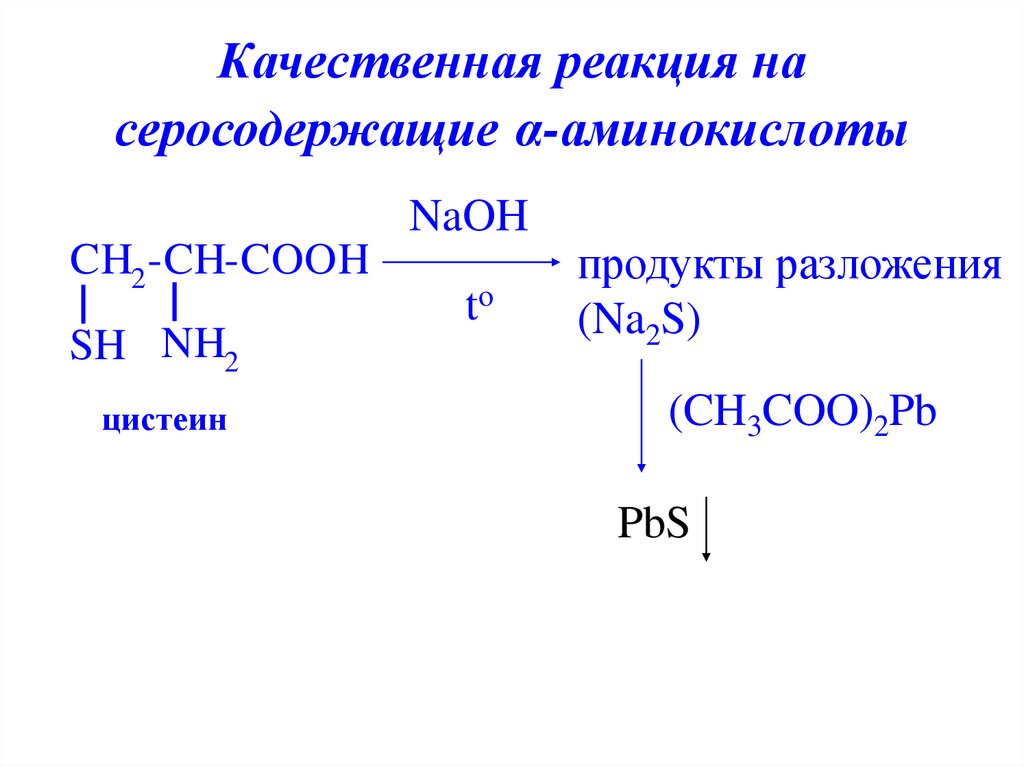
Качественная реакция насеросодержащие α-аминокислоты
NaOH
CH2 -CH-COOH
SH NH2
цистеин
to
продукты разложения
(Na2S)
(CH3COO)2Pb
PbS
29. Качественная реакция на серосодержащие α-аминокислоты
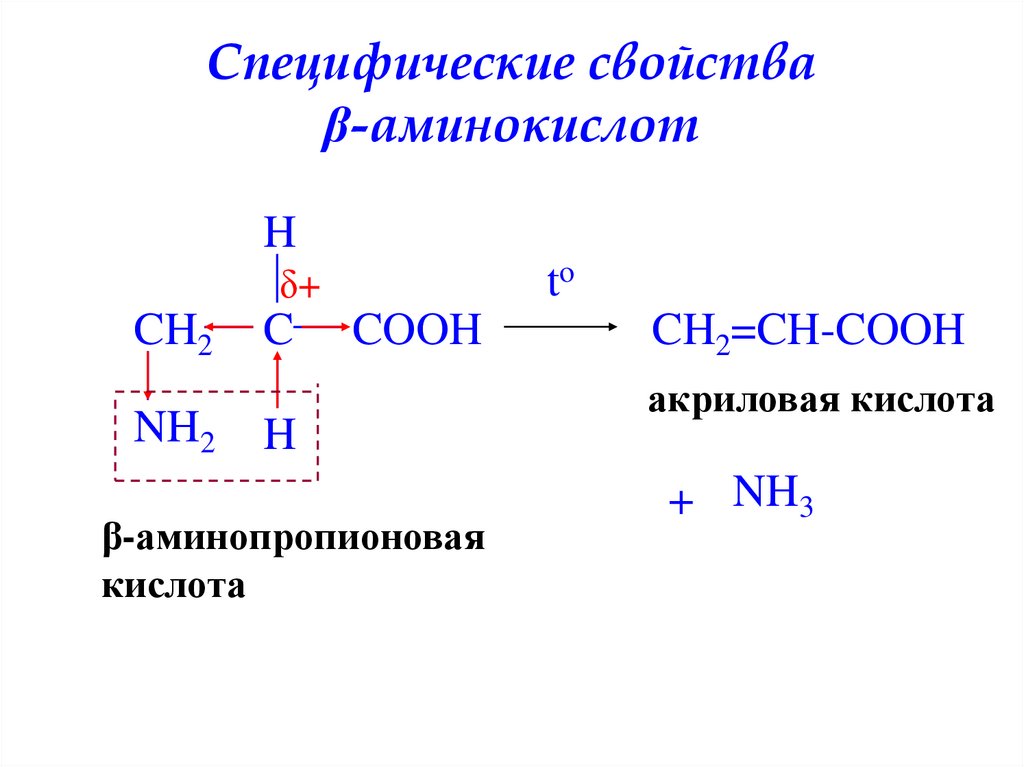
Специфические свойстваβ-аминокислот
H
to
δ+
CH2
NH2
C
COOH
H
β-аминопропионовая
кислота
CH2=CH-COOH
акриловая кислота
+ NH3
30. Специфические свойства β-аминокислот
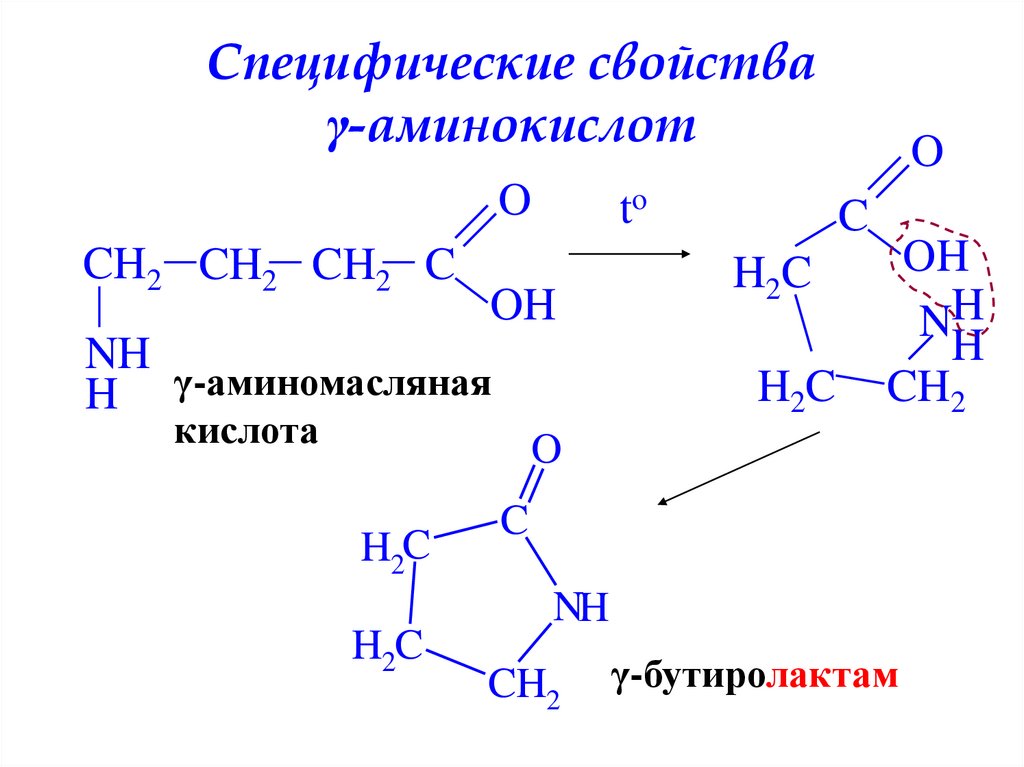
Специфические свойстваγ-аминокислот
O
CH2 CH2 CH2 C
to
OH
NH
H γ-аминомасляная
C
H 2C
H 2C
кислота
O
OH
NH
H
CH2
O
H2C
H2C
C
NH
CH2
γ-бутиролактам
31. Специфические свойства γ-аминокислот
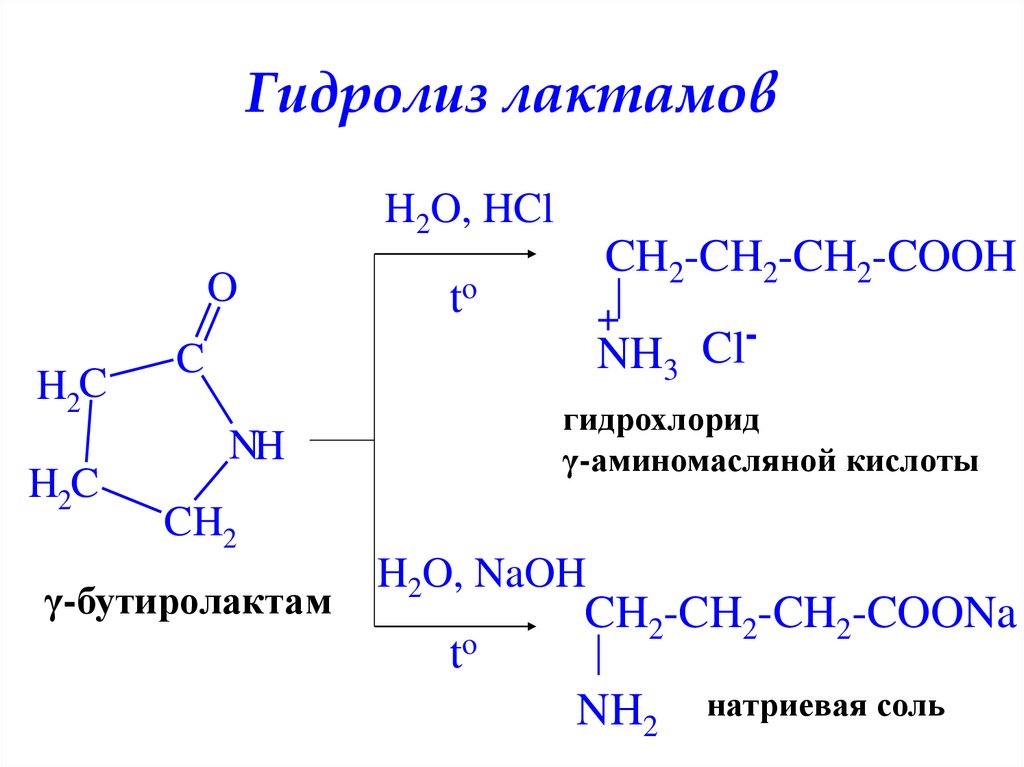
Гидролиз лактамовH2O, HCl
O
H2C
H2C
CH2-CH2-CH2-COOH
to
+
Cl
NH3
C
гидрохлорид
γ-аминомасляной кислоты
NH
CH2
γ-бутиролактам
H2O, NaOH
to
CH2-CH2-CH2-COONa
NH2
натриевая соль
32. Гидролиз лактамов
Реакции α-аминокислот in vivo• декарбоксилирование
• дезаминирование
- окислительное;
- неокислительное
• переаминирование
• образование пептидной связи
33. Реакции α-аминокислот in vivo
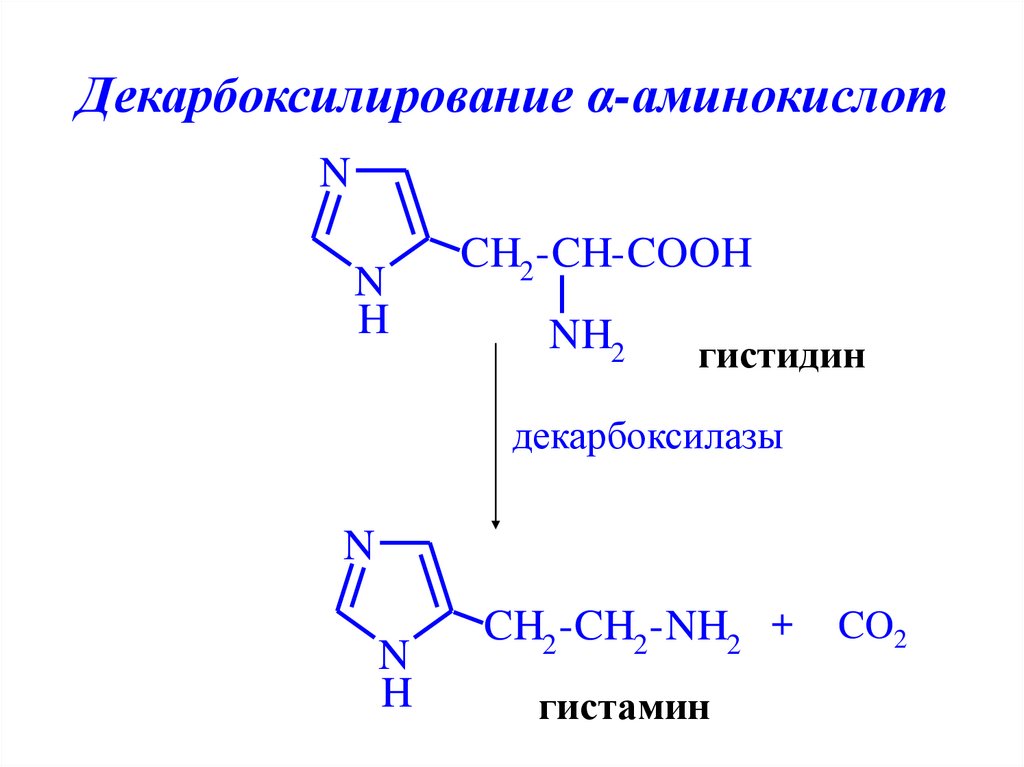
Декарбоксилирование α-аминокислотN
N
H
CH2 -CH-COOH
NH2
гистидин
декарбоксилазы
N
N
H
CH2 -CH2 -NH2 +
гистамин
CO2
34. Декарбоксилирование α-аминокислот
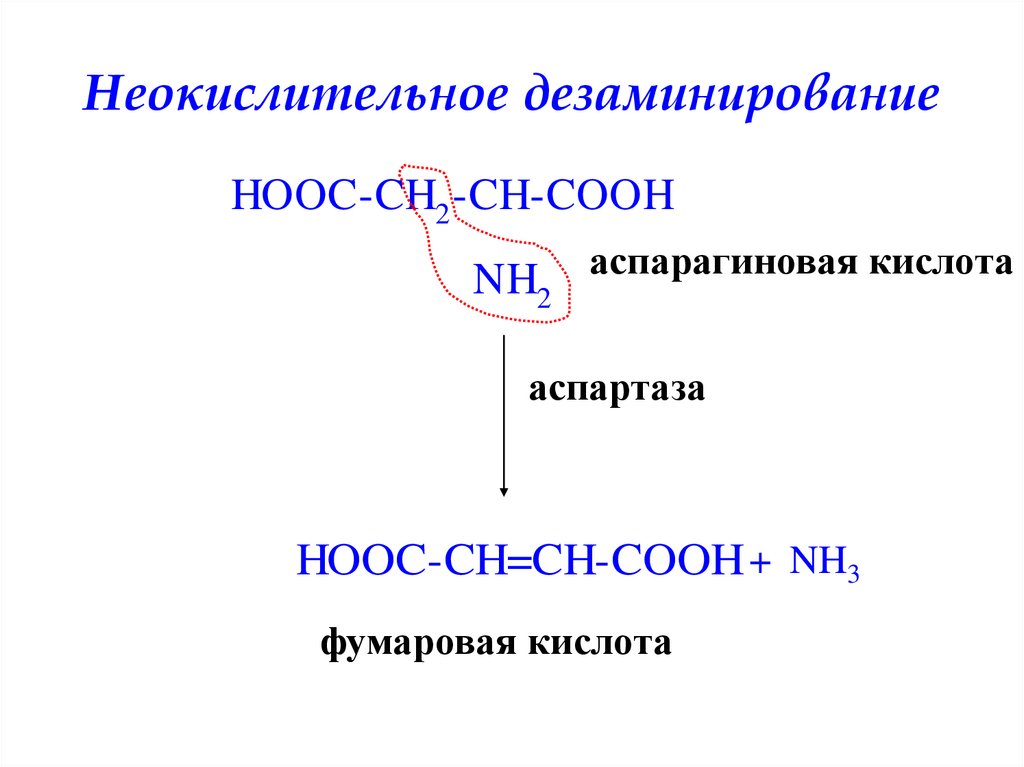
Неокислительное дезаминированиеHOOC-CH2 -CH-COOH
NH2 аспарагиновая кислота
аспартаза
HOOC-CH=CH-COOH + NH3
фумаровая кислота
35. Неокислительное дезаминирование
Окислительное дезаминирование[O]
CH3 -CH-COOH
фермент
NH
NH2
α-иминокислота
аланин
H2O
фермент
CH3 -C-COOH
CH3 -C-COOH + NH3
O пировиноградная
кислота
36. Окислительное дезаминирование
Реакция переаминированияфермент
HOOC-CH2 -CH-COOH + CH3 -C-COOH
O
NH2
аспарагиновая
кислота
пировиноградная
кислота
HOOC-CH2 -C-COOH + CH3 -CH-COOH
O
щавелевоуксусная
кислота
NH2
аланин
37. Реакция переаминирования
Методы количественногоопределения α-аминокислот
- метод формольного титрования;
- метод Фишера;
- метод Ван-Слайка;
- электрофорез
38. Методы количественного определения α-аминокислот
Пептиды и белки39. Пептиды и белки
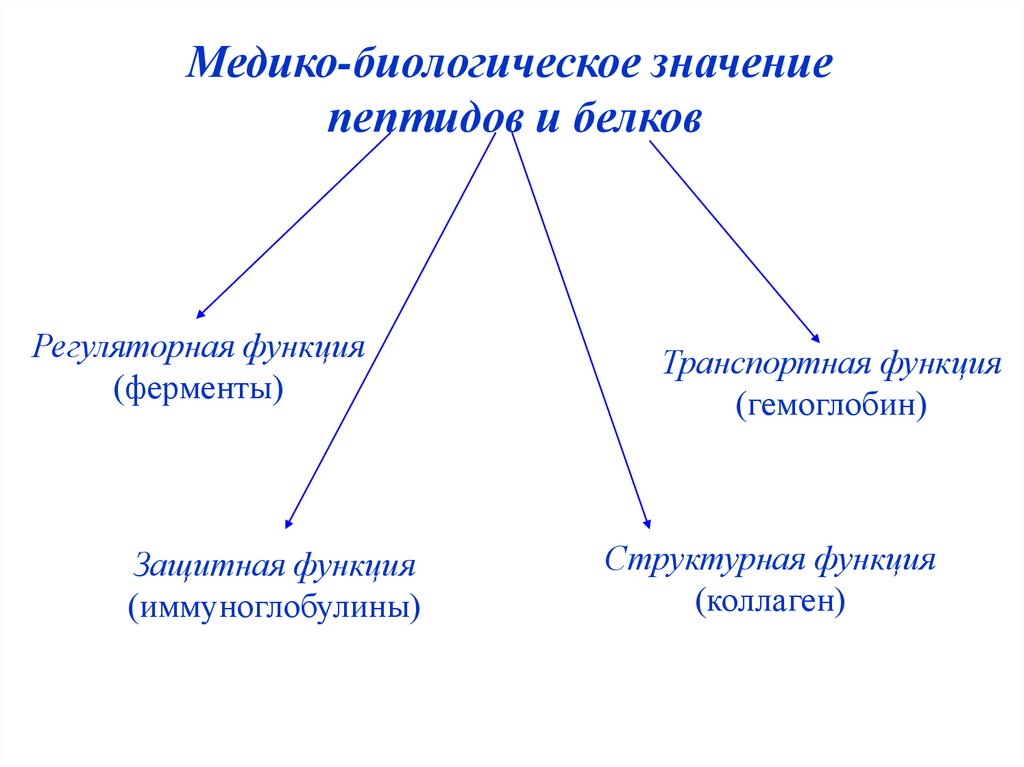
Медико-биологическое значениепептидов и белков
Регуляторная функция
(ферменты)
Защитная функция
(иммуноглобулины)
Транспортная функция
(гемоглобин)
Структурная функция
(коллаген)
40.
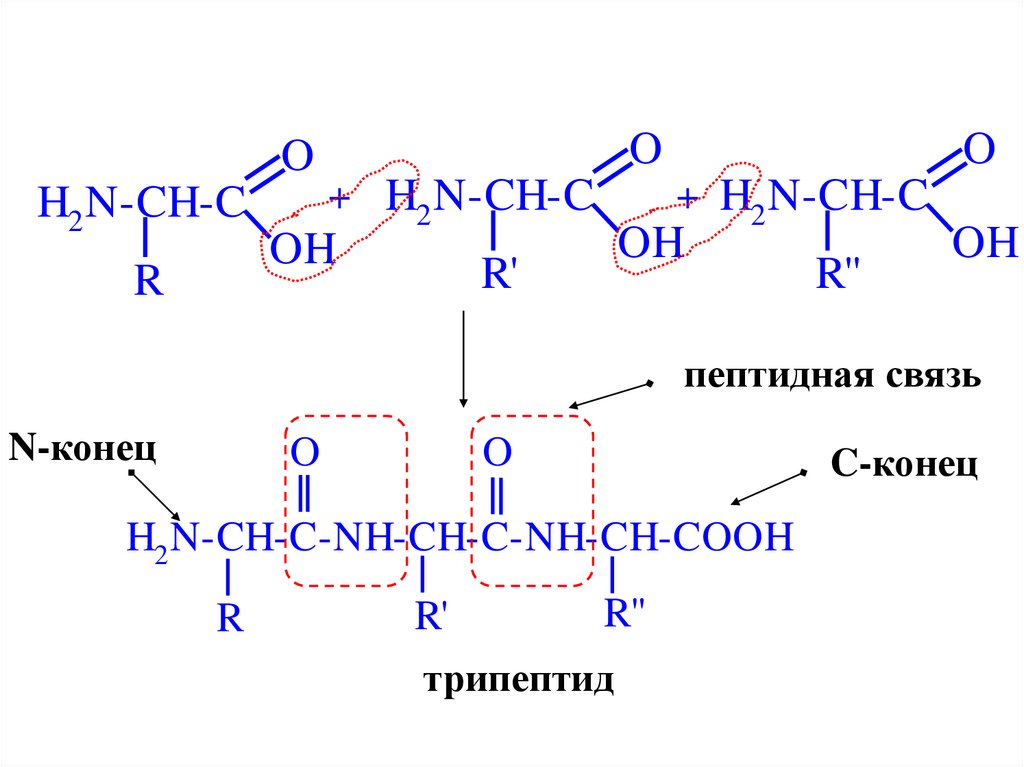
OH2 N-CH-C
R
O
+ H2 N-CH-C
OH
R'
O
+ H2 N-CH-C
OH
R''
OH
пептидная связь
N-конец
O
O
H2 N-CH-C-NH-CH-C-NH-CH-COOH
R
R"
R'
трипептид
C-конец
41.
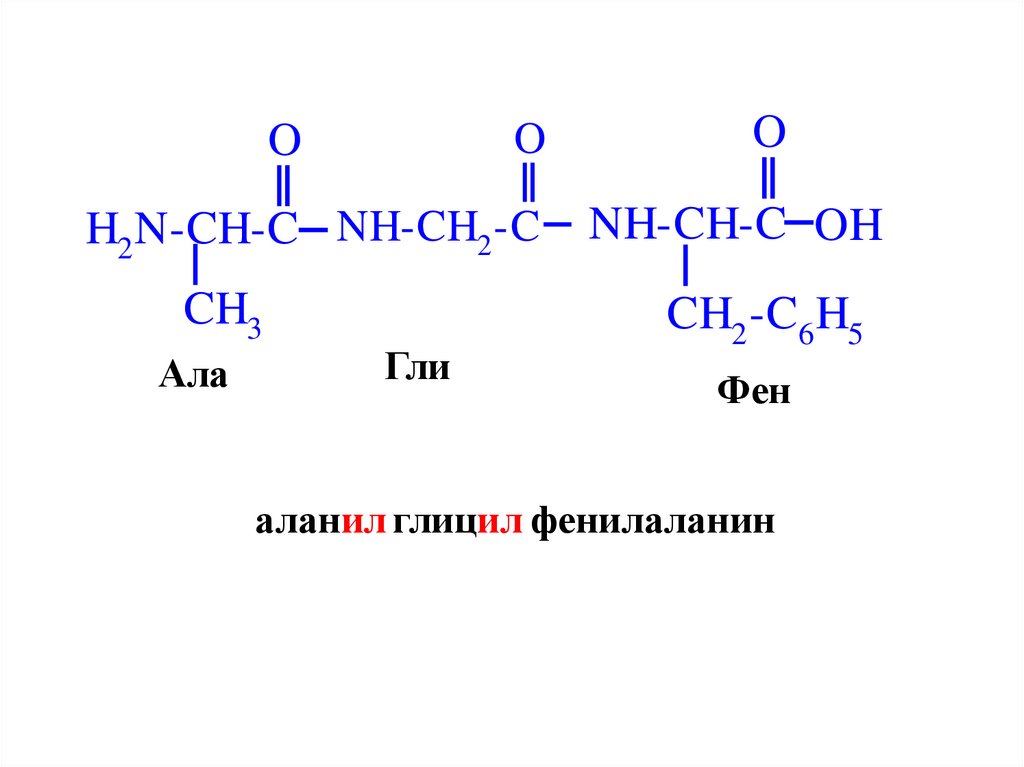
OO
H2 N-CH-C NH-CH2 -C
CH3
Ала
Гли
O
NH-CH-C OH
CH2 -C6 H5
Фен
аланил глицил фенилаланин
42.
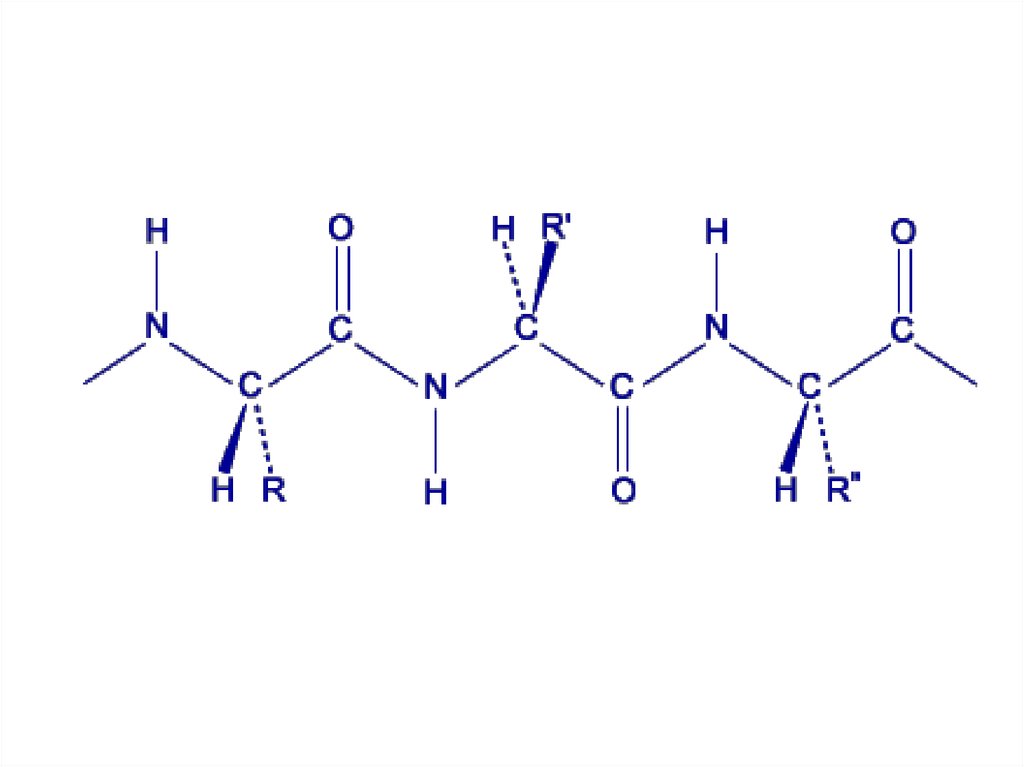
Электронное строение пептиднойсвязи
O
H
C .. C
N
H
R
O
C
N
H
43.
44. Электронное строение пептидной связи
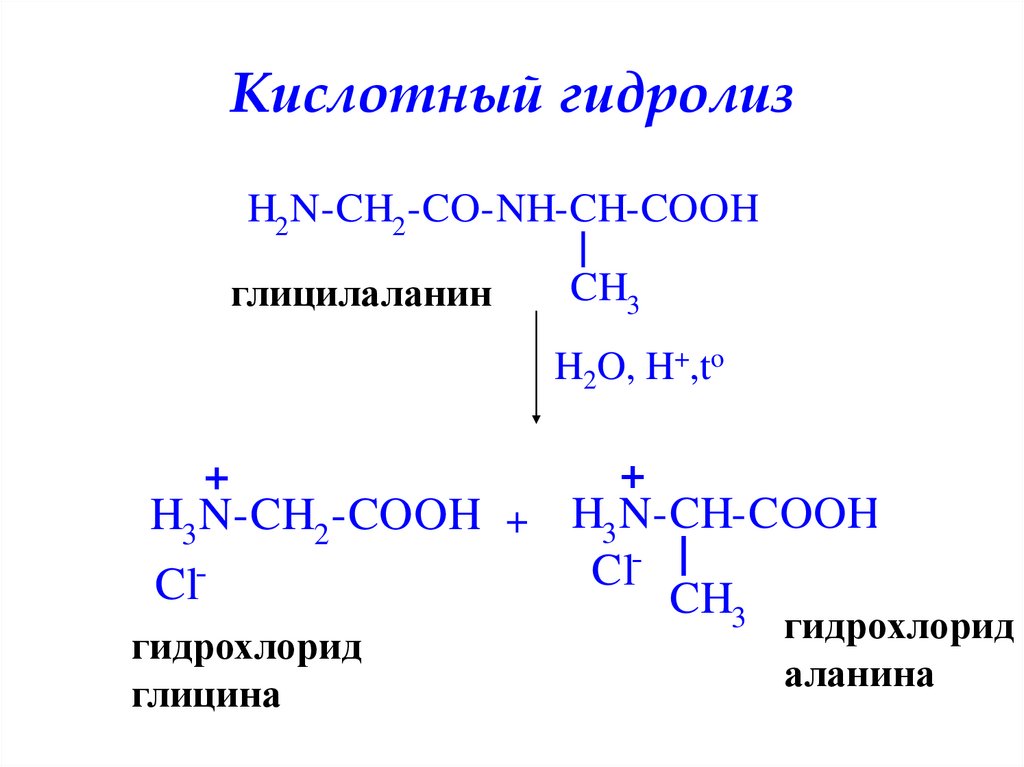
Кислотный гидролизH2 N-CH2 -CO-NH-CH-COOH
глицилаланин
CH3
H2O, H+,to
+
+
H3 N-CH2 -COOH + H3 N-CH-COOH
Cl
Cl
CH
гидрохлорид
глицина
3
гидрохлорид
аланина
45.
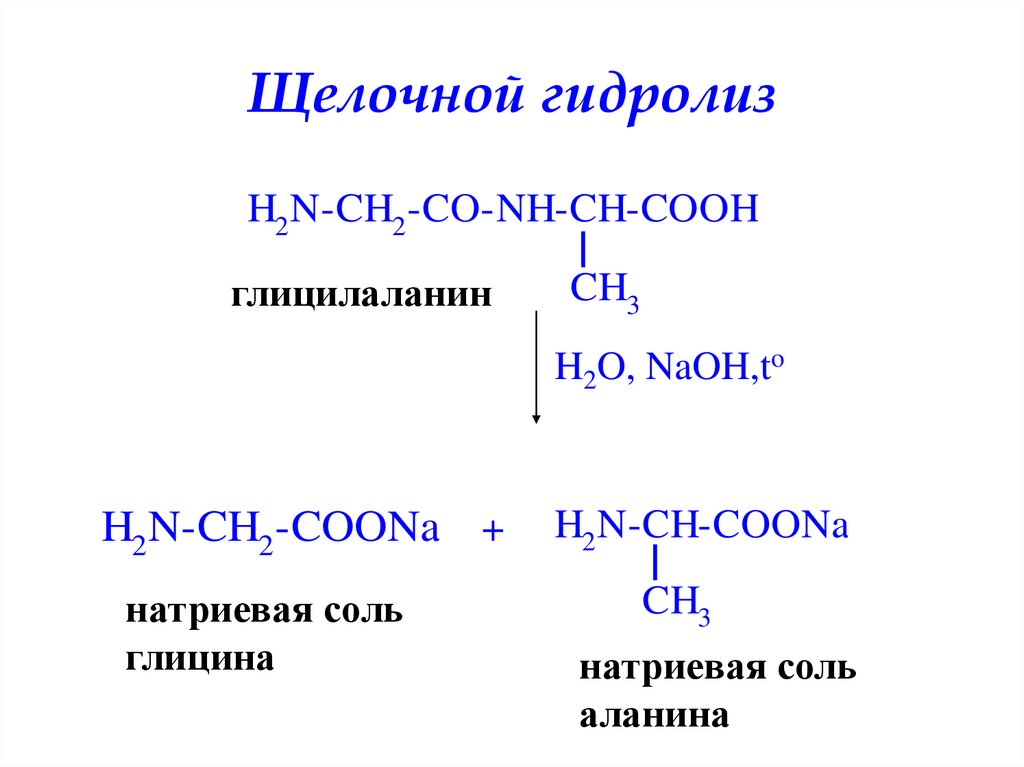
Щелочной гидролизH2 N-CH2 -CO-NH-CH-COOH
глицилаланин
CH3
H2O, NaOH,to
H2 N-CH2 -COONa +
натриевая соль
глицина
H2 N-CH-COONa
CH3
натриевая соль
аланина
46. Кислотный гидролиз
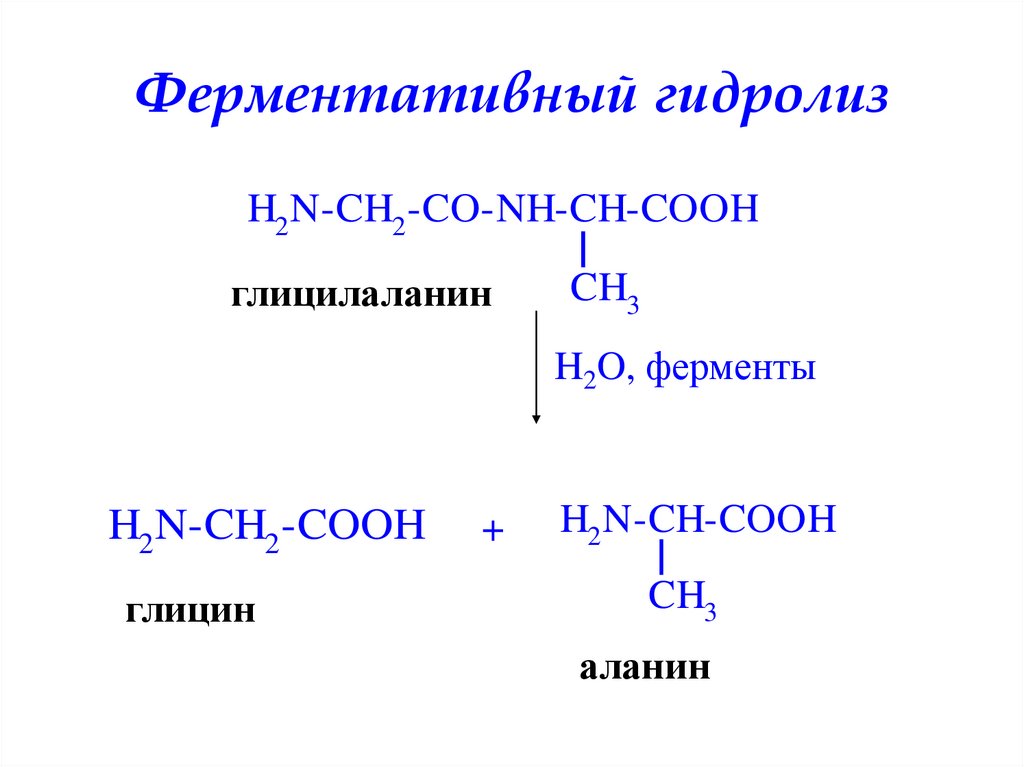
Ферментативный гидролизH2 N-CH2 -CO-NH-CH-COOH
глицилаланин
CH3
H2O, ферменты
H2 N-CH2 -COOH
глицин
+
H2 N-CH-COOH
CH3
аланин
47. Щелочной гидролиз
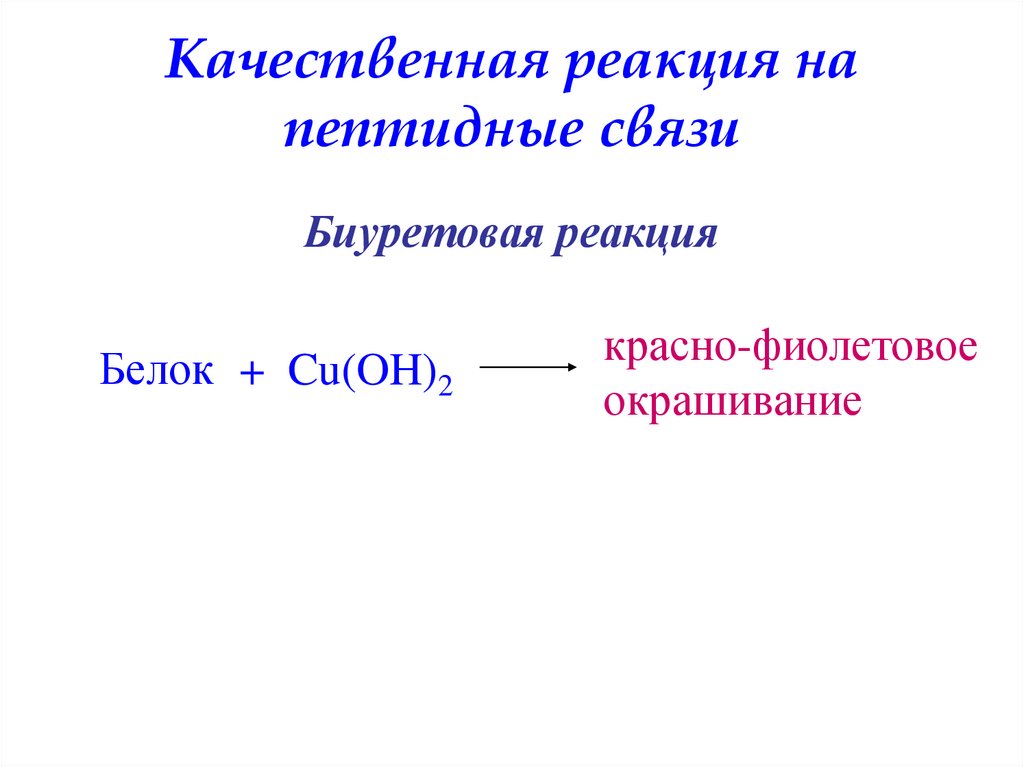
Качественная реакция напептидные связи
Биуретовая реакция
Белок + Cu(OH)2
красно-фиолетовое
окрашивание
48. Ферментативный гидролиз
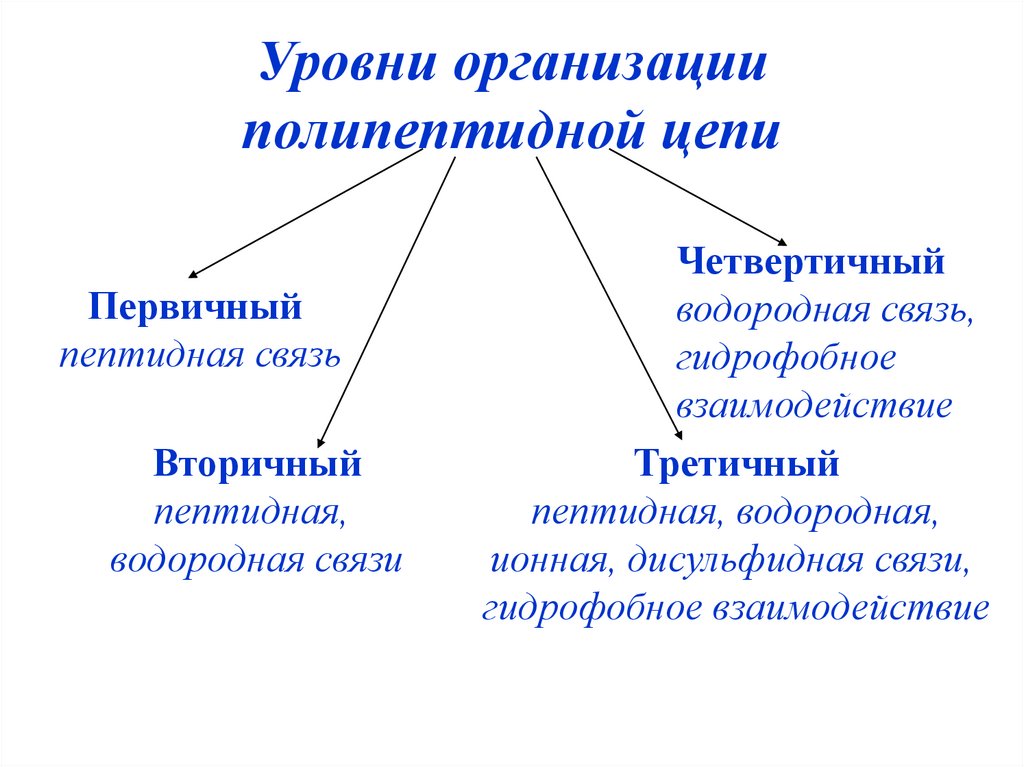
Уровни организацииполипептидной цепи
Первичный
пептидная связь
Вторичный
пептидная,
водородная связи
Четвертичный
водородная связь,
гидрофобное
взаимодействие
Третичный
пептидная, водородная,
ионная, дисульфидная связи,
гидрофобное взаимодействие
49. Качественная реакция на пептидные связи
Первичная структура белка – это определеннаяаминокислотная последовательность,
т.е.порядок чередования аминокислотных остатков
в молекуле белка.
Цистеин
Н
Первичная структура характеризуется
-аминокислотным составом;
-аминокислотной последовательностью
50. Уровни организации полипептидной цепи
Вторичная структура белка – определенноепространственное расположение полипептидной
цепи.
• α-спираль
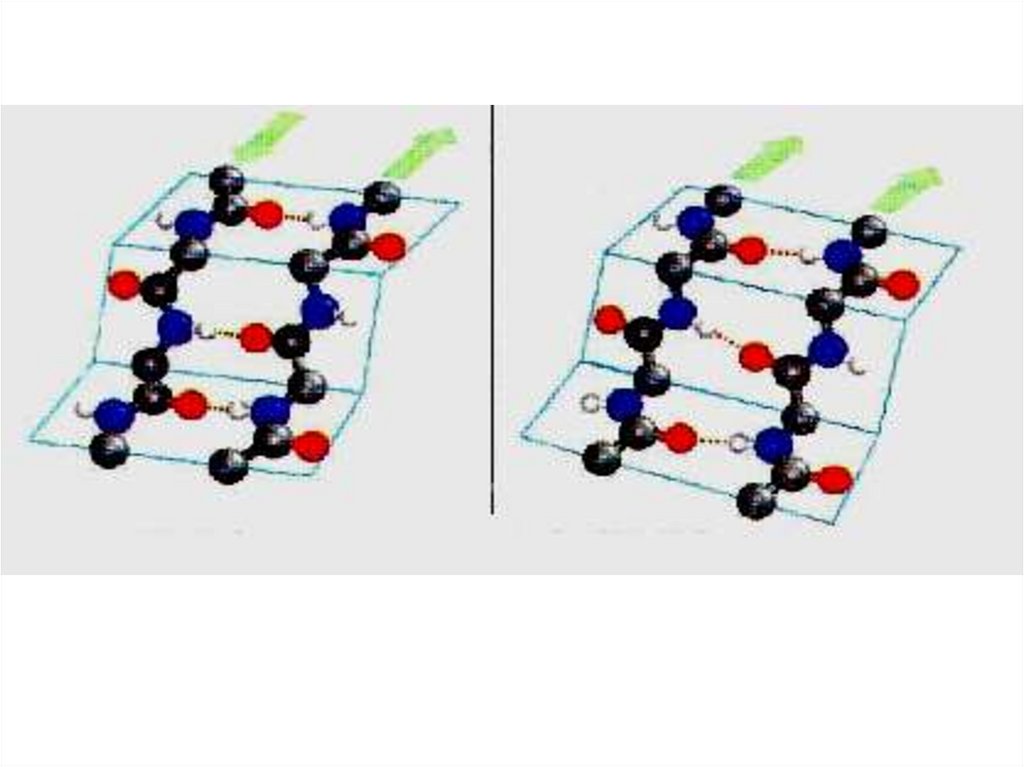
• β-складчатая структура
51.
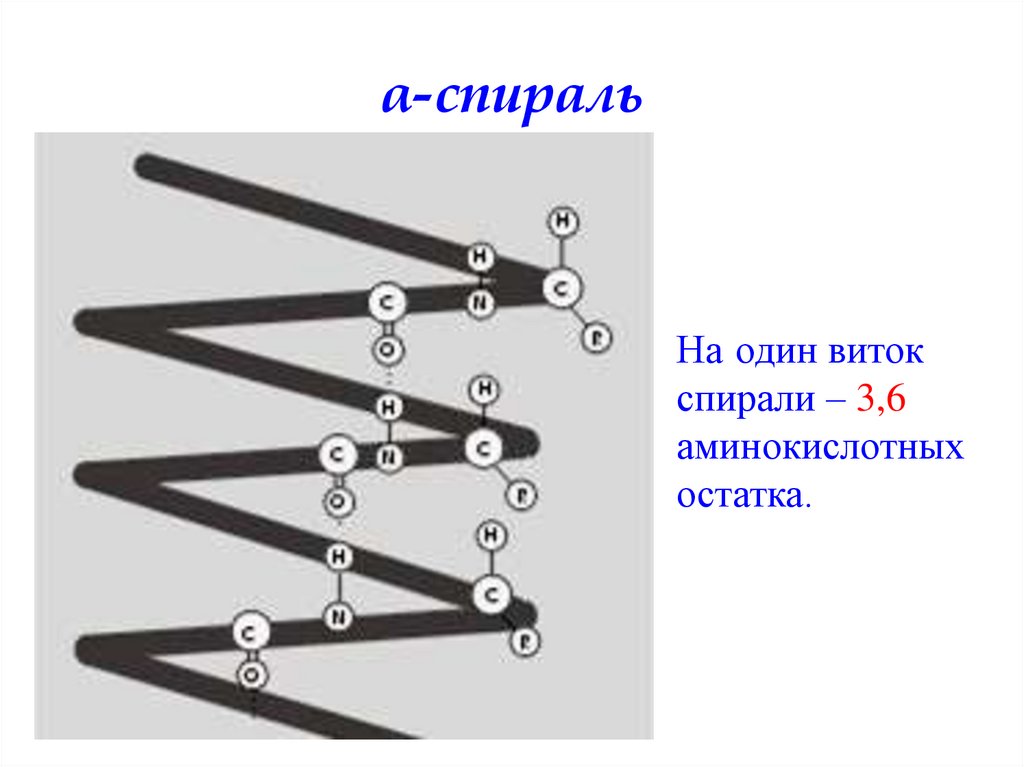
α-спиральНа один виток
спирали – 3,6
аминокислотных
остатка.
52.
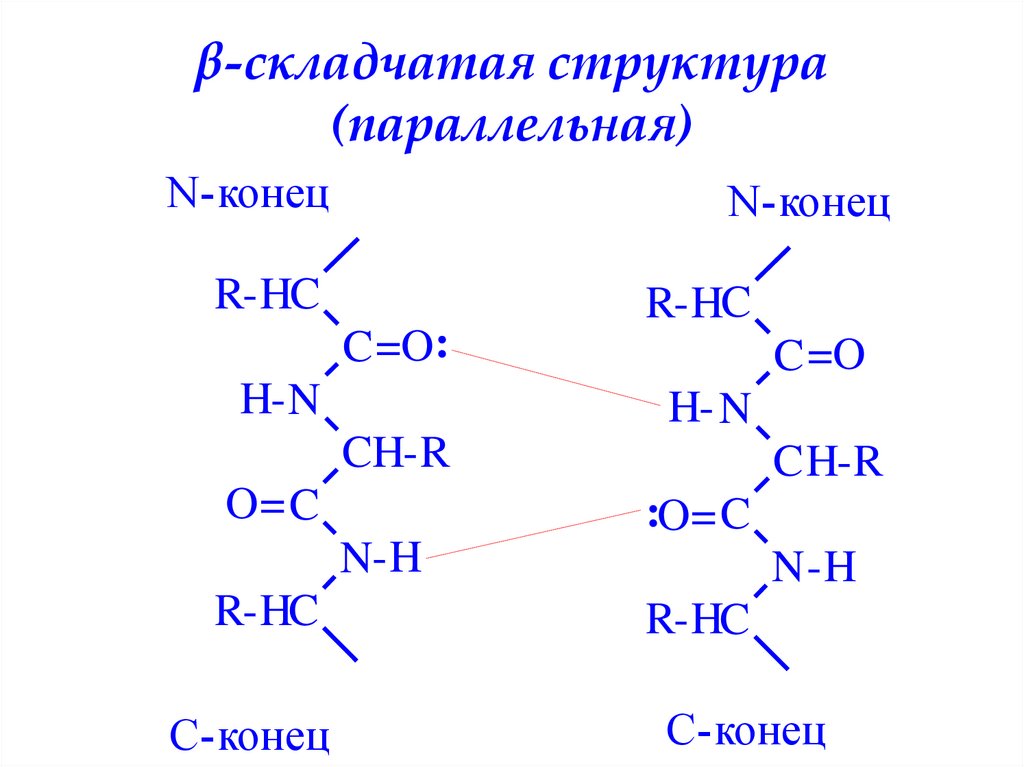
β-складчатая структура(параллельная)
N-конец
N-конец
R-HC
C =O:
H- N
R-HC
C =O
H- N
CH-R
O= C
C H-R
:O= C
N-H
R-HC
C-конец
N -H
R-HC
C-конец
53. α-спираль
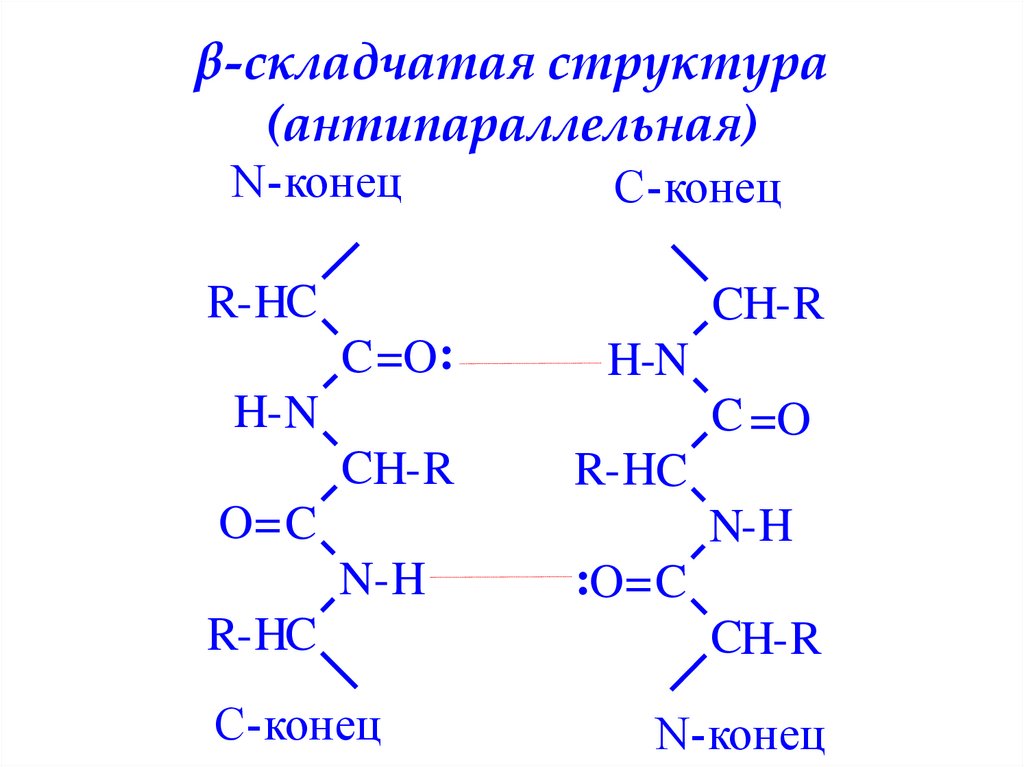
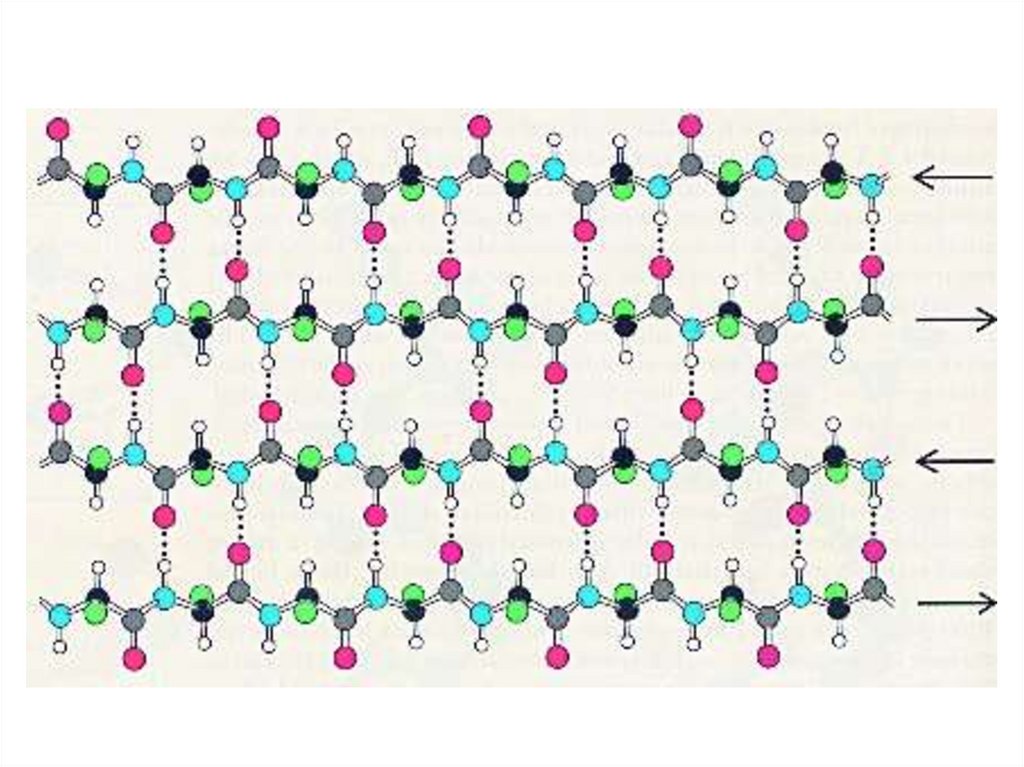
β-складчатая структура(антипараллельная)
N-конец
C-конец
R-HC
CH-R
C =O:
H-N
H- N
C =O
CH-R
R-HC
O= C
N-H
N-H
R-HC
C-конец
:O= C
CH-R
N-конец
54. β-складчатая структура (параллельная)
55. β-складчатая структура (антипараллельная)
56.
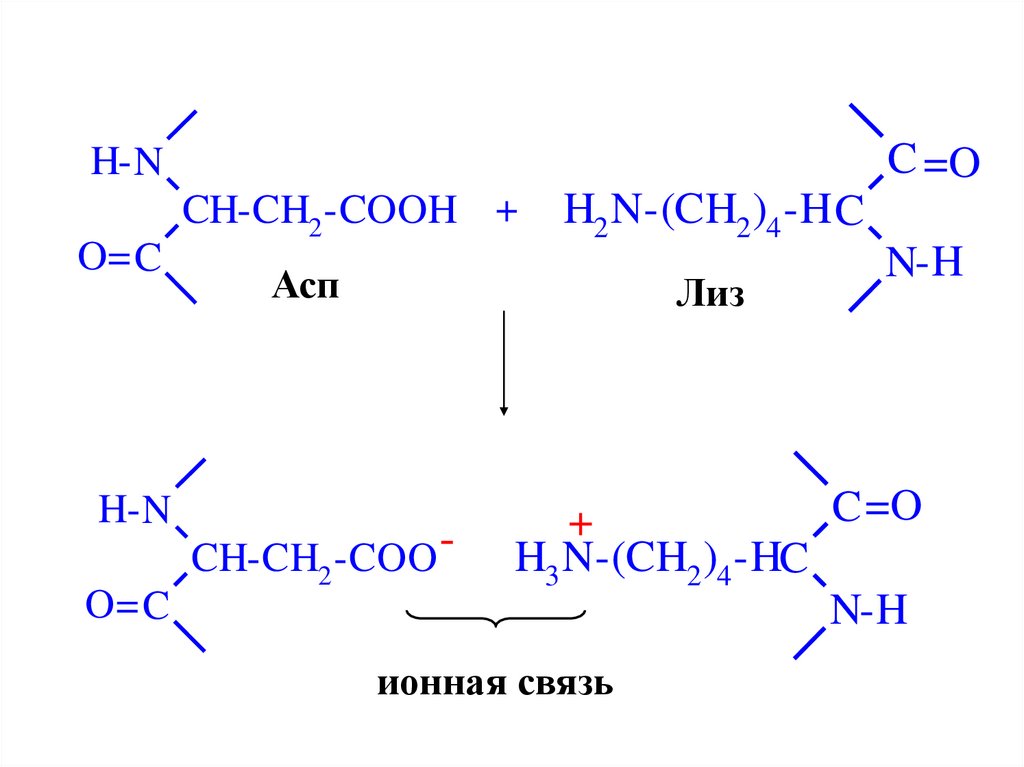
Третичная структура белка57.
C =OH- N
O= C
H- N
O= C
CH-CH2 -COOH +
H2 N-(CH2 )4 -H C
Асп
Лиз
CH-CH2 -COO -
N-H
C =O
+
H3 N-(CH2 )4 -HC
N-H
ионная связь
58. Третичная структура белка
H- NO= C
C =O
CH-CH2 -SH
Цис
+
HS-CH2 -HC
N-H
[O]
Цис
H- N
O= C
C =O
CH-CH2 -S- S-CH2 -HC
N-H
дисульфидный
мостик
+ H2O

























 Химия
Химия