Похожие презентации:
α-аминокислоты. Пептиды. Белки. (Лекция 5)
1. α-Аминокислоты. Пептиды. Белки.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕУЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАФЕДРА ОБЩЕЙ ХИМИИ
Лекция № 5
α-Аминокислоты. Пептиды.
Белки.
2.
• Аминокислоты – это гетерофункциональныеорганические соединения, содержащие
одновременно карбоксильную –СООН и
аминогруппы –NH2
CH2 -COOH
NH2
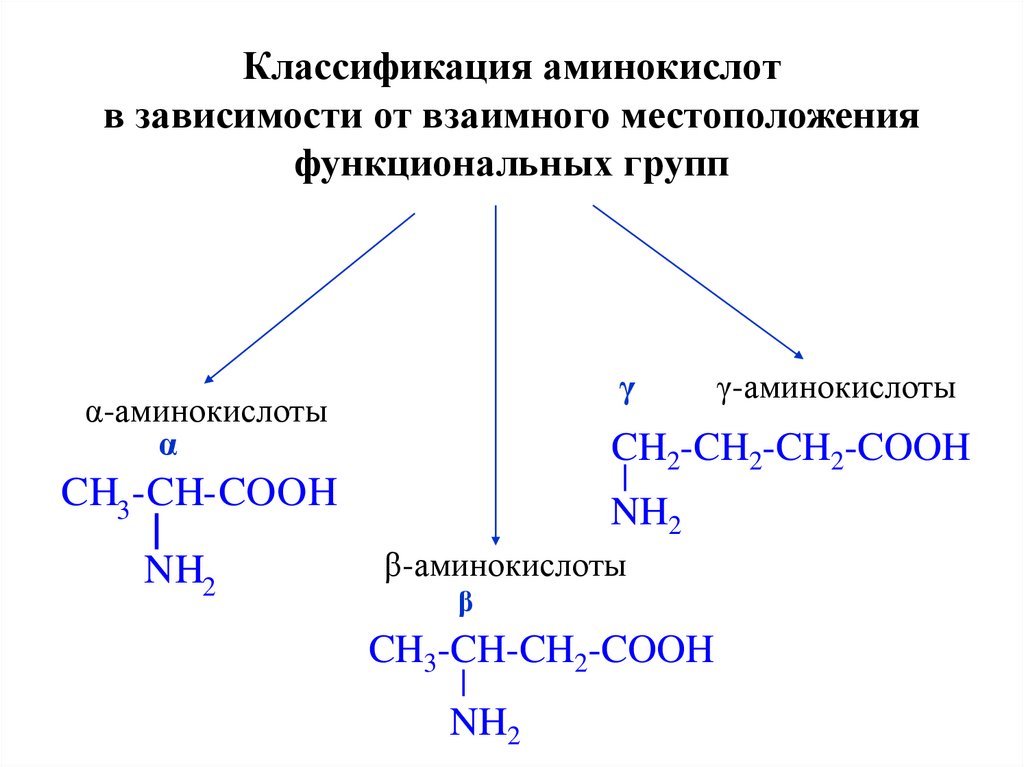
3.
Классификация аминокислотв зависимости от взаимного местоположения
функциональных групп
γ
α-аминокислоты
α
CH2-CH2-CH2-COOH
CH3 -CH-COOH
NH2
γ-аминокислоты
NH2
β-аминокислоты
β
CH3-CH-CH2-COOH
NH2
4.
Классификации аминокислот.1. По природе радикала
2. Полярность бокового радикала:
Неполярные (с гидрофобными радикалами).
Полярные (гидрофильными радикалами).
5. 3. По числу кислотных и основных групп
- Нейтральные – одна NH2 и одна СООН группыМоноаминомонокарбоновые
CH3 -CH-COOH
Аланин
NH
2
- Основные – две NH2 и одна СООН группы
Диаминомонокарбоновые
H2 N-CH2 -CH2 -CH2 -CH2 -CH-COOH
Лизин
NH2
- Кислые - одна NH2 и две СООН группы
Моноаминодикарбоновые
HOOC-CH2 -CH-COOH
NH2
Аспарагиновая кислота
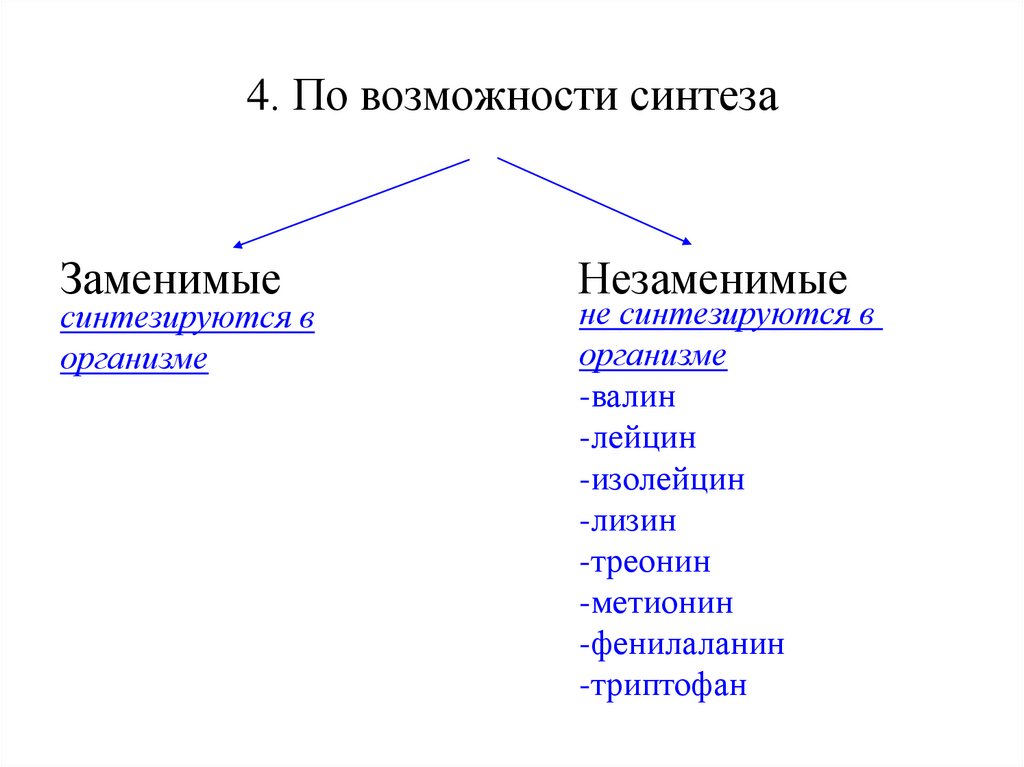
6. 4. По возможности синтеза
Заменимыесинтезируются в
организме
Незаменимые
не синтезируются в
организме
-валин
-лейцин
-изолейцин
-лизин
-треонин
-метионин
-фенилаланин
-триптофан
7.
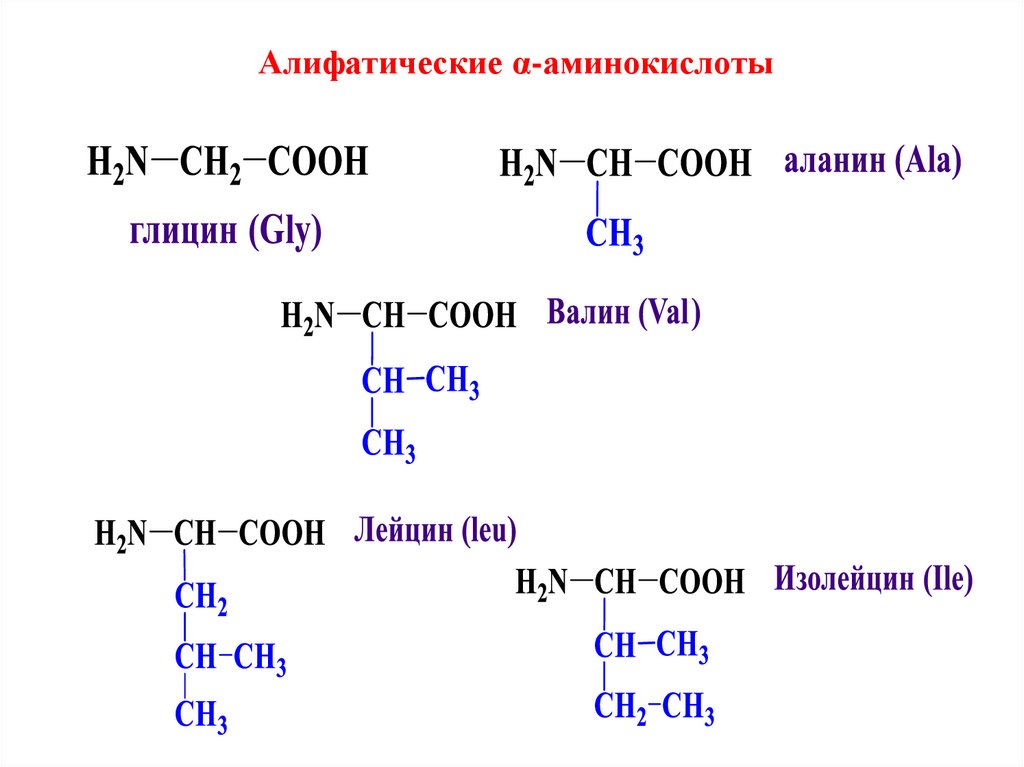
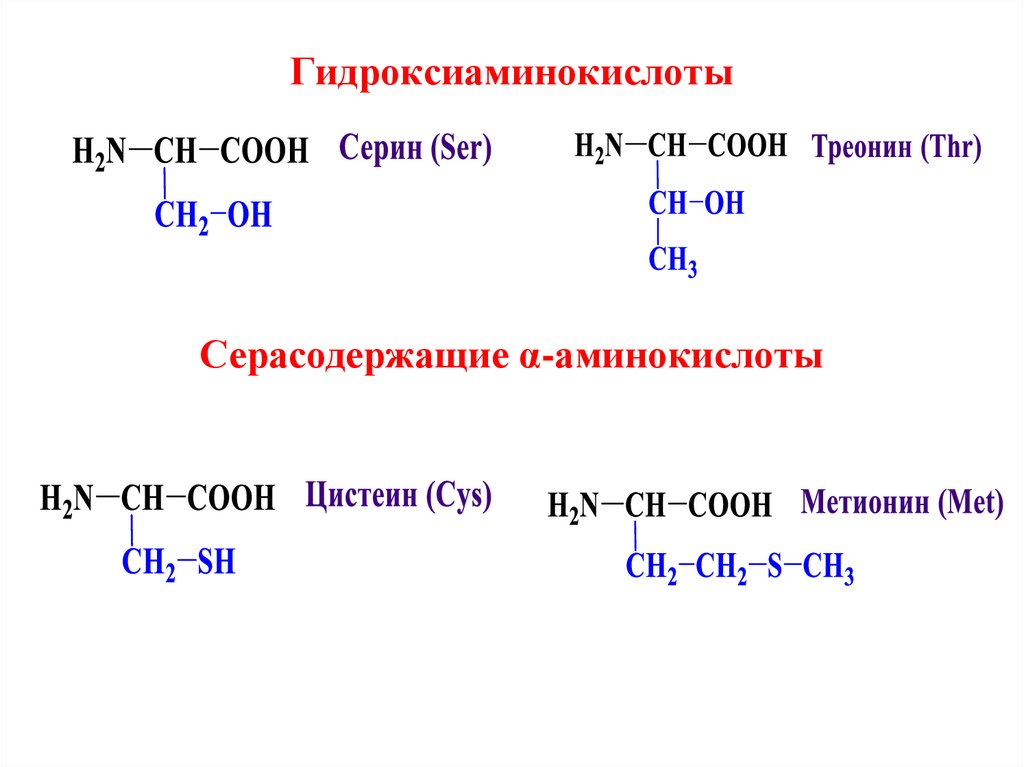
Алифатические α-аминокислоты8. Гидроксиаминокислоты
Серасодержащие α-аминокислоты9.
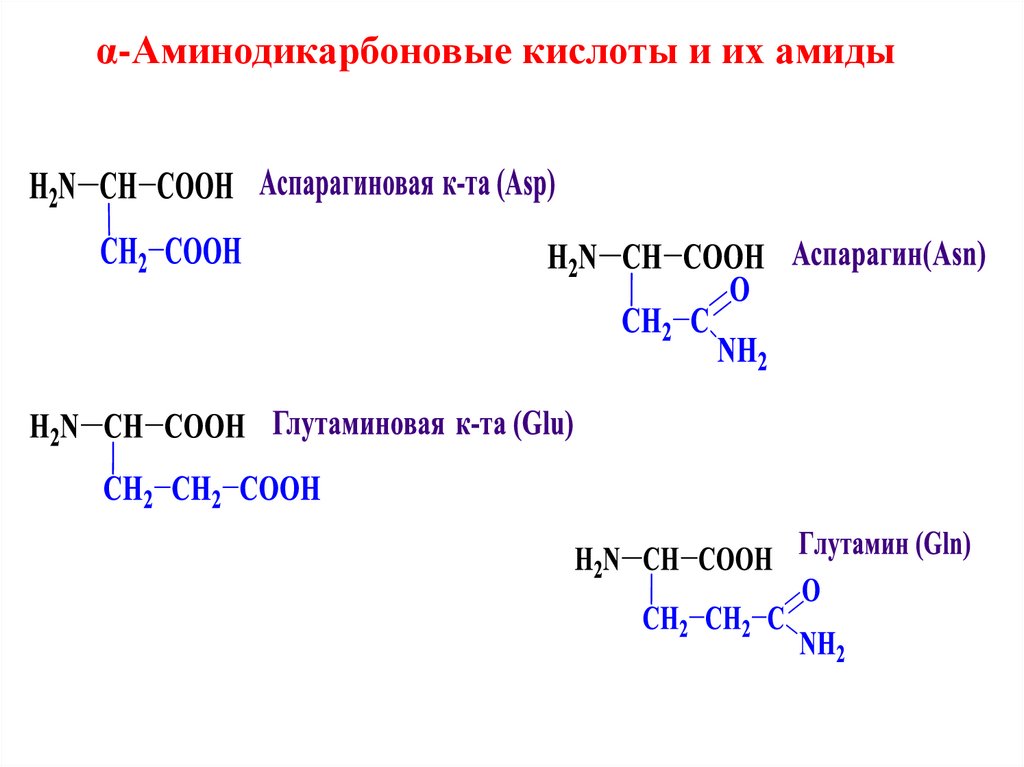
α-Аминодикарбоновые кислоты и их амиды10.
Диаминокарбоновые кислоты11.
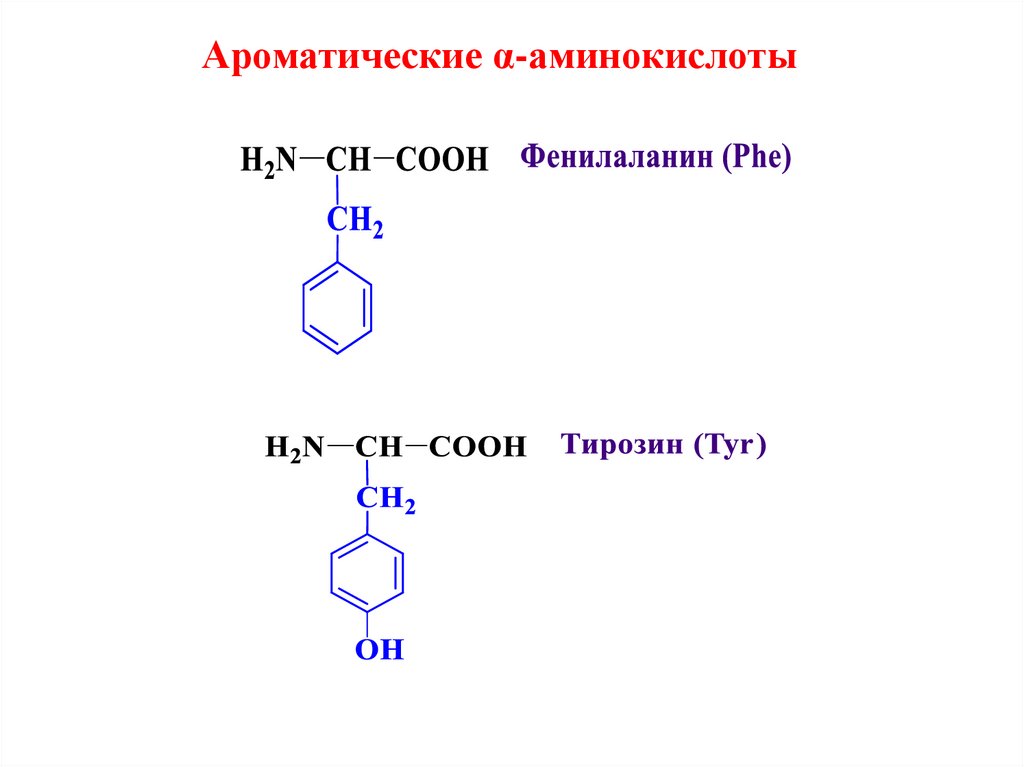
Ароматические α-аминокислоты12.
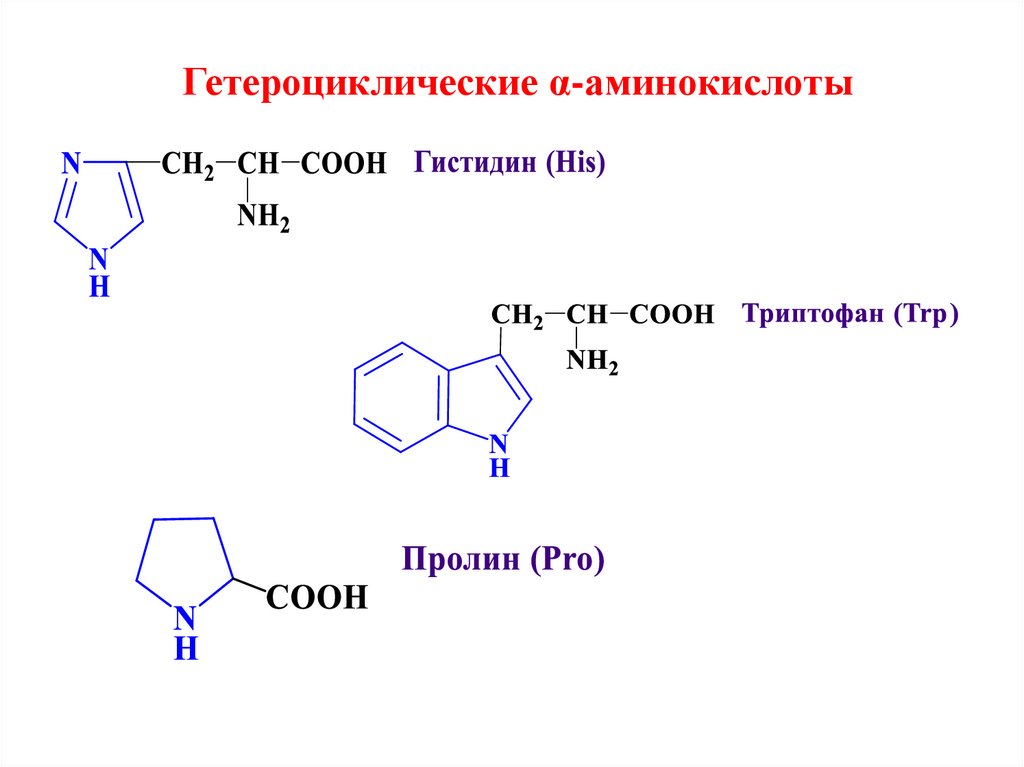
Гетероциклические α-аминокислоты13. Физические свойства
Аминокислоты:бесцветные кристаллические
вещества
сладкие на вкус
хорошо растворяются в воде
0
имеют температуру плавления 220 0
315 С.
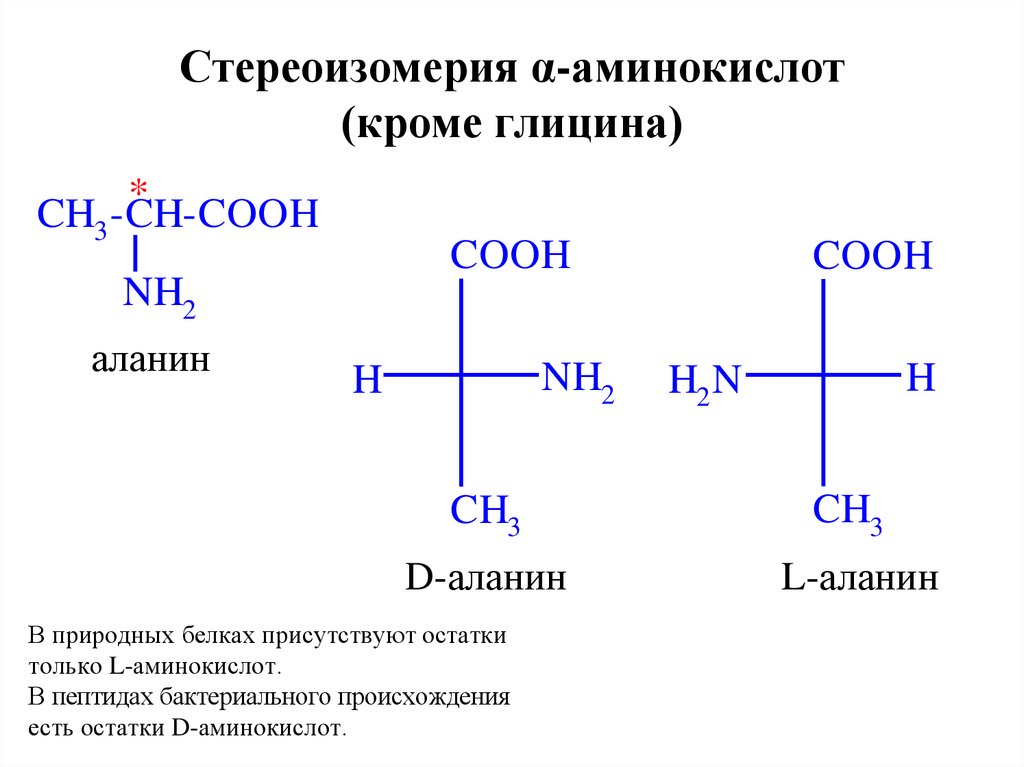
14. Стереоизомерия α-аминокислот (кроме глицина)
*CH3 -CH-COOH
COOH
NH2
аланин
NH2
H
CH3
D-аланин
В природных белках присутствуют остатки
только L-аминокислот.
В пептидах бактериального происхождения
есть остатки D-аминокислот.
COOH
H
H2 N
CH3
L-аланин
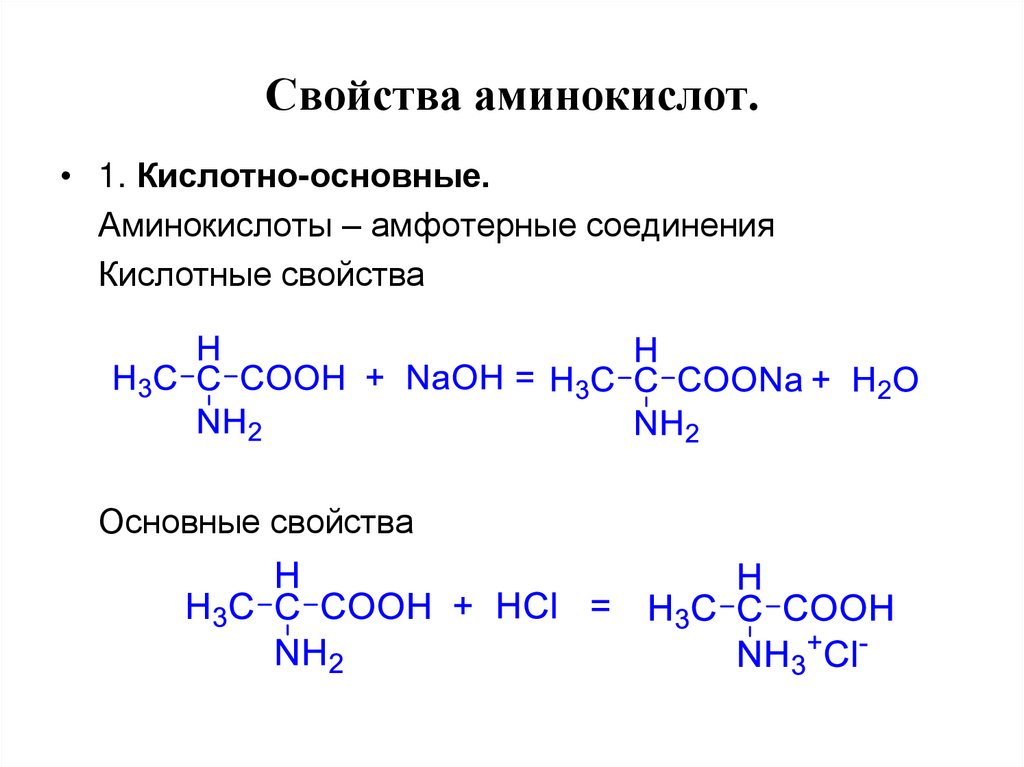
15. Свойства аминокислот.
• 1. Кислотно-основные.Аминокислоты – амфотерные соединения
Кислотные свойства
Основные свойства
16.
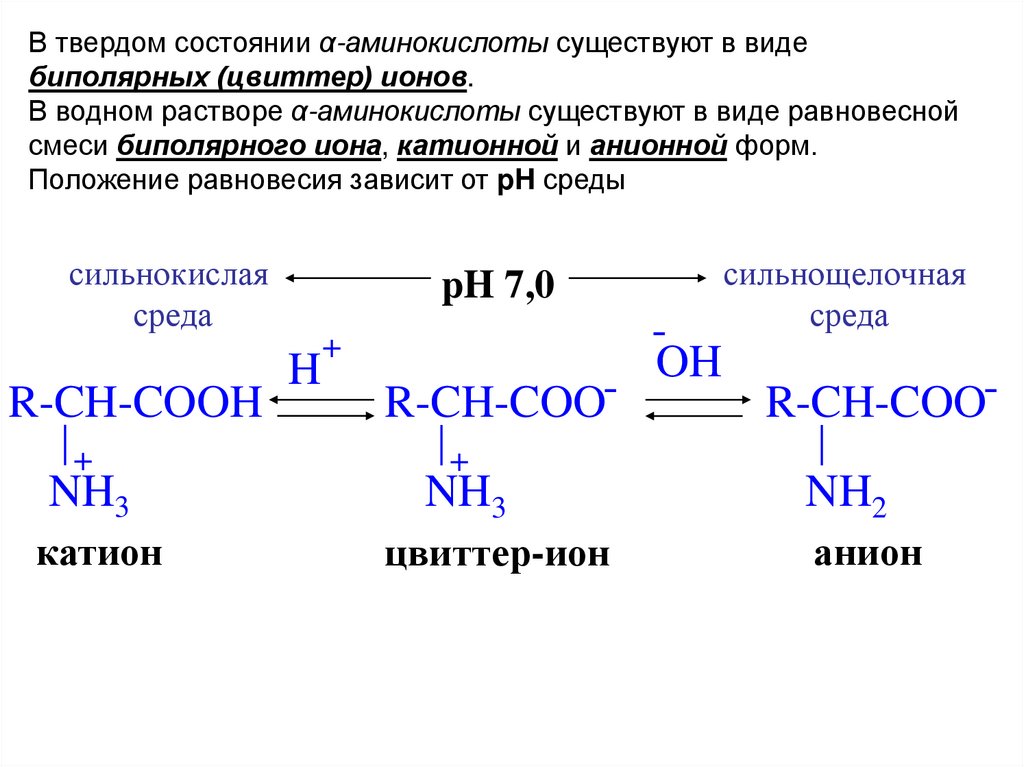
В твердом состоянии α-аминокислоты существуют в видебиполярных (цвиттер) ионов.
В водном растворе α-аминокислоты существуют в виде равновесной
смеси биполярного иона, катионной и анионной форм.
Положение равновесия зависит от pH среды
сильнокислая
среда
R-CH-COOH
+
NH3
катион
pH 7,0
H
+
R-CH-COO+
NH3
цвиттер-ион
OH
сильнощелочная
среда
R-CH-COONH2
анион
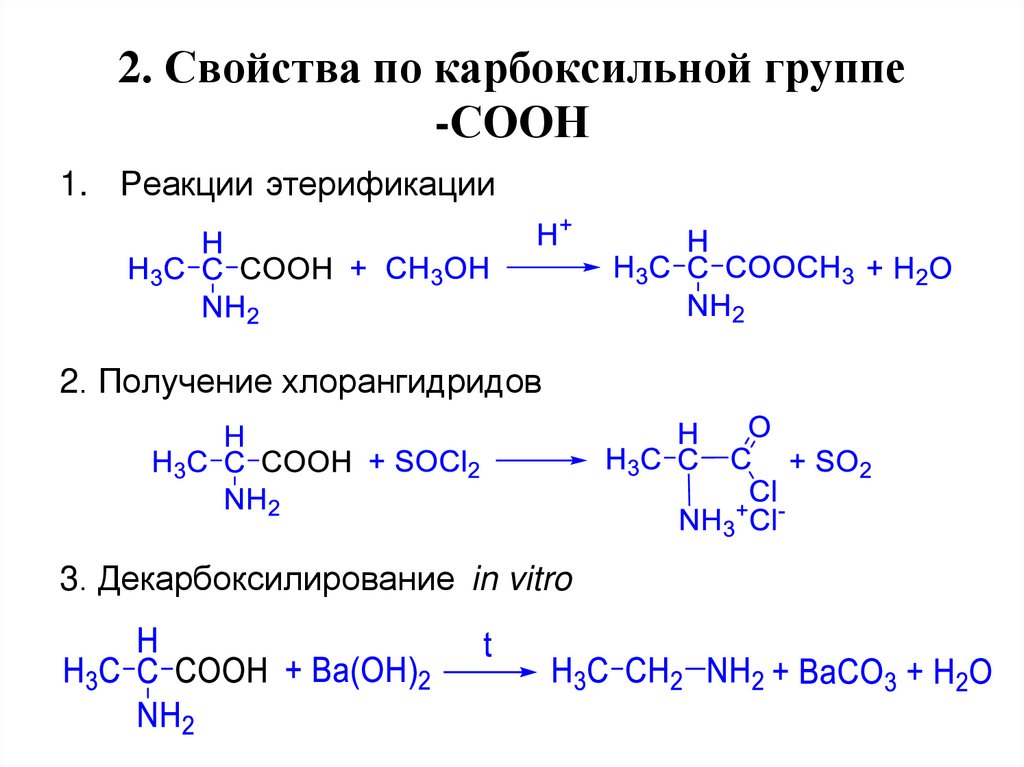
17. 2. Свойства по карбоксильной группе -СООН
1. Реакции этерификации2. Получение хлорангидридов
3. Декарбоксилирование in vitro
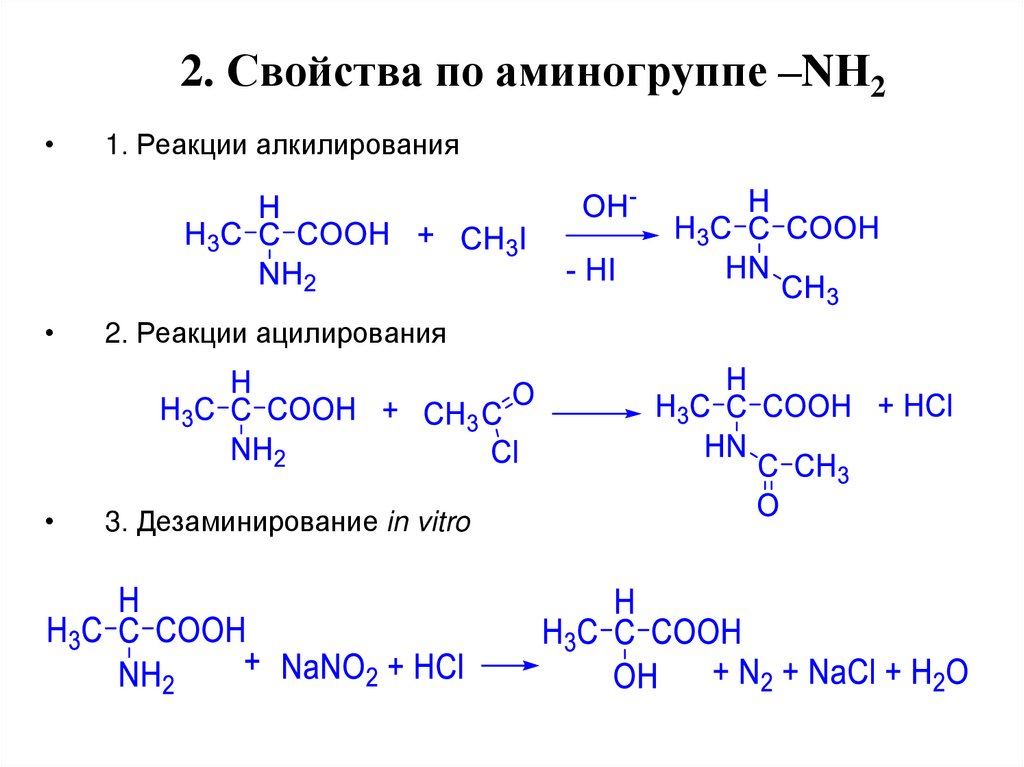
18. 2. Свойства по аминогруппе –NН2
1. Реакции алкилирования
2. Реакции ацилирования
3. Дезаминирование in vitro
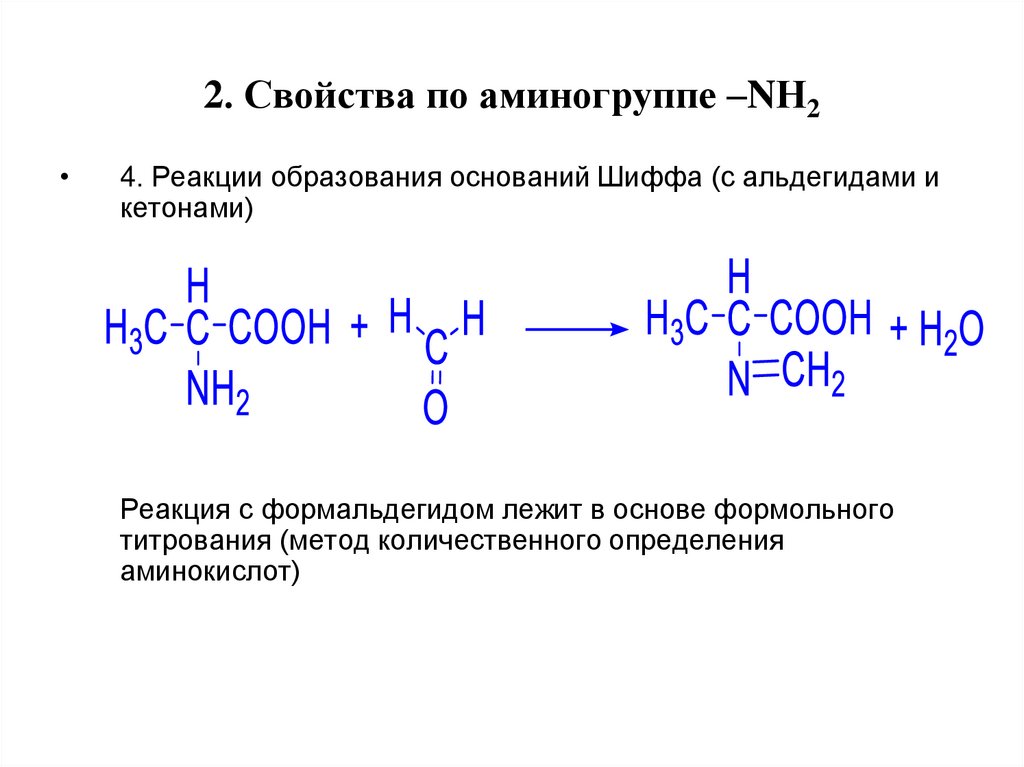
19. 2. Свойства по аминогруппе –NН2
4. Реакции образования оснований Шиффа (с альдегидами и
кетонами)
Реакция с формальдегидом лежит в основе формольного
титрования (метод количественного определения
аминокислот)
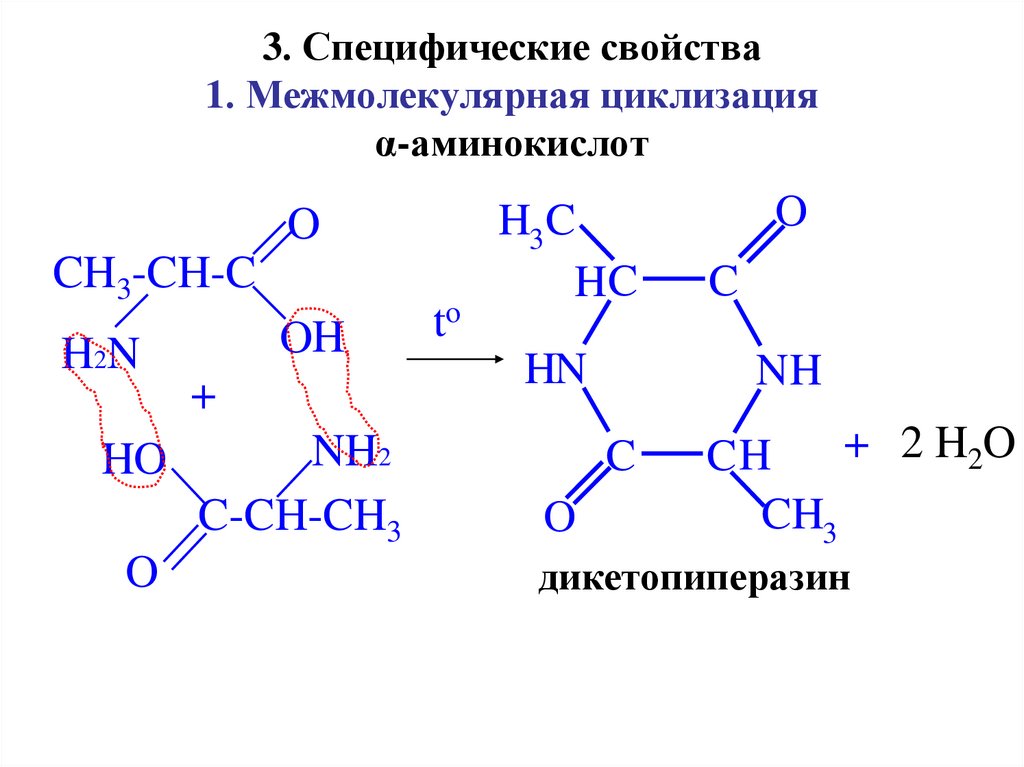
20. 3. Специфические свойства 1. Межмолекулярная циклизация α-аминокислот
OCH3-CH-C
H2N
HO
O
OH
+
NH2
C-CH-CH3
to
H3 C
HC
HN
C
NH
C
O
O
+ 2 H2O
CH
CH3
дикетопиперазин
21.
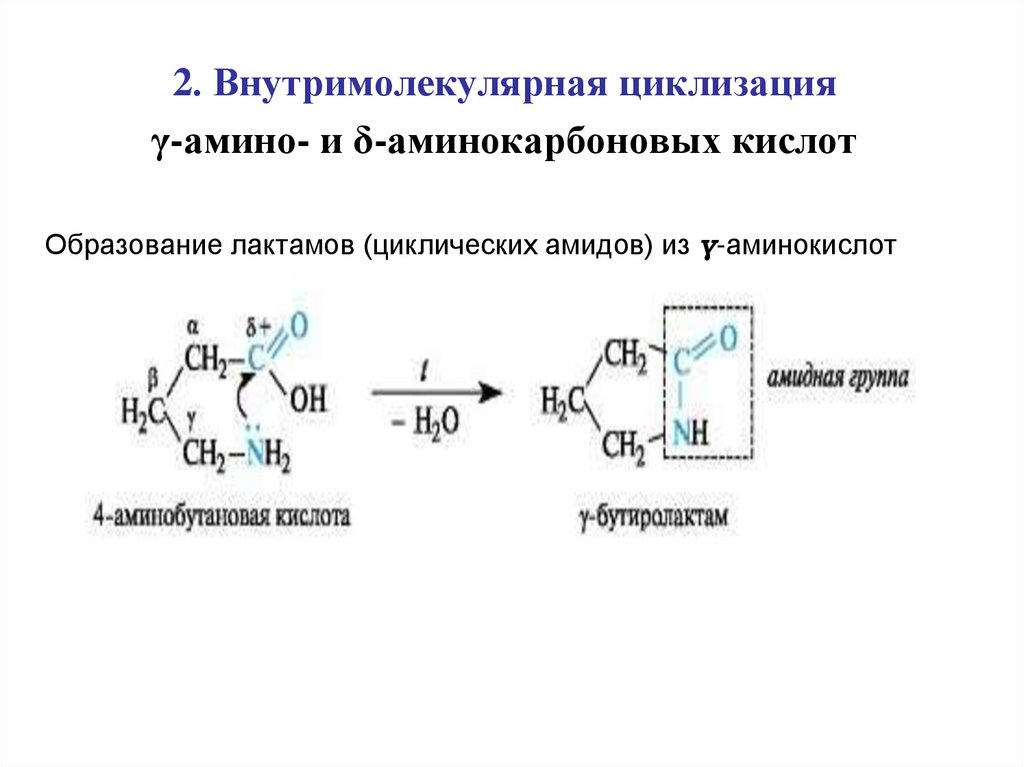
2. Внутримолекулярная циклизацияγ-амино- и δ-аминокарбоновых кислот
Образование лактамов (циклических амидов) из γ-аминокислот
22.
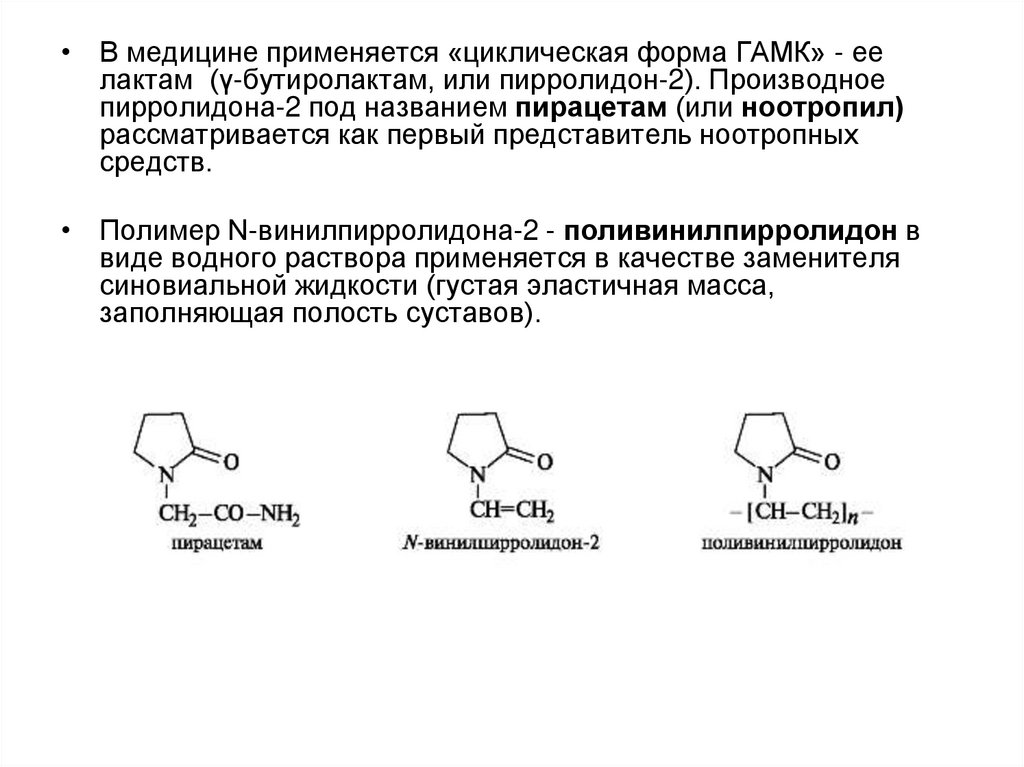
• В медицине применяется «циклическая форма ГАМК» - еелактам (γ-бутиролактам, или пирролидон-2). Производное
пирролидона-2 под названием пирацетам (или ноотропил)
рассматривается как первый представитель ноотропных
средств.
• Полимер N-винилпирролидона-2 - поливинилпирролидон в
виде водного раствора применяется в качестве заменителя
синовиальной жидкости (густая эластичная масса,
заполняющая полость суставов).
23. Реакции α-аминокислот in vivo
1. декарбоксилирование2. дезаминирование
- окислительное;
- неокислительное
3. восстановительное аминирование
4. переаминирование
5. образование пептидной связи
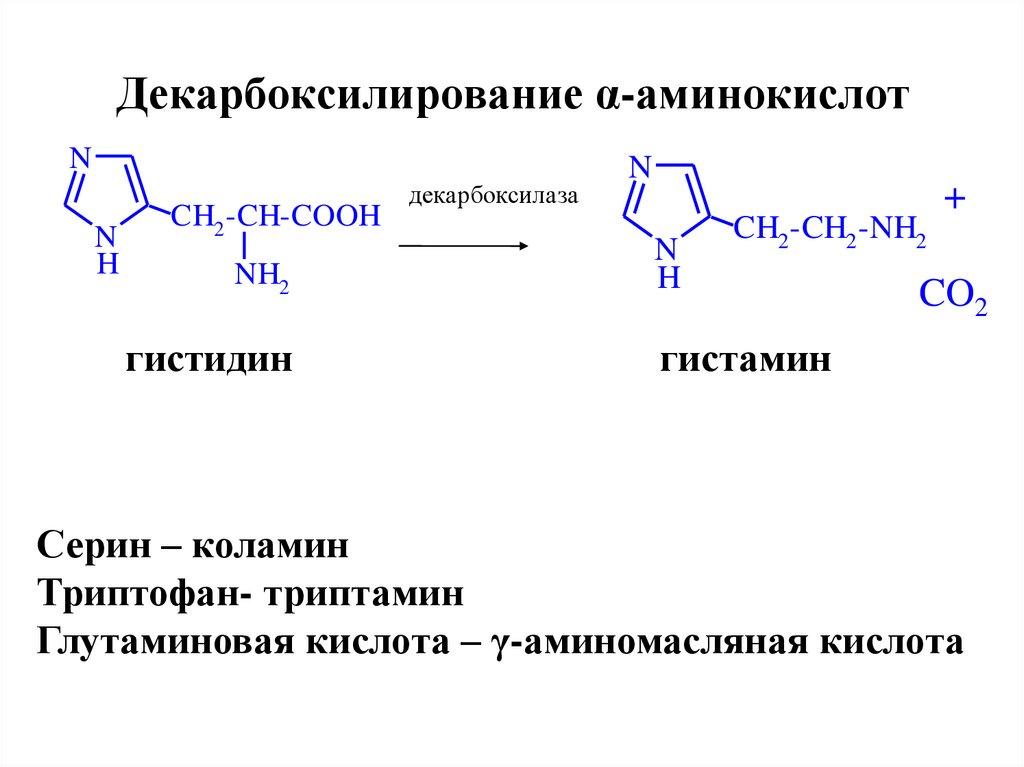
24. Декарбоксилирование α-аминокислот
NN
H
CH2 -CH-COOH
NH2
гистидин
декарбоксилаза
N
N
H
CH2 -CH2 -NH2
+
CO2
гистамин
Серин – коламин
Триптофан- триптамин
Глутаминовая кислота – γ-аминомасляная кислота
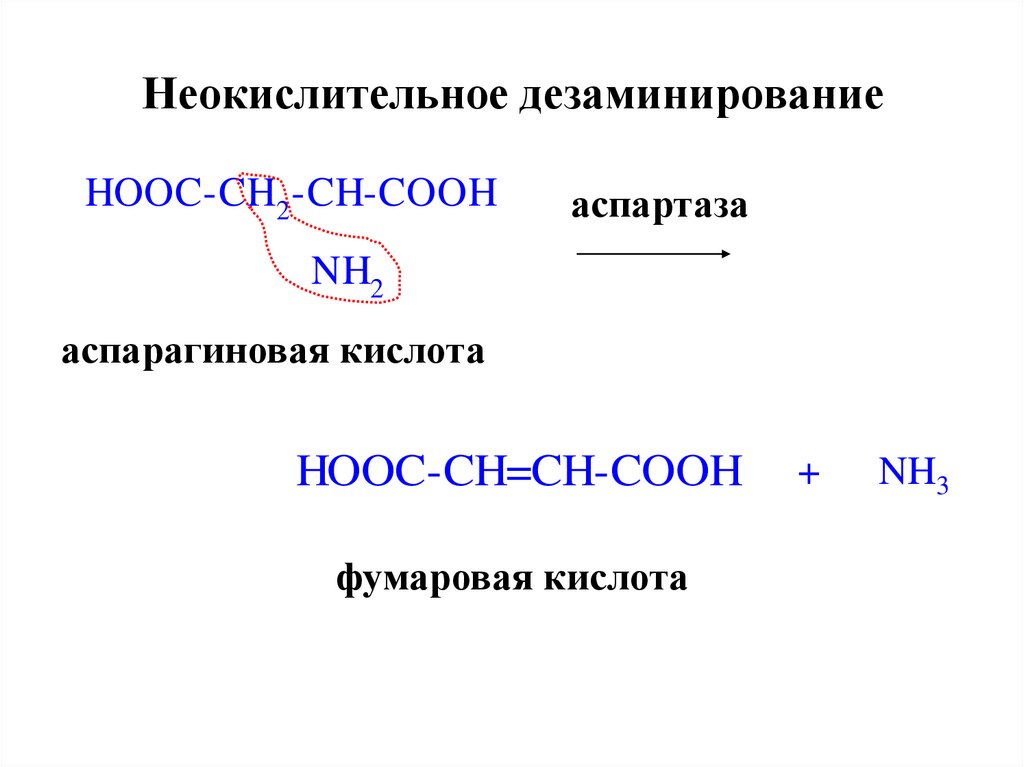
25. Неокислительное дезаминирование
HOOC-CH2 -CH-COOHаспартаза
NH2
аспарагиновая кислота
HOOC-CH=CH-COOH
фумаровая кислота
+
NH3
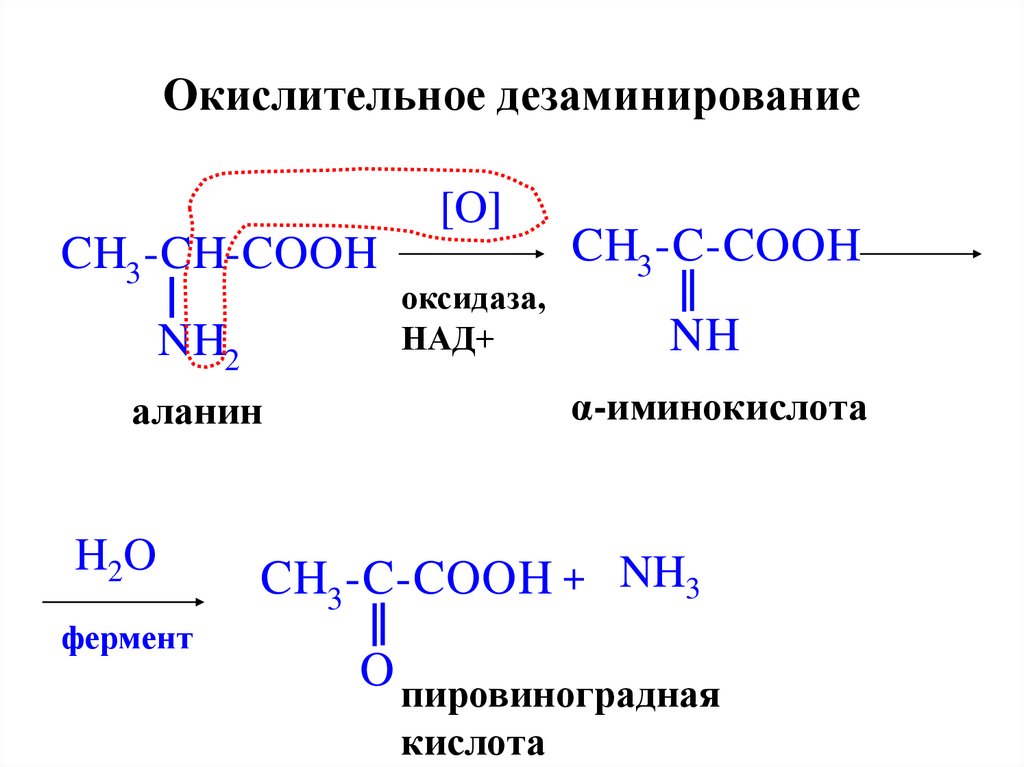
26. Окислительное дезаминирование
[O]CH3 -CH-COOH
NH2
оксидаза,
НАД+
фермент
NH
α-иминокислота
аланин
H2O
CH3 -C-COOH
CH3 -C-COOH + NH3
O пировиноградная
кислота
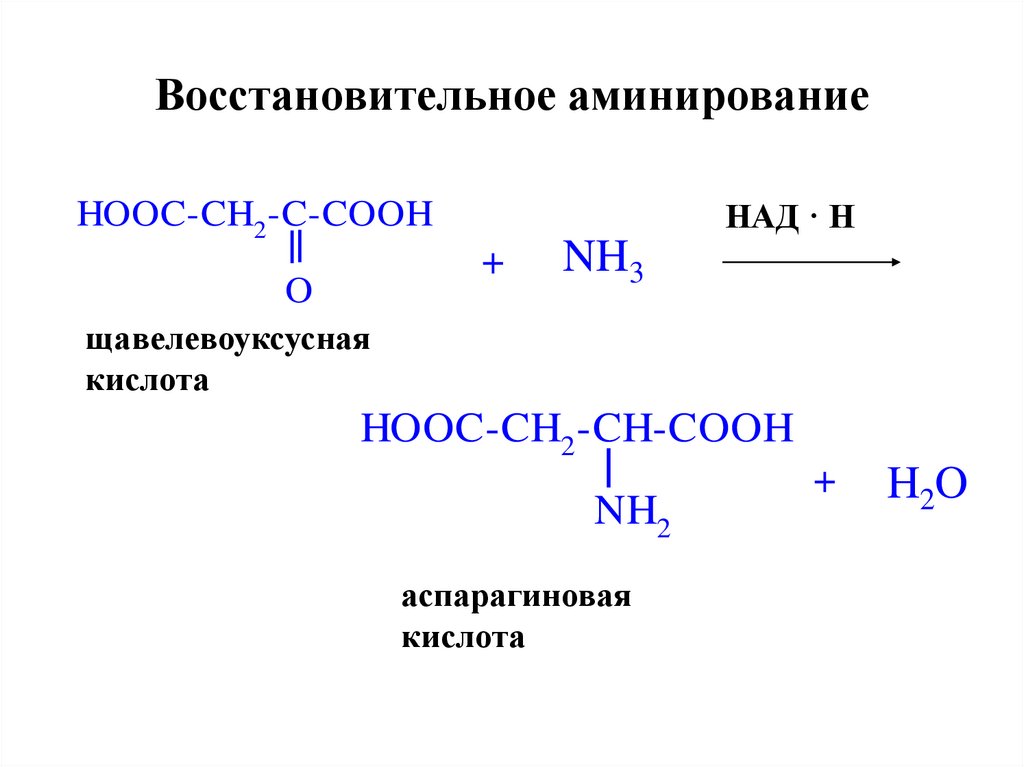
27. Восстановительное аминирование
НАД · НHOOC-CH2 -C-COOH
+
O
NH3
щавелевоуксусная
кислота
HOOC-CH2 -CH-COOH
NH2
аспарагиновая
кислота
+
H 2O
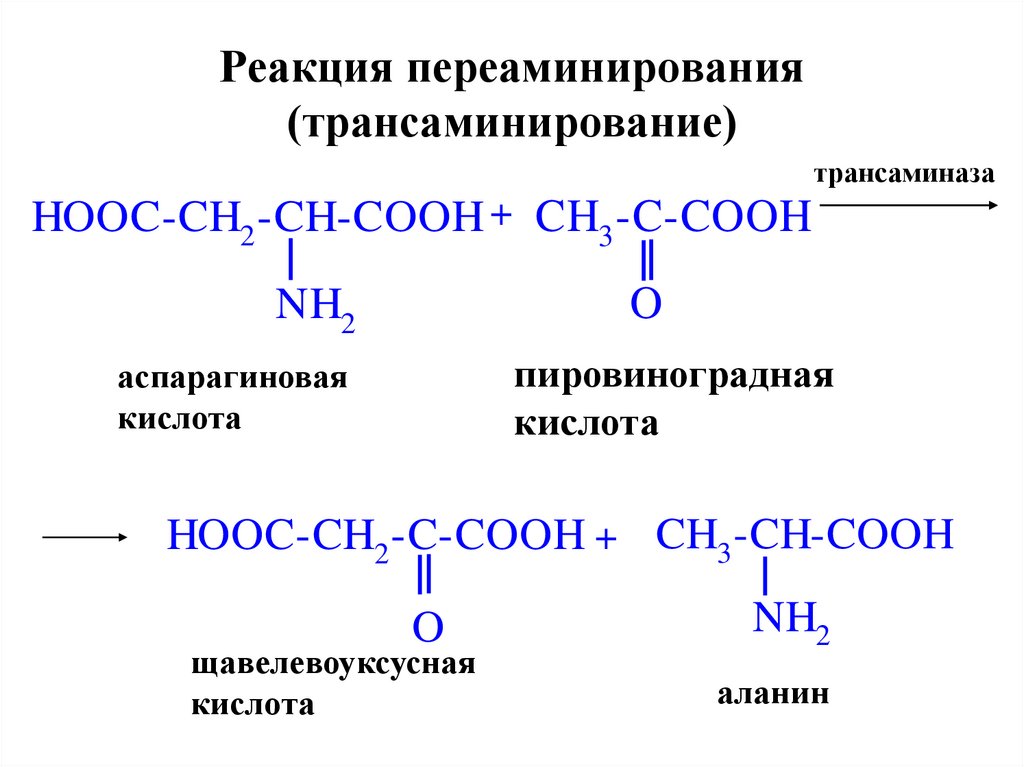
28. Реакция переаминирования (трансаминирование)
трансаминазаHOOC-CH2 -CH-COOH + CH3 -C-COOH
O
NH2
пировиноградная
кислота
аспарагиновая
кислота
HOOC-CH2 -C-COOH + CH3 -CH-COOH
O
щавелевоуксусная
кислота
NH2
аланин
29.
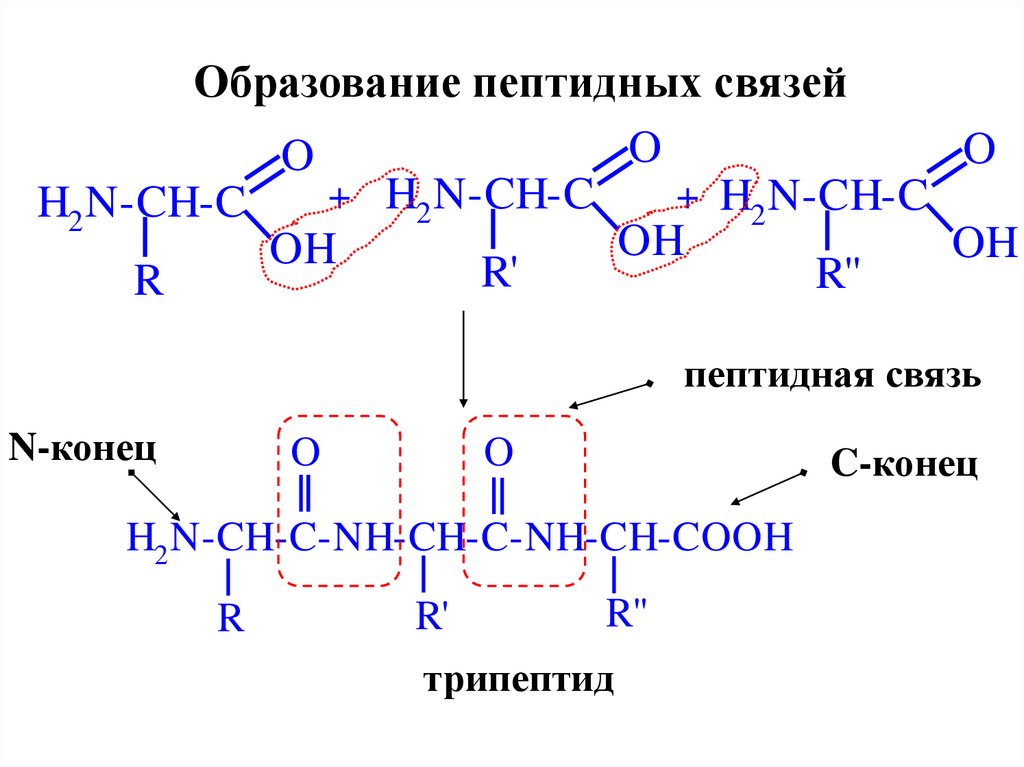
Образование пептидных связейO
O
O
+ H2 N-CH-C
+ H2 N-CH-C
H2 N-CH-C
OH
OH
OH
R'
R''
R
пептидная связь
N-конец
O
O
H2 N-CH-C-NH-CH-C-NH-CH-COOH
R
R"
R'
трипептид
C-конец
30.
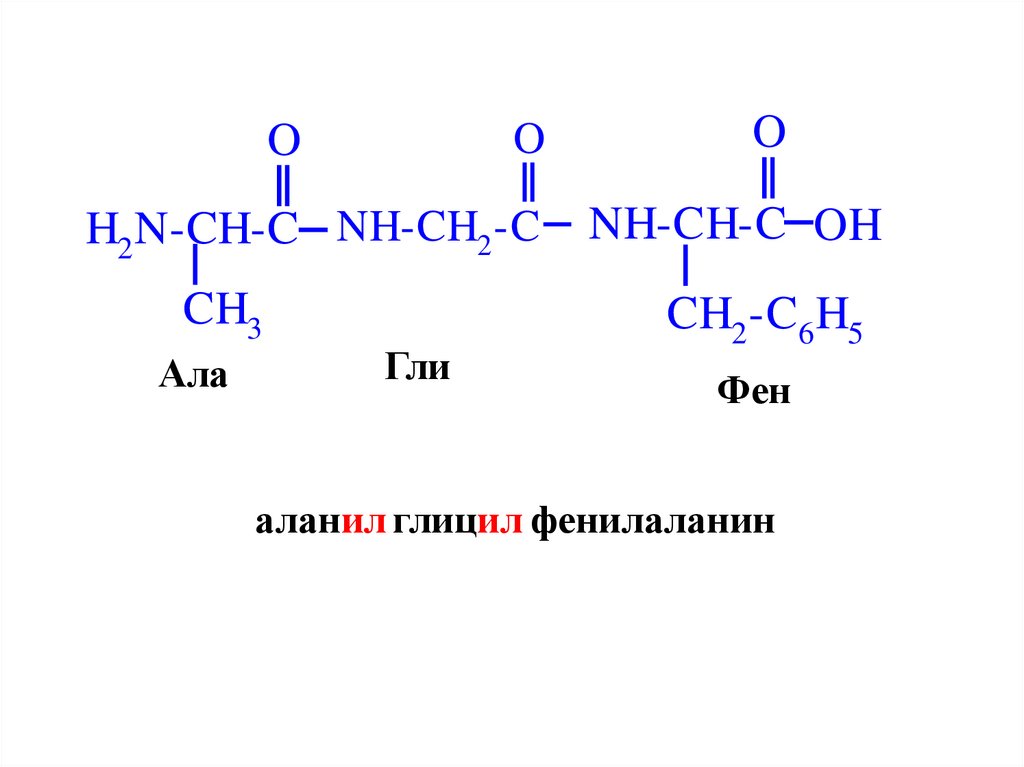
OO
H2 N-CH-C NH-CH2 -C
CH3
Ала
Гли
O
NH-CH-C OH
CH2 -C6 H5
Фен
аланил глицил фенилаланин
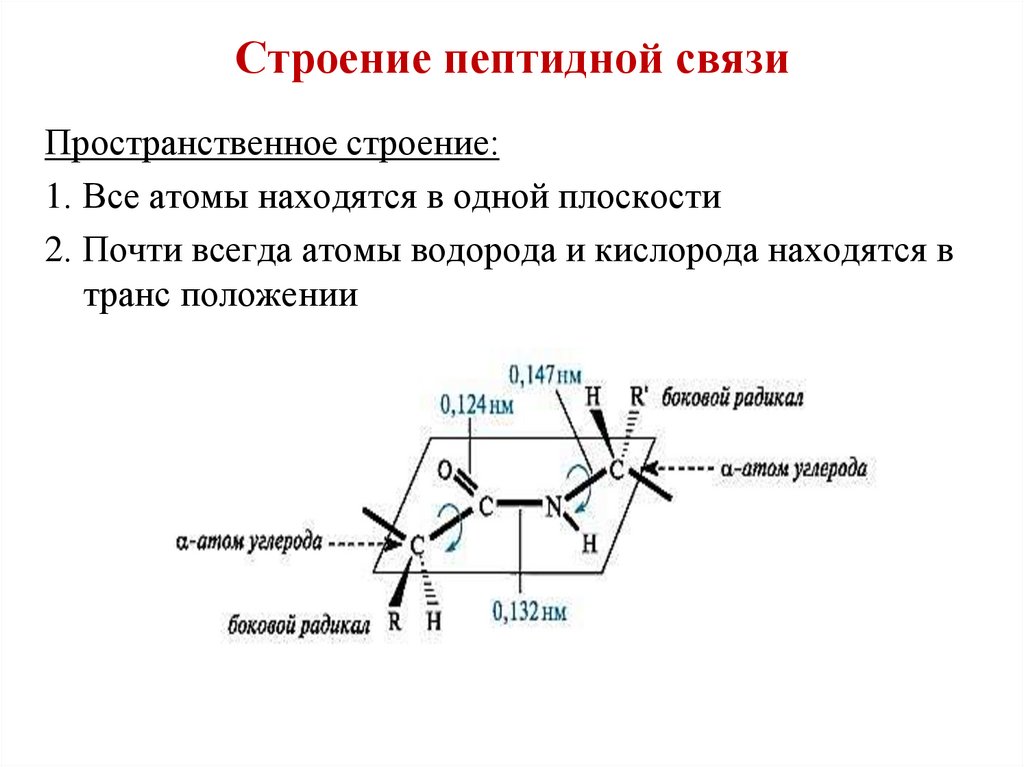
31. Строение пептидной связи
Пространственное строение:1. Все атомы находятся в одной плоскости
2. Почти всегда атомы водорода и кислорода находятся в
транс положении
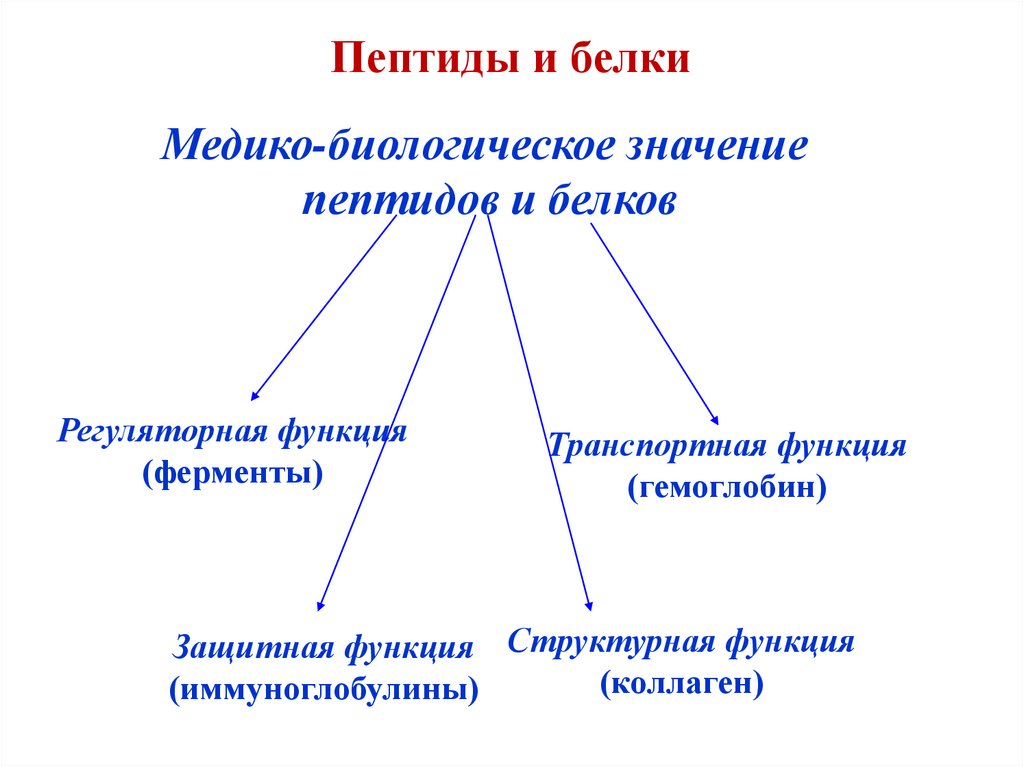
32. Пептиды и белки
Медико-биологическое значениепептидов и белков
Регуляторная функция
(ферменты)
Транспортная функция
(гемоглобин)
Защитная функция Структурная функция
(коллаген)
(иммуноглобулины)
33.
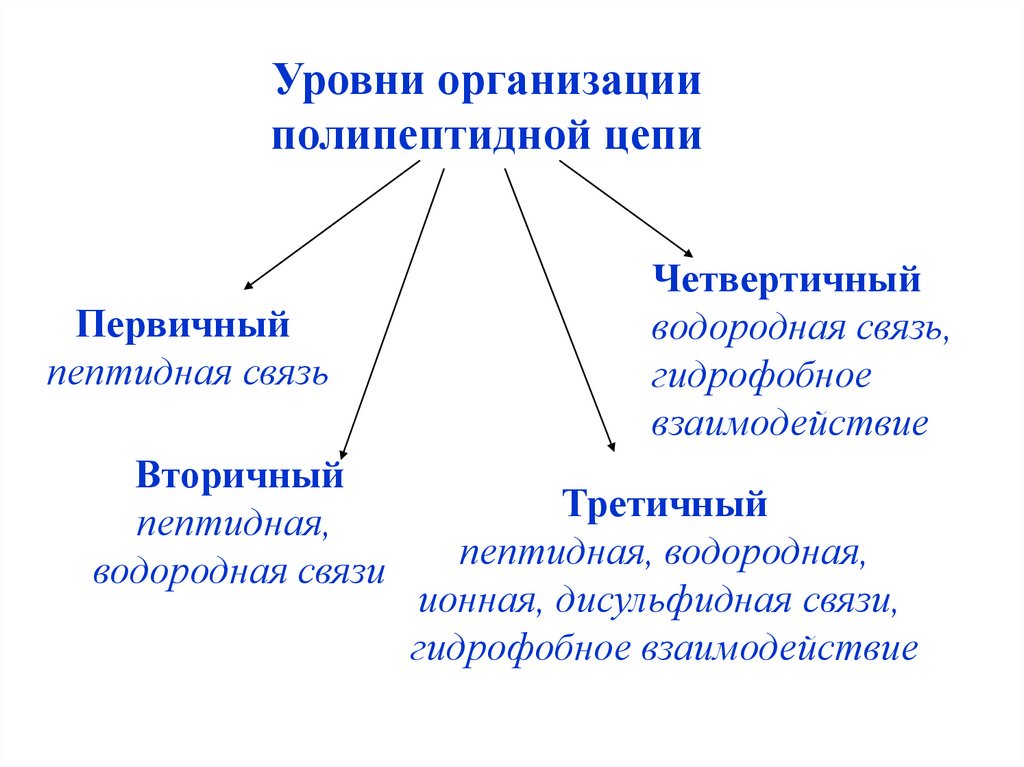
Уровни организацииполипептидной цепи
Первичный
пептидная связь
Вторичный
пептидная,
водородная связи
Четвертичный
водородная связь,
гидрофобное
взаимодействие
Третичный
пептидная, водородная,
ионная, дисульфидная связи,
гидрофобное взаимодействие
34.
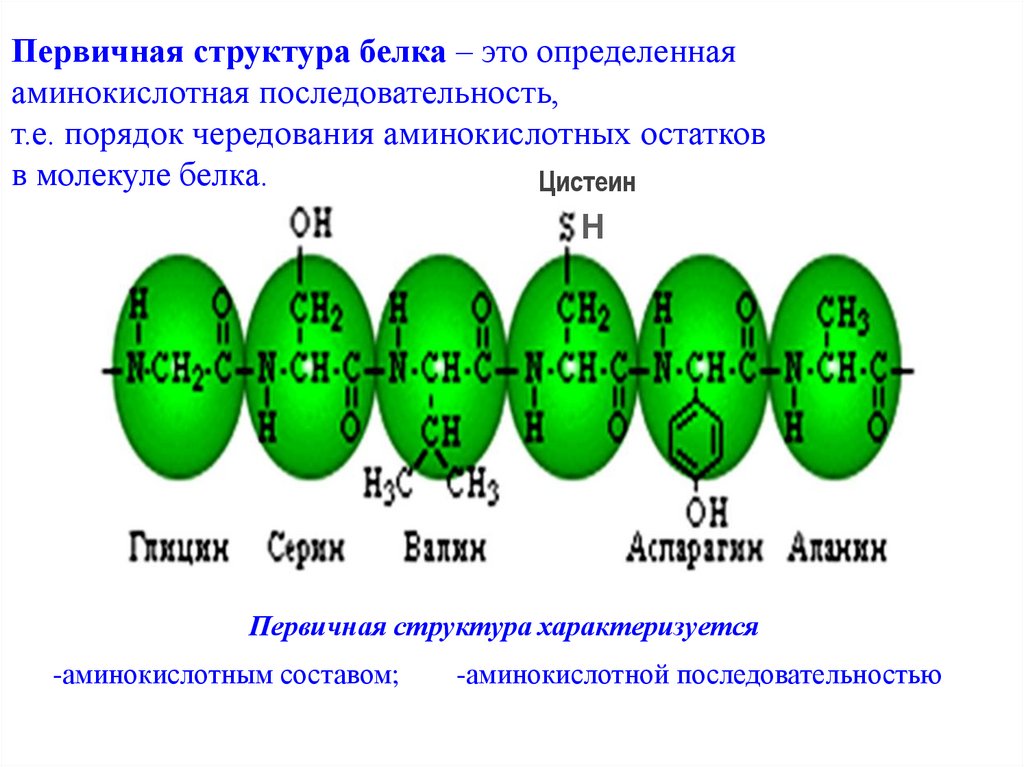
Первичная структура белка – это определеннаяаминокислотная последовательность,
т.е. порядок чередования аминокислотных остатков
в молекуле белка.
Цистеин
Н
Первичная структура характеризуется
-аминокислотным составом;
-аминокислотной последовательностью
35.
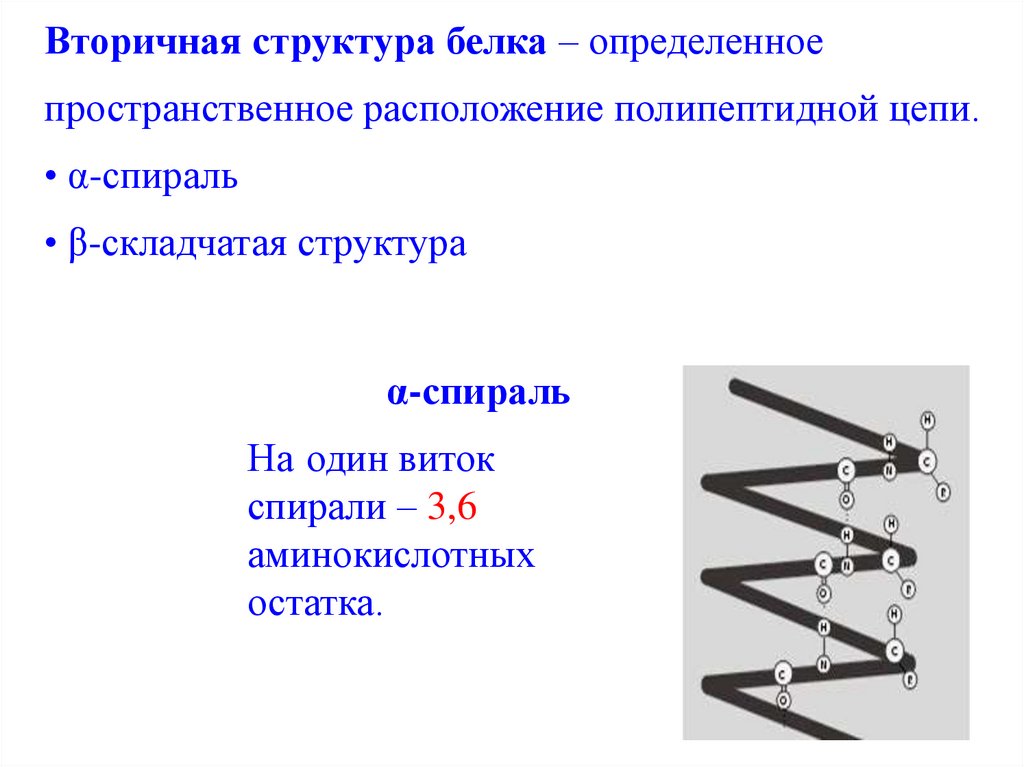
Вторичная структура белка – определенноепространственное расположение полипептидной цепи.
• α-спираль
• β-складчатая структура
α-спираль
На один виток
спирали – 3,6
аминокислотных
остатка.
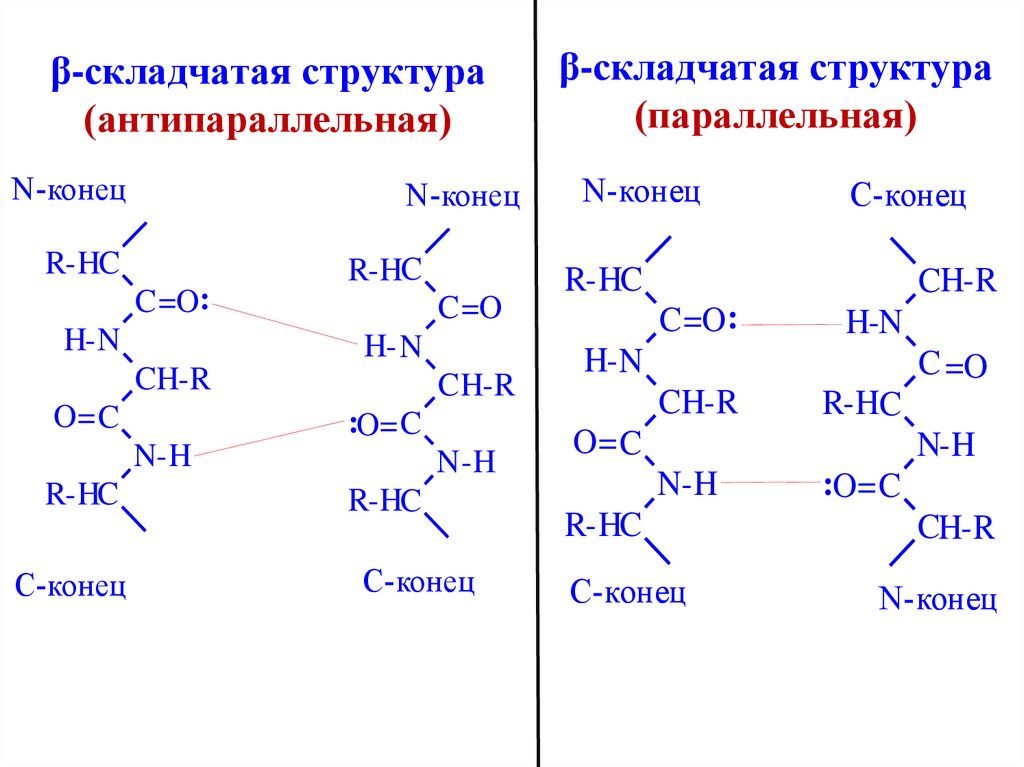
36. β-складчатая структура (антипараллельная)
N-конецN-конец
R-HC
C =O:
H- N
R-HC
C =O
H- N
CH-R
O= C
C H-R
:O= C
N-H
R-HC
C-конец
N -H
R-HC
C-конец
β-складчатая структура
(параллельная)
N-конец
C-конец
R-HC
CH-R
C =O:
H-N
H- N
C =O
CH-R
R-HC
O= C
N-H
N-H
R-HC
C-конец
:O= C
CH-R
N-конец
37.
Третичнаяструктура белка
H- N
C =O
+
CH-CH2 -COOH
O= C
H2 N-(CH2 )4 -H C
N-H
Асп
H-N
O= C
Лиз
+
CH-CH2 -COO H3 N-(CH2 )4 -HC
C =O
N-H
ионная связь
H- N
O= C
CH-CH2 -SH
+
C =O
HS-CH2 -HC
N-H
Цис
[O]
Цис
H- N
O= C
C =O
CH-CH2 -S- S-CH2 -HC
N-H
дисульфидный
мостик
+
H2O
38.
Четвертичная структура• Четвертичная структура - агрегат нескольких
белковых молекул образующих одну структуру
• Взаимодействия: ионные, водородные,
гидрофобные, ковалентные (дисульфидные)
Пример четвертичной структуры
- вирус табачной мозаики:
2130 одинаковых молекул белка
расположены вокруг РНК вируса
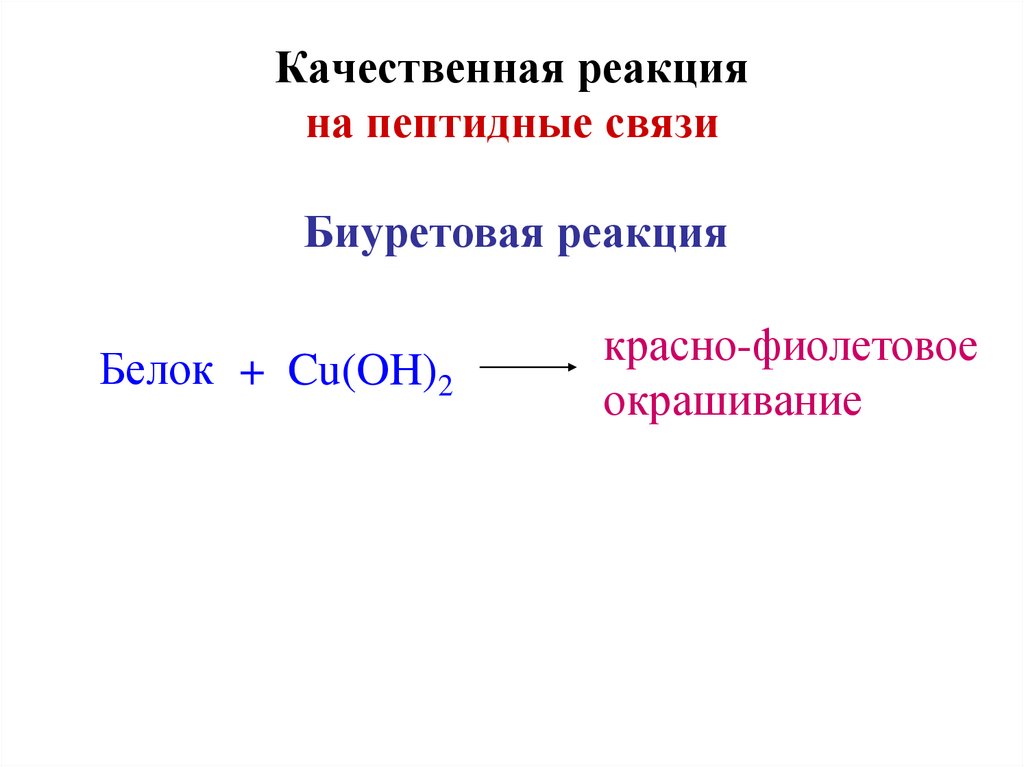
39. Качественная реакция на пептидные связи
Биуретовая реакцияБелок + Cu(OH)2
красно-фиолетовое
окрашивание
40.
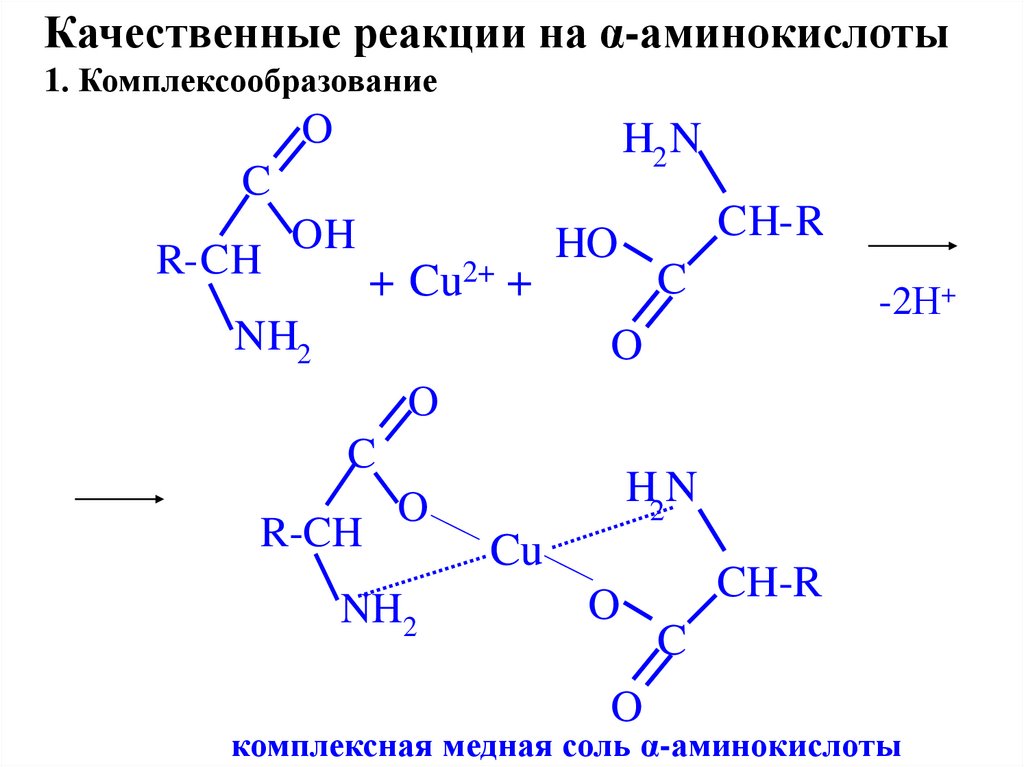
Качественные реакции на α-аминокислоты1. Комплексообразование
O
H2 N
C
R-CH
OH
+ Cu2+ +
NH2
CH-R
HO
C
-2Н+
O
O
C
R-CH
H2N
O
NH2
Cu
O
O
CH-R
C
комплексная медная соль α-аминокислоты
41.
2. Нингидриновая пробаO
OH
OH
+ H2 N-CH-COOH
R
O
нингидрин
O
O
O
N
+ R-C
+ CO2
H
O
OH
продукт сине-фиолетового цвета
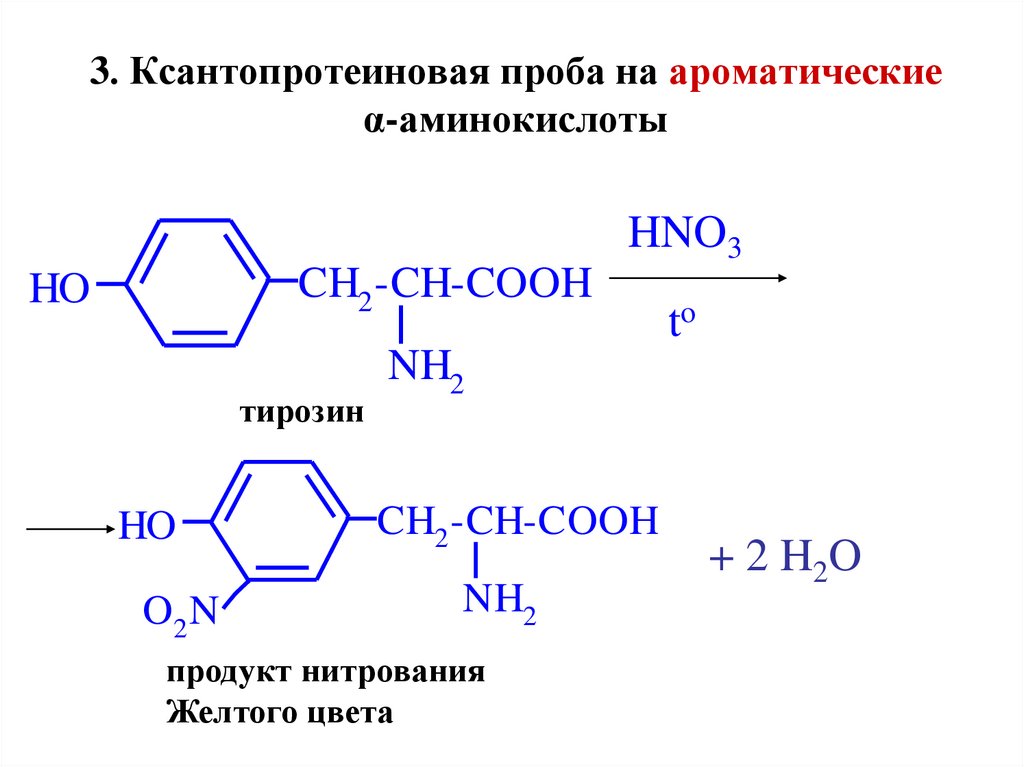
42. 3. Ксантопротеиновая проба на ароматические α-аминокислоты
HNO3CH2 -CH-COOH
HO
тирозин
HO
O2 N
to
NH2
CH2 -CH-COOH
NH2
продукт нитрования
Желтого цвета
+ 2 H 2O
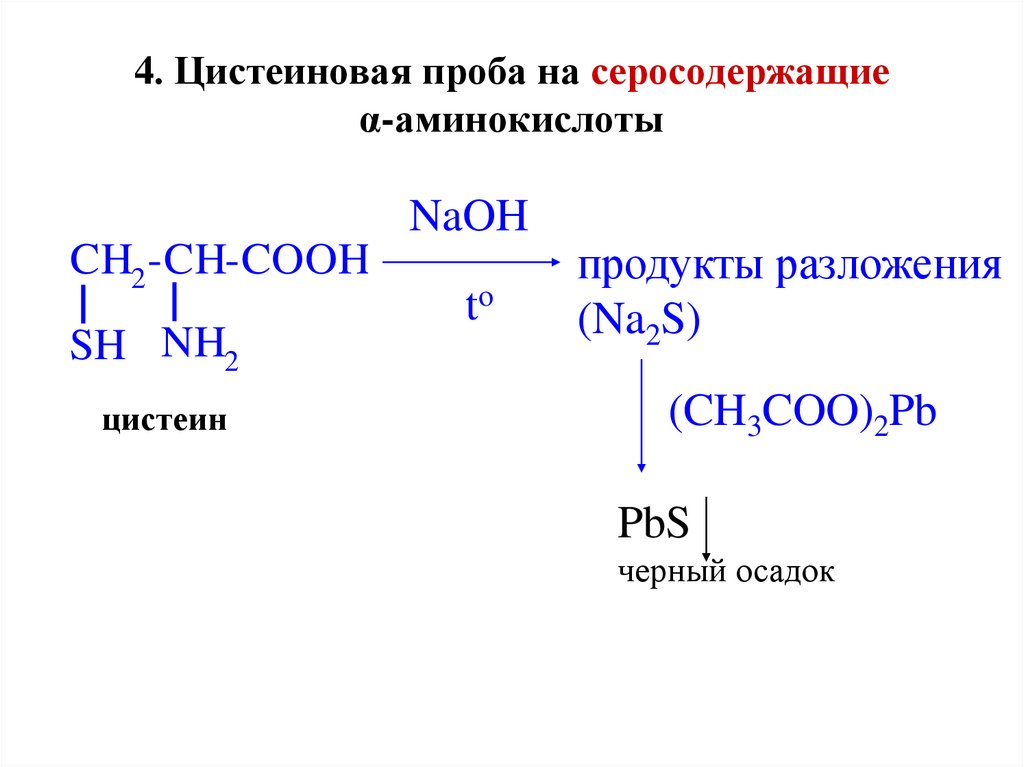
43. 4. Цистеиновая проба на серосодержащие α-аминокислоты
NaOHCH2 -CH-COOH
SH NH2
цистеин
to
продукты разложения
(Na2S)
(CH3COO)2Pb
PbS
черный осадок










 Биология
Биология Химия
Химия