Похожие презентации:
Ферменты строение и катализ. Тема 6
1.
Ферментыстроение и катализ
2.
Ферменты–
биологические
катализаторы. Почти все ферменты – белки.
Однако известно небольшое число молекул
РНК,
обладающих
каталитической
активностью – рибозимы.
Рибозим (сокращение от «рибонуклеиновая кислота» и
«энзим»), также называемая ферментативной РНК или
каталитической
РНК
—
это
молекула
РНК,
обладающая каталитическим действием.
Термин фермент предложен в XVII веке
химиком ван Гельмонтом при обсуждении
механизмов пищеварения.
3.
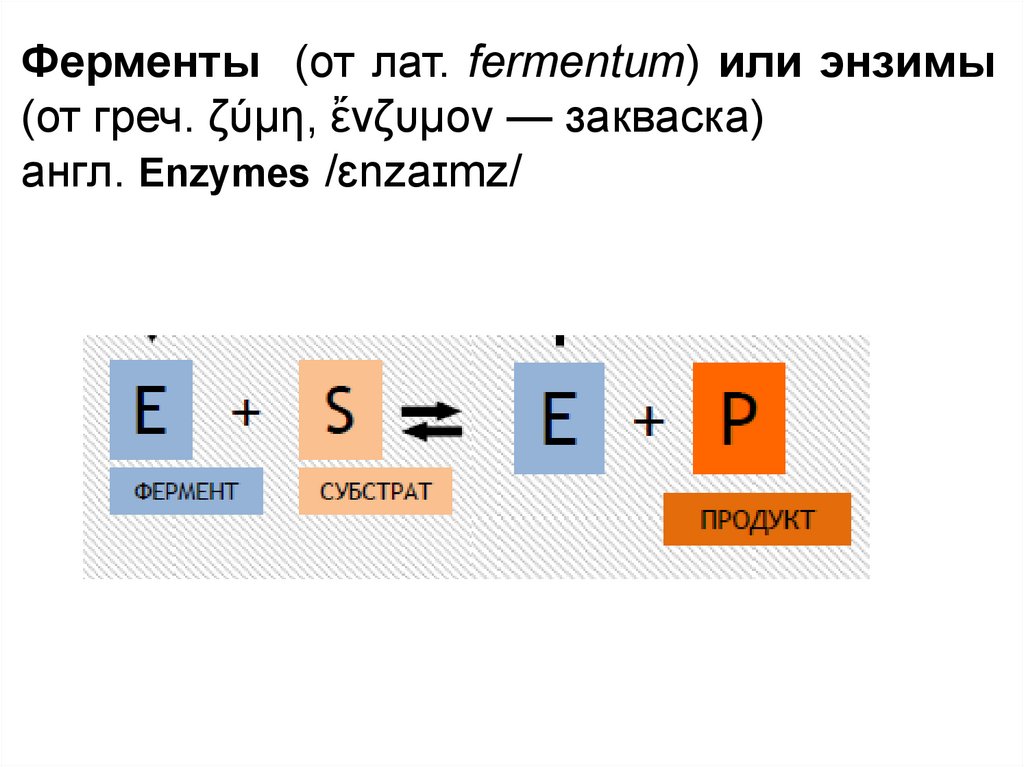
Ферменты (от лат. fermentum) или энзимы(от греч. ζύμη, ἔνζυμον — закваска)
англ. Enzymes /ɛnzaɪmz/
4.
Общие свойства ферментов1.Ферменты
не
сдвигают
равновесие реакции
2. Ферменты снижают энергию
активации для катализируемых
ими реакций
5.
6.
Свойства ферментов каккатализаторов:
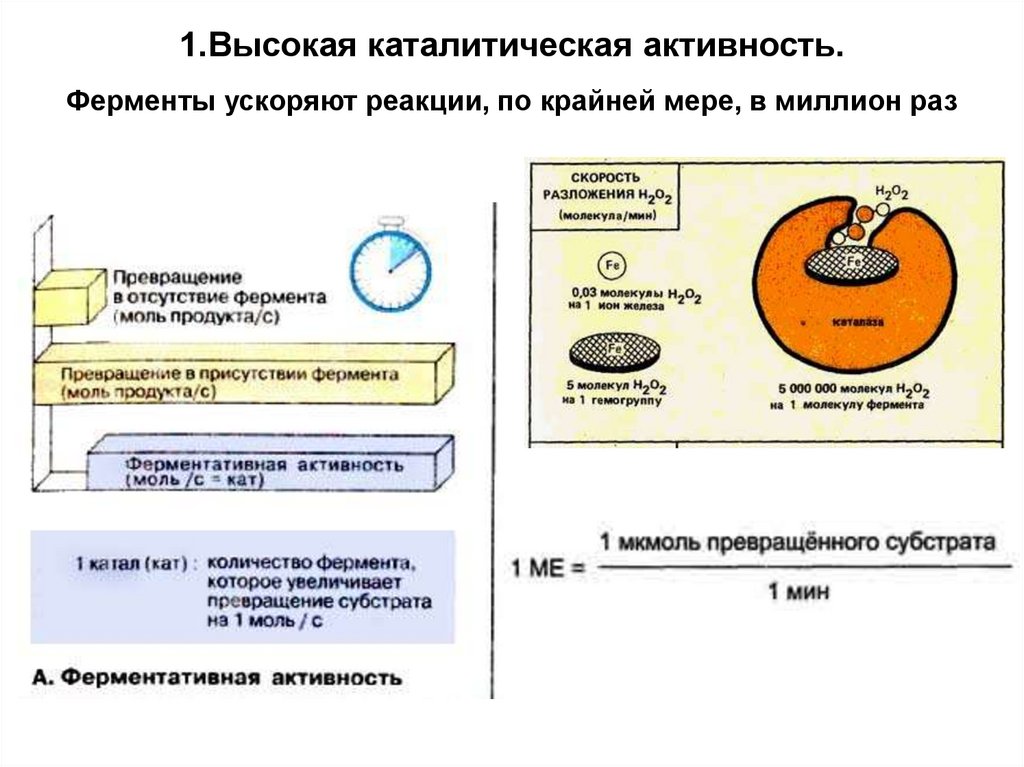
1.Высокая каталитическая активность.
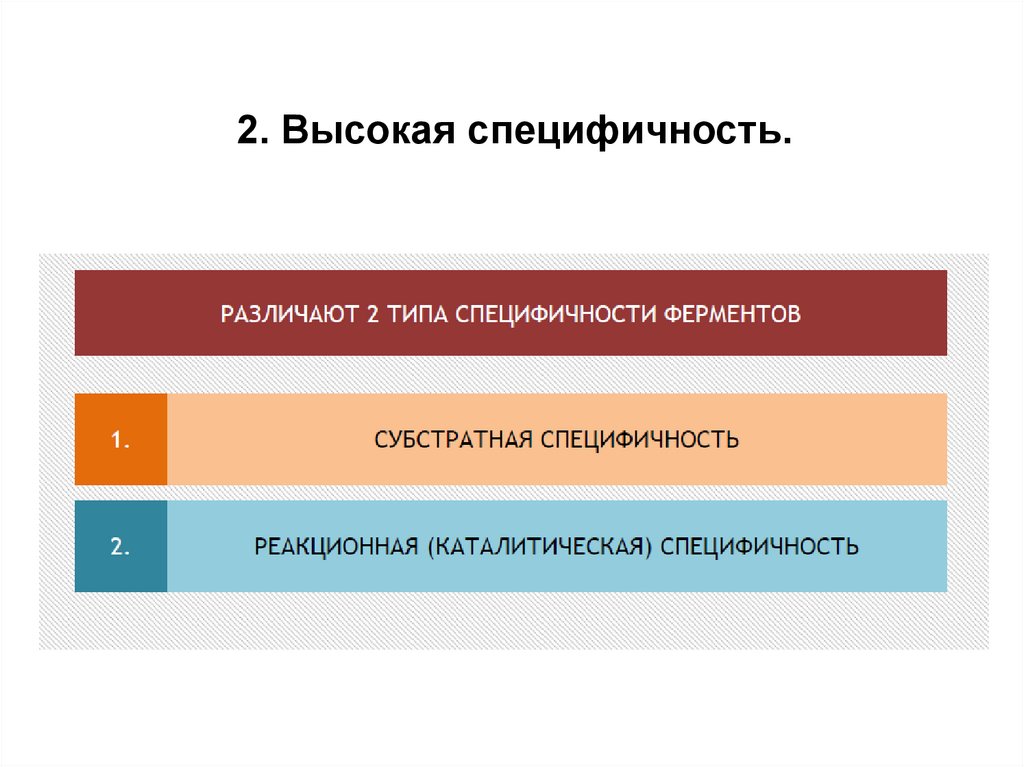
2.Высокая специфичность.
3. Лабильность – чувствительность к условиям
среды
4. Активность ферментов может регулироваться.
7.
1.Высокая каталитическая активность.Ферменты ускоряют реакции, по крайней мере, в миллион раз
8.
9.
10.
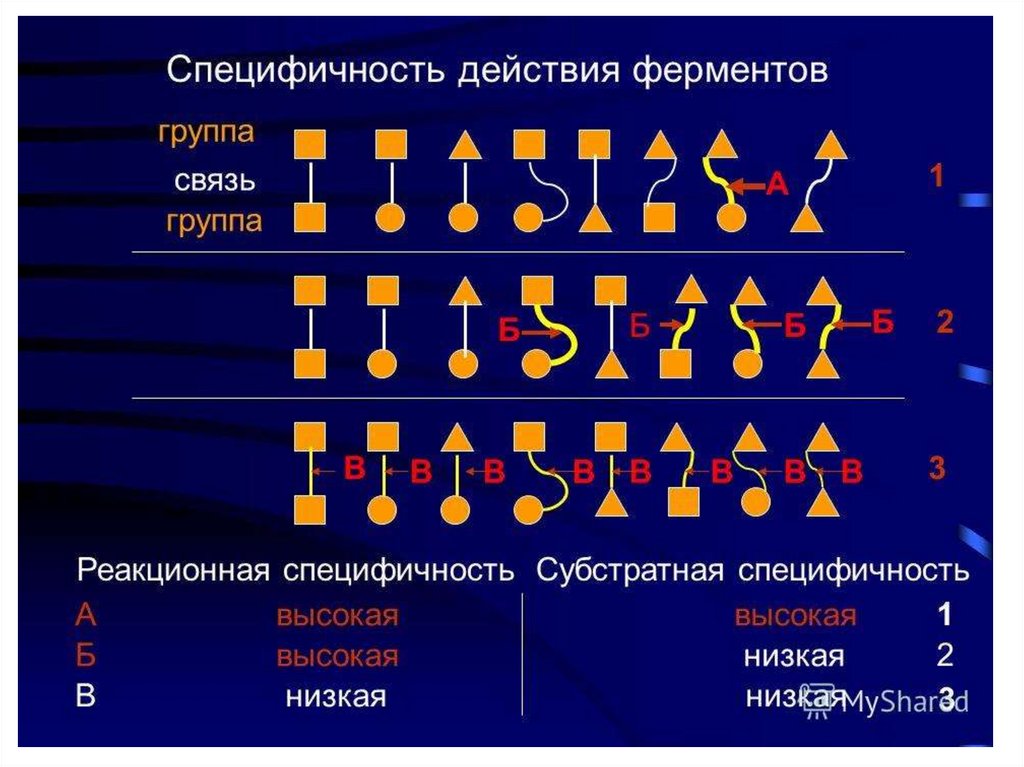
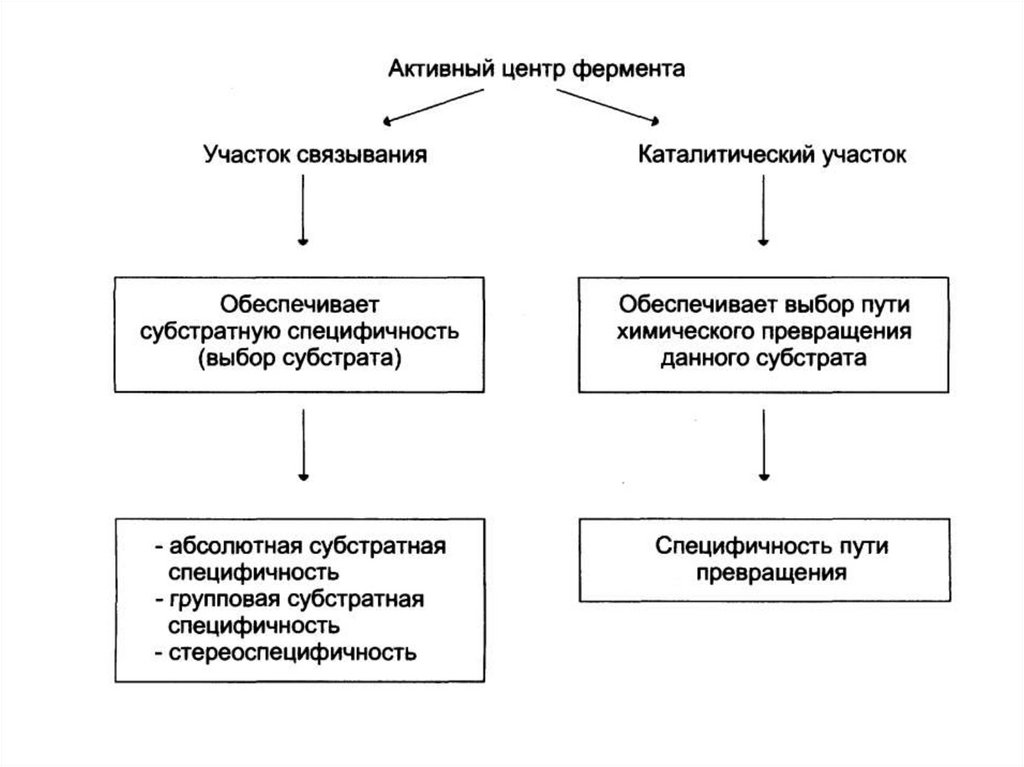
2. Высокая специфичность.11.
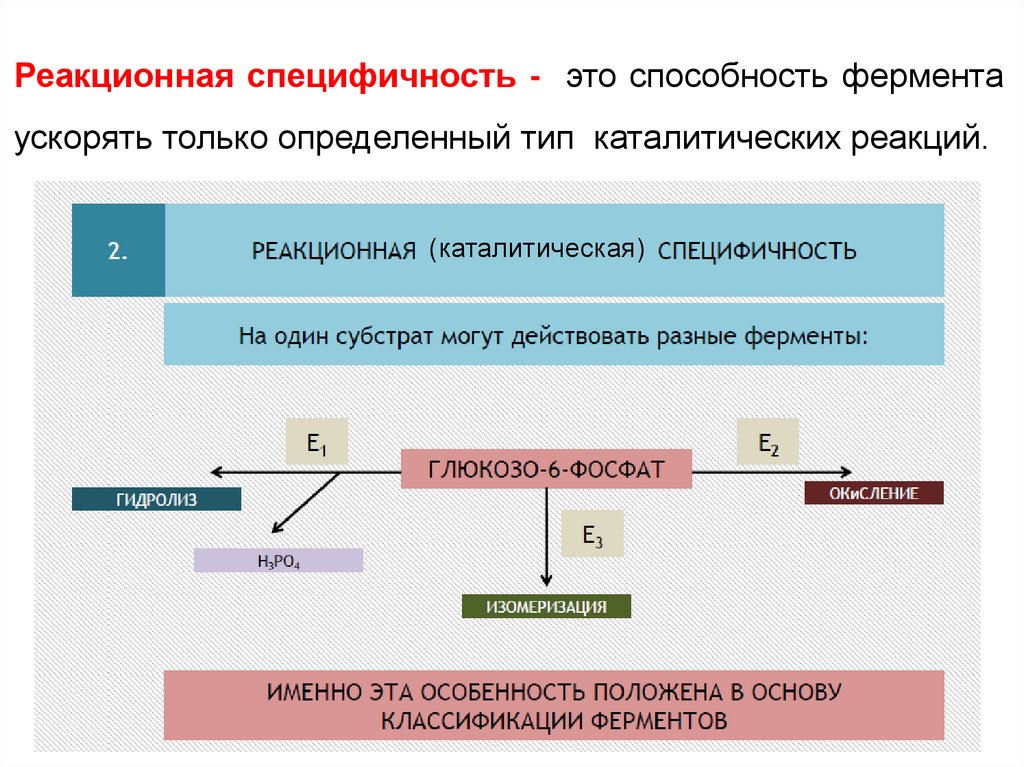
Реакционная специфичность - это способность ферментаускорять только определенный тип каталитических реакций.
(каталитическая)
12.
Субстратная специфичность - это способностькаждого фермента взаимодействовать
одним
или
несколькими
лишь с
определёнными
субстратами. Различают:
- абсолютную субстратную специфичность;
- групповую субстратную специфичность;
- стереоспецифичность.
13.
Абсолютная специфичность – это способностьфермента катализировать реакцию только с одним
субстратом
14.
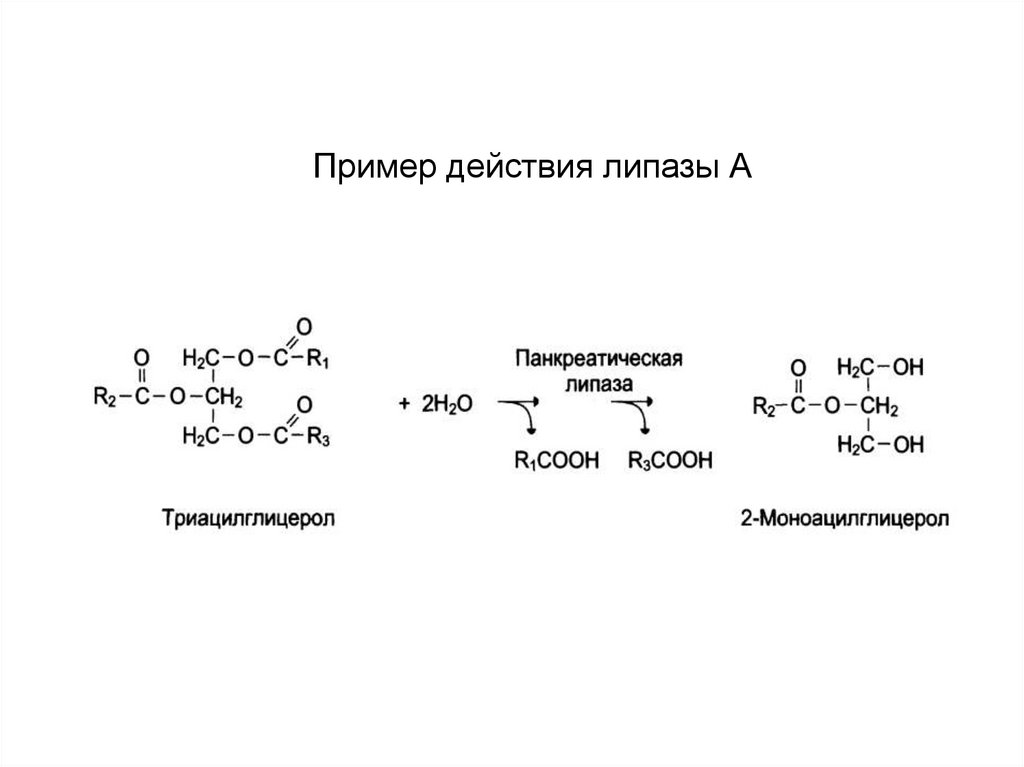
15. Пример действия липазы А
16.
Стереоспецифичность – способность фермента катализировать реакцию только сопределенным стереоизомером субстрата.
1. Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их
обмена в организме человека и других млекопитающих относят к D-стереоизомерам.
Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к Lсахарам.
2. Стереоспецифичность к L-аминокислотам. Белки человека состоят из
аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение
аминокислот, имеет стереоспецифичность к L-аминокислотам.
3. Стереоспецифичность к цистрансизомерам.
Фермент фумараза оказывает действие только
на фумарат. Малеинат (цис-изомер фумарата)
не является субстратом фумаразы.
4. Стереоспецифичность к α- и β-гликозидным связям. Фермент амилаза действует
только на α-гликозидные связи, что позволяет гидролизотать крахмал и гликоген
(полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями.
Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны βгликозидными связями. В результате отсутствия у человека ферментов, специфичных к
β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может
служить источником глюкозы.
17.
18.
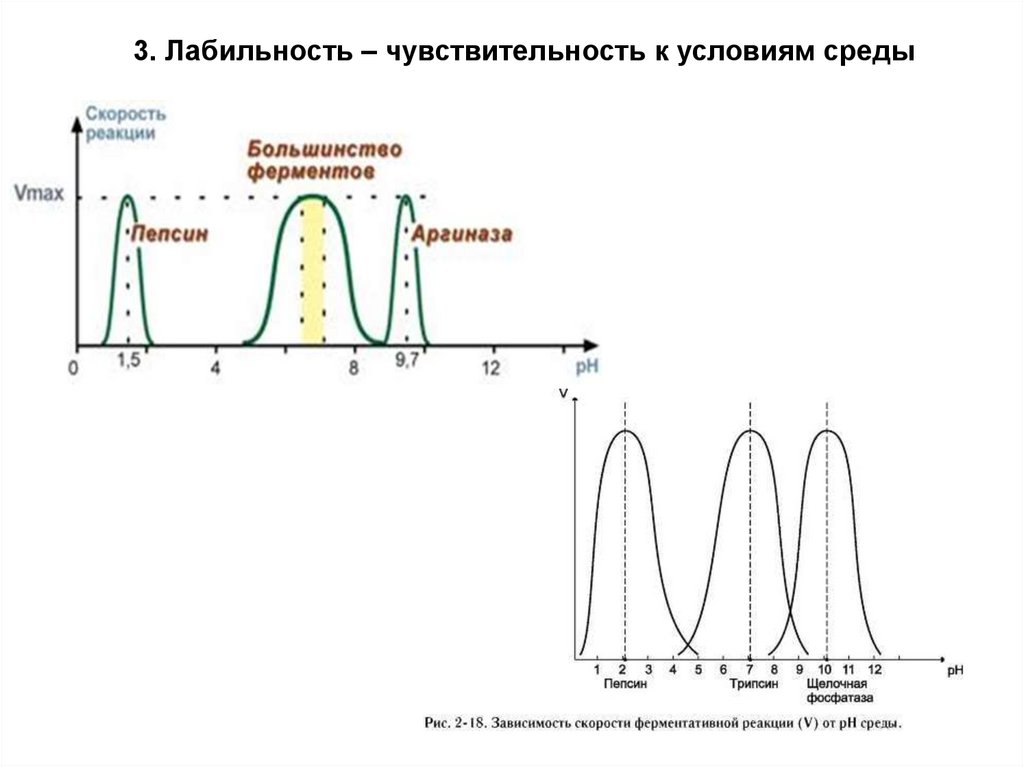
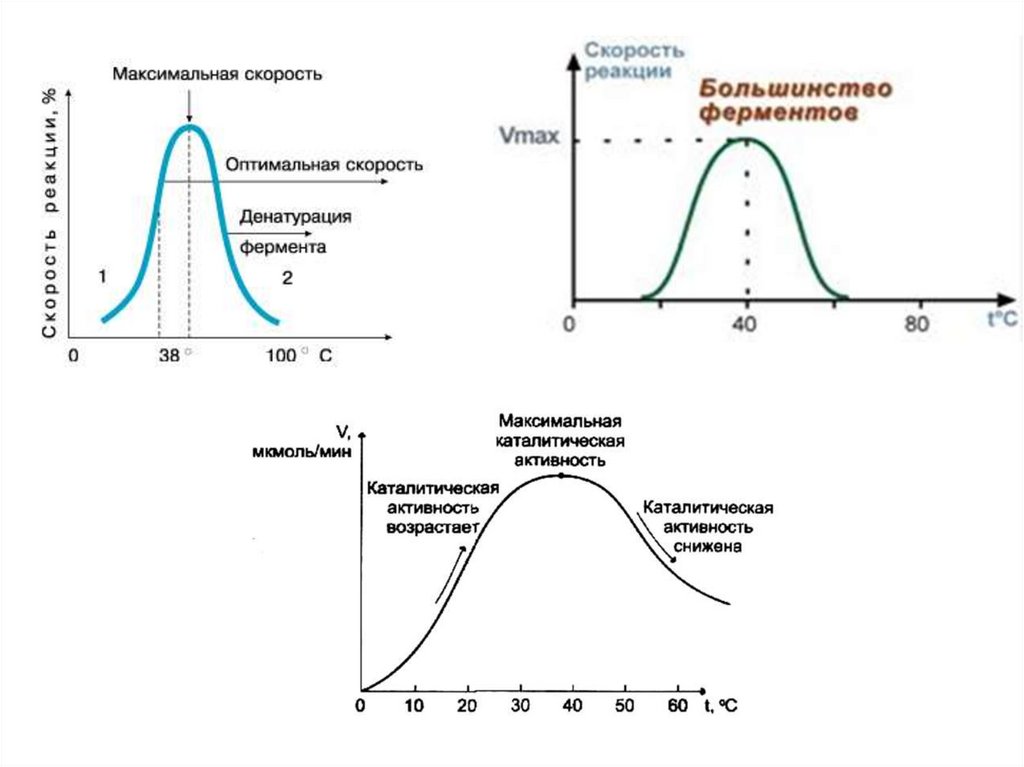
3. Лабильность – чувствительность к условиям среды19.
Оптимальные значения pH для некоторых ферментовФермент
pH
Фермент
pH
Пепсин
1,5-2,5
Каталаза
6,8-7,0
Катепсин В
4,5-5,0
Уреаза
7,0-7,2
Амилаза из солода
4,9-5,2
Липаза
панкреатическая
7,0-8,5
Сахараза кишечная
5,8-6,2
Трипсин
7,5-8,5
Амилаза слюны
6,8-7,0
Аргиназа
9,5-10,0
20.
21.
4. Активность ферментов может регулироваться.22.
Активность ферментов в клетке непостоянна вовремени. Она чутко реагирует на ситуацию, в которой
оказывается клетка, на факторы, воздействующие на
клетку как снаружи, так и изнутри.
Главная цель этой реакции – отреагировать на
изменение окружающей среды, приспособить клетку к
новым условиям, дать должный ответ на гормональные
и иные стимулы, а в некоторых ситуациях – получить
шанс выжить.
23.
24.
25.
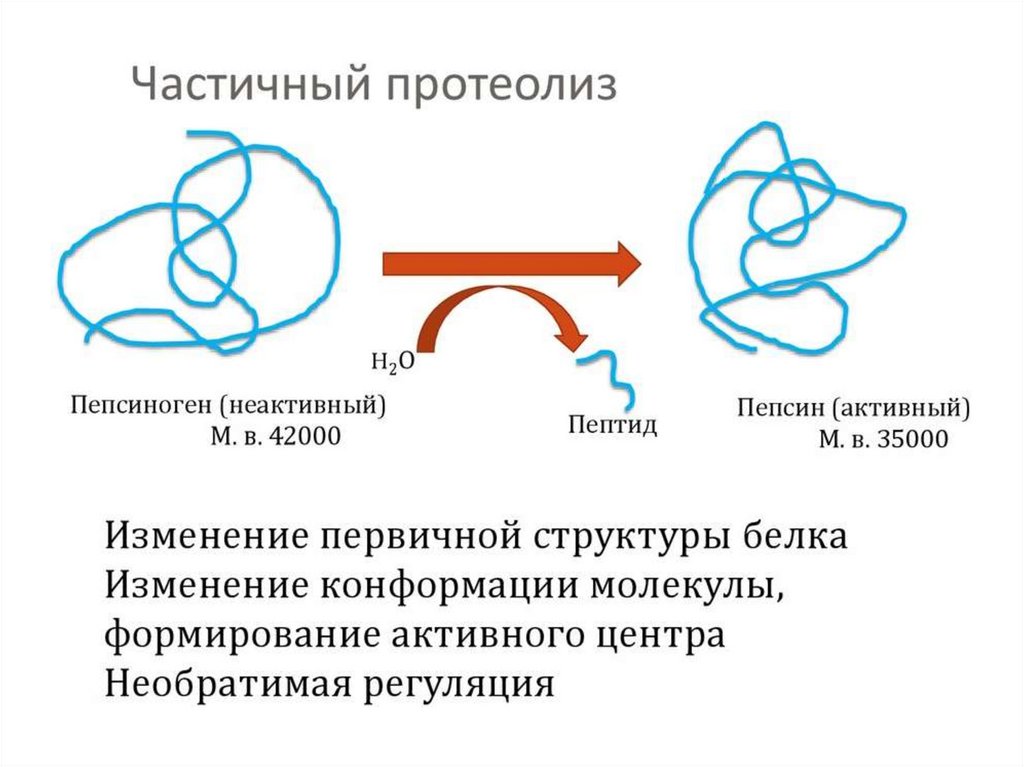
4.Ограниченный
проферментов.
(частичный)
протеолиз
Т.к. синтез некоторых ферментов осуществляется в виде
более крупного предшественника (трипсиноген, пепсиноген,
прокарбоксипептидазы, факторы свертывания крови), то
при поступлении в нужное место этот фермент активируется
через отщепление от него одного или нескольких пептидных
фрагментов.
26.
27.
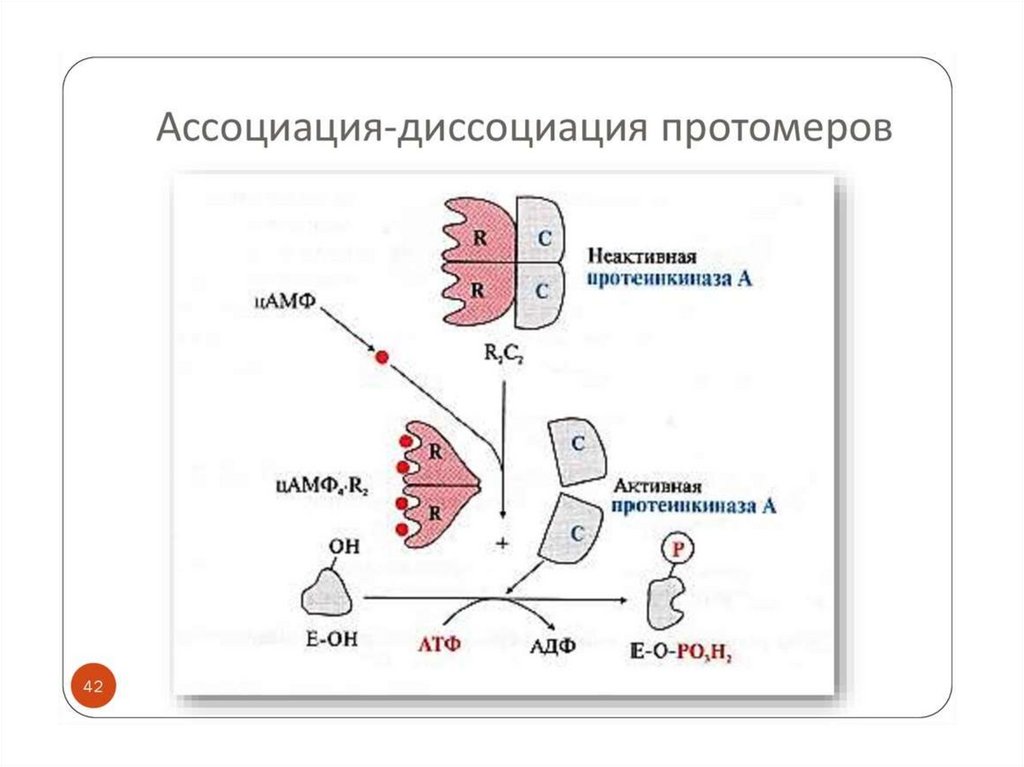
Аллостерическая регуляция.Аллостерические ферменты построены из двух и
более субъединиц: одни субъединицы содержат
каталитический
центр,
другие
являются
регуляторными. Присоединение эффектора к
аллостерической
(регуляторной)
субъединице изменяет конформацию белка и
активность каталитической
субъединицы.
Аллостерические ферменты обычно стоят в
начале
метаболических путей, и от их
активности зависит течение многих последующих
реакций. Поэтому они
часто называются
ключевыми ферментами.
28.
В качестве отрицательного регулятора может выступатьконечный метаболит биохимического процесса, продукт
данной реакции, т.е работает механизм обратной
отрицательной связи. Если регуляторами являются
начальный метаболит или субстрат реакции, то говорят о
прямой положительной регуляции.
29.
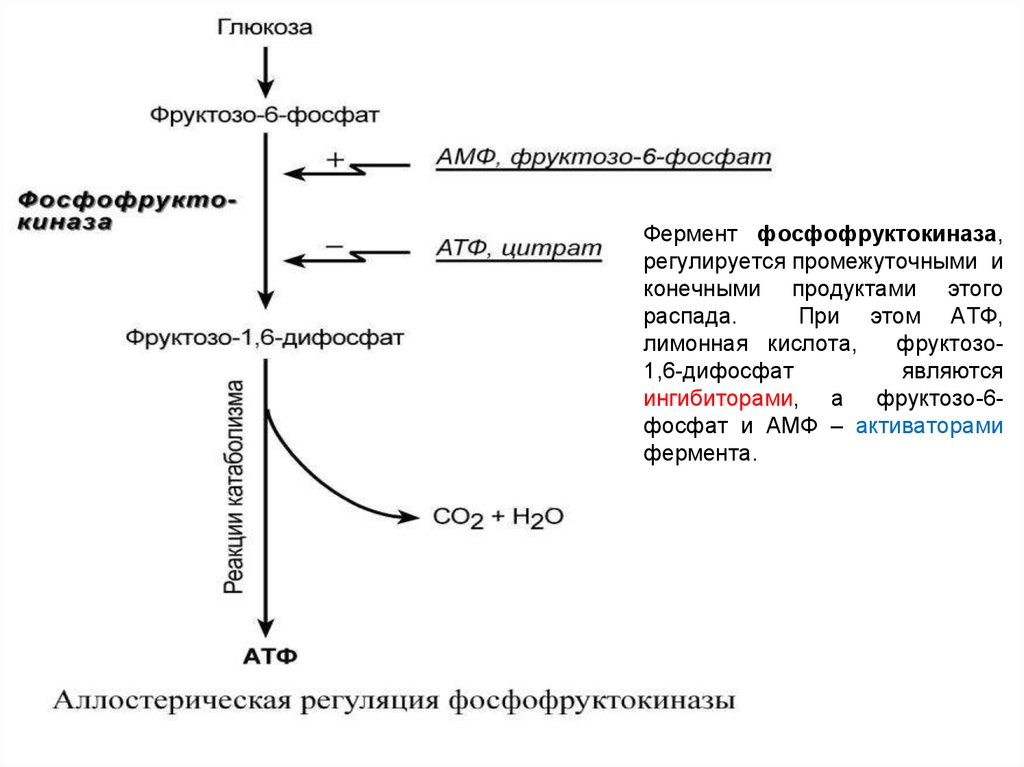
Фермент фосфофруктокиназа,регулируется промежуточными и
конечными продуктами этого
распада.
При этом АТФ,
лимонная кислота,
фруктозо1,6-дифосфат
являются
ингибиторами, а фруктозо-6фосфат и АМФ – активаторами
фермента.
30.
31.
32.
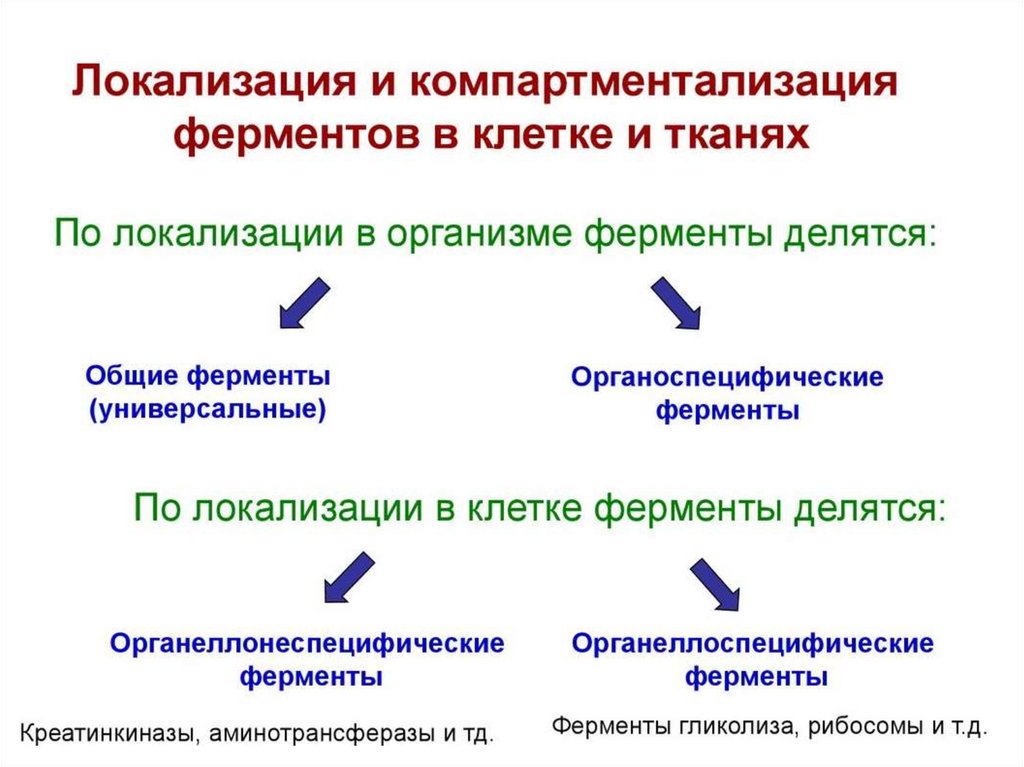
Локализация ферментов в клеткеЦитозоль
Амилаза, Липаза панкреатическая, Глицеро-З-фосфатде-гидрогеназа,
Гистидаза, Сорбитолдегидрогеназа, Лактатдегидрогеназа,
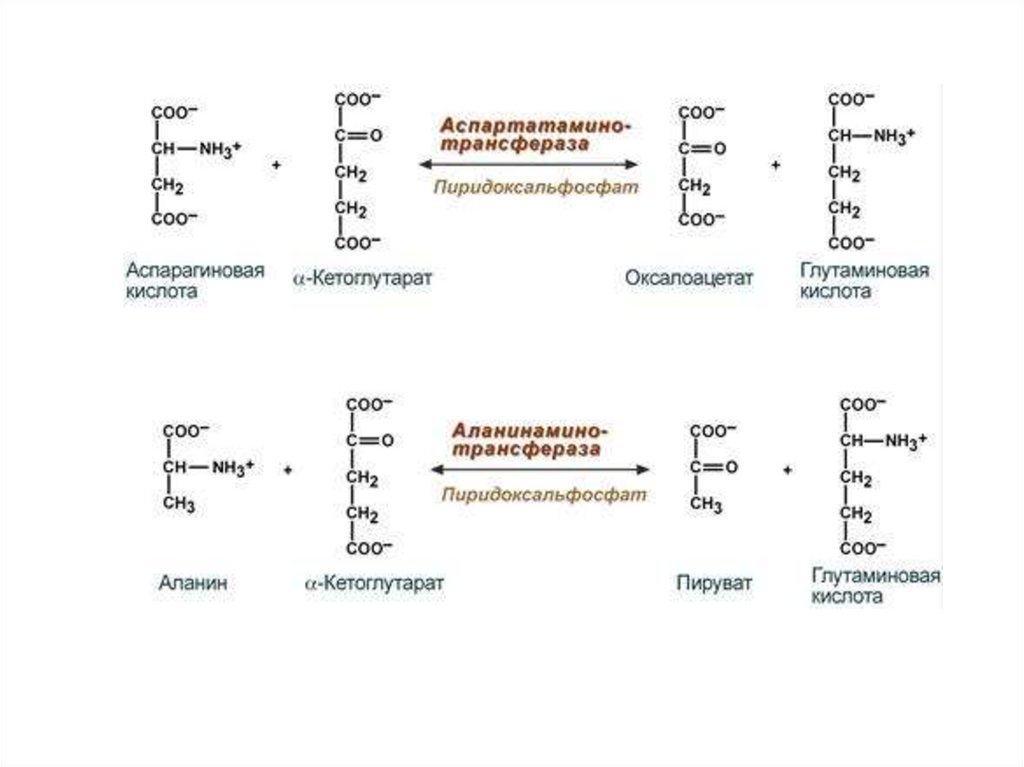
Алкогольдегидрогеназа, Креатинкиназа, Глюкозо-б-фосфатдегидрогеназа, Аланинаминотрансфераза,
Аспартатаминотрансфераза, Гликогенсинтетаза
Митохондрии
Пируватдегидрогеназный комплекс, Цитратсинтаза,
Малатдегидрогеназа, Уроканиназа, Глутаматдегидрогеназа,
Креатинкиназа, Ацил-СоА-дегидрогеназа, -аминолевулинатсинтетаза,
Аспартатаминотрансфераза, Пируваткиназа
Лизосомы
Микросомы
Ядро
Клеточная
мембрана
Кислая фосфатаза, - -Галактозидаза, - -Галактозидаза,
Гиалуронидаза, Коллагеназа, -Глюкуронидаза, Арилсульфатаза,
Кислая рибонуклеаза, Кислая дезоксирибонуклеаза, Катепсин,
-Маннозидаза
Глюкозо-6-фосфатаза, -Глутамил транспептидаза, Моноаминоксидаза,
Церулоплазмин, Глюкуронидтрансфераза
ДНК-полимераза, ДНК-лигаза, Топоизомераза, Эндонуклеаза,
РНК-полимераза, Хеликаза, NАD-синтетаза
Нуклеотидаза, Щелочная фосфатаза, -Глутамил транспептидаза,
K+,Na+-АТРаза, Аденилатциклаза
32
33.
34.
35.
36.
37.
38.
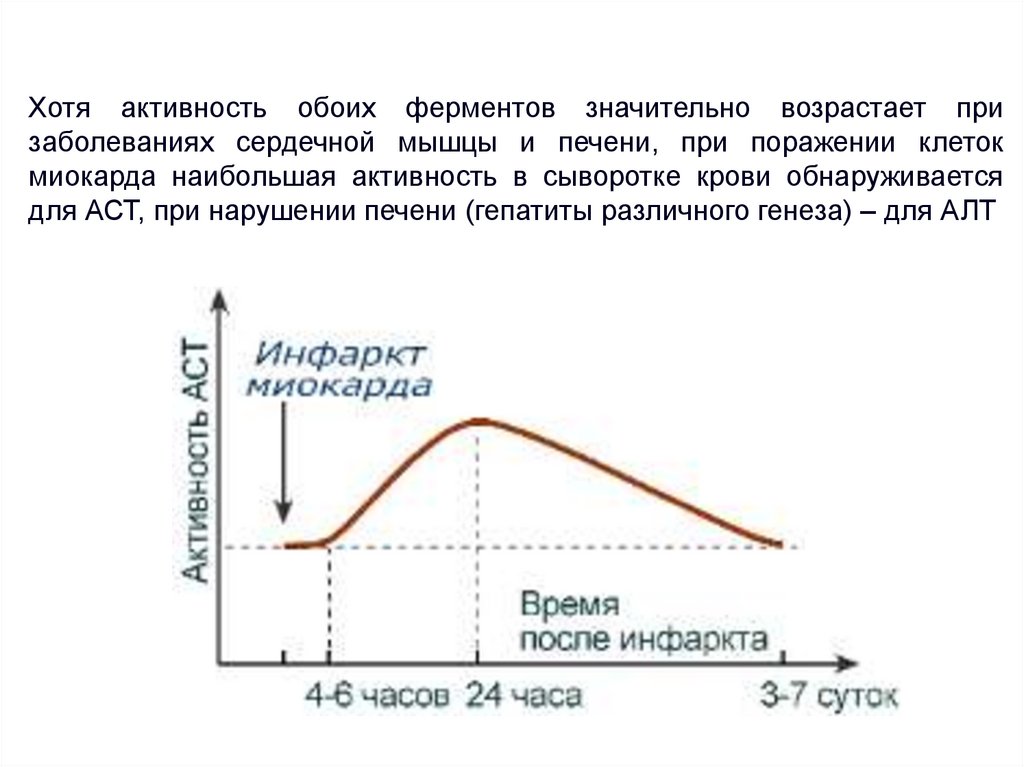
Хотя активность обоих ферментов значительно возрастает призаболеваниях сердечной мышцы и печени, при поражении клеток
миокарда наибольшая активность в сыворотке крови обнаруживается
для АСТ, при нарушении печени (гепатиты различного генеза) – для АЛТ
39.
Строение ферментов и общиепринципы их функционирования
40.
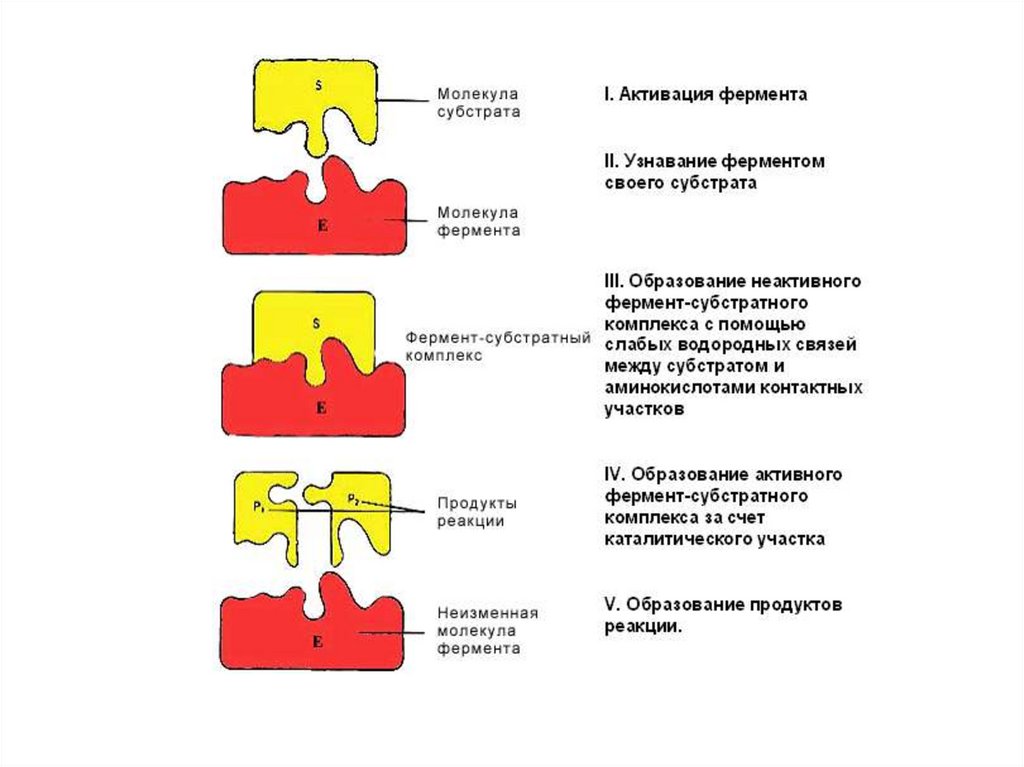
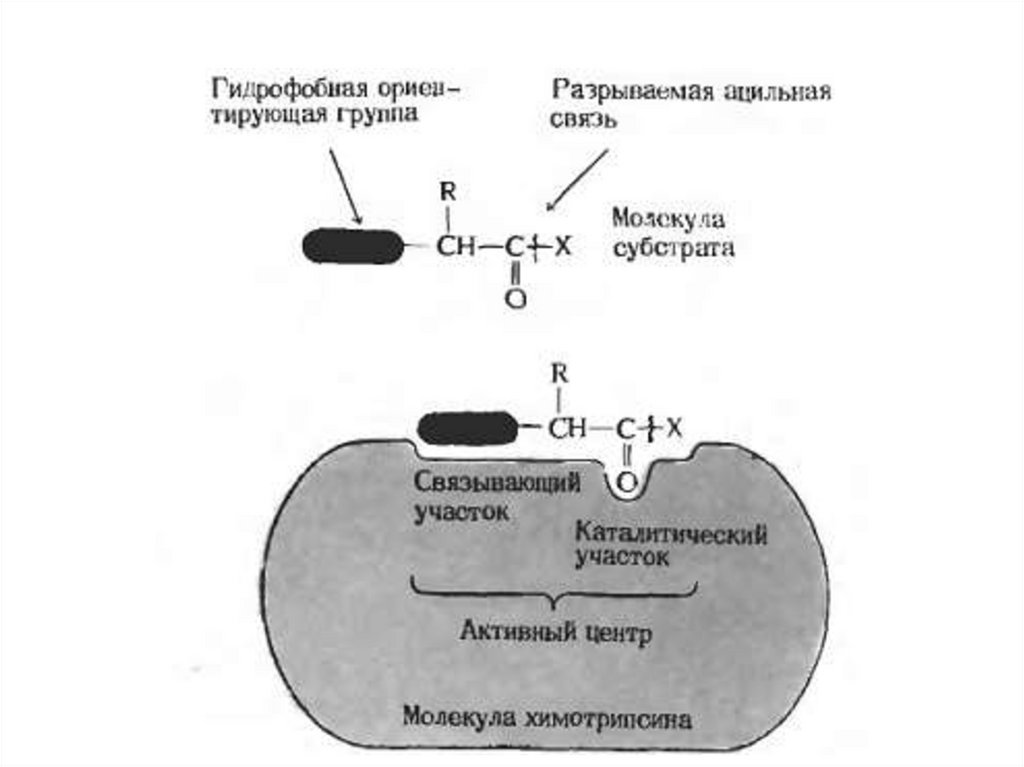
Первым этапом катализа является образованиефермент-субстратного комплекса. При этом
субстрат связывается с активным центром
фермента.
Активный центр фермента – это участок,
который
связывает
субстраты
(и
простетическую группу, если она есть) и в
котором содержатся аминокислотные остатки,
непосредственно участвующие в образовании
или разрыве химических связей. Такие остатки
называют каталитическими группами.
41.
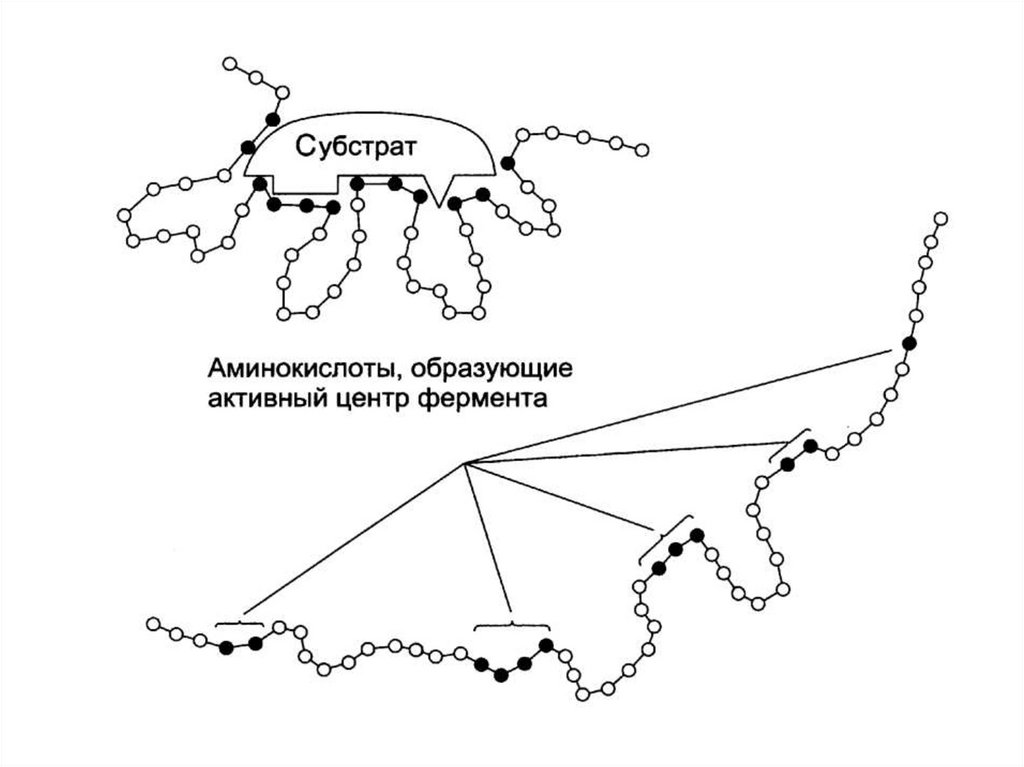
Общие свойства активных центров:1. На активный центр приходится относительно
малая
часть
от
общего
количества
аминокислот фермента.
2. Активный центр – трехмерное образование.
3. Активный центр имеет форму узкого
углубления или щели. В нем создаются
особые, отличные от водной среды условия.
4. Специфичность связывания зависит от
строго определенного расположения атомов
в активном центре.
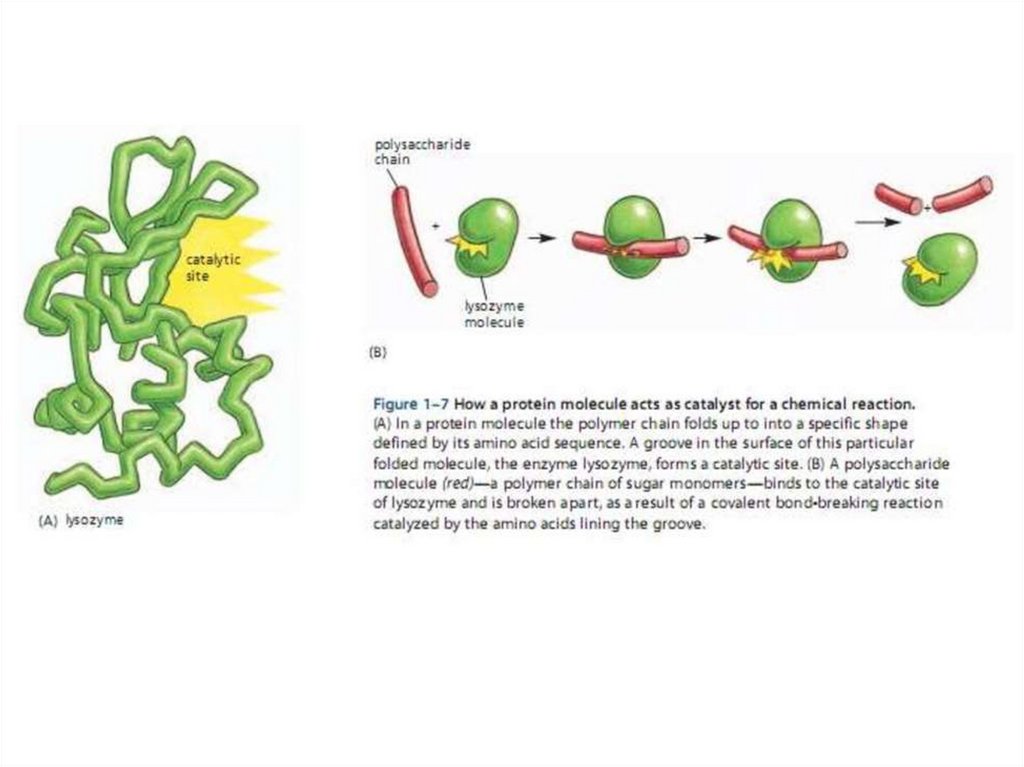
42.
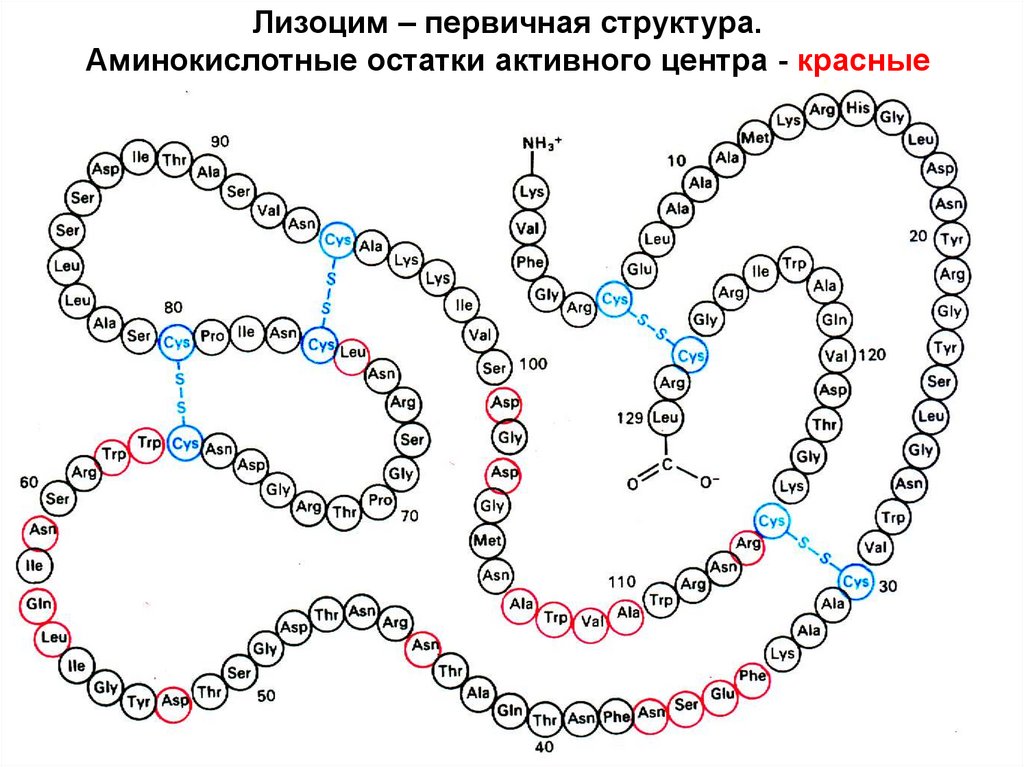
Лизоцим – первичная структура.Аминокислотные остатки активного центра - красные
43.
44.
45.
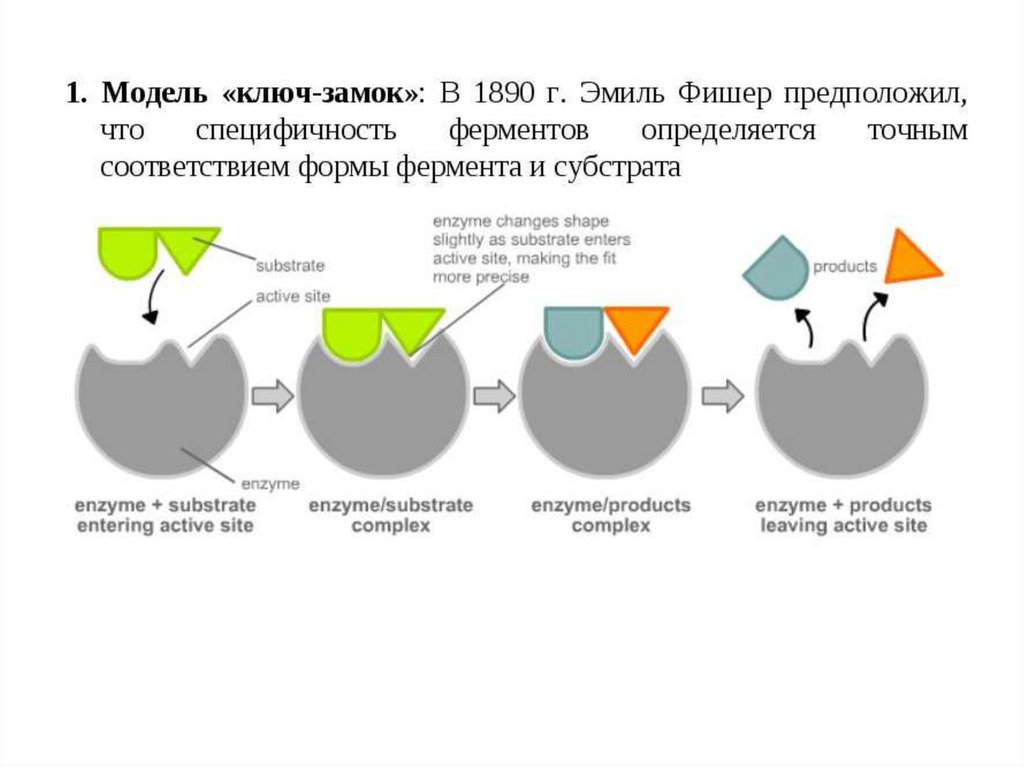
Основные модели, объясняющиеспецифичность взаимодействия
фермента и субстрата:
1. Модель ключ – замок.
2. Модель индуцированного
соответствия.
46.
47.
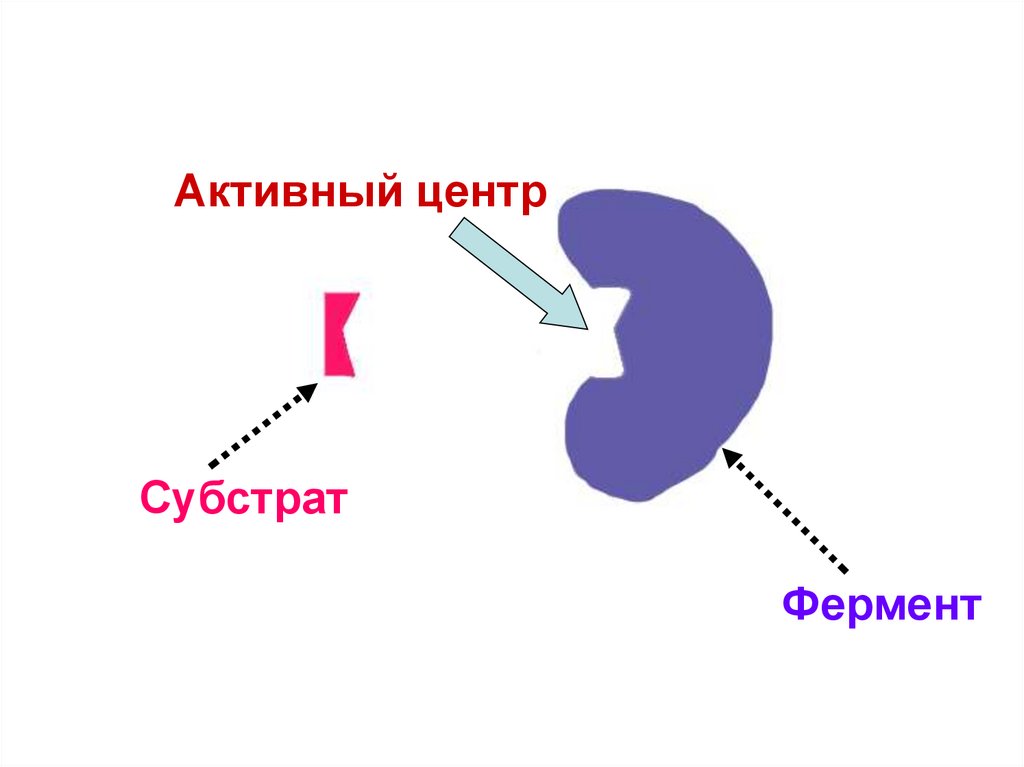
Активный центрСубстрат
Фермент
48.
Ферментсубстратныйкомплекс
49.
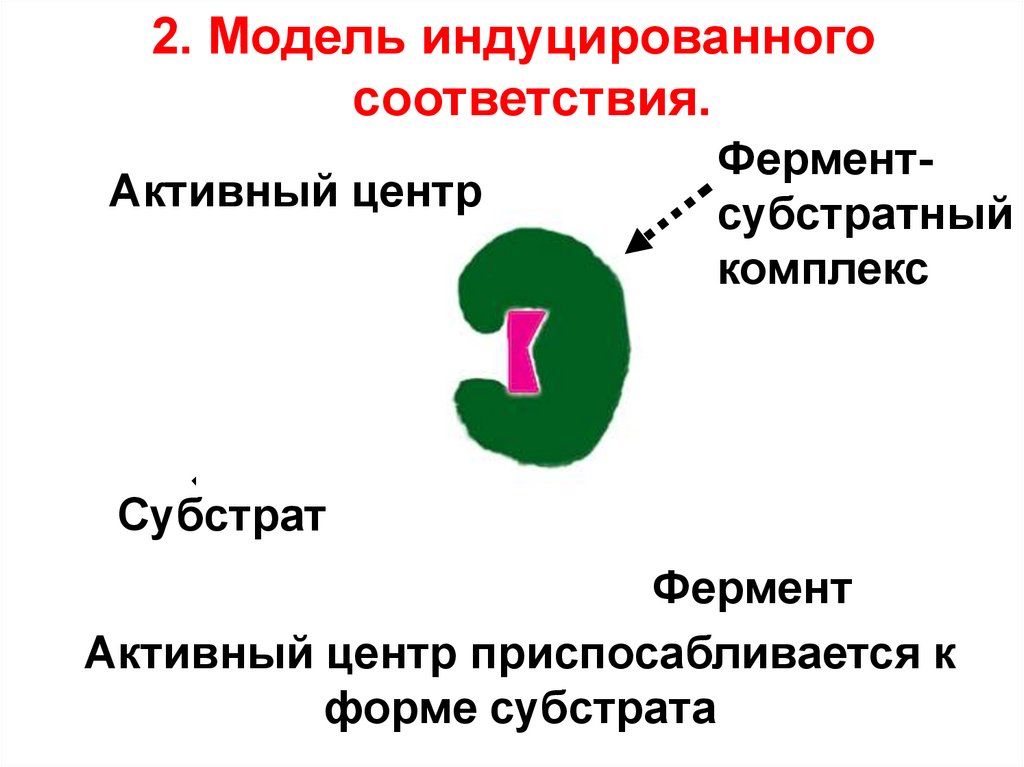
2. Гипотеза Кошланда (модель "индуцированногосоответствия", "рука-перчатка") – подразумевает
гибкость активного центра. Присоединение субстрата к
якорному участку фермента вызывает изменение
конфигурации каталитического центра таким образом,
чтобы его форма соответствовала форме субстрата.
50.
2. Модель индуцированногосоответствия.
Активный центр
Ферментсубстратный
комплекс
Субстрат
Фермент
Активный центр приспосабливается к
форме субстрата
51.
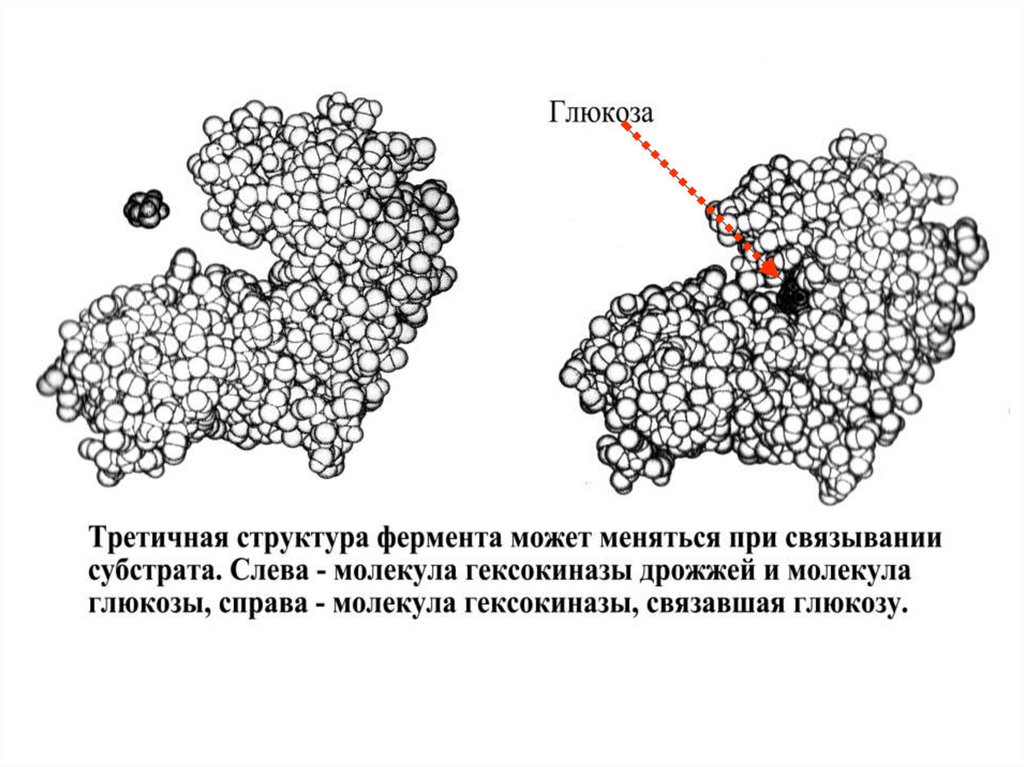
Взаимодействие субстрата и ферментамодели «индуцированного соответствия»:
согласно
1. При связывании субстрата происходит изменение
формы
фермента.
Активный
центр
фермента
становится
пространственно
комплиментарным
субстрату только после связывания субстрата.
2. Важно, что активный центр может изменить свою
форму только строго определенным образом.
Активный
центр
не
может
изменить
свою
конформацию так, чтобы быть комплиментарным
веществам, отличным от своего субстрата.
52.
53.
54.
Кинетика ферментативныхреакций
55.
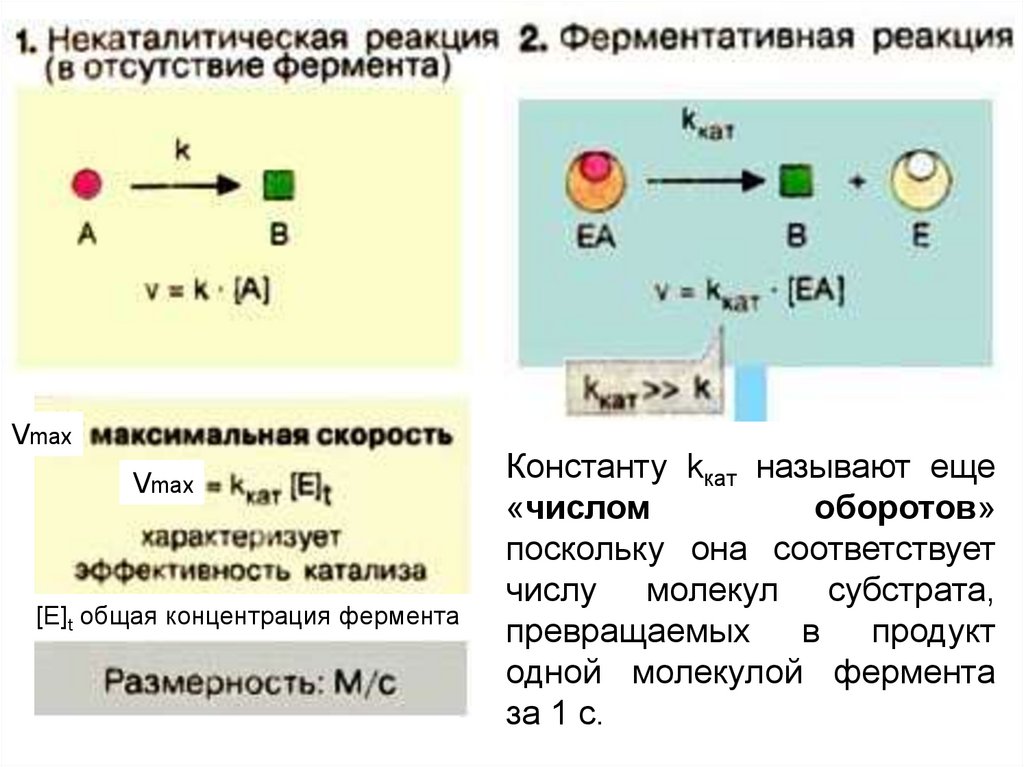
VmaxVmax
[E]t общая концентрация фермента
Константу kкат называют еще
«числом
оборотов»
поскольку она соответствует
числу молекул субстрата,
превращаемых в продукт
одной молекулой фермента
за 1 с.
56.
В 1973 г. была принята новая единица активностиферментов: 1 катал (кат), соответствующий такому
количеству катализатора, которое превращает 1 моль
субстрата за 1 с. Количество каталов определяют по
формуле:
катал =
Количество превращённого субстрата (моль)
Время (с)
57.
- субстрат- фермент
58.
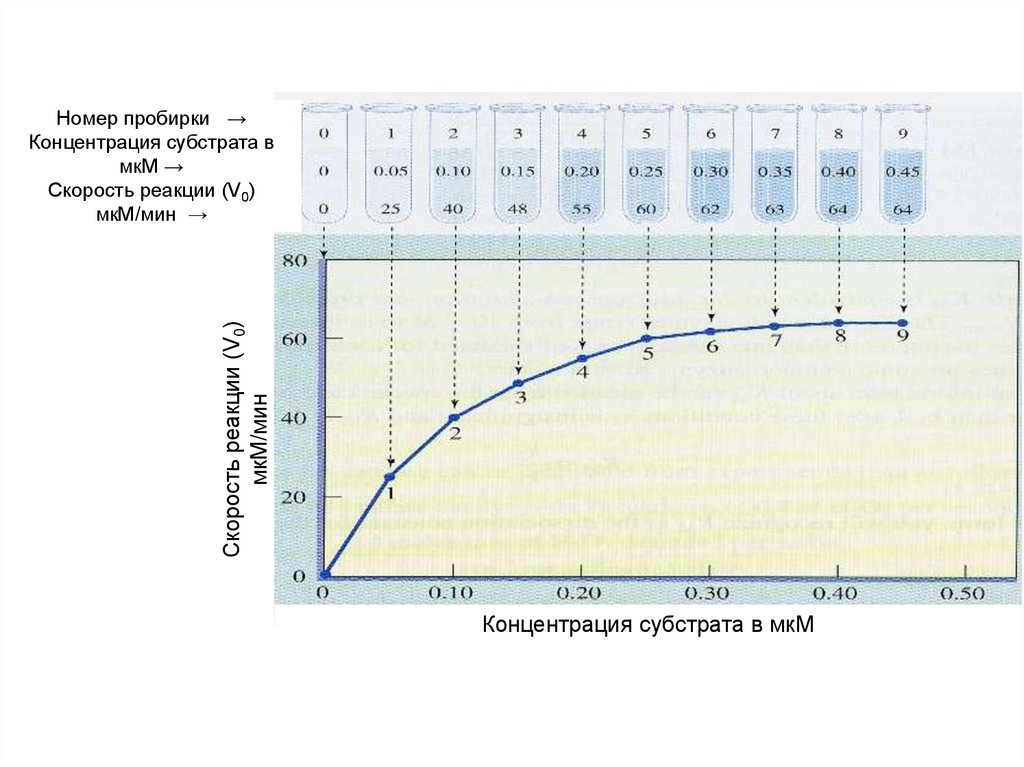
Скорость реакции (V0)мкМ/мин
Номер пробирки →
Концентрация субстрата в
мкМ →
Скорость реакции (V0)
мкМ/мин →
Концентрация субстрата в мкМ
59.
А – субстрат,[А] – концентрация свободного субстрата
E – фермент
[E] – концентрация свободного фермента
[E]t – общая концентрация фермента в системе
EА – комплекс фермента и субстрата
[EA] – концентрация комплекса фермента и
субстрата
Если система находится динамическом равновесии
(т.е. концентрация фермента в системе постоянная)
то [E]t = [E] + [EA]
Km – константа Михаэлиса
Km = [EA]
[E] ● [A]
60.
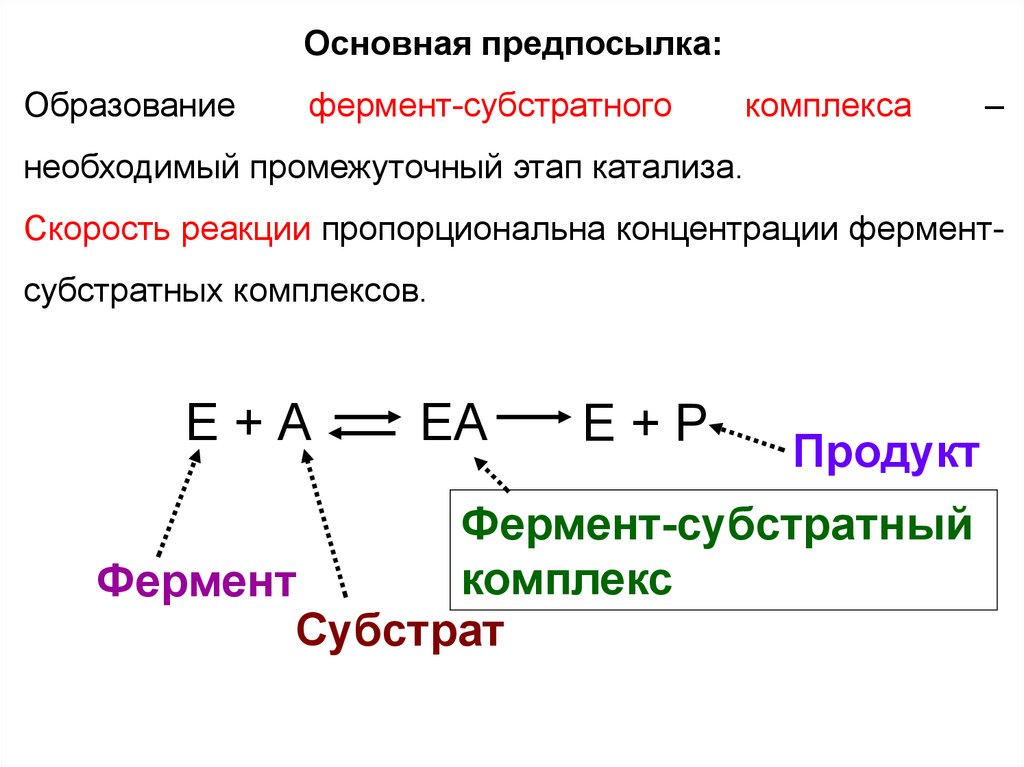
Основная предпосылка:Образование
фермент-субстратного
комплекса
–
необходимый промежуточный этап катализа.
Скорость реакции пропорциональна концентрации фермент-
субстратных комплексов.
E+А
EА
E+P
Продукт
Фермент-субстратный
комплекс
Фермент
Субстрат
61.
Уравнение Михаэлиса-МентенVmax
[A
]
V
[A
] K
M
если Vmax = kkat ● [E]t
k
kat
[
E
]t [A
]
V
[A
] K
M
62.
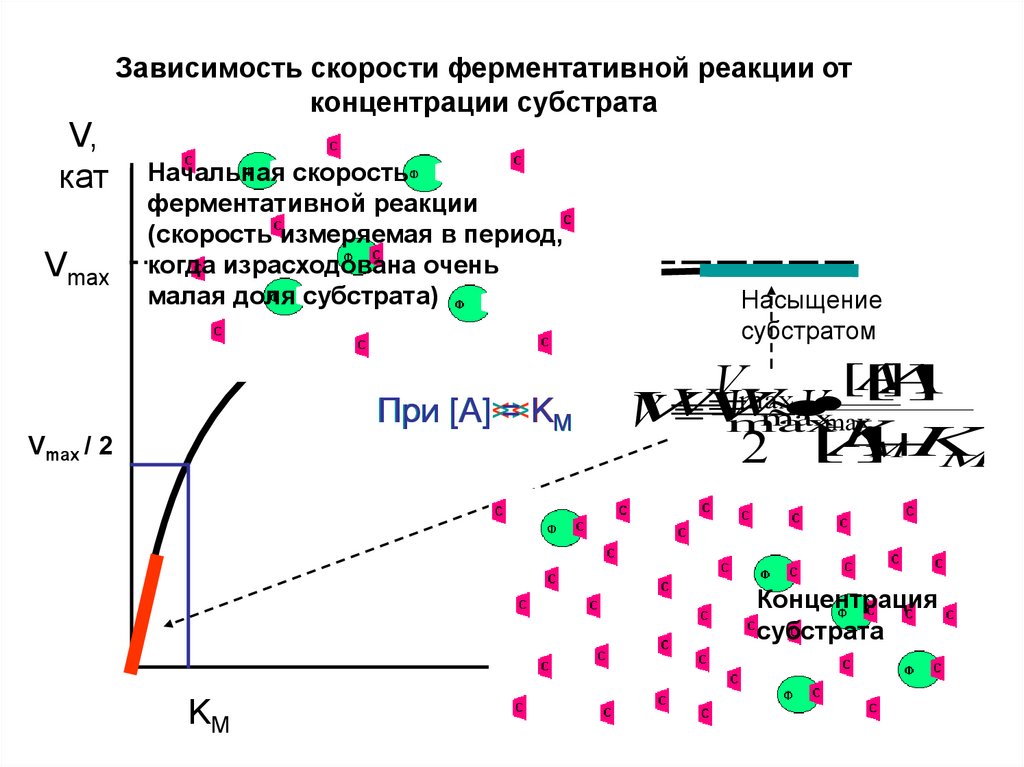
Зависимость скорости ферментативной реакции отконцентрации субстрата
V,
кат
Vmax
Начальная скорость
ферментативной реакции
(скорость измеряемая в период,
когда израсходована очень
малая доля субстрата)
[А]<<K
[А] = KM
При [А]>>K
Vmax / 2
Насыщение
субстратом
[A
]]
[A
V
max
V
V
V max
V
max
VV
V
max
K
]M
K
2 [A
M
Концентрация
субстрата
KM
[А]
63.
КонстантаМихаэлиса
(Km)численно
равна той концентрации субстрата [A],
при которой V достигает половины
максимальной величины (Vmax/2).
Следствие:
- Если фермент имеет высокое
сродство к субстрату, то Кm низкая
- Если
у
фермента
к
субстрату
сродство низкое то Кm высокая
64.
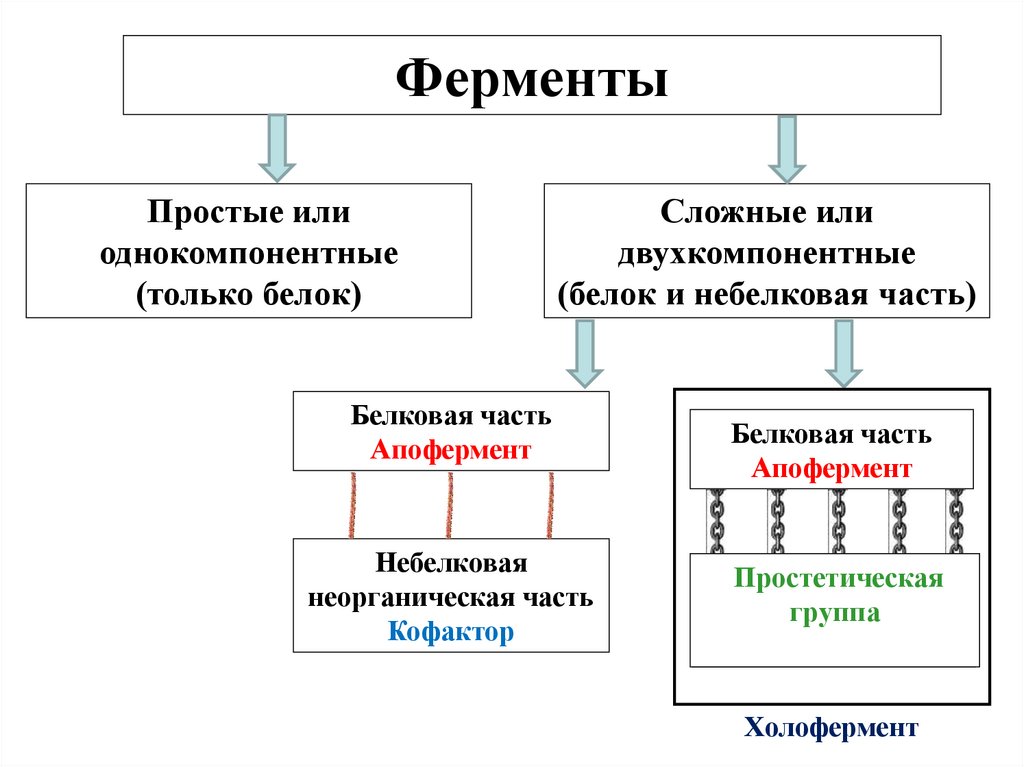
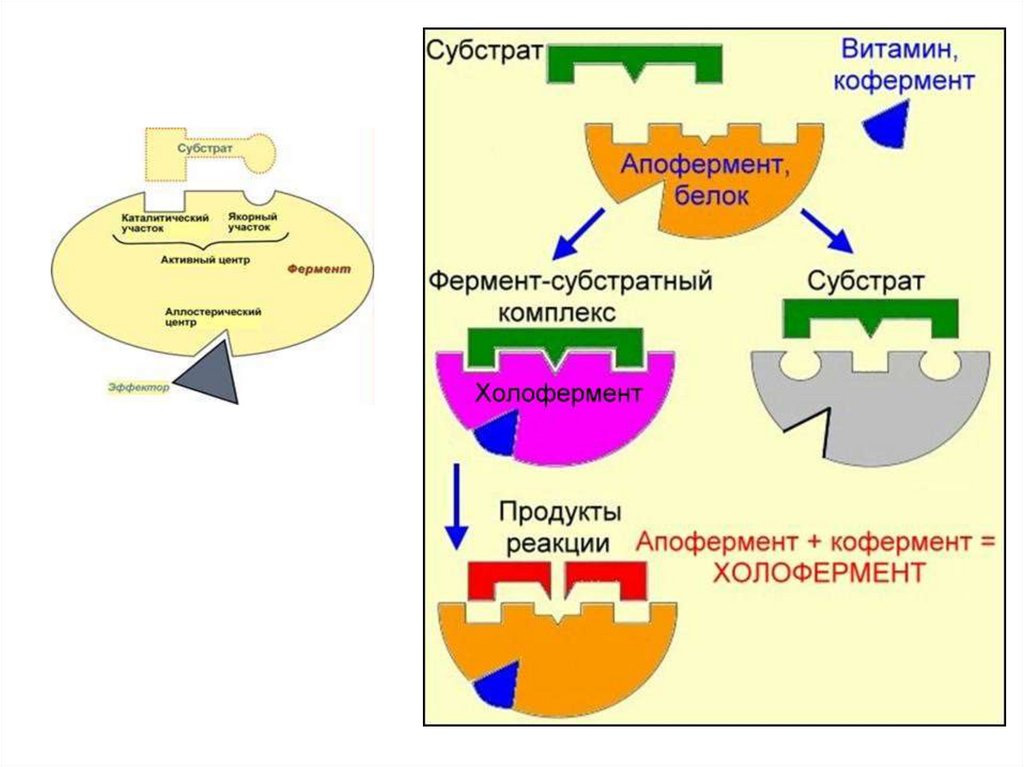
ФерментыПростые или
однокомпонентные
(только белок)
Сложные или
двухкомпонентные
(белок и небелковая часть)
Белковая часть
Апофермент
Небелковая
неорганическая часть
Кофактор
Белковая часть
Апофермент
Простетическая
Небелковая
органическая
группа часть
Кофермент
Холофермент
65.
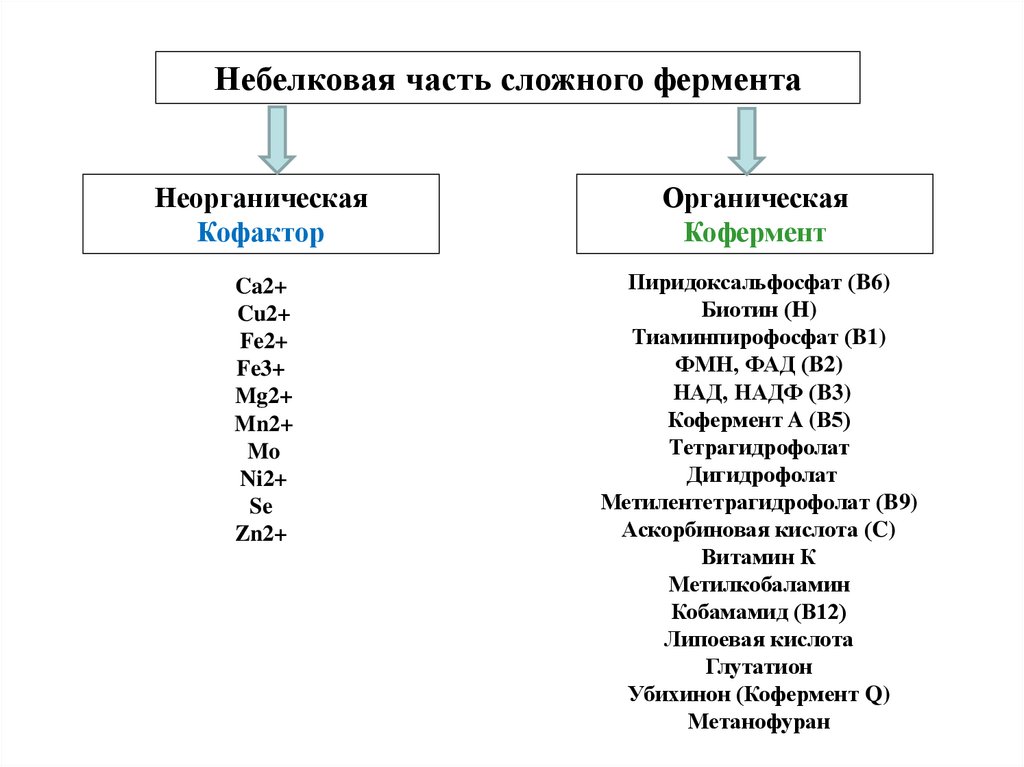
Небелковая часть сложного ферментаНеорганическая
Кофактор
Органическая
Кофермент
Ca2+
Cu2+
Fe2+
Fe3+
Mg2+
Mn2+
Mo
Ni2+
Se
Zn2+
Пиридоксальфосфат (B6)
Биотин (H)
Тиаминпирофосфат (B1)
ФМН, ФАД (B2)
НАД, НАДФ (B3)
Кофермент A (В5)
Тетрагидрофолат
Дигидрофолат
Метилентетрагидрофолат (B9)
Аскорбиновая кислота (C)
Витамин К
Метилкобаламин
Кобамамид (В12)
Липоевая кислота
Глутатион
Убихинон (Кофермент Q)
Метанофуран
66.
67.
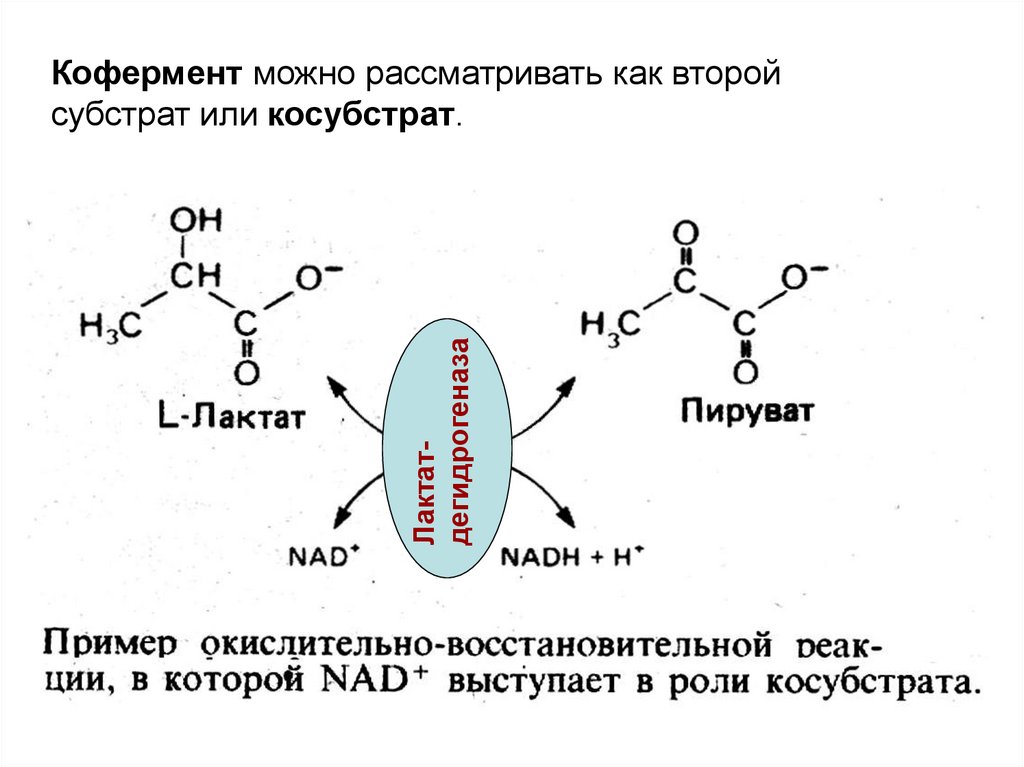
68.
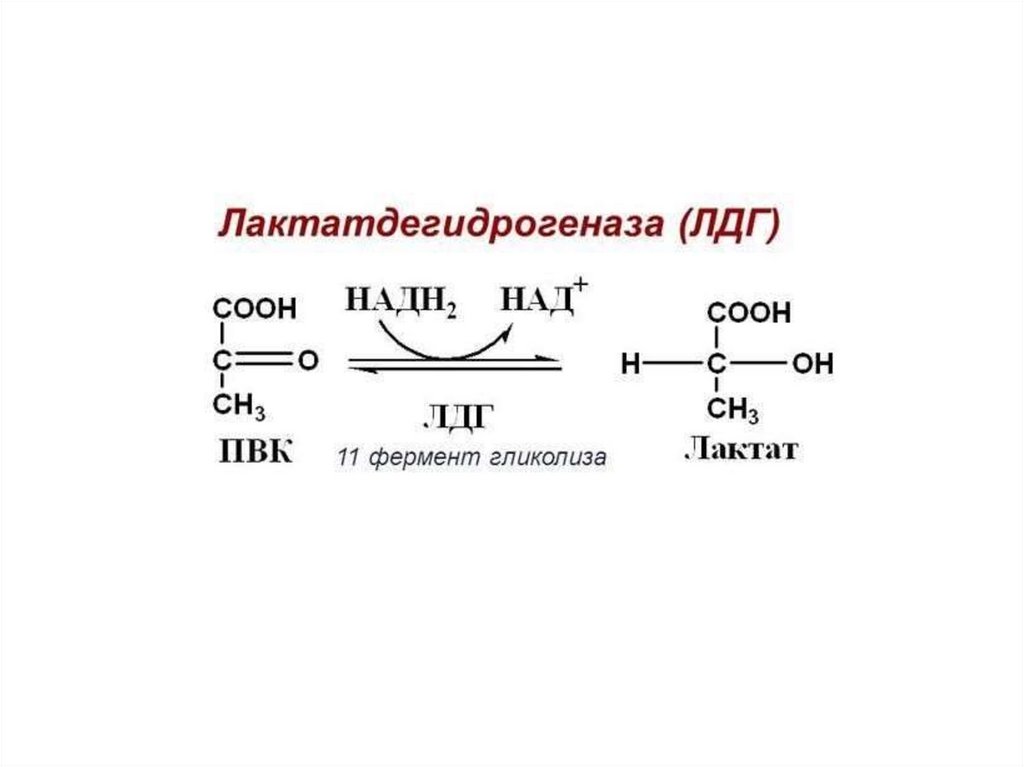
ЛактатдегидрогеназаКофермент можно рассматривать как второй
субстрат или косубстрат.
69.
Коферменты участвуют в метаболизме какпереносчики различных химических групп (в том
числе и водорода).
Например
в
реакциях
переаминирования
пиридоскальфосфат выступает как переносчик
аминогруппы от одной аминокислоты к другой.
NAD+ и NADP+
водорода.
выступают
как
переносчики
Многие витамины выступают в организме в роли
коферментов.
70.
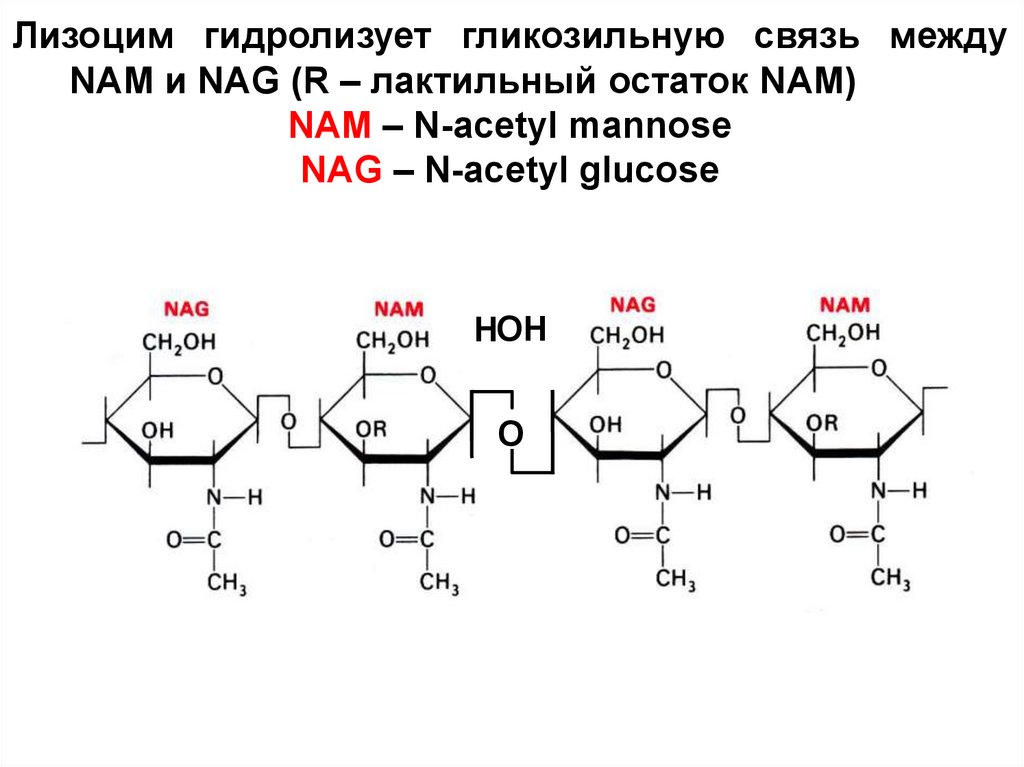
71.
Лизоцим гидролизует гликозильную связь междуNAM и NAG (R – лактильный остаток NAM)
NAM – N-acetyl mannose
NAG – N-acetyl glucose
НОН
O
72.
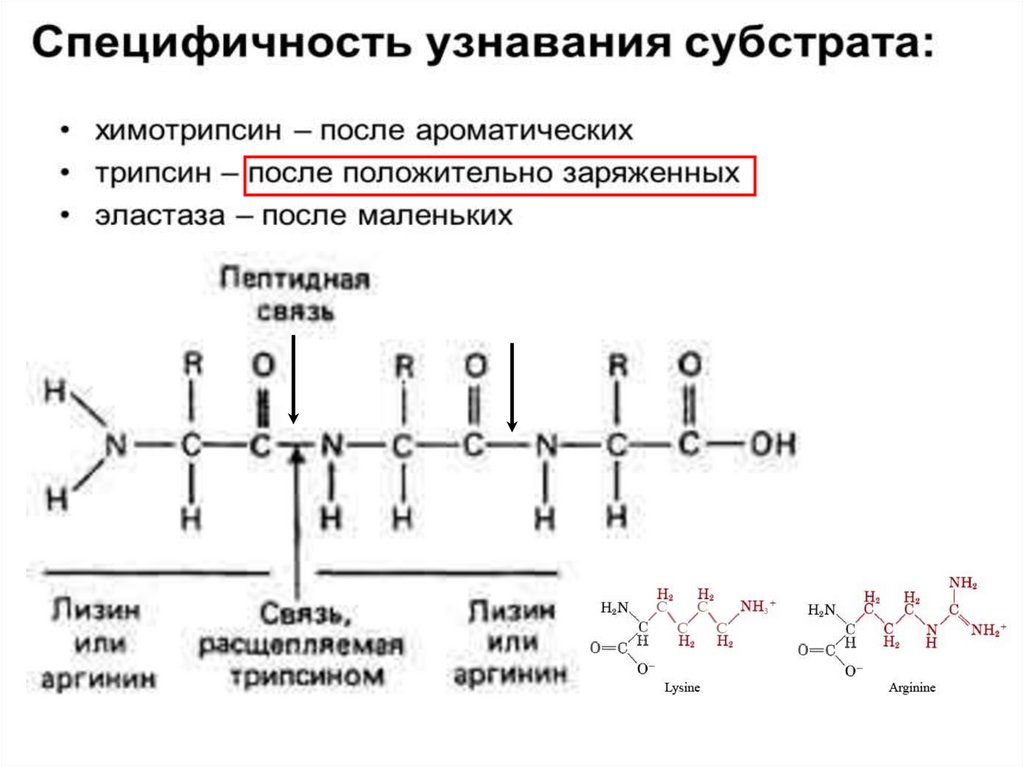
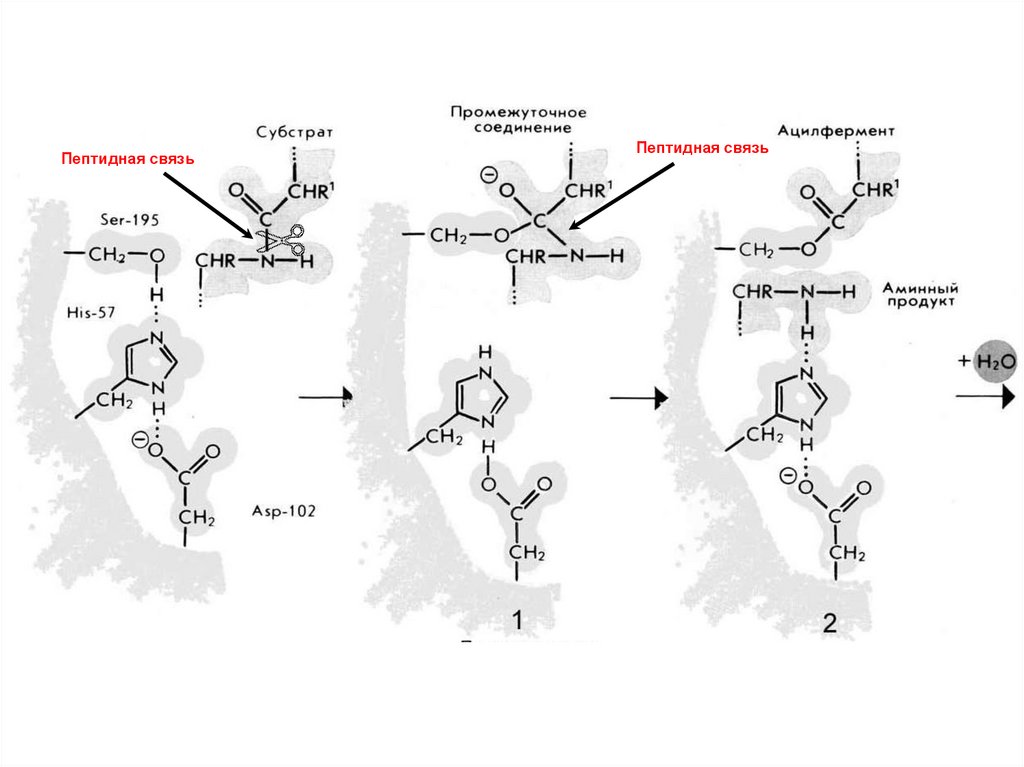
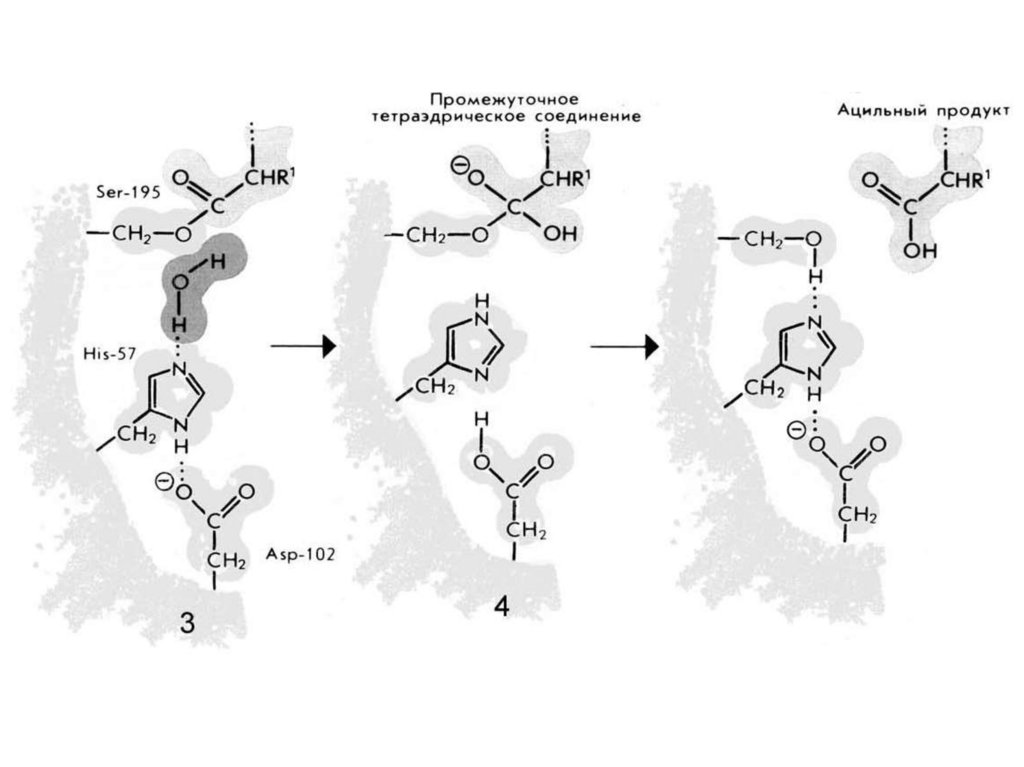
2. Протеолитическая реакциякак пример каталитической активности фермента
Например: Трипсин
Трипсин (КФ 3.4.21.4) — фермент класса гидролаз,
расщепляющий пептиды и белки.
Молекула бычьего трипсина (молекулярная масса около
24 кДа) состоит из 223 аминокислотных остатков,
образующих одну полипептидную цепь, и содержит 6
дисульфидных связей. Изоэлектрическая точка трипсина
лежит при pH 10,8, а оптимум каталитической активности
при pH 7,8—8,0. Трипсин синтезируется в поджелудочной
железе.
73.
74.
75.
Пептидная связь76.
Пептидная связьПептидная связь
77.
78.
Фермент ускоряет реакцию за счетснижения энергии активации
79.
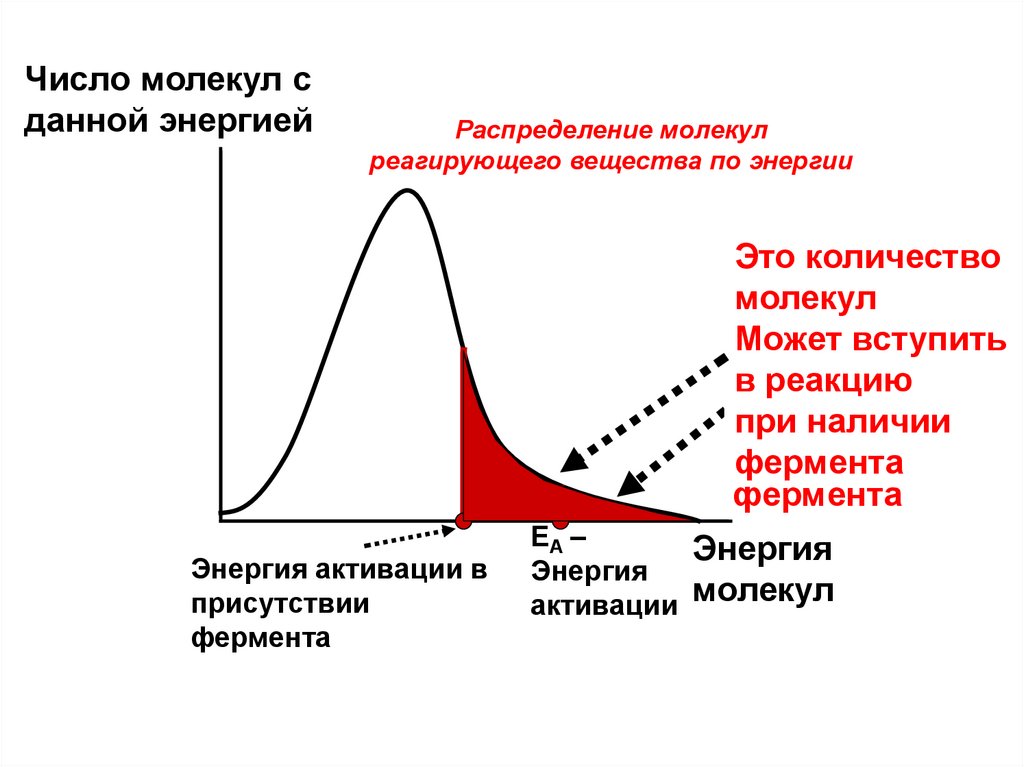
Число молекул сданной энергией
Распределение молекул
реагирующего вещества по энергии
Это количество
молекул
Это
количество
Может
вступить
молекул
в реакцию
может
вступить
при наличии
в
реакцию без
фермента
фермента
Энергия активации в
присутствии
фермента
EA –
Энергия
Энергия
активации молекул
80.
Фермент ускоряет реакцию за счет снижения энергииактивации
Механизм
катализа
заключается
в
связывании
субстрата, при этом фермент заставляет его
принимать форму переходного состояния
Переходное состояние – структура с наиболее
высоким уровнем свободной энергии возникающая в
процессе
реакции.
Фермент
снижает
энергию
переходного состояния за счет сродства к нему.
Энергией активации называют
дополнительное
количество
кинетической
энергии,
необходимое
молекулам вещества, чтобы они вступили в реакцию.
81.
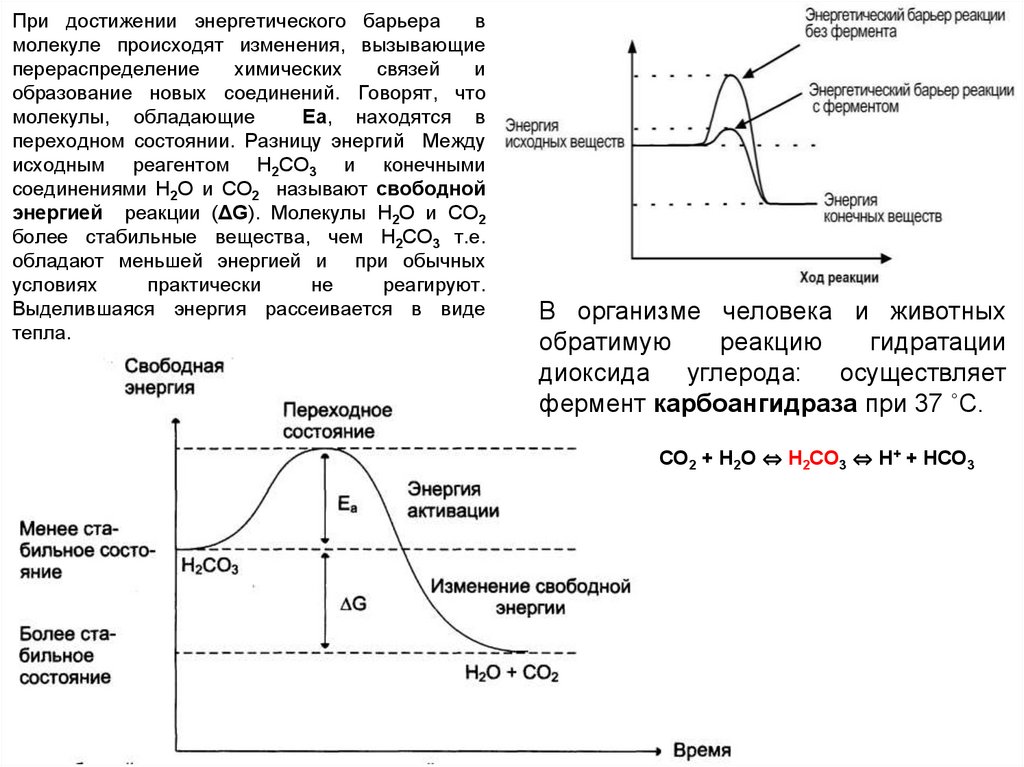
Рассмотрим реакцию разложения угольнойкислоты (не ферментативной реакцией)
Н2СО3 → Н2О + СО2
Угольная кислота слабая; реакция её разложения пойдет
в обычных условиях, если молекулы угольной кислоты
имеют энергию превышающую определённый уровень,
называемый энергией активации Еа.
82.
При достижении энергетического барьерав
молекуле происходят изменения, вызывающие
перераспределение
химических
связей
и
образование новых соединений. Говорят, что
молекулы, обладающие
Еа, находятся в
переходном состоянии. Разницу энергий Между
исходным реагентом Н2СО3 и конечными
соединениями Н2О и СО2 называют свободной
энергией реакции (ΔG). Молекулы Н2О и СО2
более стабильные вещества, чем Н2СО3 т.е.
обладают меньшей энергией и при обычных
условиях
практически
не
реагируют.
Выделившаяся энергия рассеивается в виде
тепла.
В организме человека и животных
обратимую
реакцию
гидратации
диоксида углерода: осуществляет
фермент карбоангидраза при 37 ˚С.
СО2 + Н2О ⇔ Н2СО3 ⇔ Н+ + НСО3
83.
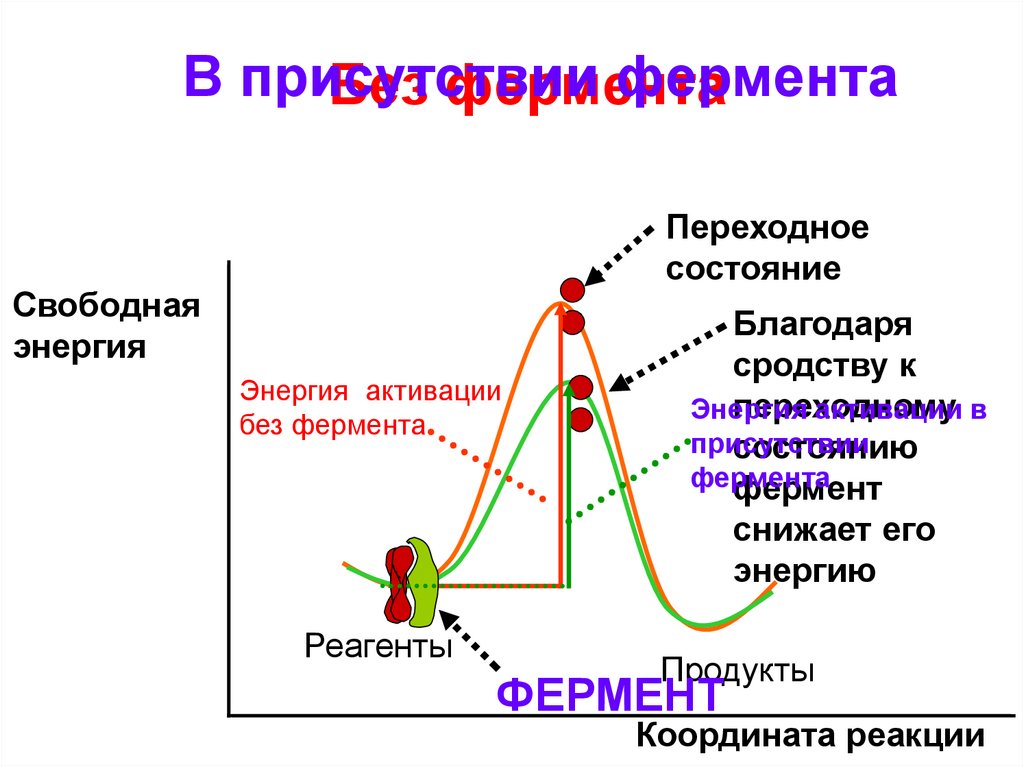
В присутствиифермента
Без фермента
Переходное
состояние
Свободная
энергия
Энергия активации
без фермента
Реагенты
Благодаря
сродству к
переходному
Энергия
активации в
присутствии
состоянию
фермента
фермент
снижает его
энергию
Продукты
ФЕРМЕНТ
Координата реакции
84.
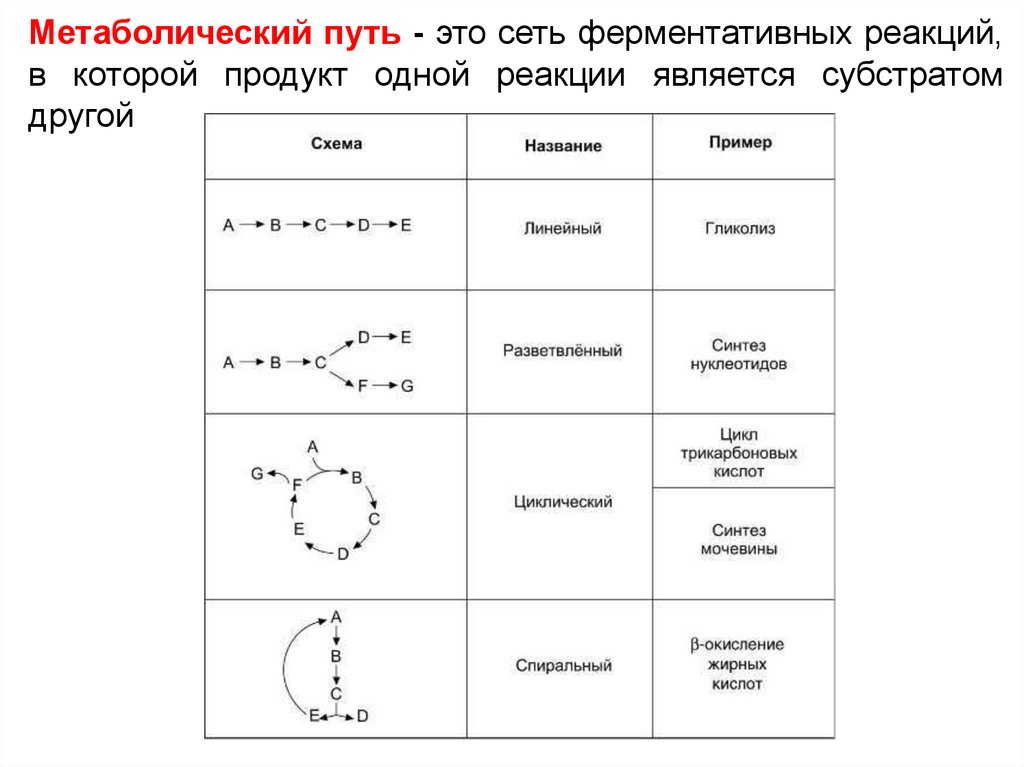
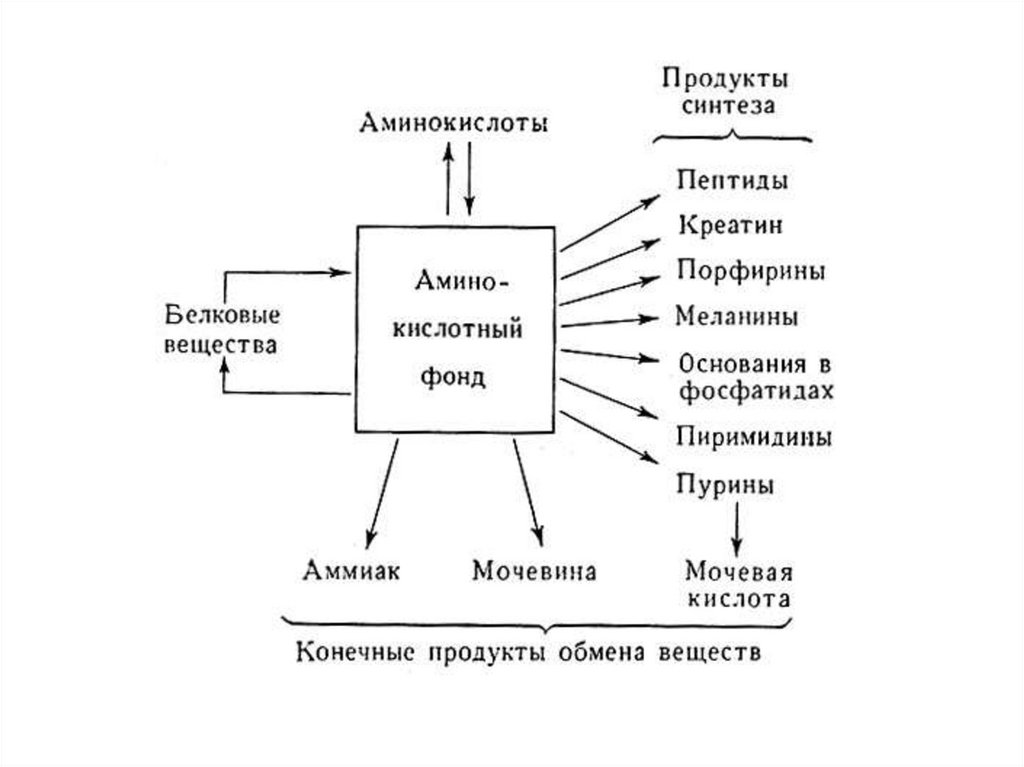
Метаболический путь - это сеть ферментативных реакций,в которой продукт одной реакции является субстратом
другой








































 Биология
Биология








