Похожие презентации:
Химическая термодинамика
1. Химическая термодинамика
12. Основные понятия и определения
• Химическая термодинамика – это раздел химии,изучающий взаимные превращения различных форм энергии
при протекании химических процессов.
• Термодинамическая система (ТД система) – это тело или
группа тел, отделённых от окружающей среды границей
раздела.
Открытая ТД система – это система, которая
обменивается с окружающей средой и веществом, и энергией.
Закрытая ТД система – это система, которая обменивается с
окружающей средой только энергией.
Изолированная ТД система – это система, которая не
обменивается с окружающей средой ни веществом, ни
энергией.
2
3.
•Фаза – это часть ТД системы, обладающаяодинаковыми физическими и химическими свойствами
•Химический компонент – это химически
индивидуальная часть ТД системы (например, Fe, O2, C).
Различают: одно-, двух-, многокомпонентные системы.
•Гомогенная система – система, состоящая из одной
фазы (например: сахар растворённый в воде)
•Гетерогенная система – система, состоящая из
нескольких фаз (песок + вода)
3
4. Параметры состояния ТД системы – это характеристики ТД системы, которые можно измерить (V, T, P, m …).
Изотермические процессы:Изобарные процессы:
Изохорные процессы:
Т = const
Р = const
V = const
Термодинамические функции – это характеристики состояния
ТД системы, которые зависят от простых параметров:
U – внутренняя энергия;
Н – энтальпия;
S – энтропия;
G – энергия Гиббса.
U, Н, S, G – функции состояния, их изменение не зависит от
пути протекания процесса.
4
5. Внутренняя энергия
• Внутренняя энергия U - это общий запас энергииколебательного, вращательного, поступательного и
т.д. движения частиц системы, кроме
потенциальной и кинетической энергии системы в
целом
U – изменение внутренней энергии
Абсолютное значение U измерить невозможно
5
6. Первый закон термодинамики
•Теплота (Q), полученная ТД системой, расходуетсяна изменение её внутренней энергии ( U) и
совершение работы (А).
Q = U + А
А – суммарная работа, совершаемая системой.
6
7. Энтальпия
Qp = U + p· V = U2 – U1 + p(V2 – V1) =(U2 + pV2) - (U1 + pV1) = H2 – H1
H = U + p· V
Изменение энтальпии равно изменению
внутренней энергии ТД системы и совершению
работы расширения.
Qp = | H|
Тепловой эффект при постоянном давлении
равен изменению энтальпии.
7
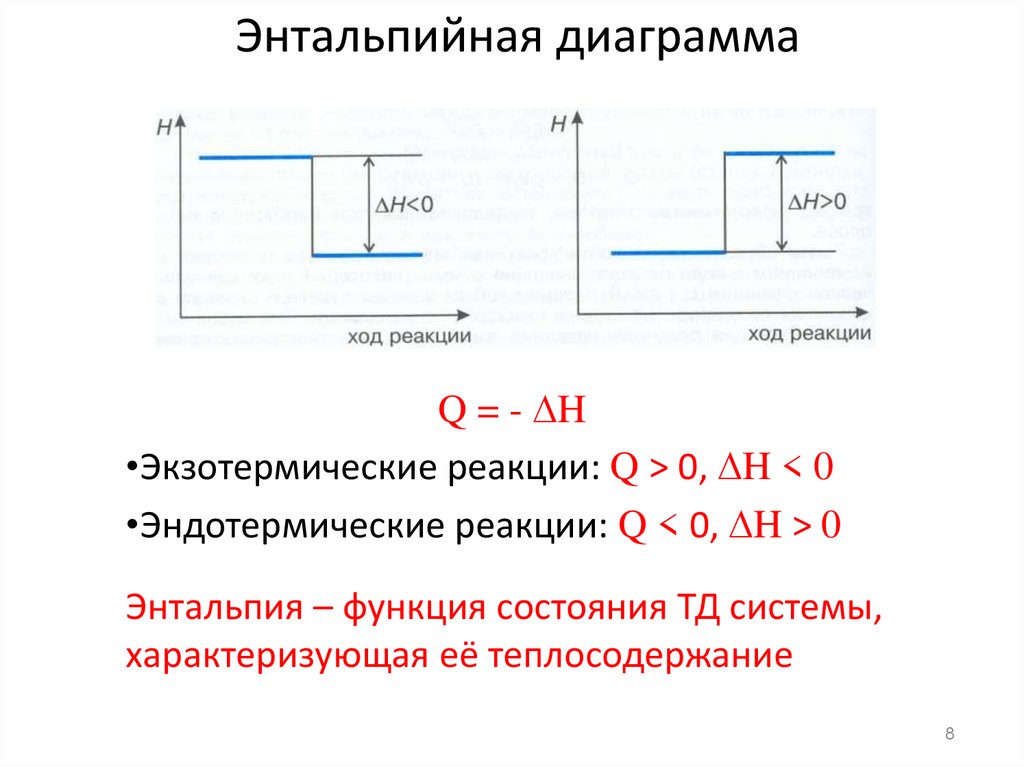
8. Энтальпийная диаграмма
Q = - H•Экзотермические реакции: Q > 0, H < 0
•Эндотермические реакции: Q < 0, H > 0
Энтальпия – функция состояния ТД системы,
характеризующая её теплосодержание
8
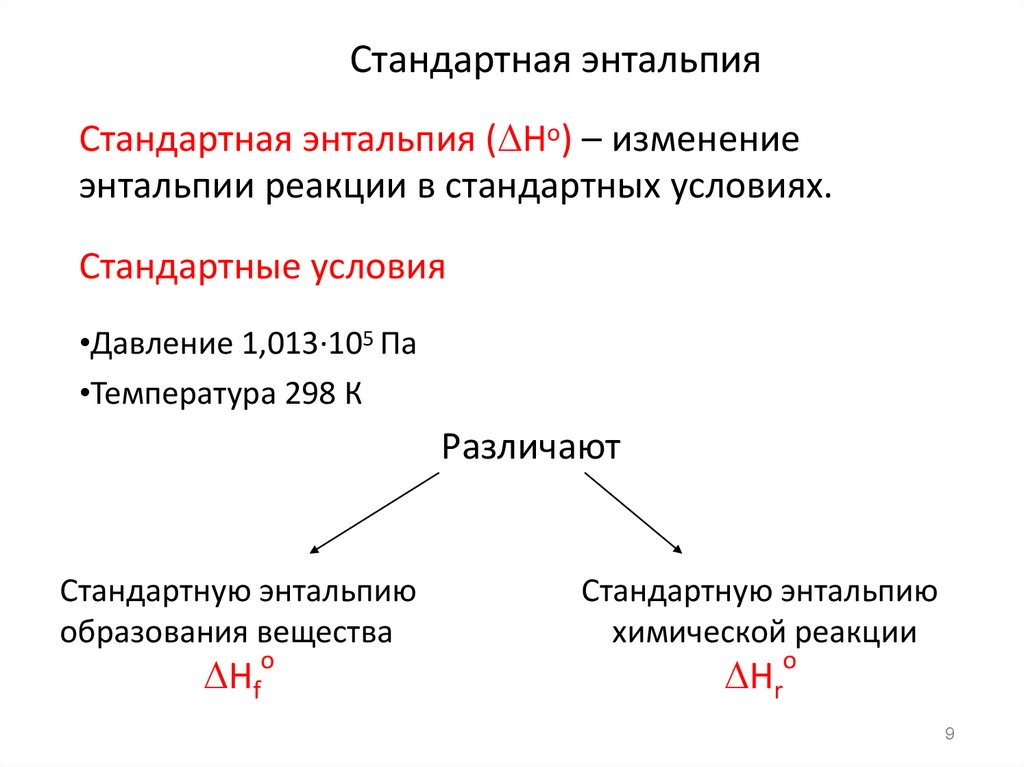
9. Стандартная энтальпия
Стандартная энтальпия ( Hо) – изменениеэнтальпии реакции в стандартных условиях.
Стандартные условия
•Давление 1,013·105 Па
•Температура 298 К
Различают
Стандартную энтальпию
образования вещества
Hf
o
Стандартную энтальпию
химической реакции
Hr
o
9
10. Стандартная энтальпия образования вещества
oHf
o
[ Hf
– количество теплоты, которое поглощается
или выделяется при образовании одного моля
сложного вещества из простых веществ при
cтандартных условиях.
] = кДж/моль
Hf – справочная величина.
o
Энтальпии образования простых веществ в
термодинамически устойчивом состоянии равны нулю.
o
Hf (O2, Сграфит, Sромбическая, Snбелое ) = 0 кДж/моль
10
11. Термохимические уравнения
Н2(г) + 1/2О2(г) = Н2О(г) ;Hfo (H2O) = - 241,8 кДж/моль
Особенности термохимических уравнений:
• указывается агрегатное состояние веществ (г, ж, к);
• указывается знак и значение Но или Q;
Н2(г) + 1/2О2(г) = Н2О(ж); Но (Н О) = - 285,3 кДж/моль
f
2
• возможны дробные коэффициенты.
11
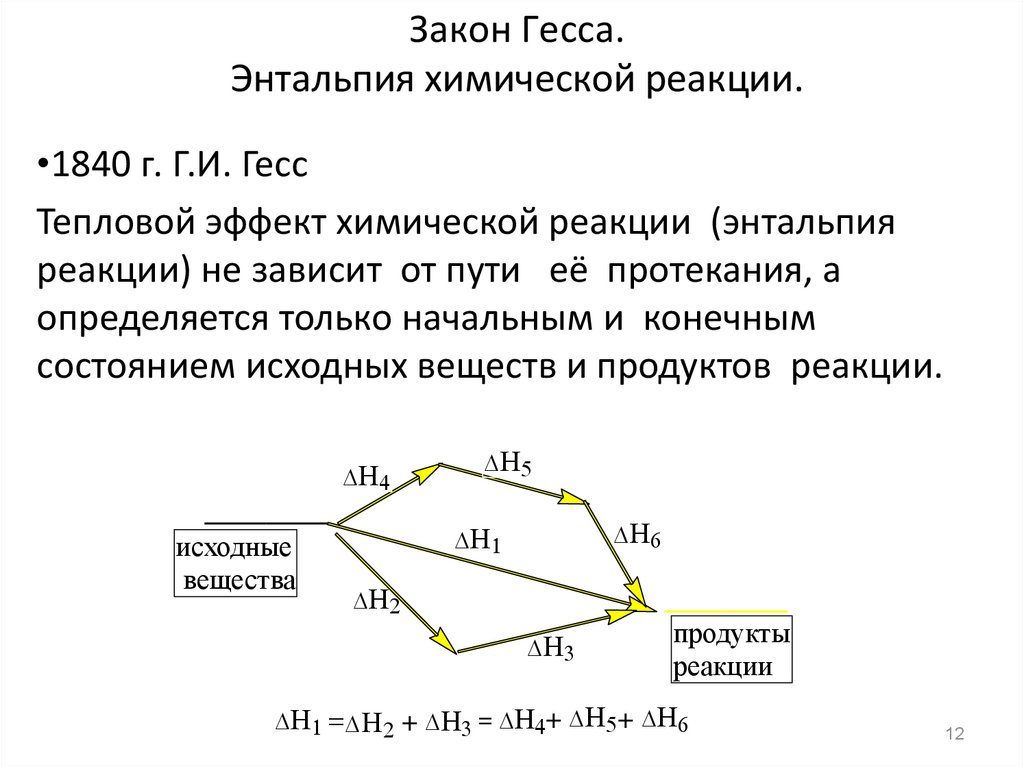
12. Закон Гесса. Энтальпия химической реакции.
•1840 г. Г.И. ГессТепловой эффект химической реакции (энтальпия
реакции) не зависит от пути её протекания, а
определяется только начальным и конечным
состоянием исходных веществ и продуктов реакции.
исходные
вещества
продукты
реакции
+ = + +
12
13. Следствия из закона Гесса
1.Энтальпия химической реакции равна суммеэнтальпий образования продуктов реакции за
вычетом суммы энтальпий образования исходных
веществ с учетом стехиометрических коэффициентов.
Hr = Hf (прод.) - Hf (исх. веществ)
o
o
o
Пример расчета
2С2Н2(г) + 5О2(г) = 4СО2(г) + 2Н2О(г)
Hоf 266,7
0
-393,5
-241,8
кДж/моль
Hоr = 2(- 241,8) + 4(-393,5) – 2(266,7) = -2591 кДж
13
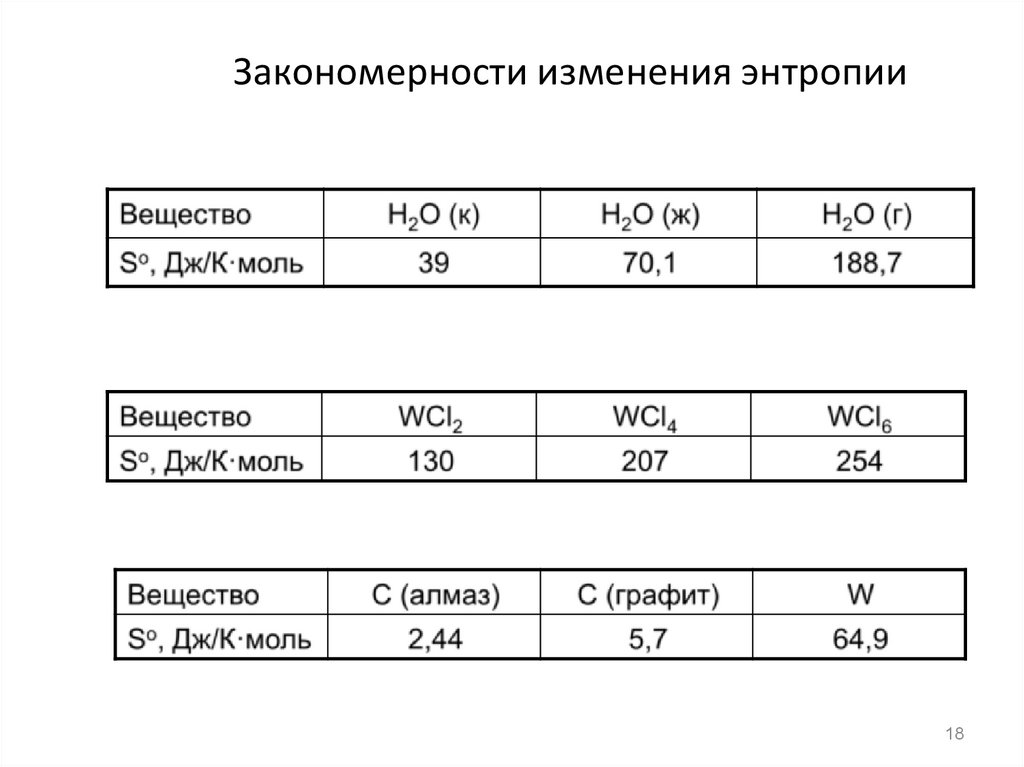
14. Энтропия. Второй закон термодинамики
Энтропия S – это мера беспорядка ТД системы.В
изолированной системе энтропия является
критерием самопроизвольности процесса.
Процессы протекают самопроизвольнов
направлении увеличения энтропии.
S
> 0 процесс протекает самопроизвольно
S < 0 процесс не протекает самопроизвольно
S=0 система находится в состоянии равновесия
So – стандартная энтропия, Дж/моль.К (в
справочнике!)
2
15.
Энтропия (S) есть логарифмическое выражениетермодинамической вероятности существования системы.
S = k lnW,
где k - постоянная Больцмана, равная 1,38 10-23 Дж/К моль.
[S] = Дж/К моль
Термодинамическая вероятность (W) – это число способов
реализации данного состояние системы.
Термодинамическую вероятность можно рассчитать по
формуле:
W
N!
n1! n2 !
N – общее число частиц;
n – число частиц в данном состоянии;
! – факториал
15
16.
1617. Третий закон термодинамики
Энтропия правильного кристалла стремится к 0 по мереприближения температуры к абсолютному 0
o
ST 0
0
• энтропия не может быть отрицательной величиной;
• можно определить абсолютные значения энтропии для
различных веществ.
Энтропия является функцией состояния.
Изменение энтропии при протекании химической
реакции рассчитывается также как изменение энтальпии,
по закону Гесса:
Sro = So (продуктов) - So (исходных)
17
18. Закономерности изменения энтропии
1819. Направление протекания химических процессов. Энергия Гиббса
G = H- Т S
G – энергия Гиббса - функция состояния ТД системы,
характеризующая возможность самопроизвольного
протекания химического процесса.
G <
0 самопроизвольный процесс возможен, реакция протекает
в прямом направлении
G >
0 самопроизвольный процесс невозможен, реакция не
протекает в прямом направлении, но может протекать в
обратном (если реакция обратимая).
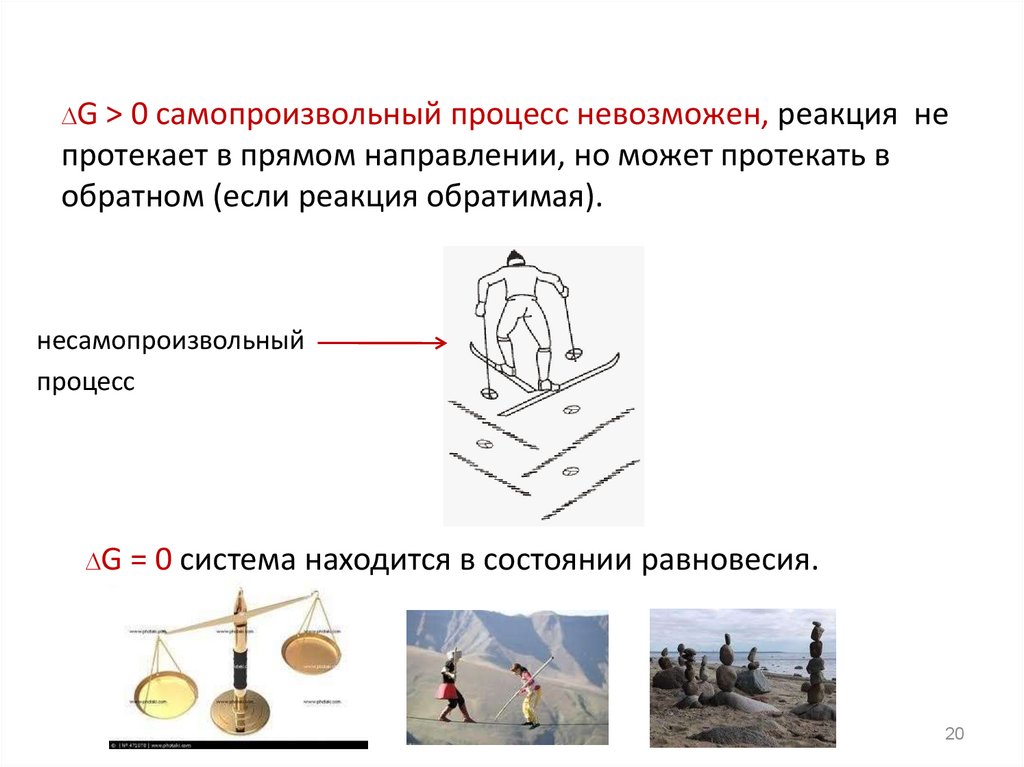
G = 0 система находится в состоянии равновесия.
19
20. G > 0 самопроизвольный процесс невозможен, реакция не протекает в прямом направлении, но может протекать в обратном (если
G >0 самопроизвольный процесс невозможен, реакция не
протекает в прямом направлении, но может протекать в
обратном (если реакция обратимая).
несамопроизвольный
процесс
G =
0 система находится в состоянии равновесия.
20
21. Температурная зависимость энергии Гиббса
•Если H < 0 и S > 0, то G < 0 реакции возможны при любых Т•Если H > 0 и S < 0, то G > 0 реакции невозможны при любых Т
•Во всех других случаях знак G зависит от соотношения H и Т S.
21
22.
oGr
o
Gf
– стандартная энергия Гиббса реакции.
– стандартная энергия Гиббса образования
вещества.
Если Gf < 0 , то индивидуальное вещество
термодинамически устойчиво, кроме того, такое
соединение можно получить из простых веществ
(прямым синтезом)
o
22
23. Например: fGо (H2S) = -33,8 кДж/моль
Например: fGо (H2S) = -33,8 кДж/моль1)H2S - термодинамически устойчиво.
2)Возможен синтез: H2(г) + S(к) = H2S(г)
Если Gfо > 0 , то вещество термодинамически
неустойчиво, его можно получить только косвенным
путём.
Например: Gfо (H2Sе) = 19,7 кДж/моль
1)H2Sе - термодинамически неустойчиво.
2)Прямой синтез невозможен.
23

















 Химия
Химия








