Похожие презентации:
Отечественные рекомбинантные препараты в лечении гемофилии
1.
Школа больныхгемофилией
г. Санкт-Петербург,
27 октября 2020 г.
ОТЕЧЕСТВЕННЫЕ
РЕКОМБИНАНТНЫЕ
ПРЕПАРАТЫ В
ЛЕЧЕНИИ
ГЕМОФИЛИИ
Константинова Валерия Николаевна
Врач-гематолог ГЦЛГ СПБ ГБУЗ
«Городская поликлиника № 37», к.м.н.
1
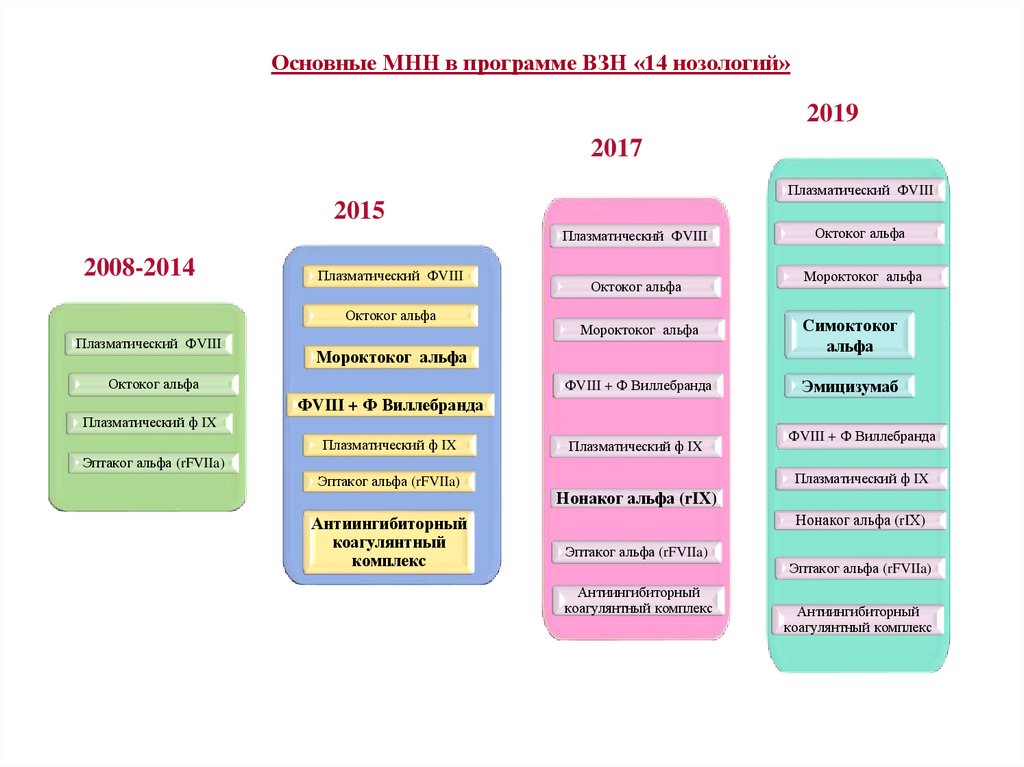
2. Основные МНН в программе ВЗН «14 нозологий»
20192017
Плазматический ФVIII
2015
Плазматический ФVIII
2008-2014
Плазматический ФVIII
Октоког альфа
Плазматический ФVIII
Октоког альфа
Симоктоког
альфа
ФVIII + Ф Виллебранда
Эмицизумаб
ФVIII + Ф Виллебранда
Плазматический ф IX
Плазматический ф IX
Мороктоког альфа
Мороктоког альфа
Мороктоког альфа
Октоког альфа
Октоког альфа
Плазматический ф IX
ФVIII + Ф Виллебранда
Эптаког альфа (rFVIIa)
Эптаког альфа (rFVIIa)
Антиингибиторный
коагулянтный
комплекс
Плазматический ф IX
Нонаког альфа (rIХ)
Нонаког альфа (rIХ)
Эптаког альфа (rFVIIa)
Эптаког альфа (rFVIIa)
Антиингибиторный
коагулянтный комплекс
Антиингибиторный
коагулянтный комплекс
3.
Компания «ГЕНЕРИУМ" производит полную линейку рекомбинантныхфакторов свертывания крови (факторы rVIIa, rVIII, rIX) для лечения
гемофилии.
За разработку данных препаратов удостоена премии Правительства РФ в области науки и техники в 2018 году.
Коагил-VII
Октофактор
Иннонафактор
эптаког альфа (активированный)
мороктоког альфа
нонаког альфа
препарат для лечения
ингибиторной формы гемофилии
препарат для лечения
гемофилии А
препарат для лечения
гемофилии В
3
4. Фармакологические свойства препарата «Октофактор» (мороктоког альфа)
Структурнои
функционально
сходен
с
эндогенным фактором свертывания крови VIII
Состоит из 1438 аминокислотных остатков с
молекулярной массой около 165 кДа
Отсутствует B-домен
Продуцируется
модифицированной
перевиваемой линией клеток
яичников
китайского хомячка СНО 2Н5
4
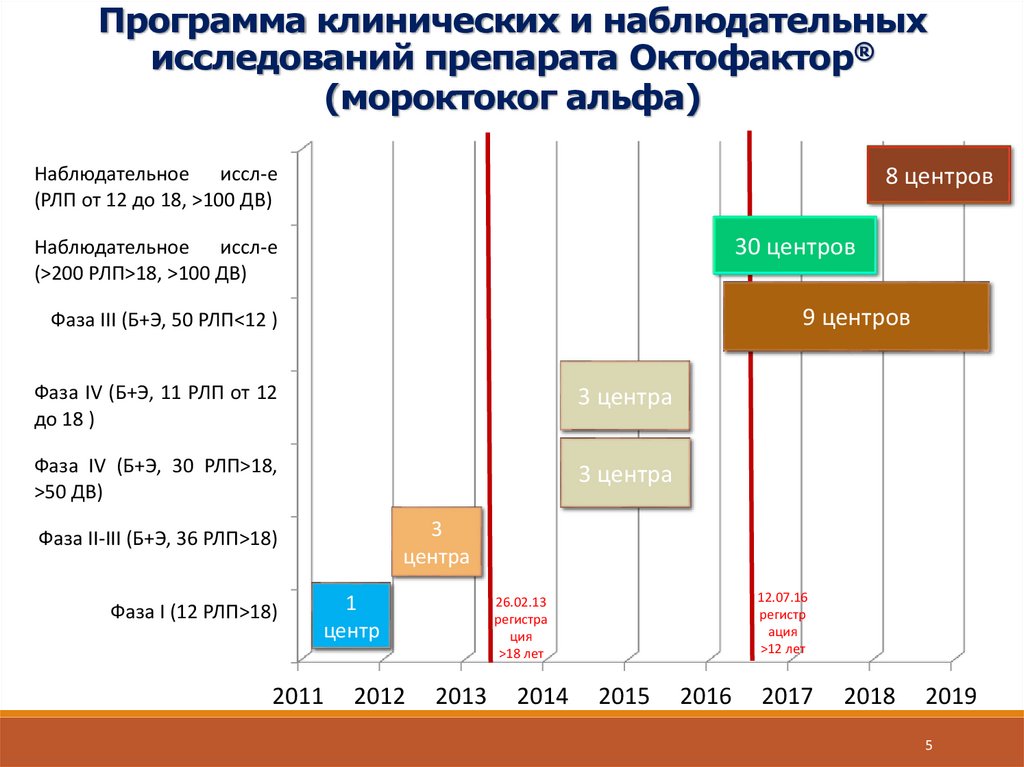
5.
Программа клинических и наблюдательныхисследований препарата Октофактор®
(мороктоког альфа)
Наблюдательное иссл-е
(РЛП от 12 до 18, >100 ДВ)
8 центров
30 центров
Наблюдательное иссл-е
(>200 РЛП>18, >100 ДВ)
9 центров
Фаза III (Б+Э, 50 РЛП<12 )
Фаза IV (Б+Э, 11 РЛП от 12
до 18 )
3 центра
Фаза IV (Б+Э, 30 РЛП>18,
>50 ДВ)
3 центра
3
центра
Фаза II-III (Б+Э, 36 РЛП>18)
Фаза I (12 РЛП>18)
1
центр
2011
2012
12.07.16
регистр
ация
>12 лет
26.02.13
регистра
ция
>18 лет
2013
2014
2015
2016
2017
2018
2019
5
6. Реестр исследований препарата Октофактор®
№Номер и сроки
исследования
КИ-15/11
09.2011 –
11.2011
Фаза
КИ-16/11
03.2012 –
10.2012
II–III
3.
КИ-29/14
08.2014 –
05.2015
IV
4.
КИ-30/14
09.2014 –
05.2015
5.
КИ-42/15
05.2015 –
06.2015
6.
КИ-48/15
08.2016 –
по наст. время
7.
КИ-51/15
01.2016 –
09.2017
НИ*
8.
OCF-HPA-N01
03.2018 –
по наст. время
НИ*
1.
2.
I
Название протокола
Число
центров
Клиническое
исследование
переносимости,
безопасности
и
1
фармакокинетических свойств препарата Октофактор после однократного
применения разных доз у больных гемофилией А.
Число
пациентов
12
Возраст
пациентов
>18 лет
Контролируемое, рандомизированное, открытое в параллельных группах,
проспективное, многоцентровое клиническое исследование эффективности и
безопасности препарата Октофактор в сравнении с препаратом Октанат у
больных тяжёлой и среднетяжёлой формой гемофилии А
Проспективное, многоцентровое клиническое исследование эффективности и
безопасности препарата Октофактор у детей в возрасте от 12 до 18 лет с
тяжёлой и среднетяжёлой формой гемофилии А
3
36
>18 лет
3
11
от 12 до 18
лет
IV
Проспективное, многоцентровое клиническое исследование эффективности и
безопасности препарата Октофактор у больных тяжёлой и среднетяжёлой
формой гемофилии А
3
30
>18 лет
НИ*
Ретроспективное
обсервационное
исследование
эффективности
и
безопасности препарата Октофактор, ЗАО «ГЕНЕРИУМ», Россия, у больных
гемофилией А в республике Крым
1
42
>18 лет
III
Открытое проспективное несравнительное многоцентровое клиническое
исследование эффективности, безопасности и фармакокинетики препарата
Октофактор® в двух возрастных когортах у детей в возрасте от 2 до 12 лет с
тяжелой формой гемофилии А
Проспективное, многоцентровое, открытое, наблюдательное исследование
эффективности и безопасности препарата Октофактор, ЗАО «ГЕНЕРИУМ»,
Россия, у больных гемофилией А.
6
50
от 2 до 12
лет
30
237
>18 лет
8
24
от 12 до 18
лет
Проспективное многоцентровое открытое наблюдательное исследование
эффективности и безопасности препарата Октофактор® (АО «ГЕНЕРИУМ») у
подростков от 12 до 18 лет с гемофилией А.
*НИ – наблюдательное (неинтервенционное) исследование
7. Фармакологические свойства препарата Иннонафактор® (нонакога альфа)
Структурно и функционально сходен сэндогенным
фактором
свертывания
крови IХ.
Одноцепочечный
гликопротеин
с
молекулярной массой около 55 кДа,
состоящий
из
415
аминокислотных
остатков.
Продуцируется
модифицированной
перевиваемой линией клеток яичников
китайского хомячка СНО 1Е6.
7
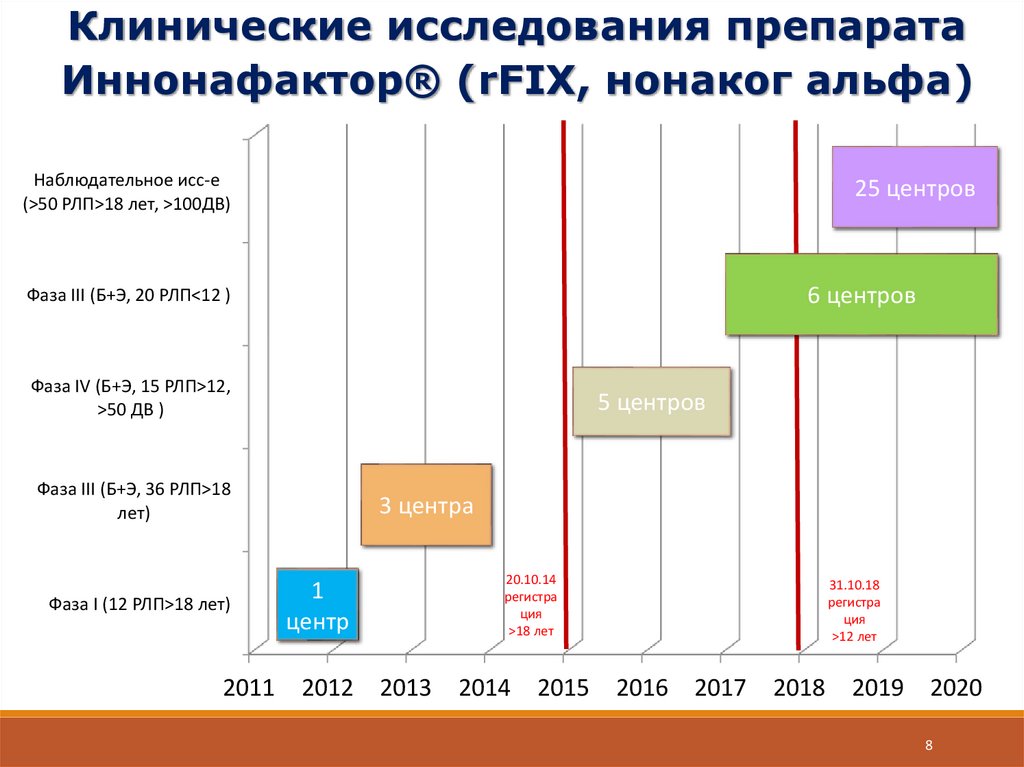
8.
Клинические исследования препаратаИннонафактор® (rFIX, нонаког альфа)
Наблюдательное исс-е
(>50 РЛП>18 лет, >100ДВ)
25 центров
6 центров
Фаза III (Б+Э, 20 РЛП<12 )
Фаза IV (Б+Э, 15 РЛП>12,
>50 ДВ )
5 центров
Фаза III (Б+Э, 36 РЛП>18
лет)
Фаза I (12 РЛП>18 лет)
2011
3 центра
20.10.14
регистра
ция
>18 лет
1
центр
2012
2013
2014
2015
31.10.18
регистра
ция
>12 лет
2016
2017
2018
2019
2020
8
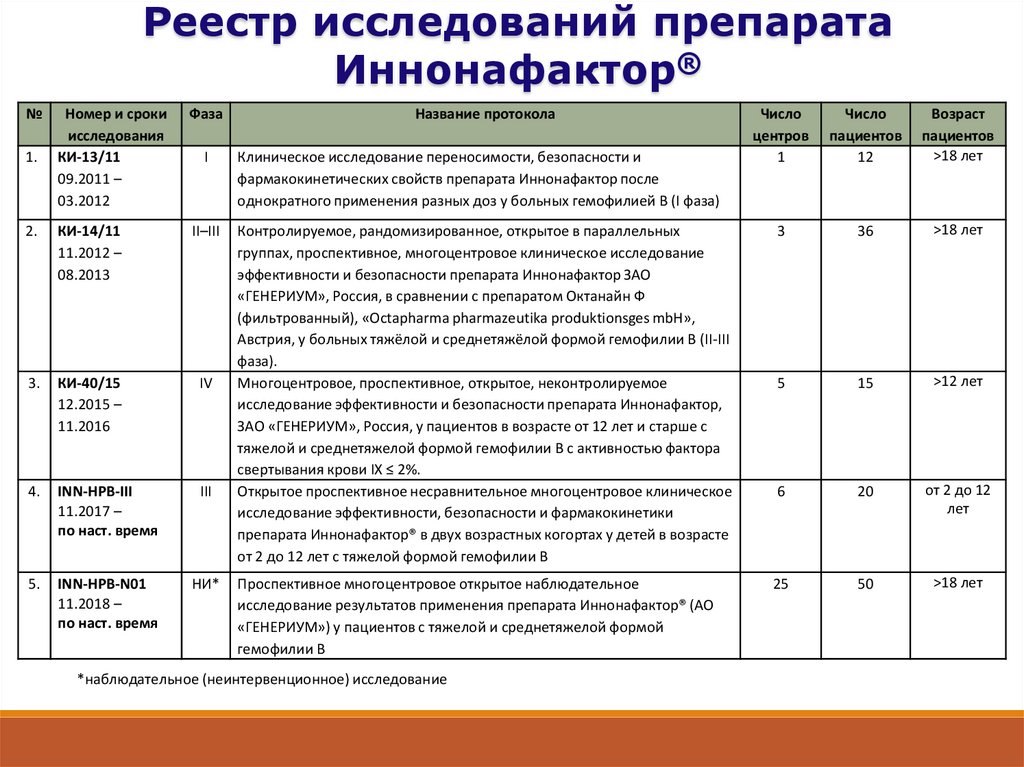
9.
Реестр исследований препаратаИннонафактор®
№
Номер и сроки
исследования
КИ-13/11
09.2011 –
03.2012
Фаза
2.
КИ-14/11
11.2012 –
08.2013
II–III
3.
КИ-40/15
12.2015 –
11.2016
IV
4.
INN-HPB-III
11.2017 –
по наст. время
III
5.
INN-HPB-N01
11.2018 –
по наст. время
НИ*
1.
I
Название протокола
Число
центров
1
Число
пациентов
12
Возраст
пациентов
>18 лет
Контролируемое, рандомизированное, открытое в параллельных
группах, проспективное, многоцентровое клиническое исследование
эффективности и безопасности препарата Иннонафактор ЗАО
«ГЕНЕРИУМ», Россия, в сравнении с препаратом Октанайн Ф
(фильтрованный), «Octapharma pharmazeutika produktionsges mbH»,
Австрия, у больных тяжёлой и среднетяжёлой формой гемофилии В (II-III
фаза).
Многоцентровое, проспективное, открытое, неконтролируемое
исследование эффективности и безопасности препарата Иннонафактор,
ЗАО «ГЕНЕРИУМ», Россия, у пациентов в возрасте от 12 лет и старше с
тяжелой и среднетяжелой формой гемофилии В с активностью фактора
свертывания крови IX ≤ 2%.
Открытое проспективное несравнительное многоцентровое клиническое
исследование эффективности, безопасности и фармакокинетики
препарата Иннонафактор® в двух возрастных когортах у детей в возрасте
от 2 до 12 лет с тяжелой формой гемофилии В
3
36
>18 лет
5
15
>12 лет
6
20
от 2 до 12
лет
Проспективное многоцентровое открытое наблюдательное
исследование результатов применения препарата Иннонафактор® (АО
«ГЕНЕРИУМ») у пациентов с тяжелой и среднетяжелой формой
гемофилии В
25
50
>18 лет
Клиническое исследование переносимости, безопасности и
фармакокинетических свойств препарата Иннонафактор после
однократного применения разных доз у больных гемофилией В (I фаза)
*наблюдательное (неинтервенционное) исследование
10. Механизм действия препарата Коагил-VII®
Механизм действияпрепарата КоагилVII®
В фармакологических дозах эптаког альфа
[активированный], активирует фактор
свертывания крови X на поверхности
активированных тромбоцитов в зоне
повреждения*.
Усиленное местное образование фактора
свертывания крови Ха ускоряет в каскаде
ферментативных реакций свертывающей
системы крови синтез тромбина и
фибриногена*.
Фактор свертывания крови Xа запускает
начальные процессы превращения
протромбина в тромбин.
Тромбин, путем превращения фибриногена в
фибрин, обеспечивает образование
гемостатической пробки, а также способствует
активации тромбоцитов и факторов
свертывания крови V и VIII в зоне повреждения.
*Инструкция по медицинскому применению препарата «Коагил-VII®»
10
11.
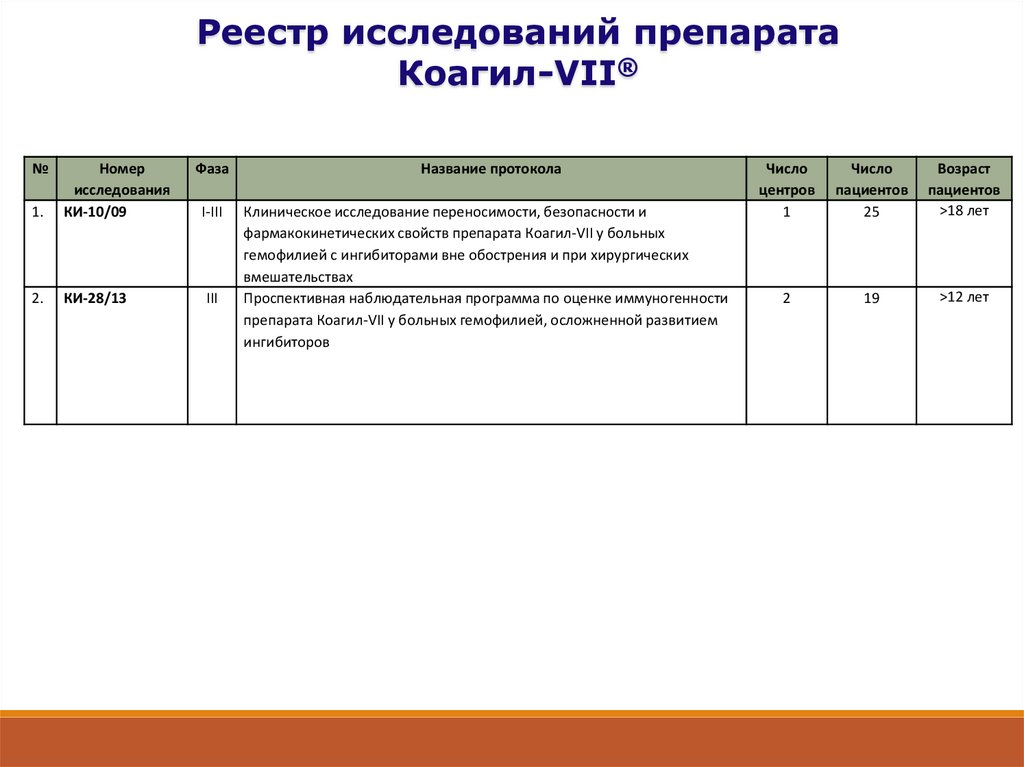
Реестр исследований препаратаКоагил-VII®
№
1.
Номер
исследования
КИ-10/09
2.
КИ-28/13
Фаза
I-III
III
Название протокола
Клиническое исследование переносимости, безопасности и
фармакокинетических свойств препарата Коагил-VII у больных
гемофилией с ингибиторами вне обострения и при хирургических
вмешательствах
Проспективная наблюдательная программа по оценке иммуногенности
препарата Коагил-VII у больных гемофилией, осложненной развитием
ингибиторов
Число
центров
1
Число
пациентов
25
Возраст
пациентов
>18 лет
2
19
>12 лет
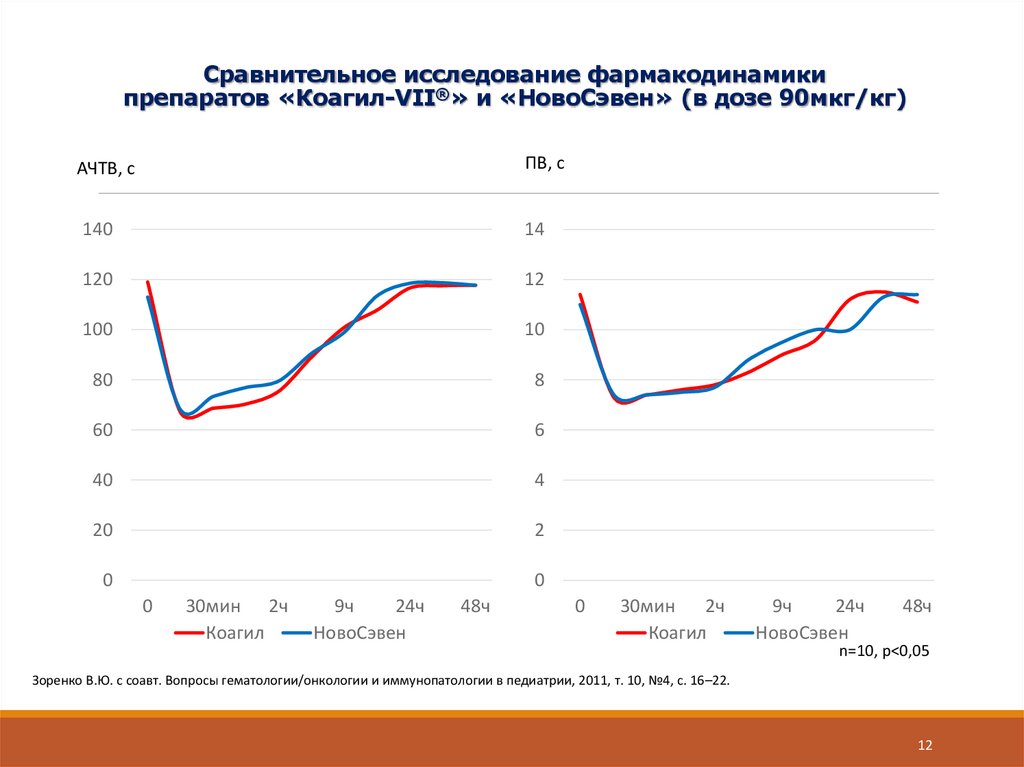
12. Сравнительное исследование фармакодинамики препаратов «Коагил-VII®» и «НовоСэвен» (в дозе 90мкг/кг)
АЧТВ, сПВ, с
140
14
120
12
100
10
80
8
60
6
40
4
20
2
0
0
0
30мин 2ч
Коагил
9ч
24ч
НовоСэвен
48ч
0
30мин 2ч
Коагил
9ч
24ч
НовоСэвен
48ч
n=10, p<0,05
Зоренко В.Ю. с соавт. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2011, т. 10, №4, с. 16–22.
12
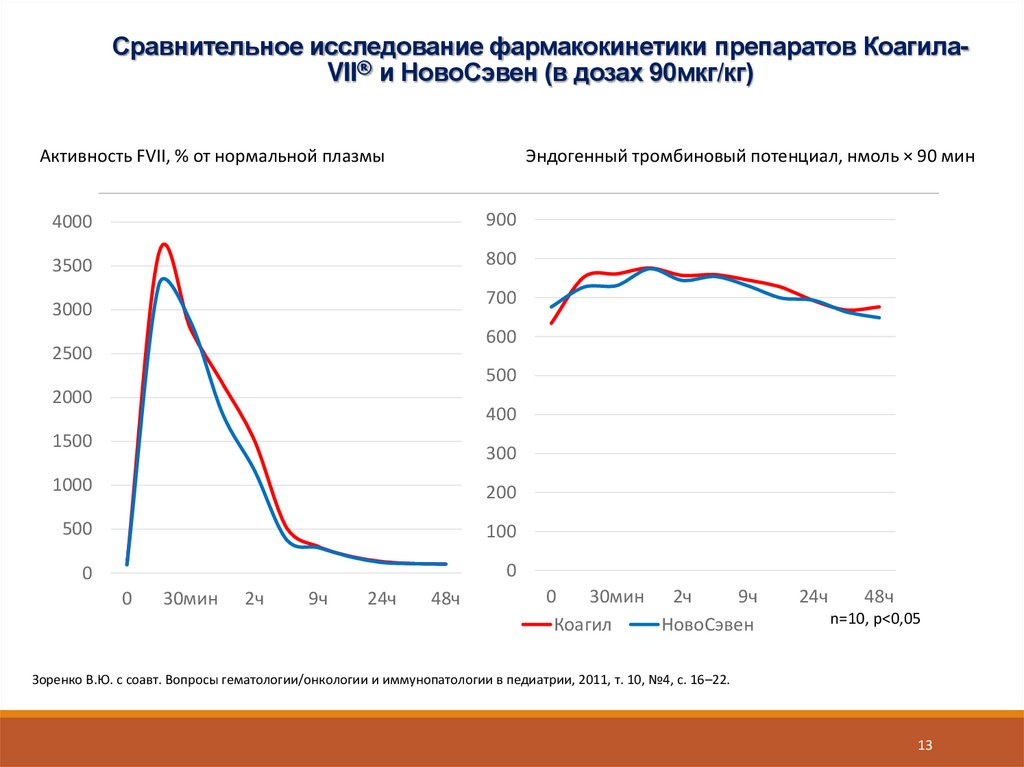
13. Сравнительное исследование фармакокинетики препаратов Коагила-VII® и НовоСэвен (в дозах 90мкг/кг)
Сравнительное исследование фармакокинетики препаратов КоагилаVII® и НовоСэвен (в дозах 90мкг/кг)Активность FVII, % от нормальной плазмы
Эндогенный тромбиновый потенциал, нмоль × 90 мин
4000
900
3500
800
700
3000
600
2500
500
2000
400
1500
300
1000
200
500
100
0
0
0
30мин
2ч
9ч
24ч
48ч
0
30мин 2ч
9ч
Коагил
НовоСэвен
24ч
48ч
n=10, p<0,05
Зоренко В.Ю. с соавт. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2011, т. 10, №4, с. 16–22.
13
14.
1415. Опыт ГЦЛГ в применении отечественных рекомбинантных препаратов
1516. Показания для назначения препарата Коагил-VII®
Показания дляназначения
препарата КоагилVII®
Для остановки кровотечений и
профилактики их развития при
проведении хирургических
вмешательств и инвазивных процедур:
•у пациентов с гемофилией
(наследственной или приобретенной) с
высоким титром ингибитора к факторам
свертывания крови VIII или IX;
•у пациентов с врожденным дефицитом
фактора свертывания крови VII;
•у пациентов с тромбастенией Гланцмана
при наличии антител к гликопротеинам
IIb-IIIа и рефрактерностью (в настоящем
или прошлом) к трансфузиям
тромбоцитарной массы.
*Инструкция по медицинскому применению препарата «Коагил-VII®»
16
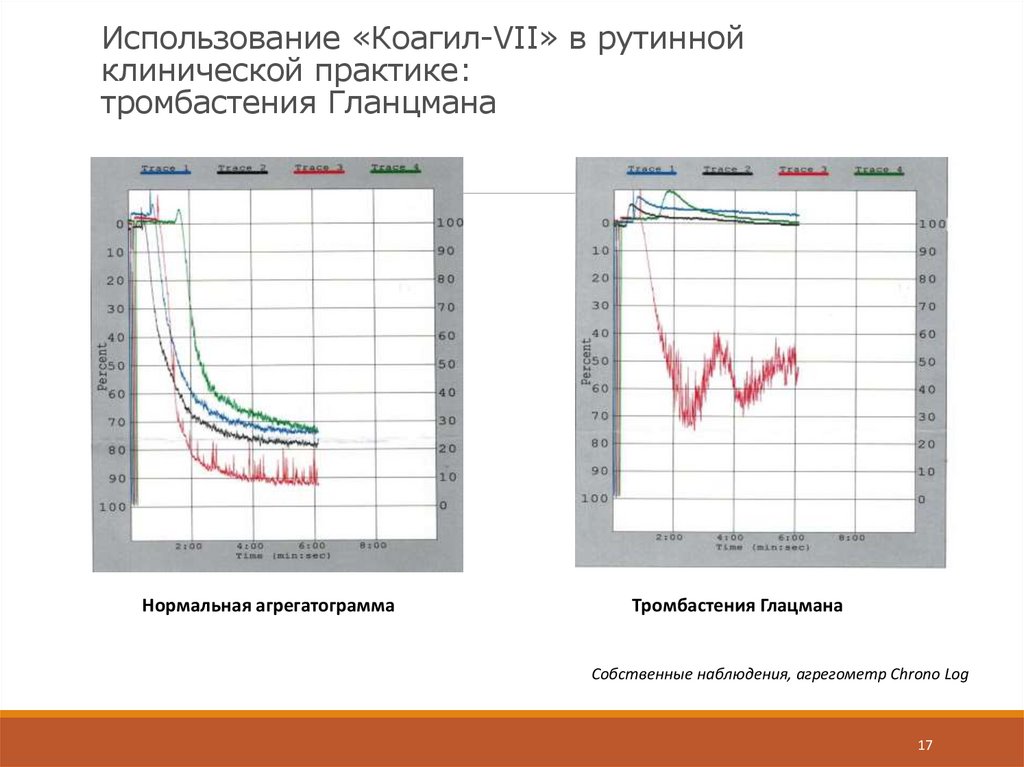
17. Использование «Коагил-VII» в рутинной клинической практике: тромбастения Гланцмана
Нормальная агрегатограммаТромбастения Глацмана
Собственные наблюдения, агрегометр Chrono Log
17
18. Использование «Коагил-VII» в рутинной клинической практике
Показания кприменению*:
- гемофилия
(наследственная
или
приобретенная) с
высоким титром
ингибитора к
факторам
свертывания крови
VIII или IX > 5 БЕ;
Всего за 2012 – 2019 г.г. в
ГЦЛГ обратилось
8 пациентов с ПГА:
6 женщин и 2 мужчин;
возраст – 25 – 87 лет
*Инструкция по медицинскому
применению препарата
«Коагил-VII®»
18
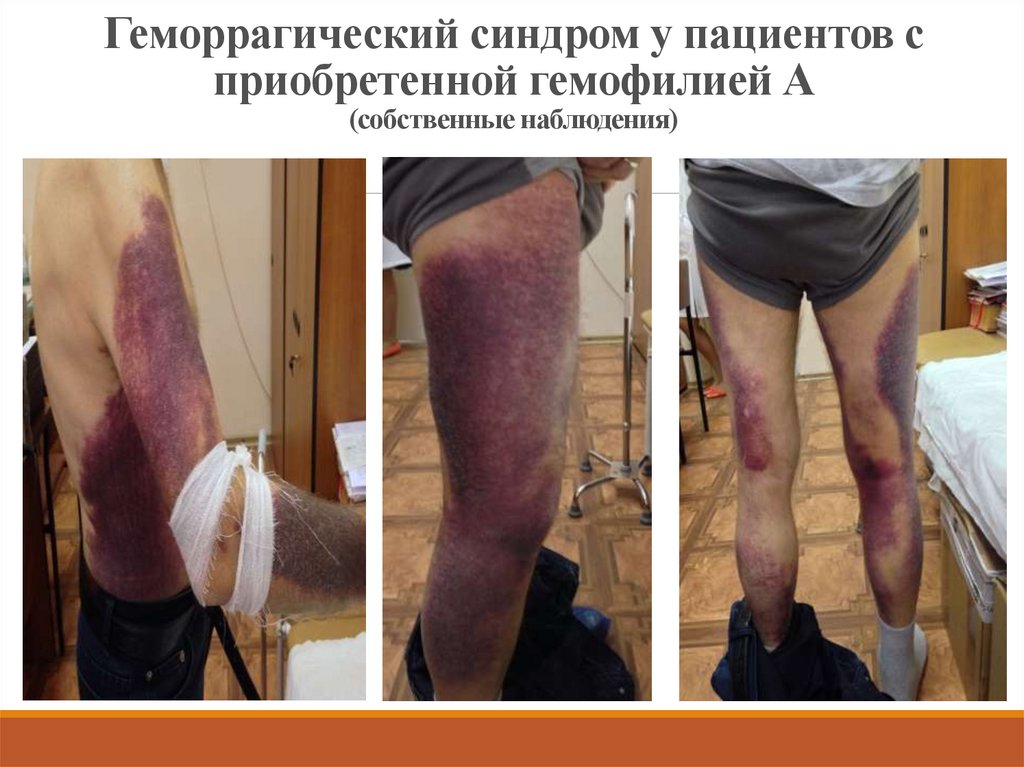
19. Геморрагический синдром у пациентов с приобретенной гемофилией А (собственные наблюдения)
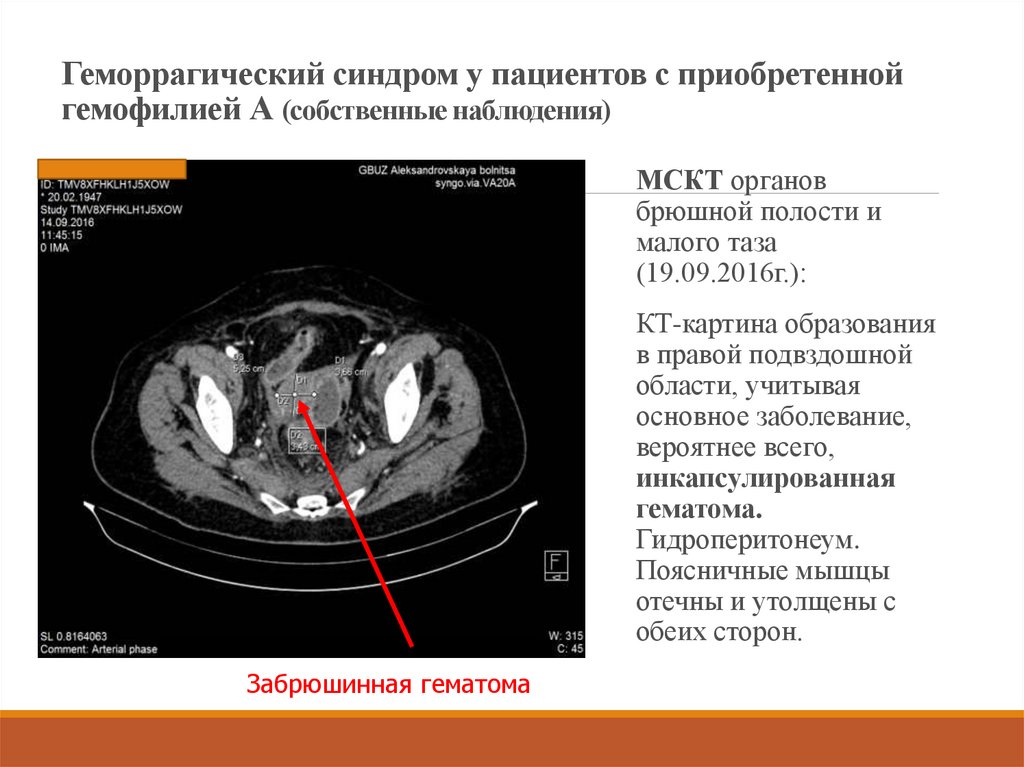
20. Геморрагический синдром у пациентов с приобретенной гемофилией А (собственные наблюдения)
МСКТ органовбрюшной полости и
малого таза
(19.09.2016г.):
КТ-картина образования
в правой подвздошной
области, учитывая
основное заболевание,
вероятнее всего,
инкапсулированная
гематома.
Гидроперитонеум.
Поясничные мышцы
отечны и утолщены с
обеих сторон.
Забрюшинная гематома
21. Заключение:
Отечественные рекомбинантные препаратыдля лечения гемофилии доказали свою
эффективность и безопасность в ходе
клинических исследований, а также при
применении в рутинной клинической
практике.
21












 Медицина
Медицина








