Похожие презентации:
Химические свойства неорганических веществ (повторение)
1. Химические свойства НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ (ПОВТОРЕНИЕ)
10-11 классы 20202.
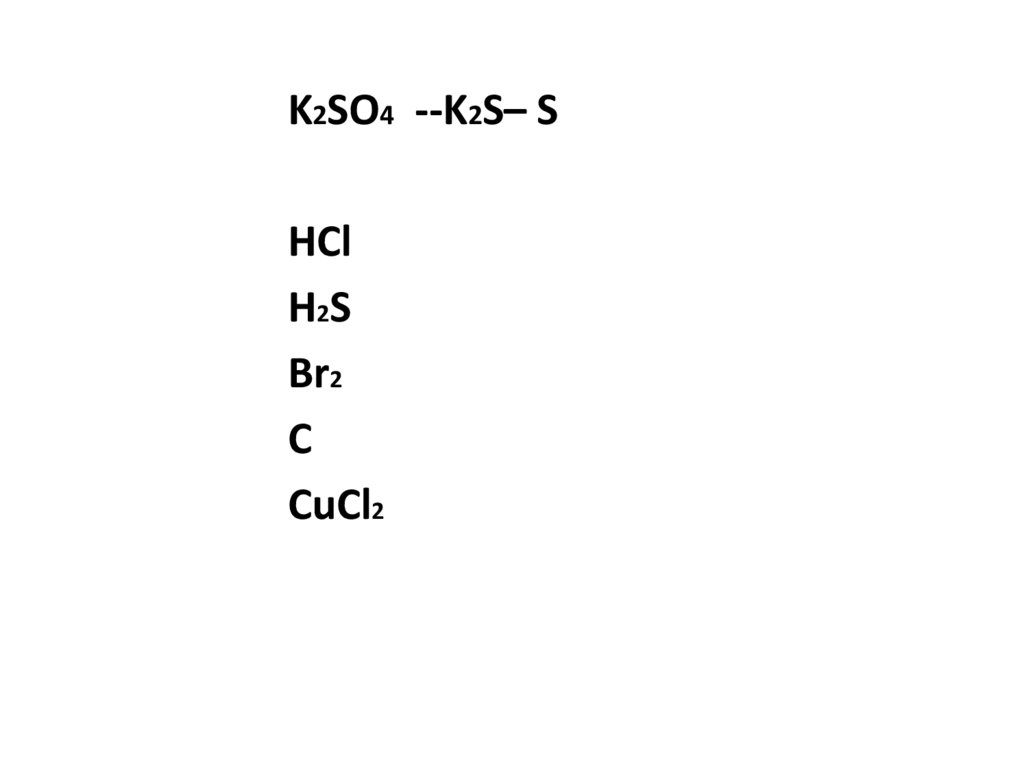
K2SO4 --K2S– SHCl
H2S
Br2
C
CuCl2
3.
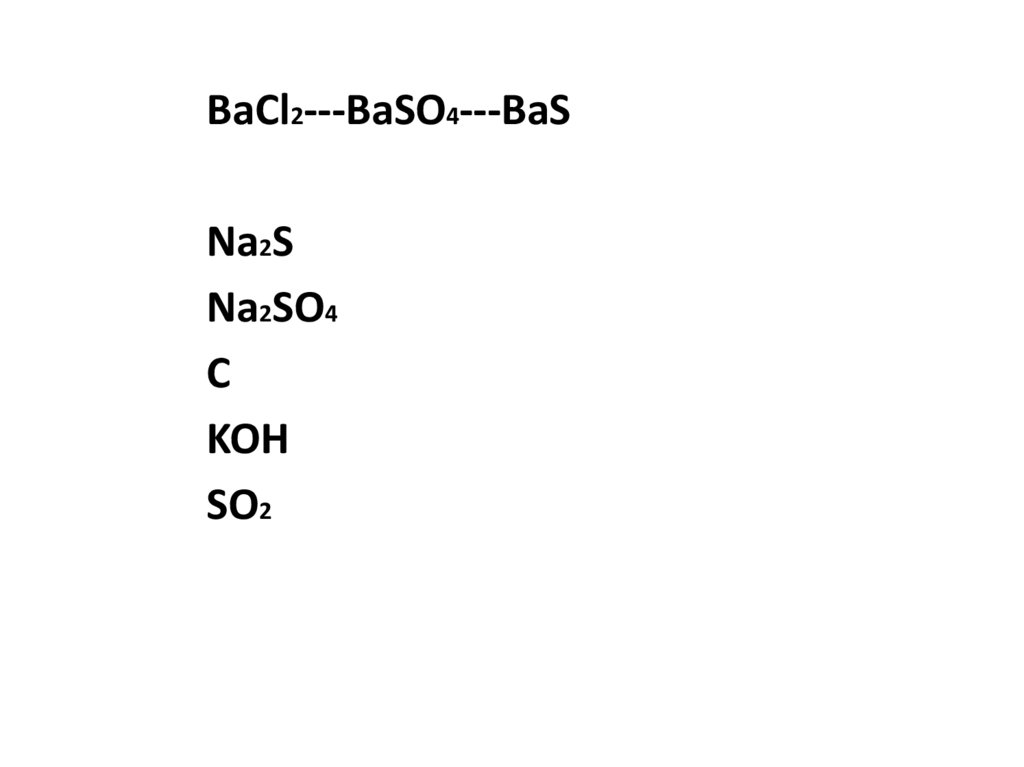
BaCl2---BaSO4---BaSNa2S
Na2SO4
C
KOH
SO2
4. Демонстрация опыта
FeY
X-----FeCl3-----FeCl2
HCl
CuCl2l
KJ
Cl2
AgJ
Демонстрация опыта
5.
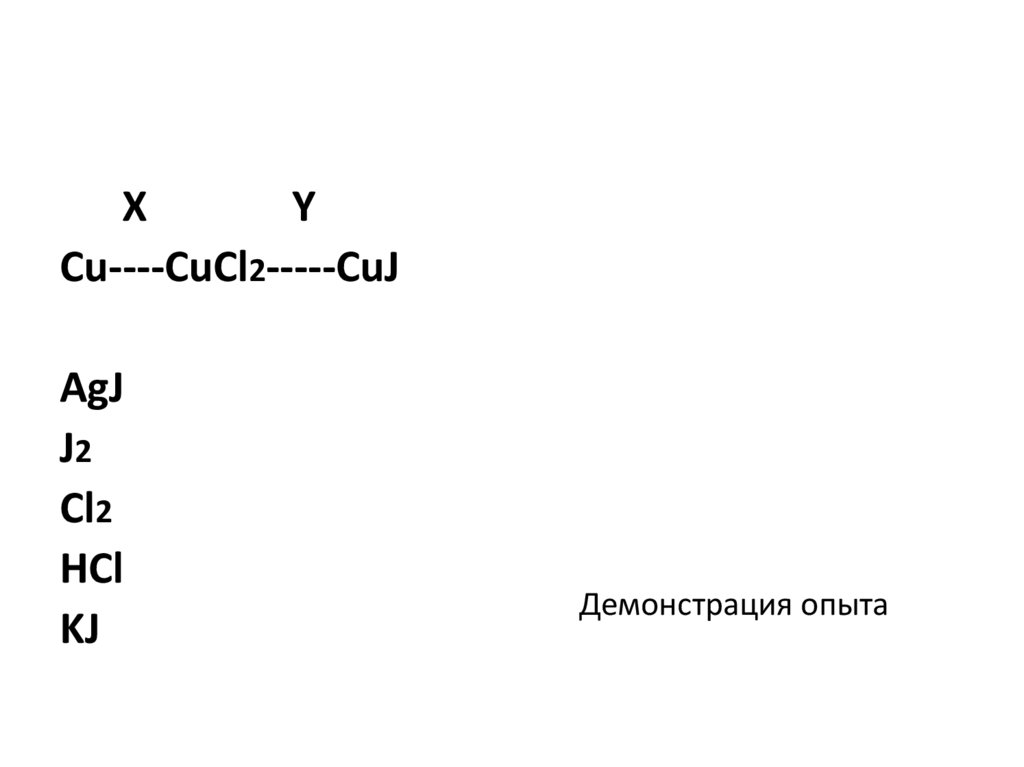
XY
Сu----CuCl2-----CuJ
AgJ
J2
Cl2
HCl
KJ
Демонстрация опыта
6.
7. https://www.youtube.com/watch?v=HwlgknbeHVo жидкий азот и туман с водой (мин. 2.39 -3.09)
H2OY
X- ------NH3------Cu
N2
CuO
CuSO4
MgN2
NH4Cl
https://www.youtube.com/watch?v=HwlgknbeHVo
жидкий азот и туман с водой (мин. 2.39 -3.09)
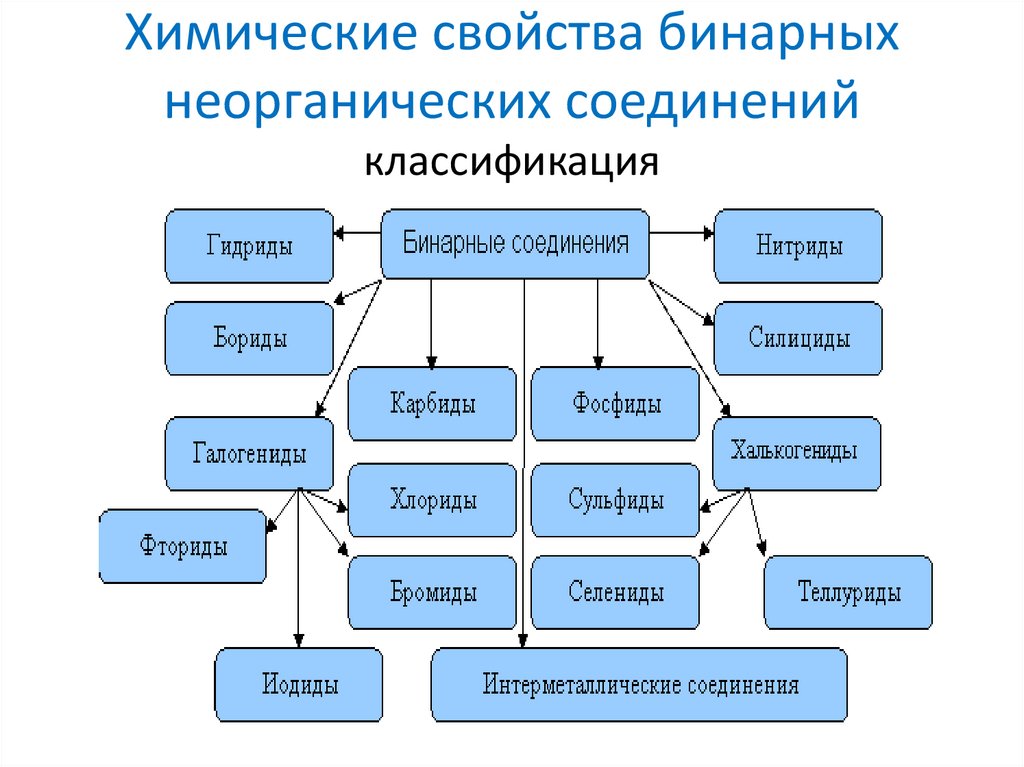
8. Химические свойства бинарных неорганических соединений
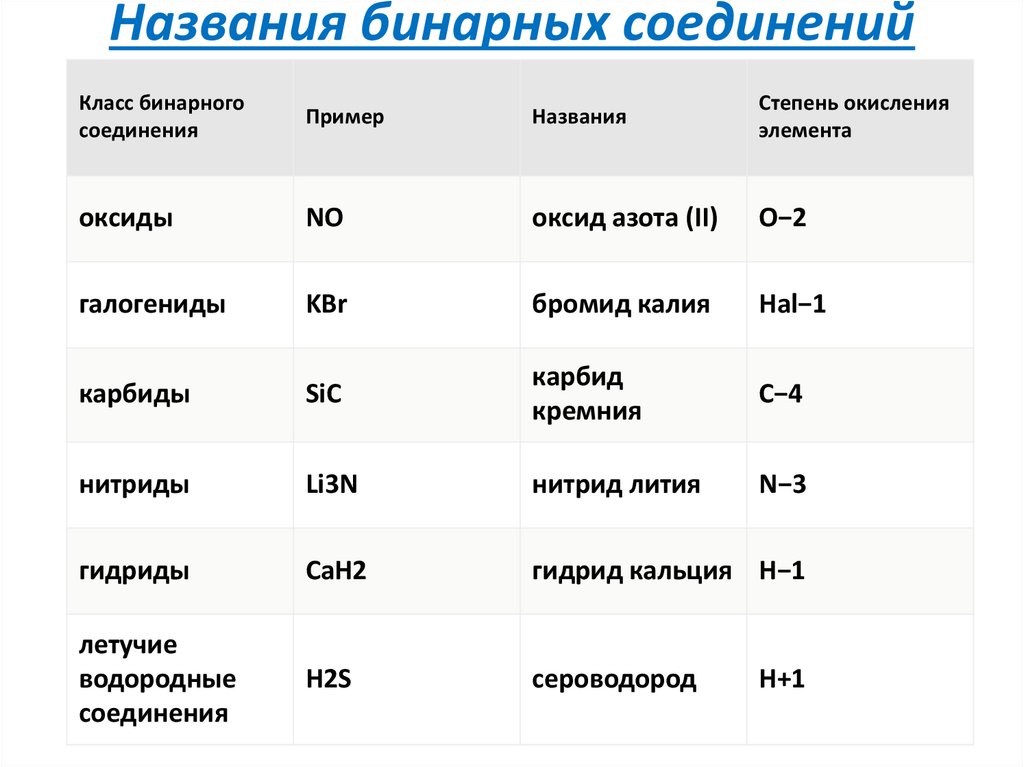
классификация9. Названия бинарных соединений
Класс бинарногосоединения
Пример
Названия
Степень окисления
элемента
оксиды
NO
оксид азота (II)
O−2
галогениды
KBr
бромид калия
Hal−1
карбиды
SiC
карбид
кремния
C−4
нитриды
Li3N
нитрид лития
N−3
гидриды
CaH2
гидрид кальция H−1
летучие
водородные
соединения
H2S
сероводород
H+1
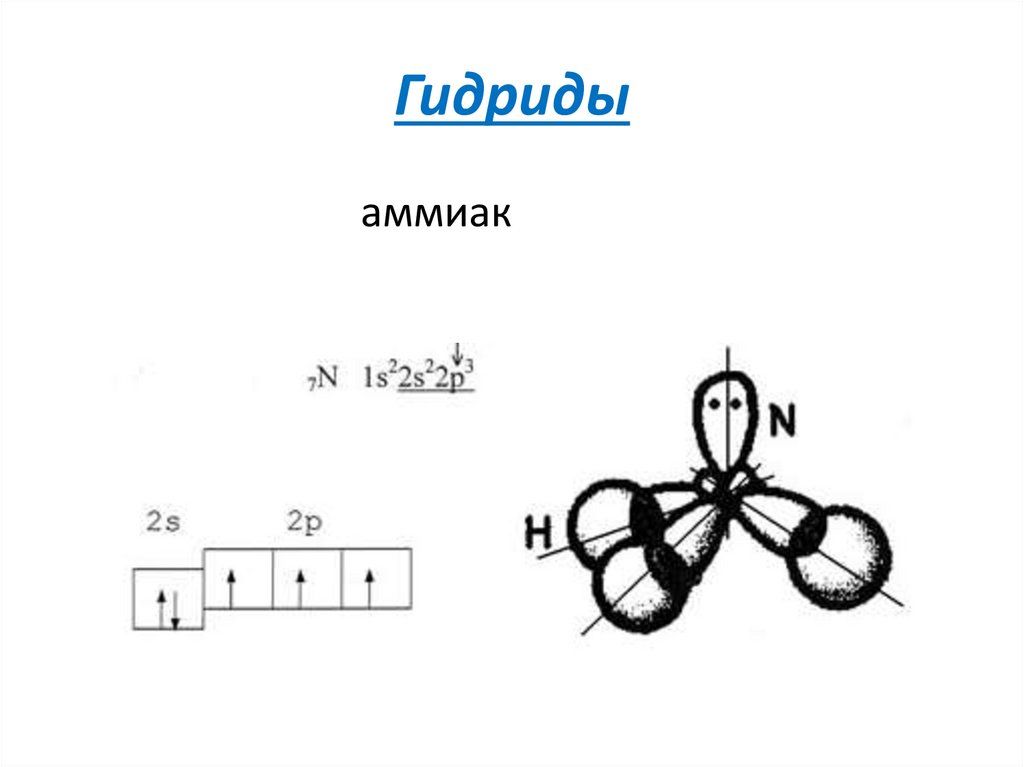
10. Гидриды
аммиак11. Химические свойства бинарных неорганических соединений
12.
13.
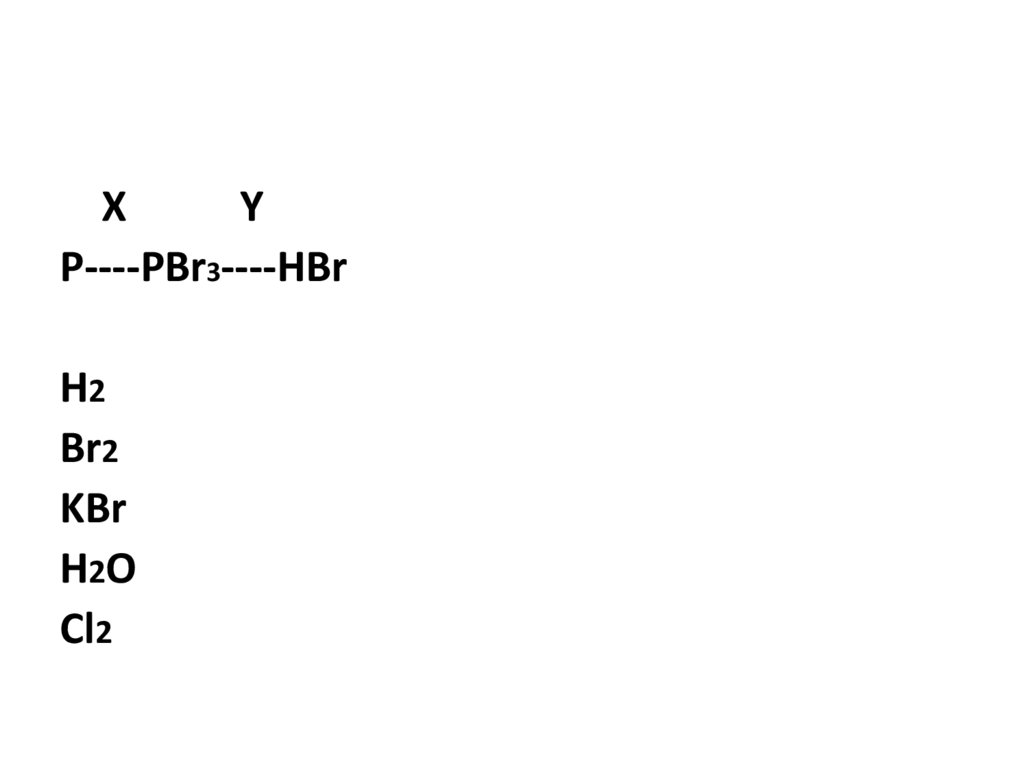
XY
P----PBr3----HBr
H2
Br2
KBr
H2O
Cl2
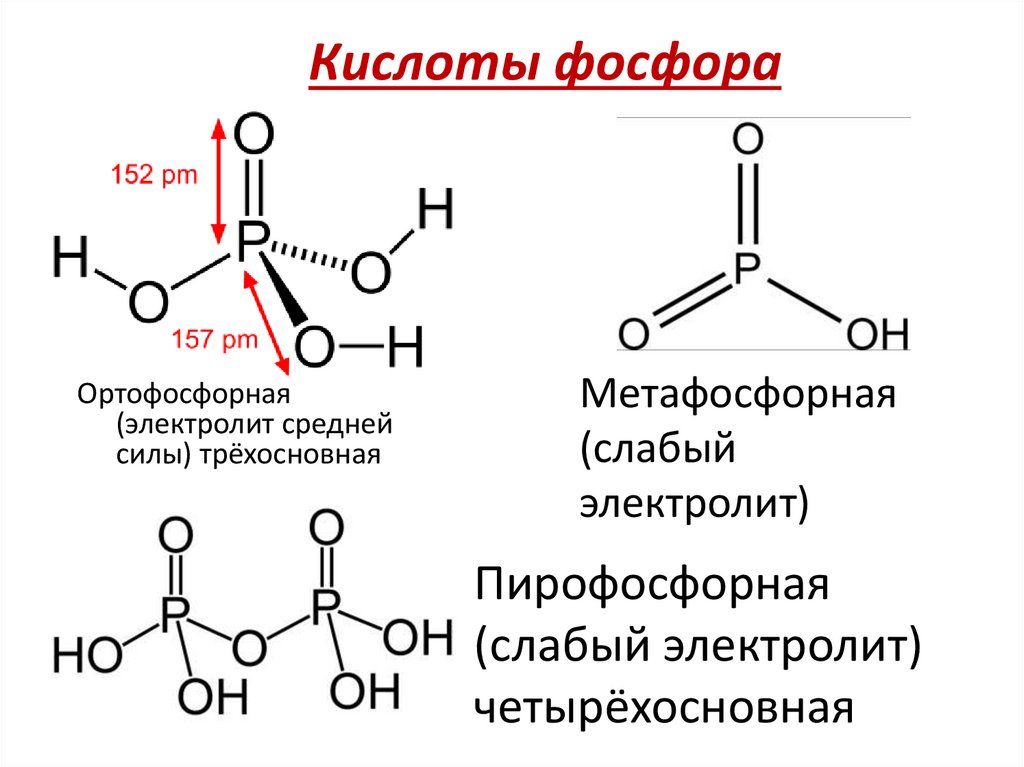
14. Кислоты фосфора
Ортофосфорная(электролит средней
силы) трёхосновная
Метафосфорная
(слабый
электролит)
Пирофосфорная
(слабый электролит)
четырёхосновная
15.
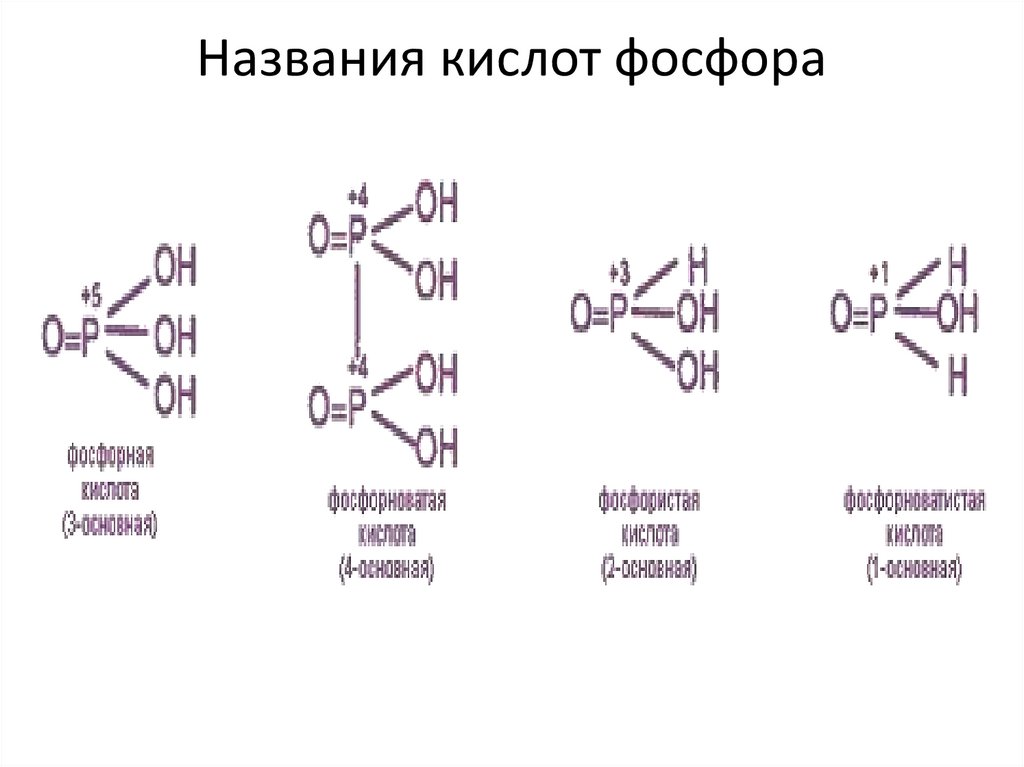
16. Кислоты фосфора (С.О.+5)
17. Названия кислот фосфора
18. фосфорноватая кислота
Диспропорционируетпри комнатной температуре
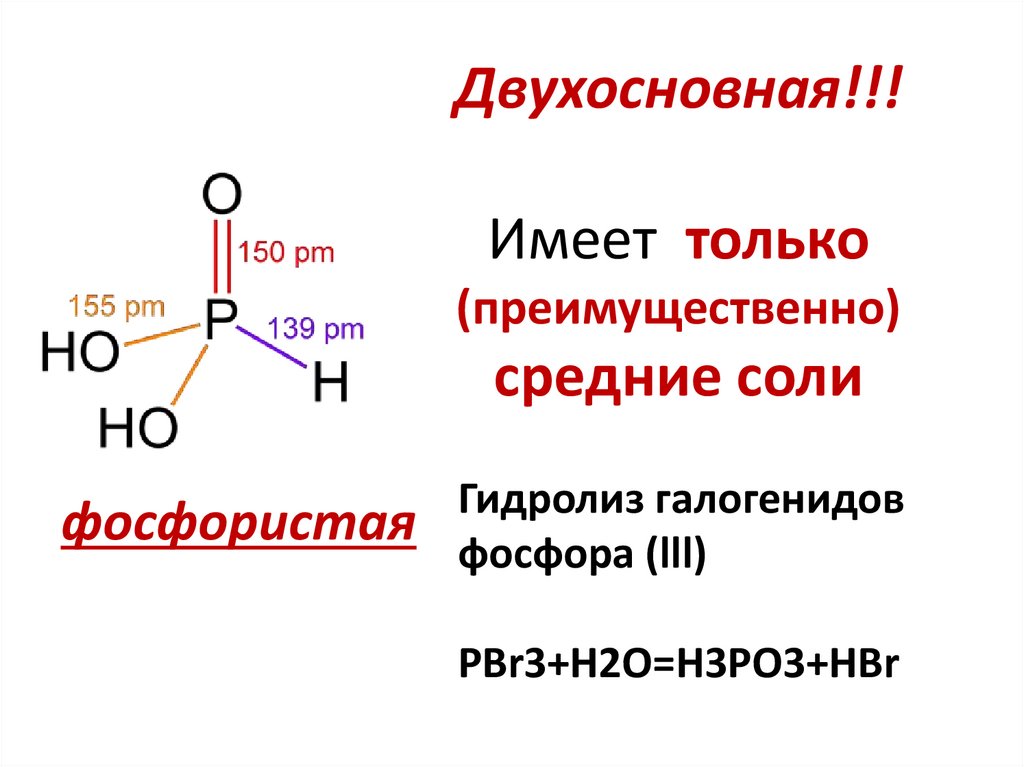
19. Двухосновная!!! Имеет только (преимущественно) средние соли
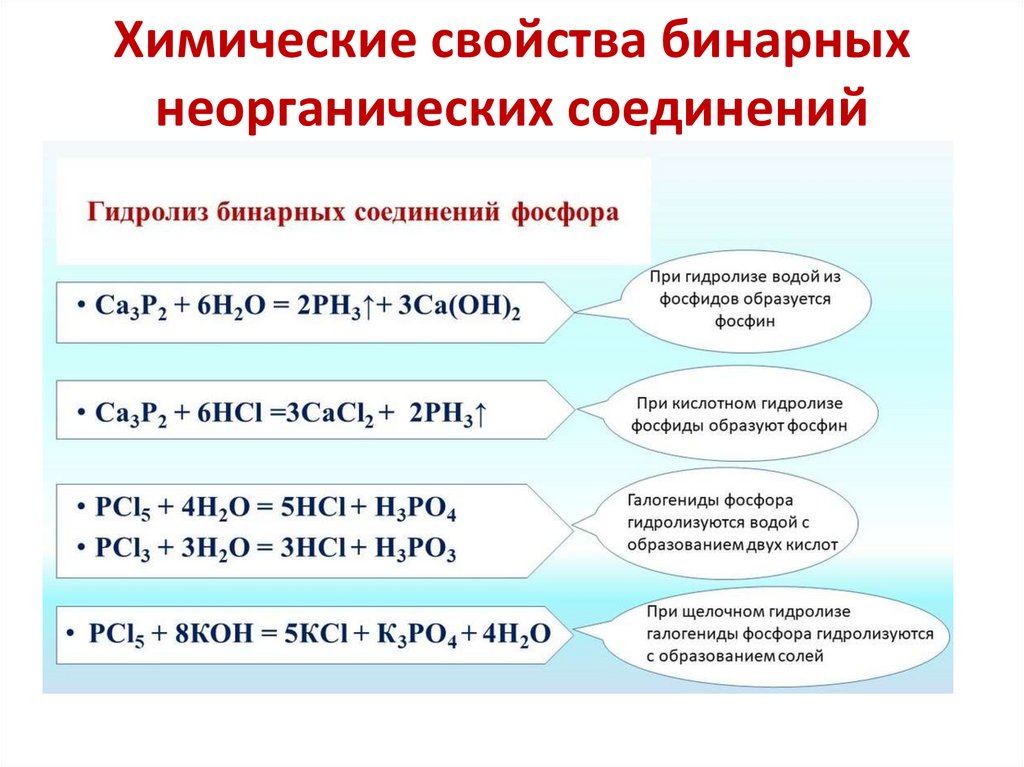
фосфористаяГидролиз галогенидов
фосфора (lll)
PBr3+H2O=H3PO3+HBr
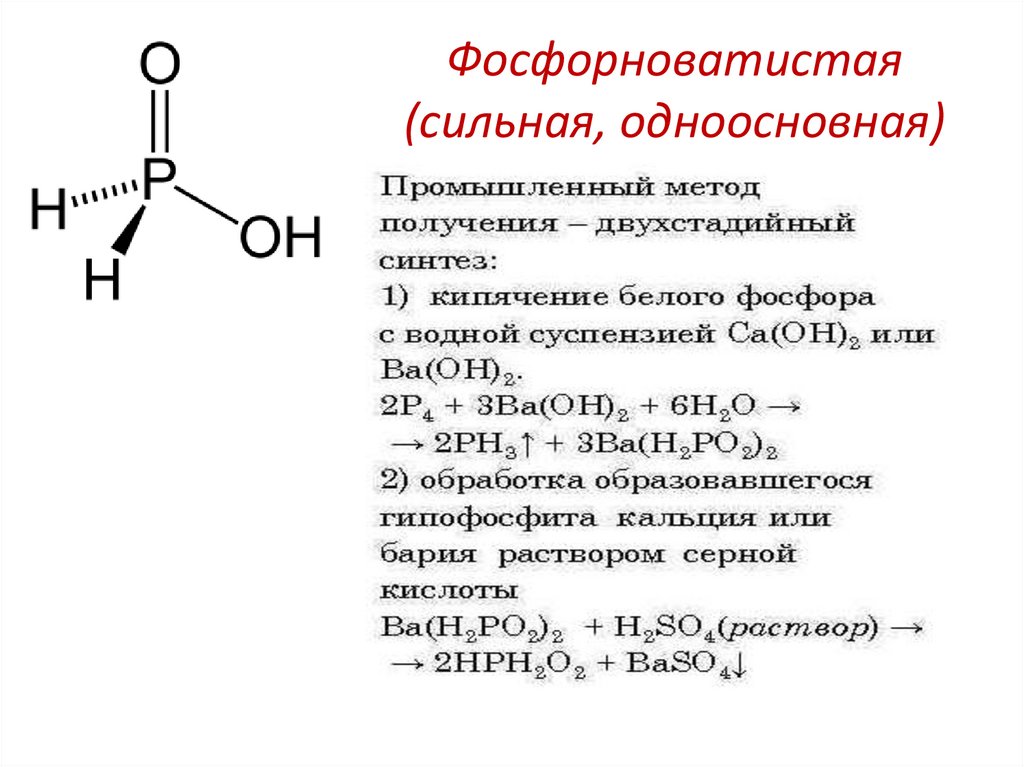
20. Фосфорноватистая (сильная, одноосновная)
21. Соли фосфорноватистой кислоты (гипофосфиты) образуются при взаимодействии белого фосфора со щелочами
https://www.youtube.com/watch?v=g1ujYPHn3Fo22.
23.
24. Классификация неорганических веществ
Классификация неорганических веществ
Формула
оксида • Li2O
• N2O3
Тип оксида
NO
• PbO
• N2O5
НесолеобCr2O3
разующий
• PbO2
• Al2O3
CrO
Кислотный
• MgO
• B2O3
MnO2
Основный
• N2O
• BeO
MnO
Амфортер• V2O5
• SeO2
ный
Mn2O7 • VO
• SO
SiO
• NO2
• CO
SiO2
• CO2
25.
ФОРМУЛА
KH2PO2
Na2H2P2O7
KFe(SO4)
KHPO4
Na[Al(OH)4]
Cr(OH)2NO3
Na2MnO4
Na2Cr2O7
Na[Ag(CN)2]
CuSO4*5H2O
NaCl*KCl
ТИП СОЛИ
• Mg2(OH)2CO2 • Средняя соль
• (CuOH)2CO3 • Кислая соль
• Na2HPO3
• Основная соль
• KH2PO3
• Смешанная
соль
• HCOOK
• Двойная соль
• Ca3(PO4)2
• Комплексная
• CaClF
соль
• AlK(SO4)2*
• Кристол• *12H2O
логидрат
26. ТРИВИАЛЬНЫЕ НАЗВАНИЯ
• Красная кровяная сольK3[Fe(CN)6]
Реактив на определение железа (II)
2 К3[Fe(CN)6 ] +3 Fe SO4 =
= KFe[Fe(CN)6])↓ + 3K2SO4
Турнбуллева синь
ВИДЕО
https://www.youtube.com/watch?v=yyhg_2k
hzbA
27.
• https://www.youtube.com/watch?v=- →→OvtjGb15EE
K4[Fe(CN)6]
Используется для обнаружения Fe3+:
образуется малорастворимый синий
осадок «берлинской лазури»:
FeIIICl3 + K4[FeII(CN)6] → Видео:
→ KFeIII[FeII(CN)6] + 3KCl, https://www.youtu
be.com/watch?v=OvtjGb15EE
28.
• Zn2+: образуется белый осадокгексацианоферрата(II) цинка-калия:
• 3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]2↓ +
6KCl,
• Cu2+: из нейтральных или слабокислых
растворов выпадает красно-бурый осадок
гексацианоферрата(II) меди(II):
• 2CuCl2 + K4[FeII(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl,
29.
• Железная окалина• (железный сурик)
• FeO*Fe2O3
• Свинцовый сурик
• 2PbO*PbO2
или
Pb2PbO4
(ортоплюмбат
свинца)
30.
31. Свинцовые белила
Pb(ОН)2CO3реставрация
32.
Свинцовые белила на воздухе очень медленно реагирует ссероводородом, часто содержащемся в загрязненной атмосфере,
при этом образуется сульфид свинца(II) черного цвета, что
обуславливает постепенное темнение и тускнение некоторых
произведений художественного искусства:
[Pb(OH)]2CO3+2H2S=2PbS+CO2+3H2O
Однако при обработке старой картины, написанной с
использованием свинцовых белил, пероксидом водорода
происходит окисление сульфида свинца до сульфата свинца(II)
белого цвета. На этой реакции основан метод восстановления
картин, выполненных масляными красками.
PbS+4H2O2=PbSO4+4H2O
33. Поташ
К2СО3Калийная
селитра
Гипс
CaSO4·2H2O
KNO3
34. Негашеная известь
СаОГашеная известь («пушонка»)
Ca(OH)2
35. Корунд
Al2O3сапфир
рубин
36. Кремнезём
SiO2SiO2 не реагирует с водой.
Химически стоек к действию кислот, но реагирует
с газообразным фтороводородом:
SiO2+4HF= SiF4+2H2O
и плавиковой кислотой:
SiO2+6HF=H2[SiF6]+2H2O
Эти две реакции широко используют для
плавления стекла.
37.
SiO2 с щелочами и основными оксидами, а также с карбонатами активныхметаллов образуются силикаты — соли не имеющих постоянного состава очень
слабых, нерастворимых в воде кремниевых кислот общей формулы xH2O·ySiO2
(довольно часто в литературе упоминаются не кремниевые кислоты, а кремниевая
кислота, хотя фактически речь при этом идёт об одном и том же веществе).
Например, может быть получен ортосиликат натрия:
SiO2+4NaOH=Na4SiO4+2H2O
38. Аналитические реакции на ионы
• https://www.youtube.com/watch?v=ExB1r4m7Bb8


























 Химия
Химия








