Похожие презентации:
Алкены
1. АЛКЕНЫ
2. Содержание
Определение. Общая формула.Гомологический ряд, радикалы.
Изомерия и номенклатура.
Строение (гибридизация).
Физические свойства.
Способы получения.
Химические свойства.
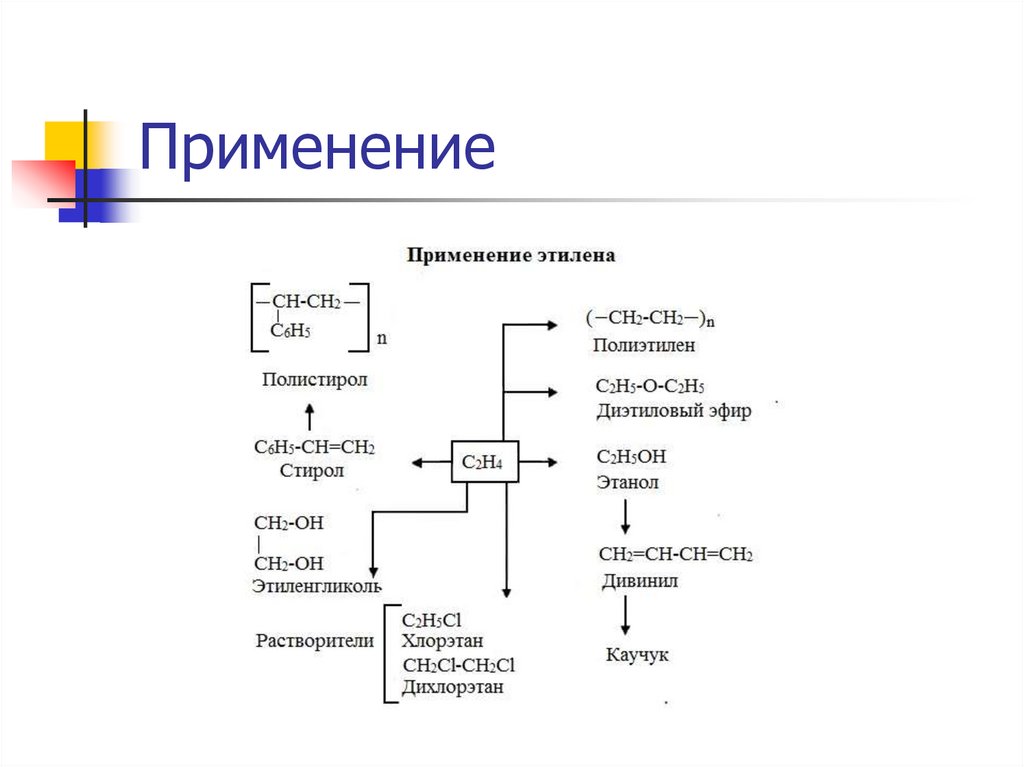
Применение.
3. Определение. Общая формула.
Алкены – ациклические углеводороды,содержащие в молекуле помимо
одинарных связей, одну двойную связь.
Общая формула: СnH2n , где n ≥2
4. Гомологический ряд.
В скобках указаны тривиальные (исторические) названия.5. Радикалы.
6. Изомерия.
Для алкенов возможны два типа изомерии:1) структурная изомерия:
- углеродного скелета
- положения двойной связи
- межклассовая
2) пространственная изомерия:
- геометрическая
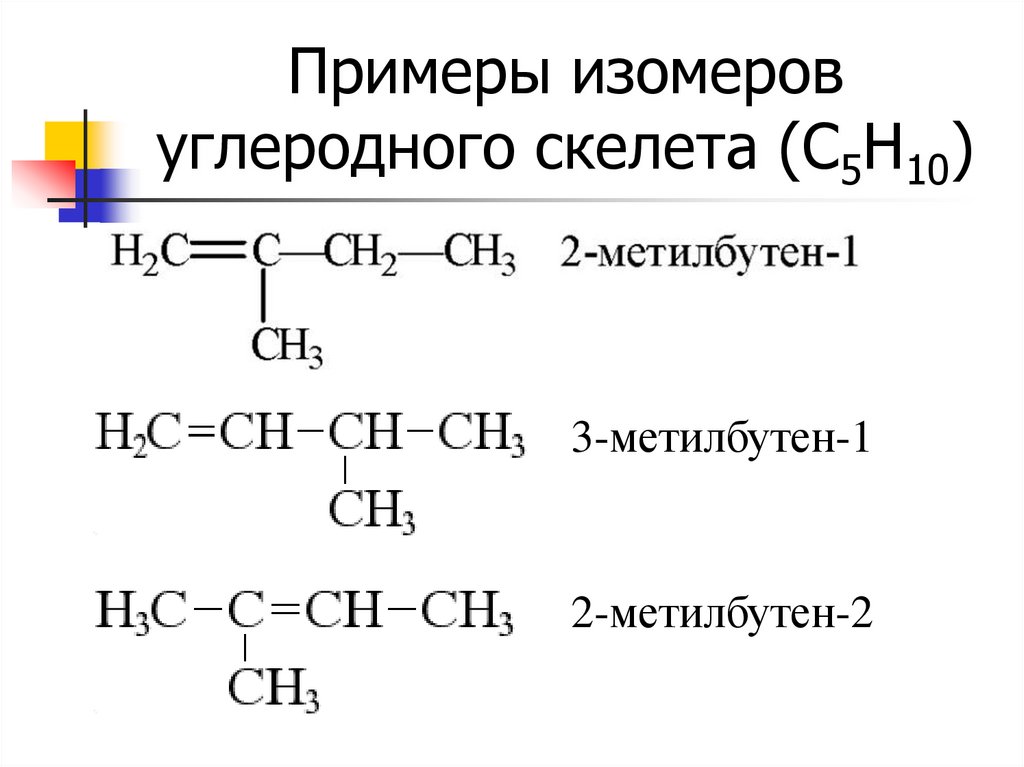
7. Примеры изомеров углеродного скелета (С5Н10)
3-метилбутен-12-метилбутен-2
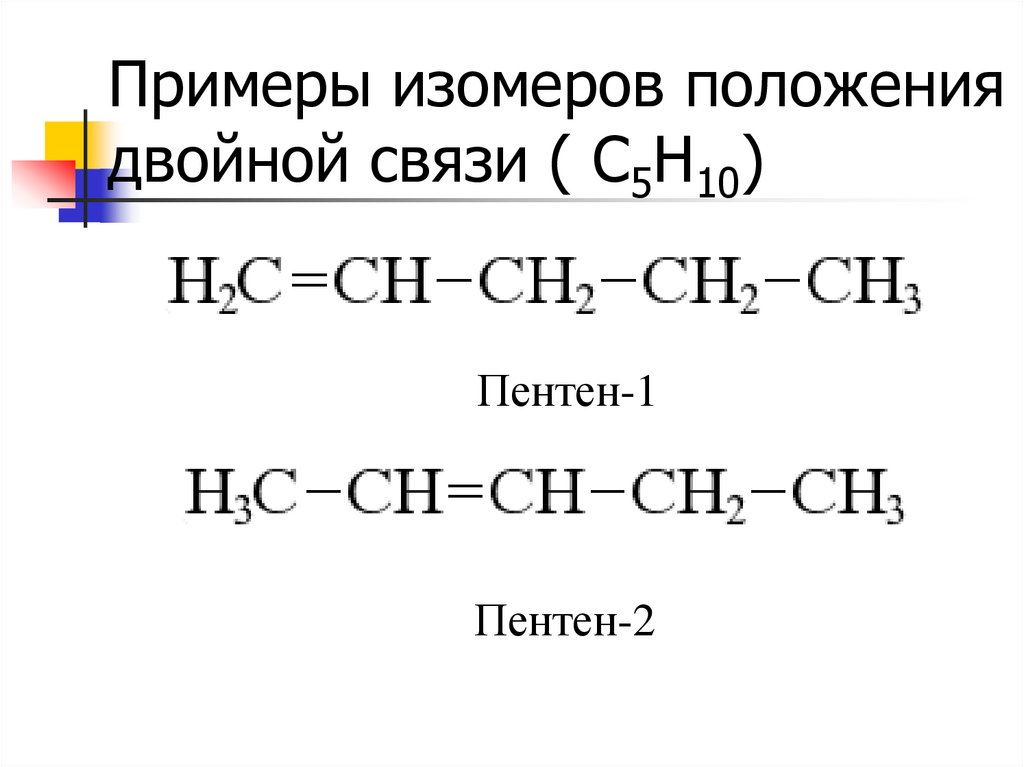
8. Примеры изомеров положения двойной связи ( С5Н10)
Пентен-1Пентен-2
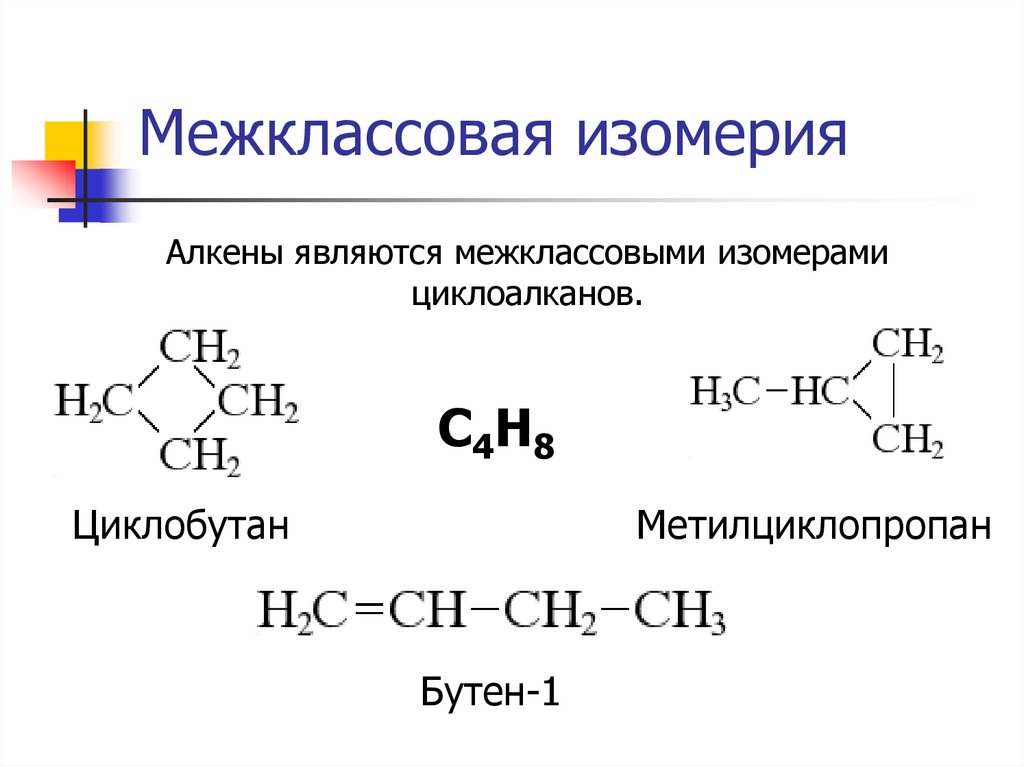
9. Межклассовая изомерия
Алкены являются межклассовыми изомерамициклоалканов.
C4H8
Метилциклопропан
Циклобутан
Бутен-1
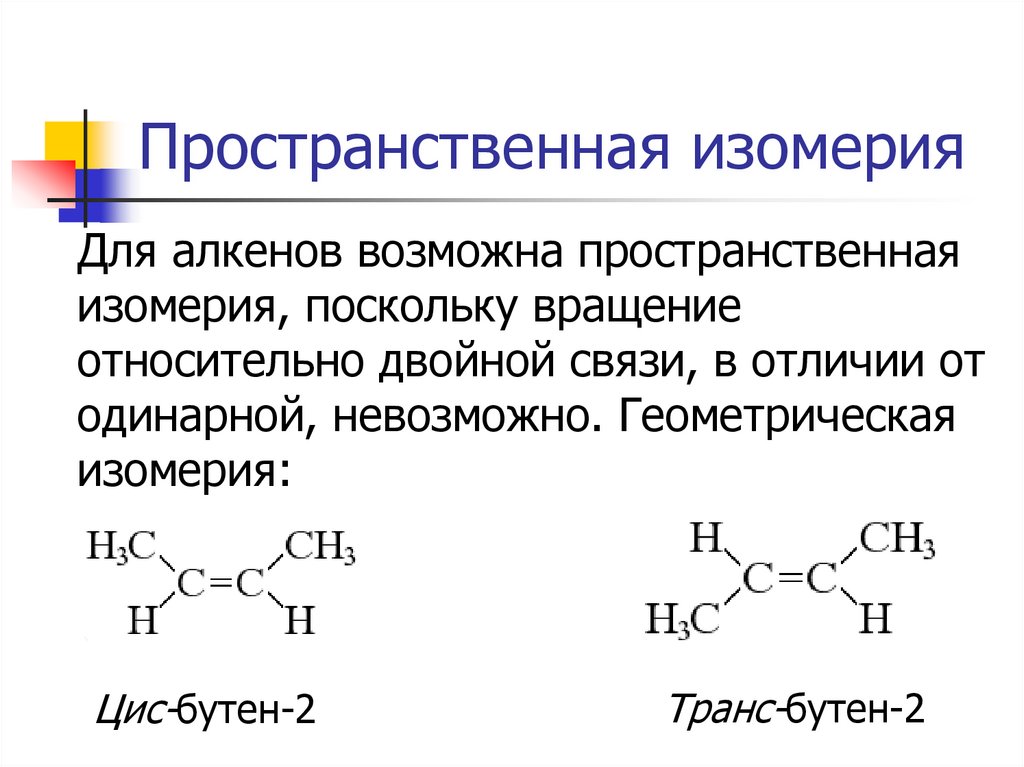
10. Пространственная изомерия
Для алкенов возможна пространственнаяизомерия, поскольку вращение
относительно двойной связи, в отличии от
одинарной, невозможно. Геометрическая
изомерия:
Цис-бутен-2
Транс-бутен-2
11. Номенклатура.
1. Выбираем основную цепочку атомовуглерода:
А) основная цепочка содержит двойную
связь
Б) максимальная длина углеродной цепи;
В) углеродная цепь самая разветвленная.
12. Номенклатура
2. Нумеруем углеродные атомы восновной цепочке:
- начинаем с того конца, где ближе
двойная связь
1
2
3
4
5-метилгексен-2
5
6
13. Номенклатура
-если по расположению двойной связи
нельзя определить начало нумерации
(двойная связь расположена одинаково с
обоих концов), то его определяет
положение заместителей, как у
алканов.
1
2
3
4
5
6
2-метилгексен-3
14. Номенклатура
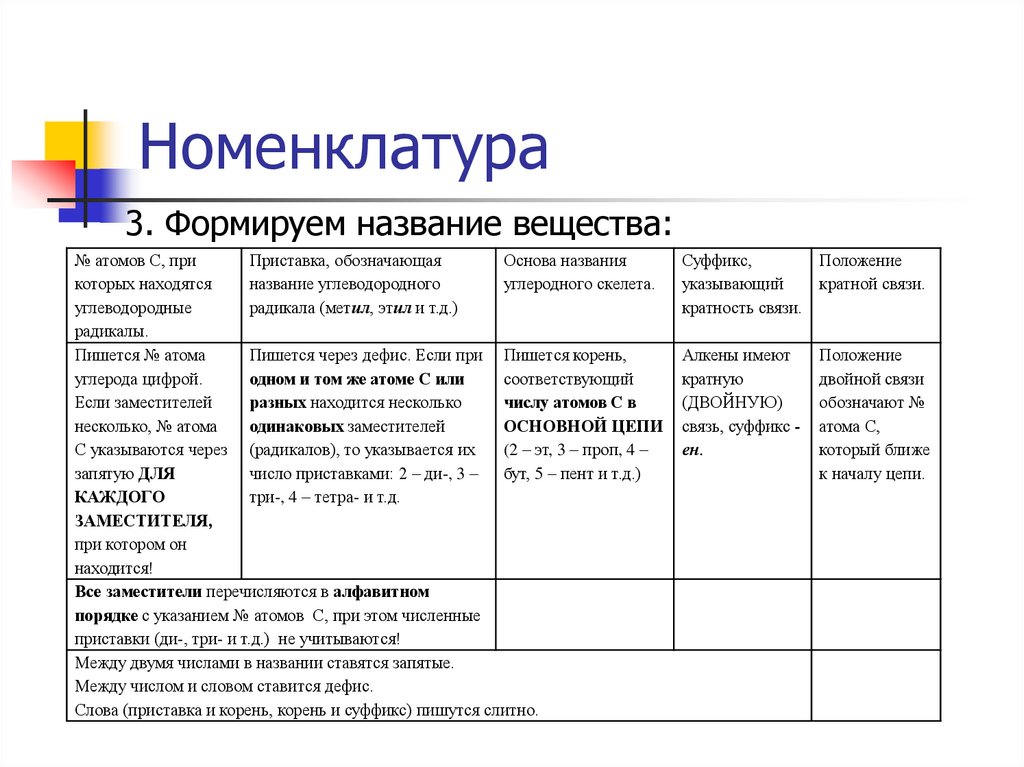
3. Формируем название вещества:№ атомов С, при
Приставка, обозначающая
Основа названия
которых находятся
название углеводородного
углеродного скелета.
углеводородные
радикала (метил, этил и т.д.)
радикалы.
Пишется № атома
Пишется через дефис. Если при Пишется корень,
углерода цифрой.
одном и том же атоме С или
соответствующий
Если заместителей
разных находится несколько
числу атомов С в
несколько, № атома
одинаковых заместителей
ОСНОВНОЙ ЦЕПИ
С указываются через (радикалов), то указывается их
(2 – эт, 3 – проп, 4 –
запятую ДЛЯ
число приставками: 2 – ди-, 3 – бут, 5 – пент и т.д.)
КАЖДОГО
три-, 4 – тетра- и т.д.
ЗАМЕСТИТЕЛЯ,
при котором он
находится!
Все заместители перечисляются в алфавитном
порядке с указанием № атомов С, при этом численные
приставки (ди-, три- и т.д.) не учитываются!
Между двумя числами в названии ставятся запятые.
Между числом и словом ставится дефис.
Слова (приставка и корень, корень и суффикс) пишутся слитно.
Суффикс,
Положение
указывающий
кратной связи.
кратность связи.
Алкены имеют
кратную
(ДВОЙНУЮ)
связь, суффикс ен.
Положение
двойной связи
обозначают №
атома С,
который ближе
к началу цепи.
15. Строение (гибридизация).
В гибридизации участвуют орбиталиодного s- и двух p-электронов:
s
p
sp2
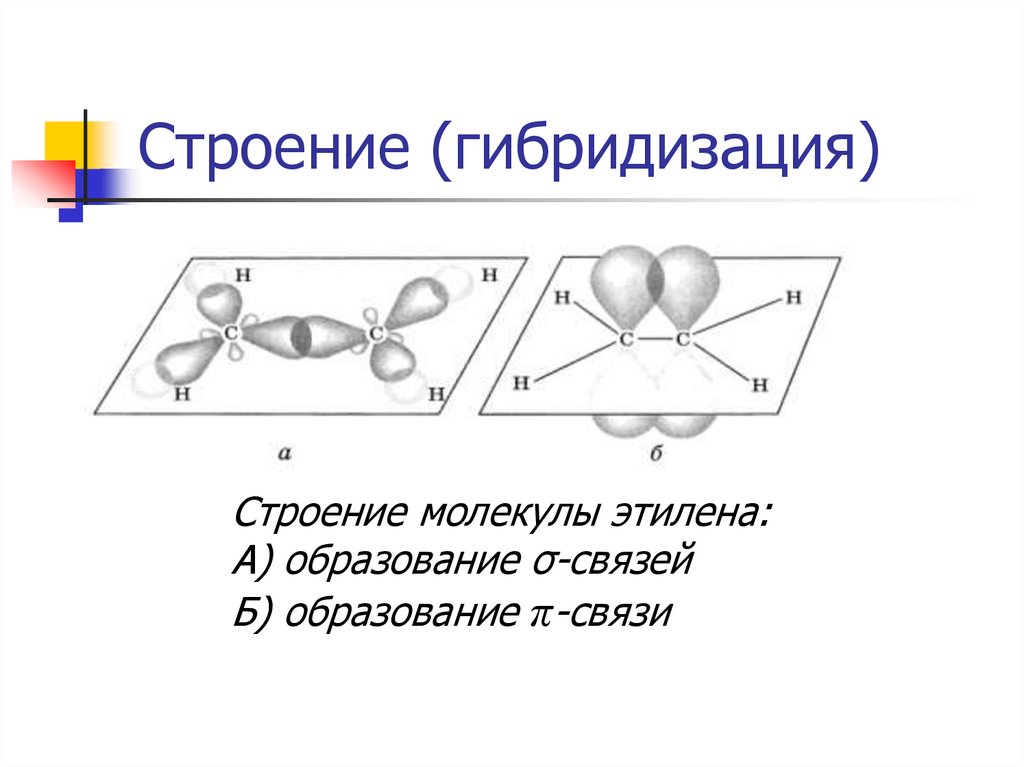
16. Строение (гибридизация)
Строение молекулы этилена:А) образование σ-связей
Б) образование π-связи
17. Строение (гибридизация)
СН2 = СН2 этилен (этен)Двойная связь: σ-связь+π-связь
Тип гибридизации: sp²
Валентный угол: 120°
Длина связи (С = С): 0,134 нм
Форма молекулы: плоскостная (треугольная)
18. Физические свойства
Алкены плохо растворимы в воде, но хорошорастворяются в органических растворителях.
С2– С4 - газы
С5– С16 - жидкости
С17… - твёрдые вещества
С увеличением молекулярной массы алкенов, в
гомологическом ряду, повышаются
температуры кипения и плавления,
увеличивается плотность веществ.
19. Получение
1. Крекинг нефтепродуктов (при высокой t):2.Дегидрирование алканов (t = 400-600 C,
катализатор Pt,Ni):
20. Получение
3.Дегидратация спиртов (отщепление воды)– внутримолекулярная дегидратация:
21. Получение
4.Дегидрогалогенирование (отщеплениегалогенводорода):
По правилу Зайцева: при отщеплении
галогенводорода от вторичных и третичных
галогеналканов атом водорода отщепляется от
наименее гидрированного атома углерода.
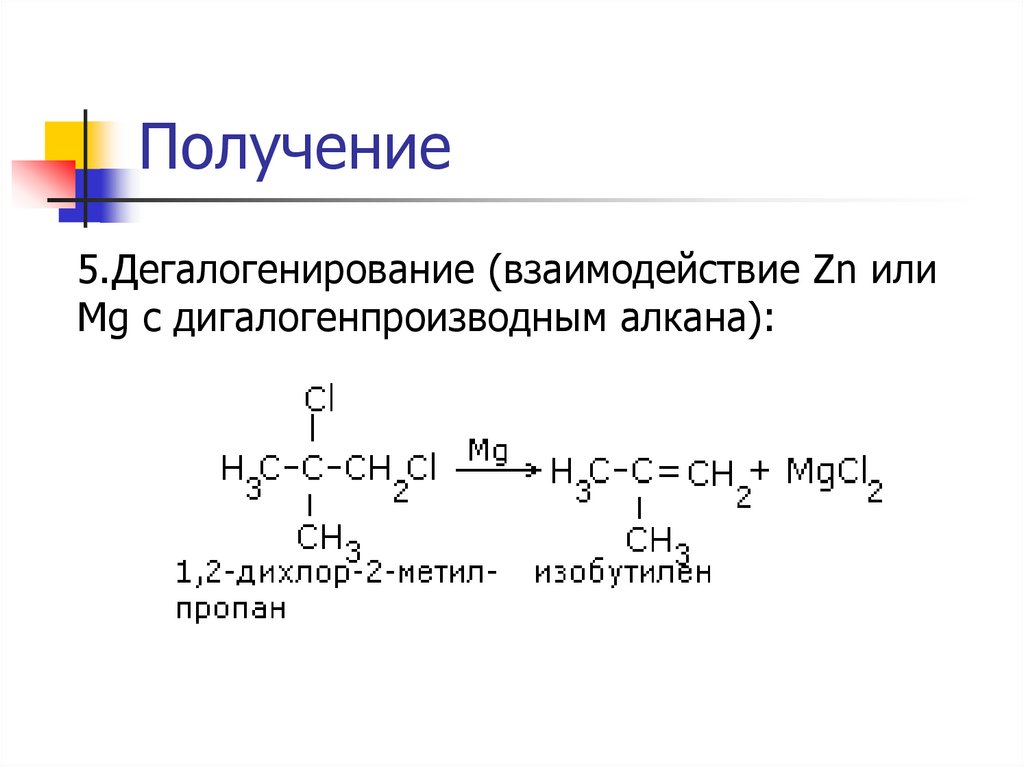
22. Получение
5.Дегалогенирование (взаимодействие Zn илиMg c дигалогенпроизводным алкана):
23. Химические свойства
I.Реакции присоединения:1.Гидрирование: (условия – t, катализатор
Pt, Ni, Pd)
CH2=CH-CH3+Н2 → CH3-CH2-CH3
пропен
пропан
24. Химические свойства
2.Галогенирование (присоединениегалогенов):
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
пропен
1,2-дихлорпропан
Качественная реакция – обесцвечивание
бромной воды.
25. Химические свойства
3.Гидрогалогенирование (присоединениегалогенводорода):
CH2=CH-CH3+НCl → CH3-CHCl-CH3
пропен
2-хлорпропан
Идет по правилу Марковникова: при
присоединении галогенводорода к алкену
водород присоединяется к более
гидрированному атому углерода, т.е. к атому,
при котором находится больше атомов
водорода, а галоген – к менее гидрированному.
26. Химические свойства
4.Гидратация (присоединение воды):Идет по правилу Марковникова: при присоединении
воды к алкену водород присоединяется к более
гидрированному атому углерода, т.е. к атому, при котором
находится больше атомов водорода, а гидроксильная
группа – к менее гидрированному
27. Химические свойства
II. Полимеризация– это последовательное соединение одинаковых молекул
в более крупные (условия – повышенная температура,
давление, катализатор).
28. Химические свойства
III.Реакции окисления:1.Полное окисление (горение):
С2Н4 + 3О2 → 2СО2 + 2Н2О
Алкены горят красноватым светящимся
пламенем, в то время как пламя предельных
углеводородов голубое.
29. Химические свойства
2.Неполное окисление:- В нейтральной или щелочной среде до
двухатомных спиртов
3С2Н4 + 2KMnO4 +4Н2О →3HOCH2-CH2OH +
этен
+2MnO2 + 2KOH
этандиол-1,2
(этиленгликоль)
Реакция Вагнера (качественная реакция –
обесцвечивание раствора перманганата калия)
30. Химические свойства
- в кислой среде происходит полноеразрушение двойной связи с
образованием карбоксильной группы:
31. Химические свойства
Если двойная связь находится в конце молекулы,то одним из продуктов окисления будет
муравьиная кислота, которая легко окисляется
до углекислого газа и воды:
32. Химические свойства
Если в молекуле алкена атом углерода придвойной связи содержит два углеводородных
заместителя, то при его окислении происходит
образование кетона:

























 Химия
Химия








