Похожие презентации:
Алкены
1. Алкены
УрокАлкены
2. Непредельные углеводороды
Алкены - это ациклические углеводороды,содержащие в молекуле, помимо одинарных связей,
одну двойную связь между атомами углерода и
соответствующие общей формуле
CnH2n
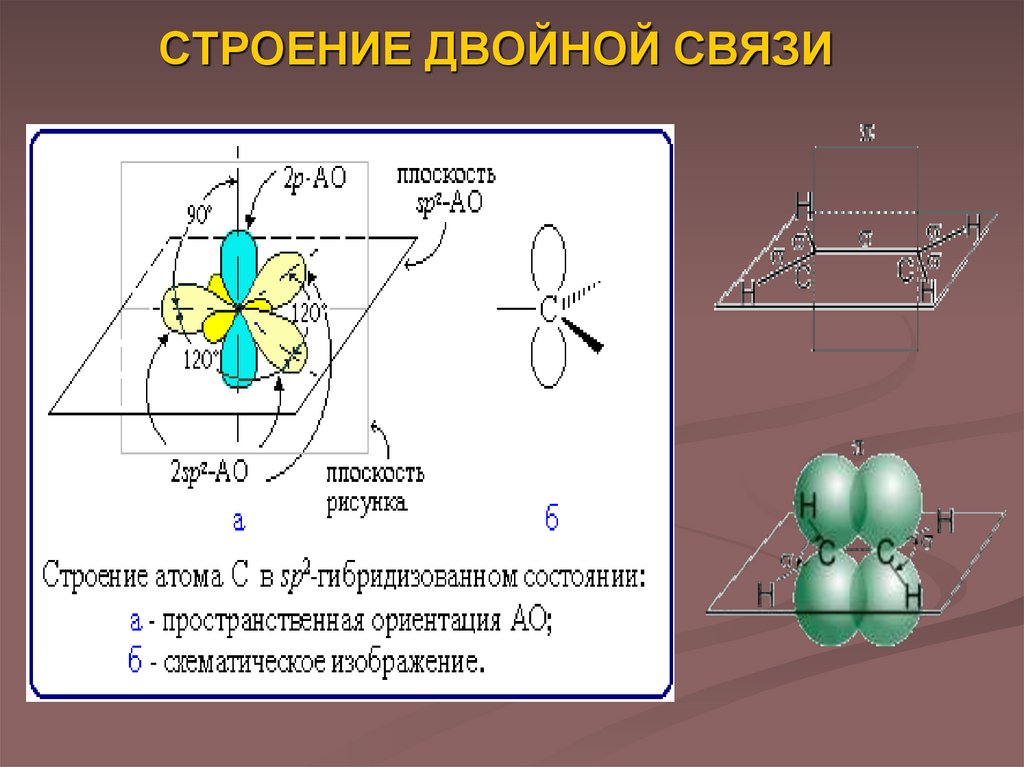
3. СТРОЕНИЕ ДВОЙНОЙ СВЯЗИ
В отличие от предельных углеводородов, алкены содержатдвойную связь С=С, которая осуществляется 4-мя
общими электронами:
δ-связь возникает при осевом перекрывании sp2гибридных орбиталей, а π-связь – при боковом
перекрывании р-орбиталей соседних sp2гибридизованных атомов углерода
По своей природе π-связь резко отличается от δ-связи: πсвязь менее прочная вследствие меньшей эффективности
перекрывания р-орбиталей
Модели молекулы
этилена:
4. СТРОЕНИЕ ДВОЙНОЙ СВЯЗИ
5. СТРОЕНИЕ ДВОЙНОЙ СВЯЗИ
δ-связи, образуемые sp2-гибридными орбиталями,
находятся в одной
плоскости под углом 120°.
Поэтому молекула этилена
имеет плоское строение:
6. Номенклатура алкенов
• По систематической номенклатуре названия алкенов производят отназваний соответствующих алканов (с тем же числом атомов углерода) путем
замены суффикса –ан на –ен:
С2Н4-_этен;
С3Н6 -пропен и т.д.
• Главная цепь выбирается таким образом, чтобы она обязательно включала
в себя двойную связь (т.е. она может быть не самой длинной).
• Нумерацию углеродных атомов начинают с ближнего к двойной связи конца
цепи. Цифра, обозначающая положение двойной связи, ставится обычно
после суффикса –ен.
Например
• Для простейших алкенов применяются также исторически сложившиеся
названия: этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен
• В номенклатуре различных классов
органических соединений наиболее часто
используются следующие одновалентные
радикалы алкенов:
7. Изомерия алкенов
Алкенам свойственна изомерия различных типов. Если алканС4Н10 имеет 2 изомера, то алкену с тем же числом углеродных
атомов формулы С4Н8 соответствует уже 5 изомерных
соединений (4 алкена и один циклоалкан).
Такое многообразие изомеров объясняется тем, что алкенам
свойственны несколько видов изомерии:
Углеродного скелета
Положения двойной связи
Межклассовая изомерия
8. Пространственная изомерия
Алкены, имеющие у каждого из двух атомов углерода при двойнойсвязи различные заместители, могут существовать в виде двух
пространственных изомеров, отличающихся расположением
заместителей относительно плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут
находиться либо по одну сторону от двойной связи в цис-изомере,
либо по разные стороны в транс-изомере.
9. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
По физическим свойствам этиленовые углеводородыблизки к алканам:
Закономерно изменяются в гомологическом ряду:
от С2Н4 до С4Н8 – газы
начиная с С5Н10 – жидкости
с С18Н36 – твердые вещества
Температура их плавления и кипения, а также плотность
увеличиваются с ростом молекулярной массы
Алкены практически нерастворимы в воде, но хорошо
растворяются в органических растворителях
10. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Алкены вступают в разнообразные реакцииприсоединения:
Гидрирование - реакции с водородом
образуются алканы
Галогенирование – реакции с галогенами
образуются дигалогенопроизводные алканов
Гидратации – реакции с водой
образуются спирты
Гидрогалогенирование – реакции с
галогеноводородами
образуются
моногалогенопроизводные алканов
11.
Гидрирование -присоединение водородаАлкены взаимодействуют с водородом при нагревании в
присутствии металлов Pt, Pd или Ni:
Присоединение водорода к атомам углерода в алкенах
приводит к понижению степени их окисления:
Поэтому гидрирование алкенов относят к реакциям
восстановления. Эта реакция используется в
промышленности для получения высокооктанового топлива.
12.
Галогенирование - присоединение галогеновПрисоединение галогенов по двойной связи С=С происходит легко
в обычных условиях (при комнатной температуре, без
катализатора)Например, быстрое обесцвечивание красно-бурой
окраски раствора брома в воде (бромной воды) служит
качественной реакцией на наличие двойной связи
Эта реакция протекают по механизму электрофильного
присоединения с гетеролитическим разрывом связей в молекуле
галогена
Еще легче происходит присоединение хлора:
13. Горение этилена
Напишите уравнение реакции14. Этилен с КМnO4
Напишите уравнение реакции15. Этилен с бромом
Напишите уравнение реакции16. Гидратация - присоединение воды
Гидратация происходит в присутствии минеральных кислотпо механизму электрофильного присоединения:
В реакциях несимметричных алкенов соблюдается
правило Марковникова:
17. Гидрогалогенирование
Направление реакции присоединения галогеноводородов калкенам несимметричного строения (например, к пропилену
CH2=CH–СН3) определяется правилом Марковникова:
CH3–CH=CH2 + HСl → CH3–CHCl–CH3 2хлорпропан
18. ОКИСЛЕНИЕ АЛКЕНОВ
Мягкое окисление алкенов водным раствором перманганатакалия приводит к образованию двухатомных спиртов
(реакция Вагнера):
В ходе этой реакции происходит обесцвечивание
фиолетовой окраски водного раствора KMnO4. Поэтому
она используется как качественная реакция на алкены
Полное уравнение реакции:
19. ИЗОМЕРИЗАЦИЯ АЛКЕНОВ
Алкены вступают в реакцию изомеризации принагревании в присутствии катализаторов (Al2O3)
Изомеризация алкенов приводит или к перемещению π–связи:
или к перестройке углеродного скелета:
20. ПОЛИМЕРИЗАЦИЯ АЛКЕНОВ
процесс образования высокомолекулярного соединения(полимера) путем соединения друг с другом молекул
исходного низкомолекулярного соединения (мономера)
nCH2=CH2→(-CH2-CH2)-n
этилен
полиэтилен
При полимеризации двойные связи в молекулах исходного
непредельного соединения "раскрываются", и за счет
образующихся свободных валентностей эти молекулы
соединяются друг с другом
21. ПРИМЕНЕНИЕ АЛКЕНОВ
Этилен (этен) Н2С=СН2 используется для получения полиэтилена,политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида,
галогенопроизводных и многих других органических соединений
Применяется как средство для ускоренного созревания фруктов.
22. ПРИМЕНЕНИЕ АЛКЕНОВ
в качестве исходныхпродуктов
в производстве
полимерных материалов
(пластмасс, каучуков,
пленок) и других
органических веществ
Пропилен (пропен)
Н2С=СН2–СН3 и
бутилены (бутен-1 и
бутен-2) используются
для получения спиртов
и полимеров
Изобутилен (2-метилпропен)
Н2С=С(СН3)2 применяется в
производстве синтетического каучука
23.
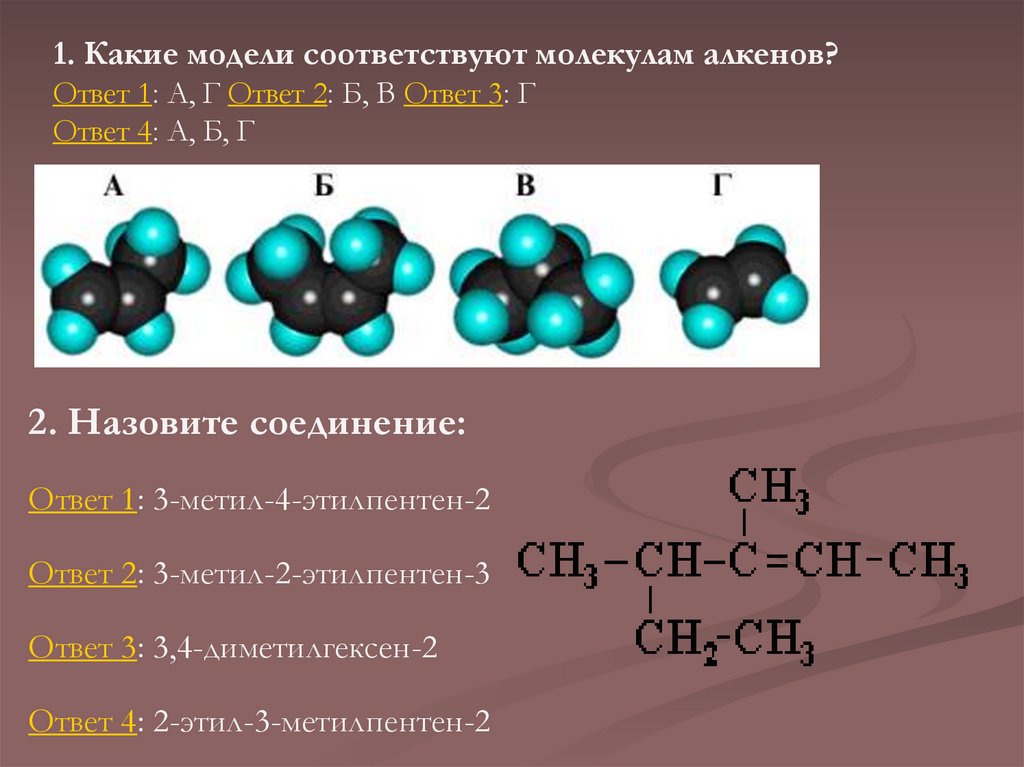
1. Какие модели соответствуют молекулам алкенов?Ответ 1: А, Г Ответ 2: Б, В Ответ 3: Г
Ответ 4: А, Б, Г
2. Назовите соединение:
Ответ 1: 3-метил-4-этилпентен-2
Ответ 2: 3-метил-2-этилпентен-3
Ответ 3: 3,4-диметилгексен-2
Ответ 4: 2-этил-3-метилпентен-2
24.
3. Сколько изомерных алкенов соответствует формуле С4Н8 ?Ответ 1: изомеров нет
Ответ 2: два
Ответ 3: три
Ответ 4: четыре
4. Двойная связь является сочетанием . . .
Ответ 1: двух σ-связей
Ответ 2: двух π-связей
Ответ 3: одной σ-связи и одной π-связи
Ответ 4: ионной связи и ковалентной связи
5. Какова гибридизация атомов углерода в молекуле алкена:
Ответ 1: 1 и 4 – sp2, 2 и 3 – sp3
Ответ 2: 1 и 4 – sp3, 2 и 3 – sp2
Ответ 3: 1 и 4 – sp3, 2 и 3 – sp
Ответ 4: 1 и 4 – не гибридизованы, 2 и 3 – sp2
25.
6. Наиболее характерными реакциями алкенов являются . . .Ответ 1: реакции замещения
Ответ 2: реакции присоединения
Ответ 3: реакции разложения
7. Какой продукт преимущественно образуется при
взаимодействии бромоводорода с 2-метилпропеном?
26.
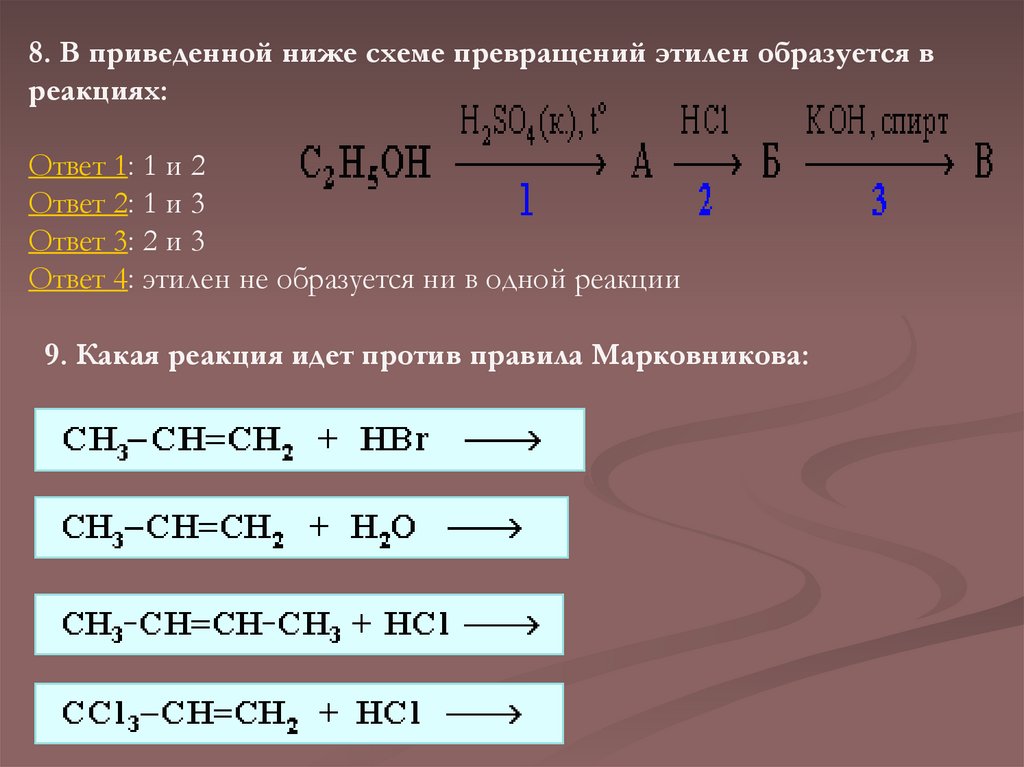
8. В приведенной ниже схеме превращений этилен образуется вреакциях:
Ответ 1: 1 и 2
Ответ 2: 1 и 3
Ответ 3: 2 и 3
Ответ 4: этилен не образуется ни в одной реакции
9. Какая реакция идет против правила Марковникова:
27. Кроссворд АЛКEНЫ для учащихся 10–11 классов
1.Буква греческого алфавита, которойобозначают более прочную связь,
образующуюся при перекрывании атомных
орбиталей вдоль оси, соединяющей центры
атомов.
2. Бесцветный газ, немного легче воздуха, почти
не имеющий запаха, плохо растворим в воде,
простейший алкен. В смеси с кислородом
используется в медицине для общего наркоза
при хирургических операциях.
3. Предельный углеводород – бесцветная
жидкость, нерастворимая в воде.
4. Название химического процесса соединения
одинаковых молекул в более крупные
молекулы с большой молекулярной массой.
5. Термин для обозначения химической связи в
молекуле этилена.
6. Один из переводов греческого слова makros, от
которого произошел термин «макромолекула».
























 Химия
Химия








