Похожие презентации:
Периодическая система химических элементов Д.И. Менделеева
1.
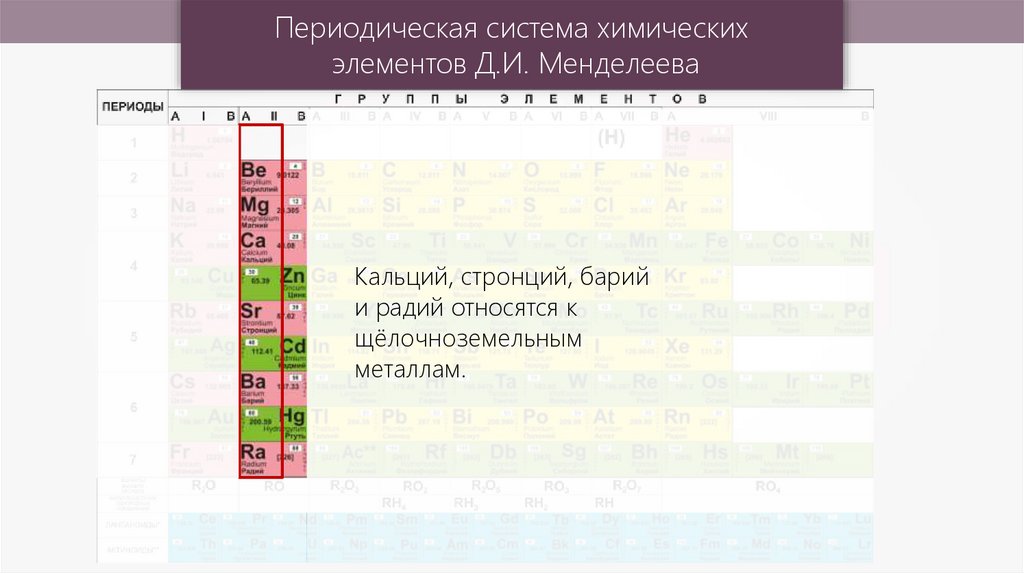
Периодическая система химическихэлементов Д.И. Менделеева
Кальций, стронций, барий
и радий относятся к
щёлочноземельным
металлам.
2.
DePiepPtyx
Chemicalinterest
Бериллий
Магний
3.
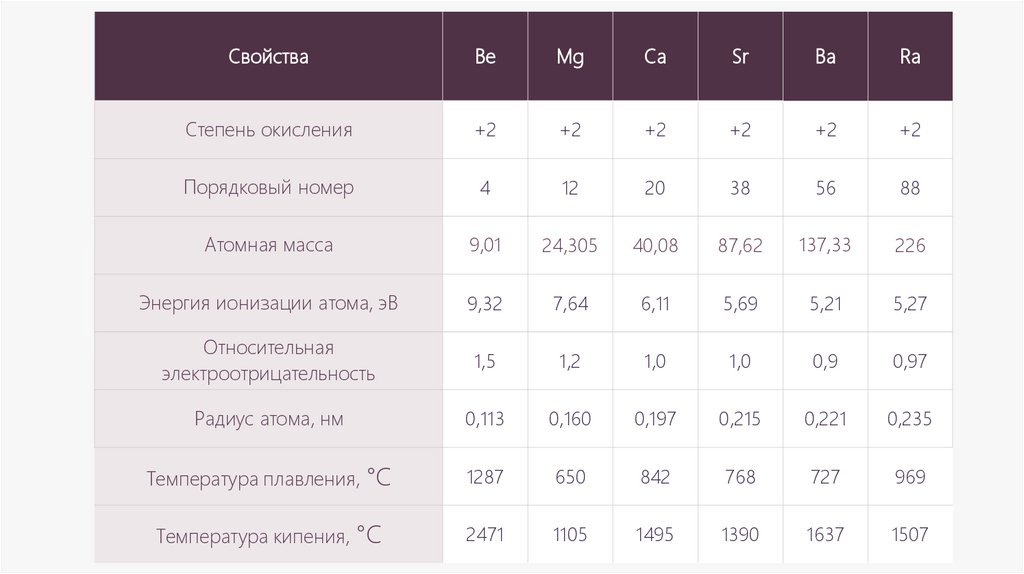
СвойстваBe
Mg
Ca
Sr
Ba
Ra
Степень окисления
+2
+2
+2
+2
+2
+2
Порядковый номер
4
12
20
38
56
88
Атомная масса
9,01
24,305
40,08
87,62
137,33
226
Энергия ионизации атома, эВ
9,32
7,64
6,11
5,69
5,21
5,27
Относительная
электроотрицательность
1,5
1,2
1,0
1,0
0,9
0,97
Радиус атома, нм
0,113
0,160
0,197
0,215
0,221
0,235
Температура плавления, °C
1287
650
842
768
727
969
Температура кипения, °C
2471
1105
1495
1390
1637
1507
4.
PtyxChemicalinterest
Барий
Магний
5.
Alchemist-hpСтронций
Jurii
Кальций
6.
Кальций7.
8.
9.
Химические свойства металловглавной подгруппы II группы
Ca + CI2 = CaCI2
хлорид
При взаимодействии кальция с хлором
образуется хлорид кальция.
10.
Химические свойства металловглавной подгруппы II группы
Сa + S = CaS
сульфид
При взаимодействии кальция с серой
образуется сульфид кальция.
11.
Химические свойства металловглавной подгруппы II группы
3Сa + N2 = Ca3N2
нитрид
При взаимодействии кальция с азотом
образуется нитрид кальция.
12.
Химические свойства металловглавной подгруппы II группы
Сa + 2Н2О = Ca(ОН)2+ Н2
Кальций (Ca), являясь активным металлом,
вытесняет водород из воды.
13.
Химические свойства металловглавной подгруппы II группы
2Сa + О2 = 2CaО
0
0
t
+2 –2
2М + О2 = 2МО
4e–
При нагревании на воздухе кальций
сгорает, образуя оксид кальция.
14.
Химические свойства металловглавной подгруппы II группы
Сa + 2С = CaС2
карбид кальция
При взаимодействии кальций с углеродом
образуется карбид кальция.
15.
Вследствие своей высокой химическойактивности в природе щёлочноземельные
металлы находятся только в форме
соединений.
Оксиды данных металлов твёрдые белые
тугоплавкие вещества, устойчивые к
воздействию высоких температур.
Проявляют основные свойства.
16.
Оксид кальция17.
Оксид кальцияCaO + H2O = Ca(OH)2 + Q
18.
Гашёная известь19.
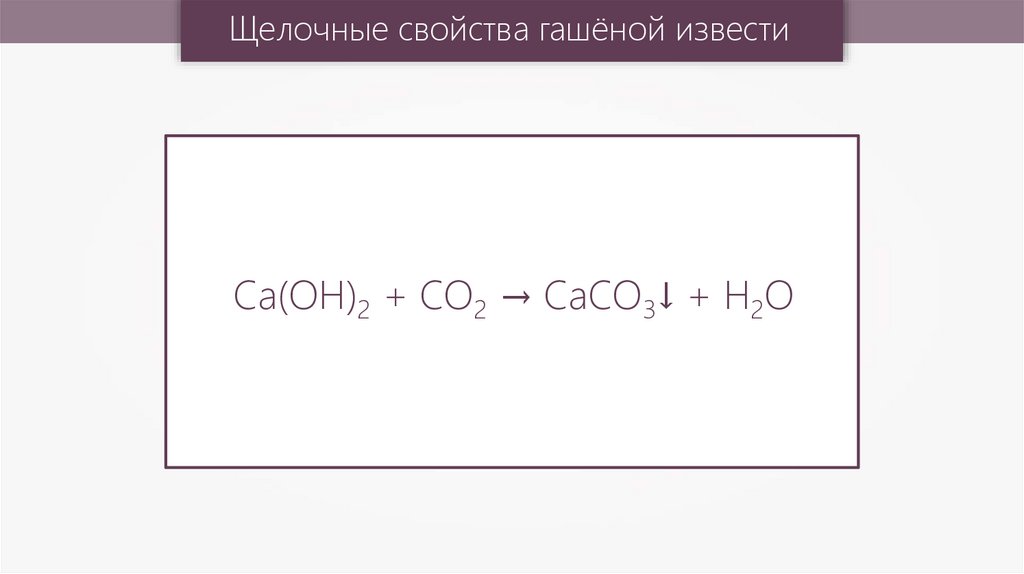
Щелочные свойства гашёной известиCa(OH)2 + CO2 → CaCO3↓ + H2O
20.
CaСO3 + CO2 + H2O → Ca(HCO3)2→
При пропускании через известковую воду
оксида углерода (IV) раствор мутнеет.
21.
Карбонат кальцияCaCO3
22.
23.
24.
25.
Сульфат кальцияCaSO4 ⋅ 2H2О
26.
Жжёный гипс27.
CaSO4 ⋅ 0,5H2О +1,5H2О = CaSO4 ⋅ 2H2ОЕсли алебастр смешать с водой, то он быстро
затвердевает, снова превращается в гипс.
28.
Сульфат кальция широко используютв строительстве для изготовления
скульптур и скульптурных элементов,
для облицовочных и отделочных
работ, в медицине для изготовления
гипсовых повязок.

























 Химия
Химия








