Похожие презентации:
Периодическая система химических элементов Д.И. Менделеева
1.
Периодическая система химическихэлементов Д.И. Менделеева
2.
Фосфор был открыт в 1669 г.немецким алхимиком Г. Брандом,
а своё название получил за способность
светиться в темноте, в переводе с греческого
фосфор означает «светоносный».
Г. Бранд
1630–1710 гг.
3.
Фосфор расположен в III периоде, в 5 группе главной подгруппе «А», подпорядковым номером №15. Относительная атомная масса Ar(P) = 31.
Р +15)2 )8 )5
1S22S22P63S23P3,
фосфор: p– элемент, неметалл
N
P
1s2 2s2 2p3
1s2 2s2 2p6 3s2 3p3
4.
В соединениях фосфор способенпроявлять степень окисления –3
(в соединениях фосфора с металлами
— фосфидах), но чаще всего он
проявляет свою максимальную
положительную степень окисления +5,
реже +3.
5.
Аллотропные модификации фосфораMaterialscientist
6.
Белый фосфорМолекулы P4 имеют форму тетраэдра. Это
легкоплавкое
t(пл)=44,1оС,
t(кип)=275оС,
мягкое, бесцветное воскообразное вещество.
Хорошо растворяется в сероуглероде и ряде
других органических растворителей. Ядовит,
воспламеняется на воздухе, светится в темноте.
Хранят его под слоем воды.
7.
Белый фосфорБелый фосфор очень
ядовит, легко окисляется
на воздухе. Особым его
м является
свойством
способность светиться в
темноте вследствие его
окисления.
8.
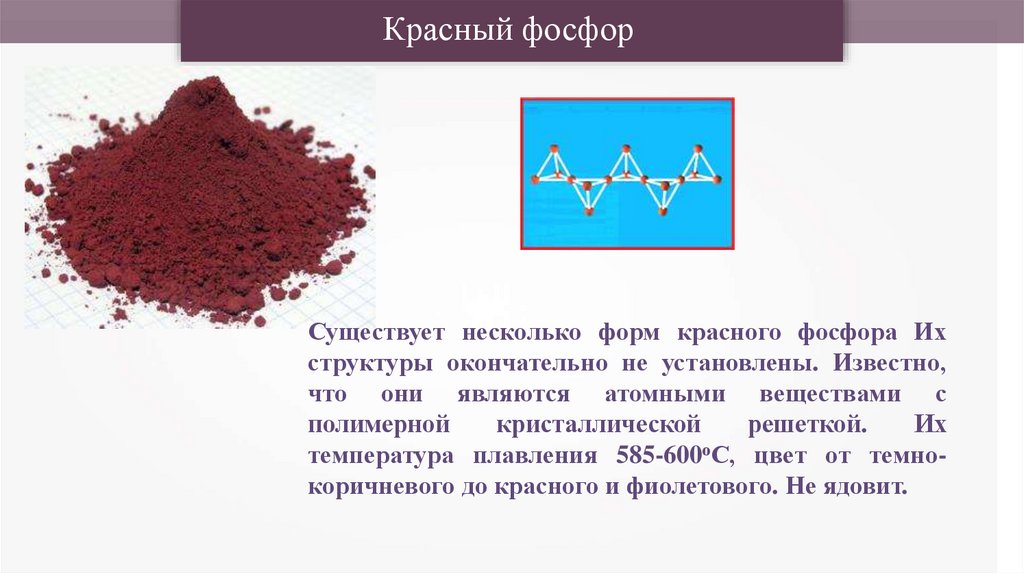
Красный фосфорСуществует несколько форм красного фосфора Их
структуры окончательно не установлены. Известно,
что они являются атомными веществами с
полимерной
кристаллической
решеткой.
Их
температура плавления 585-600оС, цвет от темнокоричневого до красного и фиолетового. Не ядовит.
9.
Красный фосфорПри нагревании красного
фосфора он превращается в
пар, при конденсации
которого образуется белый
фосфор
10.
Чёрный фосфорЧерный фосфор имеет слоистую атомную
кристаллическую решетку. По внешнему
виду похож на графит, но является
полупроводником. Не ядовит
11.
Красный и черный фосфоробладают очень сложной
структурой, поэтому в уравнениях
реакций их формулу записывают
просто Р.
Р
12.
Белый фосфор и красный фосфоробладают схожими химическими
свойствами, однако белый обладает
большей реакционной способностью.
13.
Химические свойства фосфораВосстановительные свойства фосфора
1.Окисление фосфора кислородом
0
0
+5 -2
кислородом
4Р + 5О2 = 2Р2ООкисление
фосфора(V)
5 - оксидфосфора
2Р + 3S = Р2S3 - сульфид фосфора(III)
2. 2Р + 3Са = Са3Р2
При взаимодействии фосфора с металлами образуются
фосфиды
14.
Соединенияфосфора
Соединения фосфора
PH3, Р2О5
Химические свойства Р2О5имические свойства Р2О5
Х1.Взаимодействует с водой с образованием кислоты:
Р2О5 + 3Н2О = 2Н3РО4
2. Взаимодействует с основными оксидами с образованием солей –
фосфатов:
Р2О5 + 3ВаО = Ва3(РО4)2
3. Взаимодействует с основаниями с образованием соли и воды:
Р2О5 + 3Ва(ОН)2 = Ва3(РО4)2 + 3Н2О
имические свойства
15.
Получение фосфина РН3Са3Р2 + 6НСl = 3CaCl2 + 2PH3↑
Фосфин — это очень ядовитый газ,
обладающий неприятным запахом, который
легко воспламеняется на воздухе.
16.
Фосфорная кислота Н3РО4 —твёрдое, прозрачное,
кристаллическое вещество,
которое хорошо растворяется в
воде в любых соотношениях.
17.
Химические свойства ортофосфорной кислоты1. Водный раствор кислоты изменяет окраску индикаторов на красный:
Ортофосфорная кислота диссоциирует ступенчато:
H3PO4 ↔ H+ + H2PO4-(дигидроортофосфат-ион)
H2PO4- ↔ H+ + HPO42-(гидроортофосфат-ион)
HPO42- ↔ H+ + PO43-(ортофосфат-ион)
2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4=соль+Н2↑
3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О
4. Взаимодействует с основаниями Ме(ОН)n: основание + H3PO4 = соль + Н2О
если кислота в избытке, то образуется кислая соль: H3PO4(изб)+ NaOH = NaH2PO4+ H2O или
H3PO4(изб) + 2NaOH =Na2HPO4 + 2H2O
5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота,
образуются кислые соли: H3PO4 + NH3 = NH3H2PO4
H3PO4 + 2NH3 = (NH3)2HPO4
H3PO4 + 3NH3 = (NH3)3PO4
6. Реагирует с солями слабых кислот: 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑
18.
Специфичекие свойства1. При нагревании ортофосфорная кислота постепенно превращается в
метафосфорную кислоту:
2H3PO4 (t˚C) → H2O + H4P2O7
H4P2O7 (t˚C)→ H2O + 2HPO3
2. Качественная реакция на PO43- - фосфат ион.
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот
является реакция с нитратом серебра — образуется жёлтый осадок:
Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3
3. Играет большую роль в жизнедеятельности животных и растений. Её остатки
входят в состав АТФ. При разложении АТФ выделяется большое количество
энергии, что очень важно для живых организмов.
19.
+РО4 + 3Ag = Ag3PO4↓
3-
жёлтый осадок
Качественным реактивом на фосфаты
РО43- является нитрат серебра AgNO3.
20.
Типы солей, которыеобразует фосфорная
кислота
Фосфаты
(Са3(РО4)2,
Na3PO4)
Дигидрофосфаты
(Са(H2РО4)2,
NaH2PO4)
Гидрофосфаты
(СаHРО4,
Na2HPO4)
21.
ФосфорФосфорввприроде
природе
Фосфориты
Апатиты
22.
В промышленности фосфорполучают из наиболее часто
встречающегося фосфата
кальция Ca3(PO4)2.
23.
Фосфор присутствует в живых клеткахв виде орто- и пирофосфорной кислот,
входит в состав нуклеотидов,
нуклеиновых кислот, фосфопротеидов,
фосфолипидов, коферментов,
ферментов. Кости человека состоят из
гидроксилапатита 3Са3(РО4)3·CaF2. В
состав зубной эмали входит
фторапатит. Основную роль в
превращениях соединений фосфора в
организме человека и животных
играет печень. Обмен фосфорных
соединений регулируется гормонами и
витамином D. Суточная потребность
человека в фосфоре 800-1500 мг. При
недостатке фосфора в организме
развиваются различные заболевания
костей.
24.
25.
Схема круговорота фосфора в природеP
P
P
P
P
P
P
P
P
P
P
26.
Применение фосфораСпички
Фосфорная кислота

























 Химия
Химия








