Похожие презентации:
Кинетическая теория идеальных газов
1. Молекулярная физика и термодинамика
2.
• М.П. Сарина. Механика, молекулярнаяфизика и термодинамика. Молекулярная
физика и термодинамика
3. Кинетическая теория идеальных газов
• Изучаются системы, состоящие избольшого числа частиц
• Законы поведения большого числа частиц
изучаются статистическим методом
• Описываются средними значениями величин
( средняя скорость, средняя энергия……)
4. Идеальный газ
• Молекулы идеального газа –материальныеточки
Отсутствуют силы взаимодействия
между молекулами
Размерами молекул пренебрегаем
Молекулы движутся хаотично
Между столкновениями движение
равномерное и прямолинейное
5.
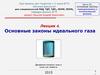
• Рассмотрим столкновение молекулы состенками сосуда
P P2 P1
P1
P2
P P2 P1
2P1 2mV
m- масса молекулы
V- скорость молекулы
6.
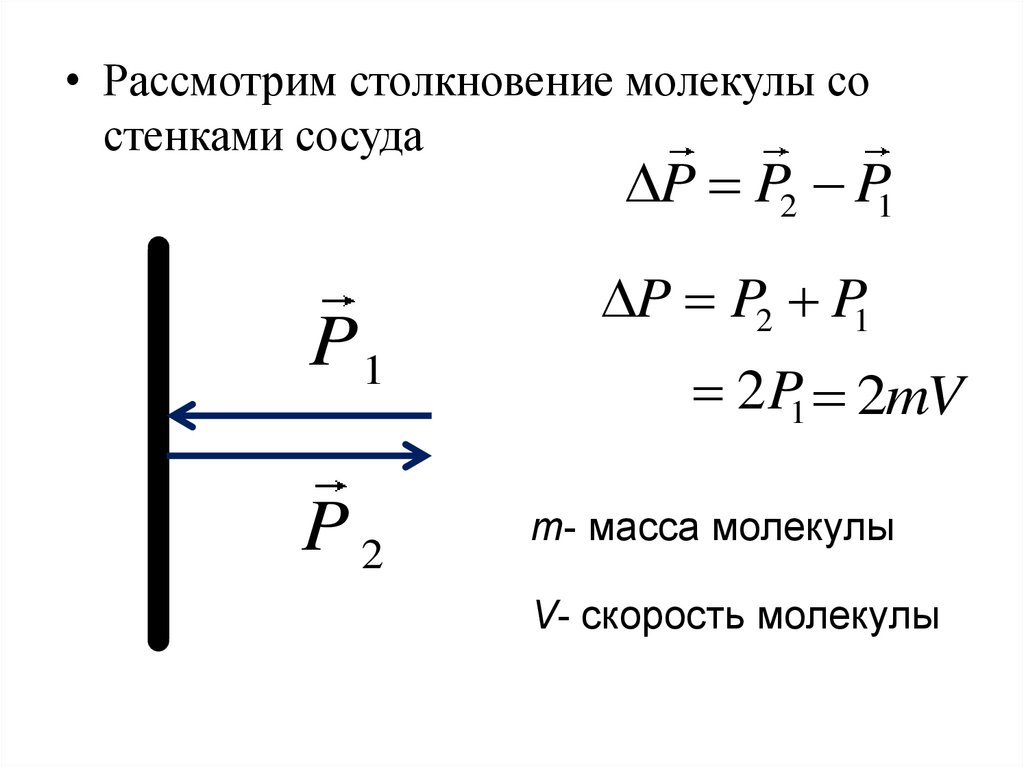
• ДавлениеF
S
P
2mV
F
t
t
7.
• Вычислим импульс силы, передаваемыйвсеми молекулами стенке сосуда
Vx Δt
Y
S
Х
Z
Vx Δt
• За время Δt к стенке подойдут только те
молекулы, которые находятся на расстоянии
Vx Δt
8.
• Вычислим количество молекул (N), которыеударятся о стенку за время Δt
• Концентрация (n) – количество молекул в
единице объема
N 12 n Vx t S
• ½ появляется из-за того, что только
половина молекул движется по
направлению к стенке
9.
• Каждая молекула передает стенке импульсP 2mVx
• Все молекулы передают импульс
P N 2mVx N
2mVx 12 n Vx t S
mVx n t S
2
10.
• Давление, оказываемое на стенку2
F
mVx n t S
2
m n Vx
S
t S
V V V V
2
2
x
2
y
V V V
2
x
2
y
2
z
1
m n V 2
3
2
z
Vx V
2
1
3
2
11.
• Если в газе содержится N молекул,движущихся со скоростями V1, V2,V3…, то
рассматривается средняя квадратичная
скорость
Vкв
N
1
2
Vi
N i 1
12.
• Основное уравнение молекулярнокинетической теории1
2
m n Vкв
3
1Н
Па 2
1м
13.
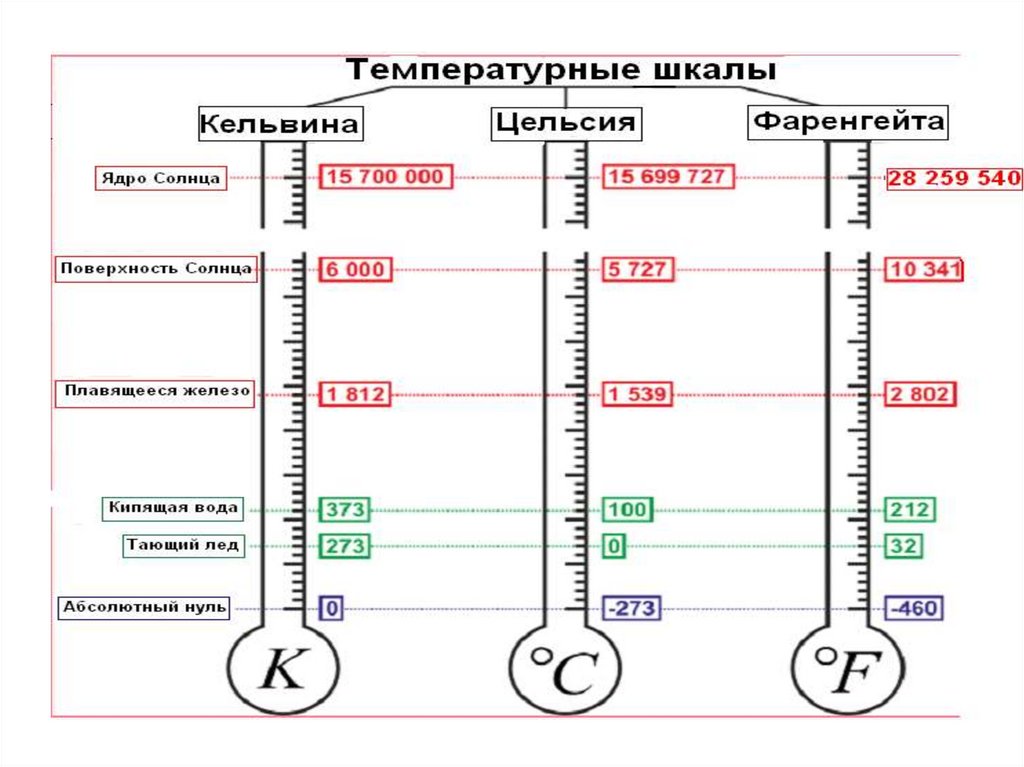
14. ТЕМПЕРАТУРА
• Температура – величина, характеризующаятепловое равновесие
• Особенности
• 1) температура не аддитивна
• 2) температурную шкалу можно выбирать
произвольно
15.
• Выбирают 2 реперные точки (температуракипения воды и таяния льда) и делят этот
интервал на 100 частей
• С помощью газового термометра измеряют
давление
~Т
кип
Т кип
таян
Т таян
кип
1, 3661
таян
16. Шкала Кельвина
Tкип1,3661
Tтаян
Tкип Tтаян 100
Tкип 373,15
Tтаян 273,15
Шкала Кельвина
t (C ) T ( K ) 273,15
Шкала Цельсия
17.
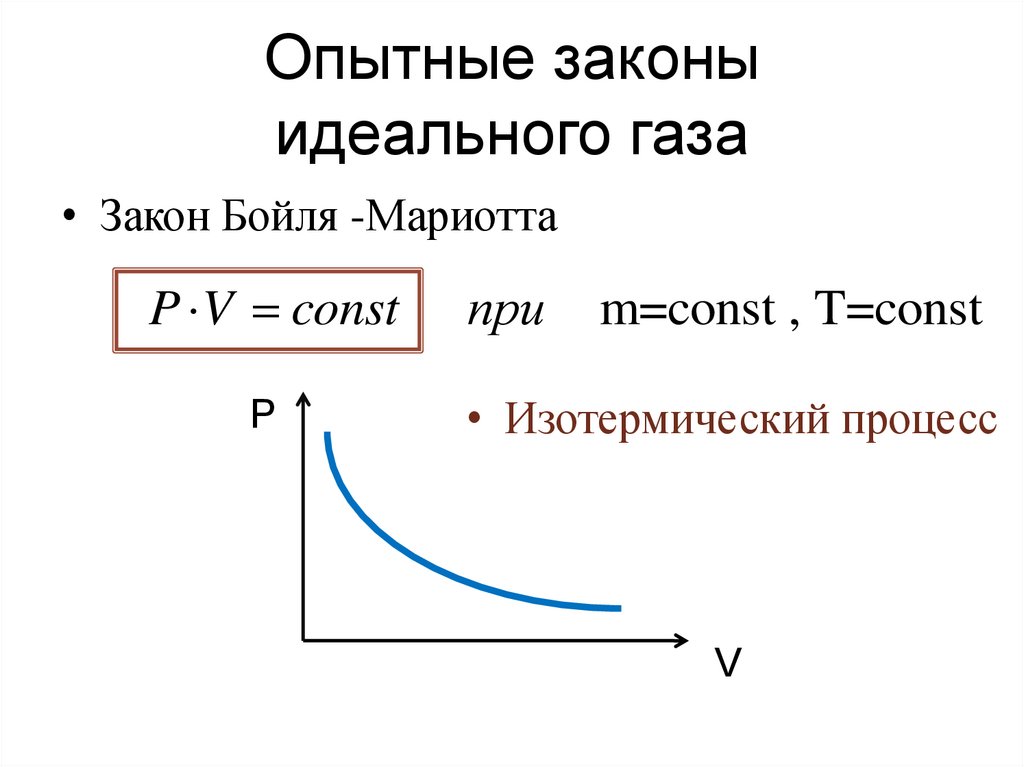
18. Опытные законы идеального газа
• Закон Бойля -МариоттаP V const
P
при
m=const , T=const
• Изотермический процесс
V
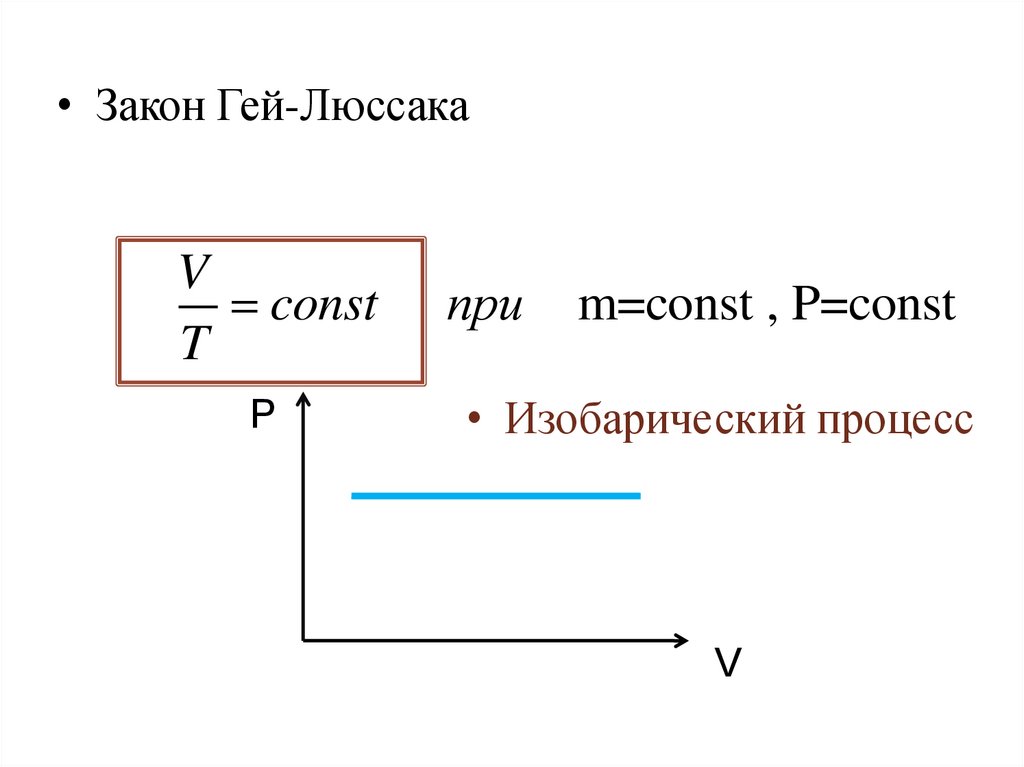
19.
• Закон Гей-ЛюссакаV
const
T
P
при
m=const , P=const
• Изобарический процесс
V
20.
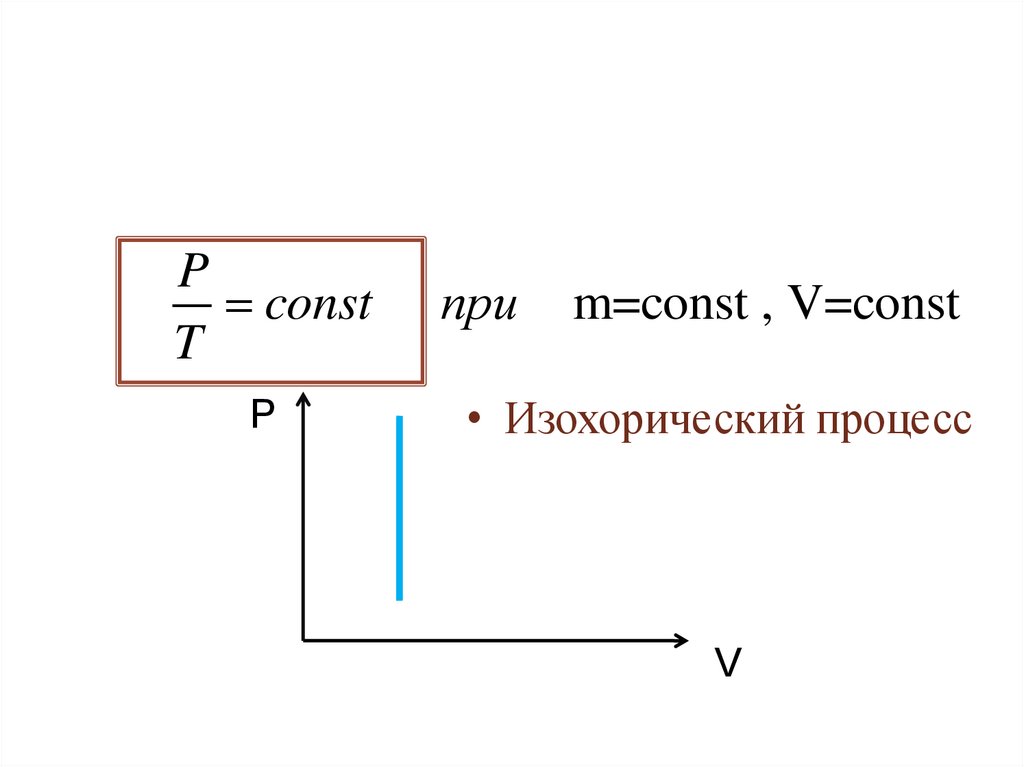
Pconst
T
P
при
m=const , V=const
• Изохорический процесс
V
21. Закон Авогадро
• При одинаковом давлении и температуре вравных объемах газов содержится
одинаковое количество молекул
• В 1 моле вещества содержится
23
• N A 6, 022 10 молекул
22. Закон Дальтона
• Давление смеси газов равно суммепарциальных давлений
P P1 P2 P3 ...
• Парциальное давление – давление , которое
производил бы газ, если бы он один
занимал весь объем
23. Уравнение Клапейрона –Менделеева (уравнение состояния идеального газа)
Уравнение Клапейрона –Менделеева (уравнение
состояния идеального газа)
P V
m
RT
• m- масса газа
• µ- молярная масса
• R= 8,31 Дж/(моль·К) - универсальная
газовая постоянная
24.
• Для 1 моляP V RT
R N Ak
• k- постоянная Больцмана
k 1,38 10
P V
m
23
N A kT
P V NkT
Дж / К
N
m
NA
• N- количество молекул
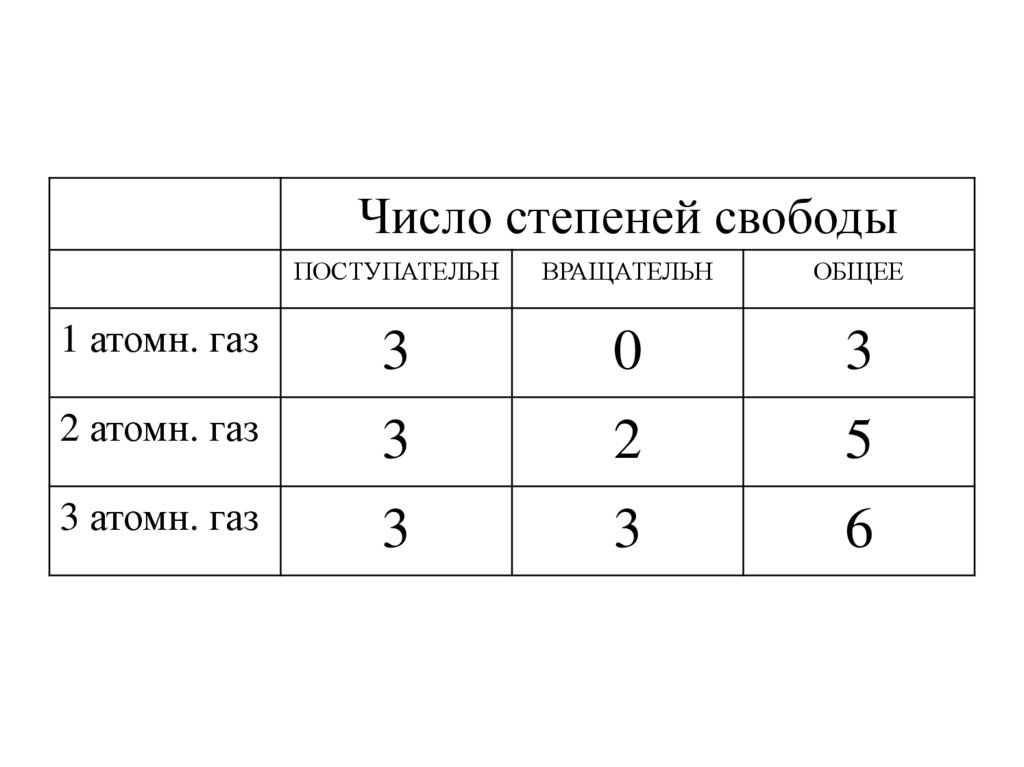
25. Число степеней свободы
• Число степеней свободы- количествонезависимых переменных, полностью
определяющих положение системы в
пространстве
26.
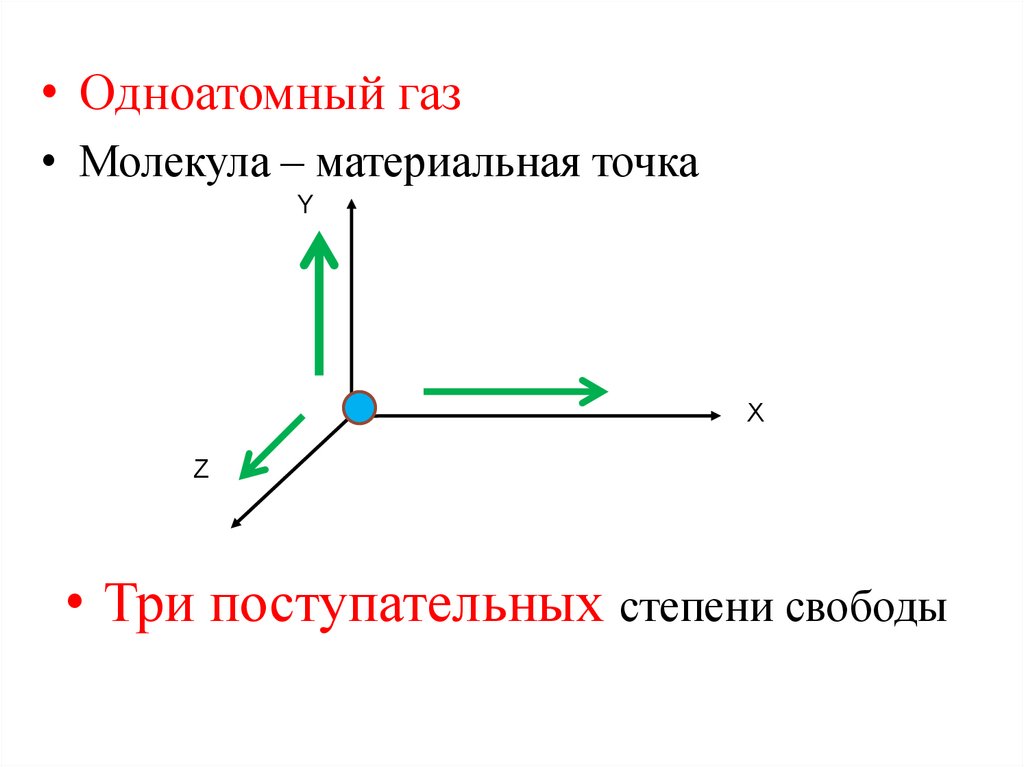
• Одноатомный газ• Молекула – материальная точка
Y
Х
Z
• Три поступательных степени свободы
27.
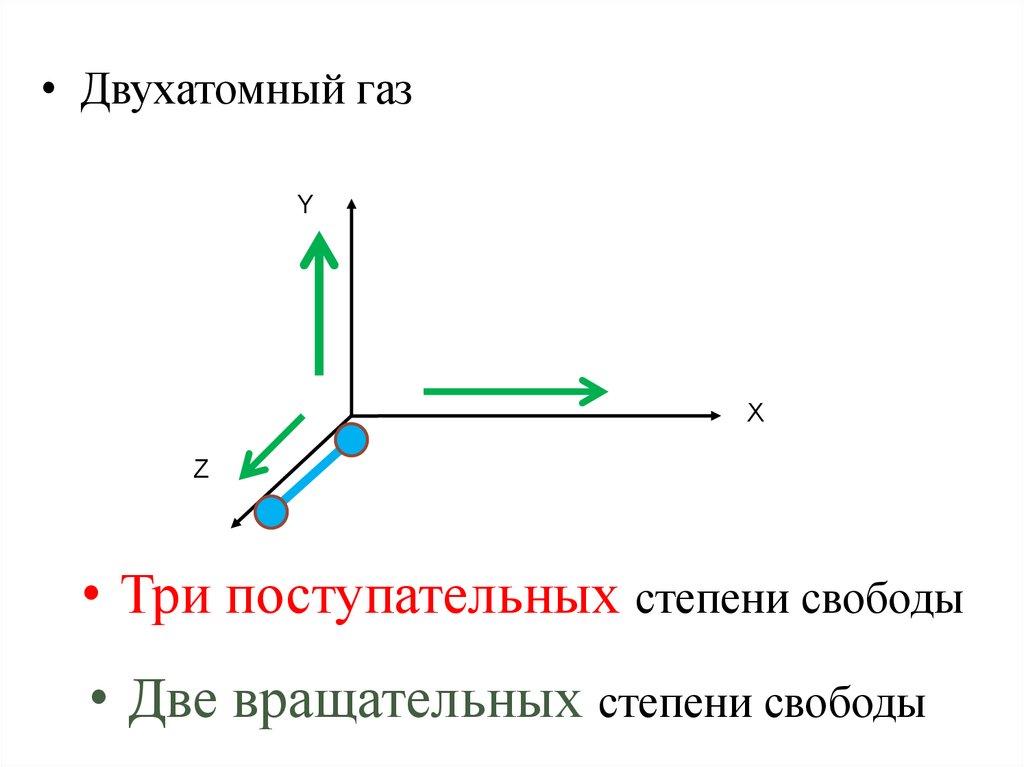
• Двухатомный газY
Х
Z
• Три поступательных степени свободы
• Две вращательных степени свободы
28.
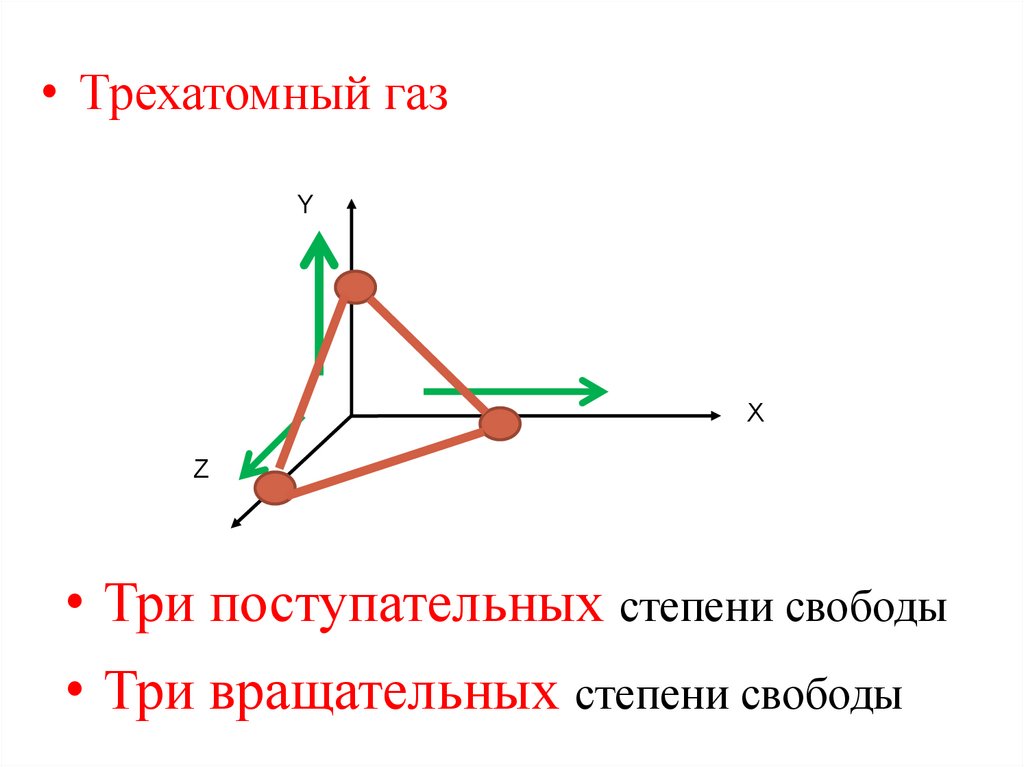
• Трехатомный газY
Х
Z
• Три поступательных степени свободы
• Три вращательных степени свободы
29.
• Для реальных молекул необходимоучитывать колебательные степени свободы
30.
Число степеней свободыПОСТУПАТЕЛЬН
ВРАЩАТЕЛЬН
ОБЩЕЕ
1 атомн. газ
3
0
3
2 атомн. газ
3
2
5
3 атомн. газ
3
3
6
31. Закон равномерного распределения энергии по степеням свободы
• Для системы, находящейся в тепловомравновесии на каждую поступательную
и вращательную степень свободы
приходится энергия kT/2, а на каждую
колебательную степень свободы –
энергия kT
32.
ikT
2
i iпост iвращ 2iколеб
<ε> - средняя энергия молекулы
i
- число степеней свободы




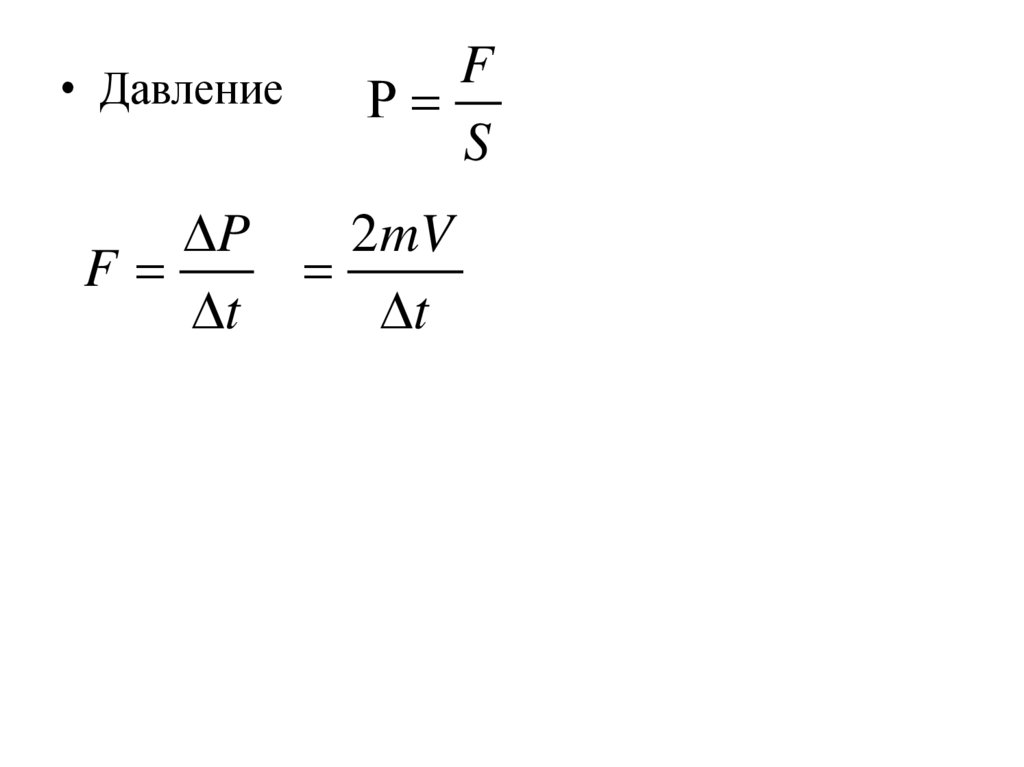
















 Физика
Физика