Похожие презентации:
Молекулярно-кинетическая теория идеальных газов
1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХ ГАЗОВ (мкт) 1. Введение
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ИДЕАЛЬНЫХГАЗОВ (
мкт)
1. Введение
В этом разделе физики изучаются макроскопические свойства систем(тел),
состоящих из очень большого числа частиц.
Примером такой системы является любое тело, состоящее из молекул.
Методы механики для описания этих систем не годятся, а применяются два
качественно различных метода – статистический и термодинамический.
2.
1.1 Статистический и термодинамический методыисследования.
Статистический метод используется в молекулярной физике. На основе
рассмотрения движения отдельных частиц он позволяет получить средние
характеристики движения частиц -и перейти к
макроскопическим свойствам системы – например, р и Т.
Поведение каждой частицы внутри системы
описывается физическими величинами,
которые называются микроскопическими
параметрами.
Примерами таких параметров являются
масса, значения координат и импульсов
частиц.
3. Макроскопическим параметром называется физическая величина, характеризующая какое-либо свойство системы частиц как целого ,
например, температура, давление, объем газа.Поскольку макроскопические параметры определяют усредненную
картину движения частиц, то они имеют смысл средних значений
физических величин.
Примеры связи макропараметра системы и среднего значения,
характеризующего микрочастицу:
Плотность вещества : m0 n , где m 0 - масса одной частицы;
n - их среднее число в единице объема.
Давление газа определяется средним импульсом его частиц .
Температура газа определяется средней кинетической энергией
поступательного движения одной частицы:
m0 2
3
к kT
2
2
4. Пример : Как можно получить среднее значение микропараметра. Пусть N раз измеряли скорость молекул газа:
Если значения распределены непрерывно, то суммирование заменяетсяинтегрированием по всей области изменения скорости:
(1а) где dN -- число молекул, скорости которых лежат в
интервале (v, v+dv).
По аналогии
5. Термодинамический метод исследования не рассматривает внутреннее строение вещества и характер движения отдельных частиц.
Термодинамика :-- изучает различные превращения энергии, происходящие с системой
как с целым;
-- предсказывает наиболее вероятное протекание процессов, в которых
система участвует;
-- в отличие от статистического метода, не вскрывает микроскопический
механизм явлений, а лишь устанавливает связь между
макроскопическими свойствами вещества.
Метод основан на установленных опытным путем законах (трех началах
термодинамики).
Молекулярная физика и термодинамика взаимно дополняют друг друга
, изучая макросистемы с различных позиций, поэтому далее
рассматриваем оба метода.
6. 1.2 Состояние системы. Процесс.
Макросостояние системы задается набором значений макропараметров(для газов это P,V,T).
Микросостояние системы задается состояниями всех ее частиц; для газа
это координаты и импульсы всех его молекул r1, p1, r2 , p2 .... rn , pn .
Очевидно, что одному макросостоянию соответствует большое число
микросостояний.
Состояние равновесно, если все макроскопические параметры постоянны
для всей системы (например, P и T одинаковы по всему объему газа.)
Для наглядности равновесные состояния изображают на координатной
плоскости точкой, где по осям координат откладывают значения каких-либо
двух параметров данного состояния (например, точка А на рис. 1) .
В неравновесном состоянии система обычно не
имеет определенных значений макропараметров: в
разных точках системы они могут быть разными.
рис. 1
7. Переход системы из одного макроскопического состояния в другое называется процессом, что обязательно связано с нарушением
равновесия, при этомсистема должна проходить ряд последовательных неравновесных состояний.
Пример: процесс сжатия газа, находящегося под поршнем в закрытом сосуде.
Быстрое движение поршня: под поршнем образуется
газовая подушка, где давление больше, чем в остальном
объеме.
Медленное движение поршня: давление приблизительно
одинаково во всем объеме.
В последнем случае можно считать, что в каждый момент
времени для каждого положения поршня газ будет
находиться в соответствующем равновесном состоянии, а
весь процесс сжатия равновесным.
Реально любой процесс, связанный с нарушением равновесного состояния,
является неравновесным. Равновесный - это идеализированный
бесконечно медленный процесс.
Равновесный процесс состоит из непрерывного ряда равновесных
состояний системы. Он может быть изображен графически (см., например,
кривую 1-А-2 на рис.1).
8. Равновесный процесс всегда обратим, т.е. может проходить в обратном направлении через те же состояния, что и в прямом
направлении (кривая 2А1) ,причем в конечной точке состояния системы и
окружающей среды станут прежними.
Круговым (циклическим) называется процесс, при
котором после каких-либо макроскопических
изменений система переходит в исходное состояние.
Часто макроскопические системы участвуют в процессах, при которых
один из макроскопических параметров системы остается постоянным.
Такие процессы называются изопроцессами.
Примерами изопроцессов являются: изотермический ( T const ),
изобарный ( p const ), изохорный ( V const ).
9. 2. Элементы молекулярно-кинетической теории
2.1 Идеальный газ. Уравнение состояния.Основная физическая модель, с которой работает МКТ – идеальный газ.
Идеальным газом называется система частиц, собственными размерами
которых по сравнению со средним расстоянием между ними можно
пренебречь и взаимодействие между которыми сводится к упругим
столкновениям. Макропараметры системы не являются независимыми.
Математическая связь между равновесными значениями параметров
называется уравнением состояния.
На основе опытных данных было получено уравнение состояния,
называемое уравнением Менделеева – Клапейрона:
(1)
где m – масса газа, R-- универсальная газовая постоянная,
масса газа.
-- молярная
10. В молекулярной физике естественно при измерении количества вещества исходить из массы одной молекулы -- .
В молекулярной физике естественно при измерении количествавещества исходить из массы одной молекулы -.
11. Уравнение Менделеева – Клапейрона (1) для 1-го моля газа: PV=RT. Универсальная газовая постоянная
постоянная Больцмана.Запишем выражение (1) через концентрацию молекул:
(2) – другой вид уравнения состояния
идеального газа.
12.
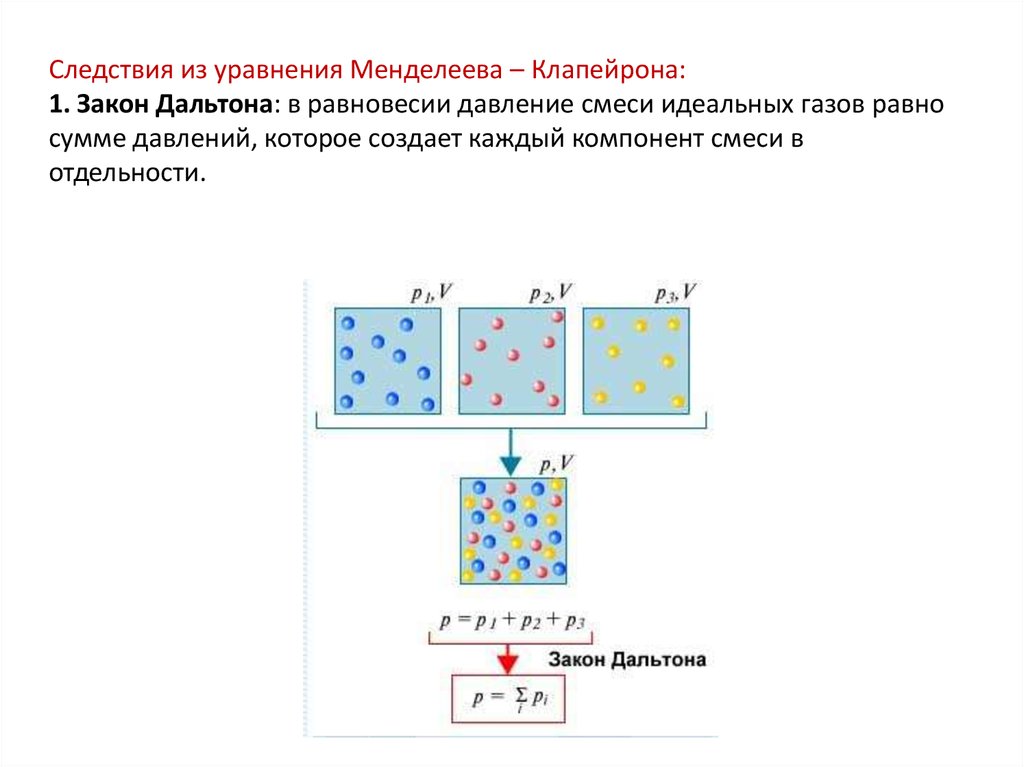
Следствия из уравнения Менделеева – Клапейрона:1. Закон Дальтона: в равновесии давление смеси идеальных газов равно
сумме давлений, которое создает каждый компонент смеси в
отдельности.
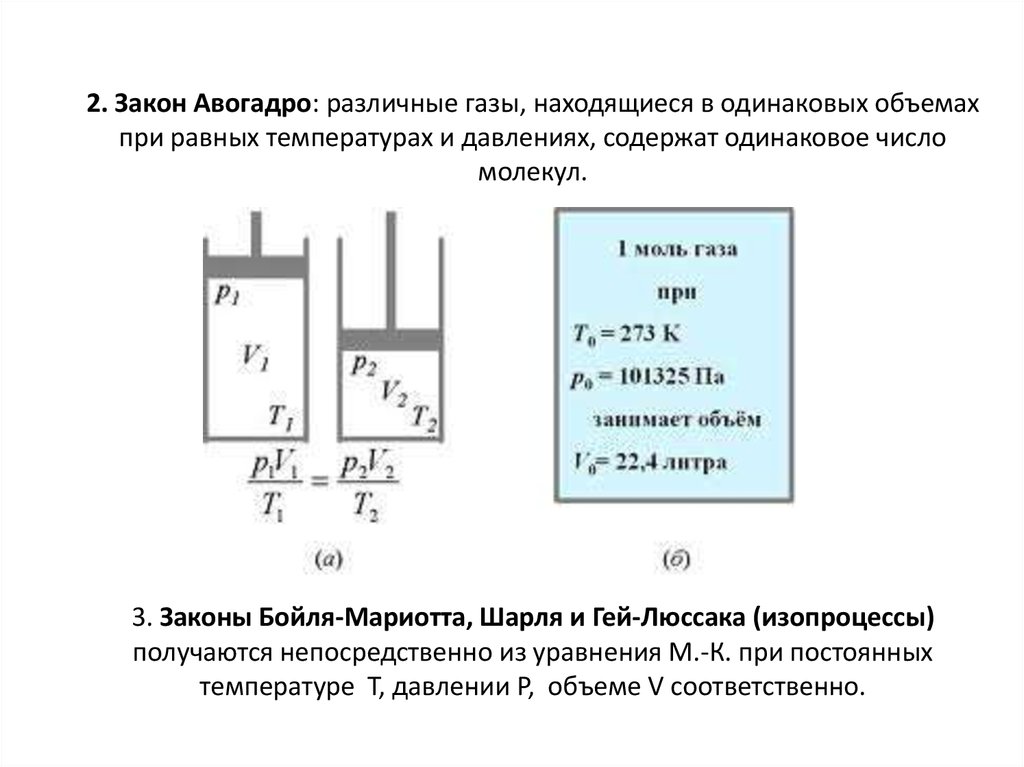
13. 2. Закон Авогадро: различные газы, находящиеся в одинаковых объемах при равных температурах и давлениях, содержат одинаковое
числомолекул.
3. Законы Бойля-Мариотта, Шарля и Гей-Люссака (изопроцессы)
получаются непосредственно из уравнения М.-К. при постоянных
температуре T, давлении P, объеме V соответственно.
14.
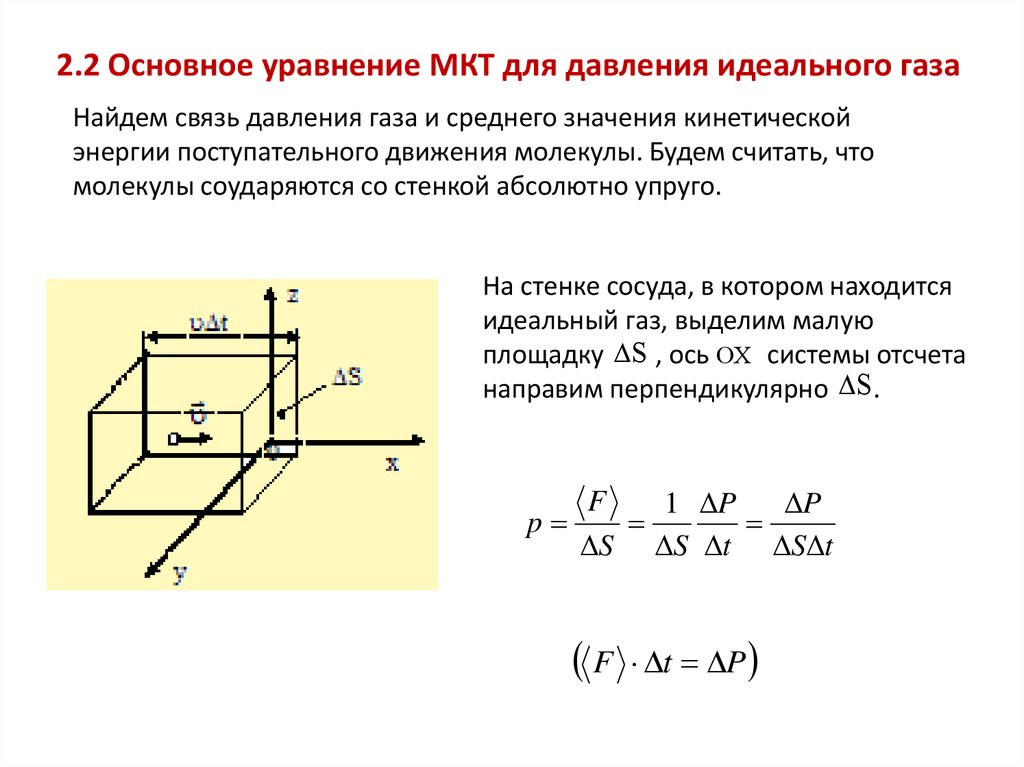
2.2 Основное уравнение МКТ для давления идеального газаНайдем связь давления газа и среднего значения кинетической
энергии поступательного движения молекулы. Будем считать, что
молекулы соударяются со стенкой абсолютно упруго.
На стенке сосуда, в котором находится
идеальный газ, выделим малую
площадку S , ось OX системы отсчета
направим перпендикулярно S .
F
1 P
P
p
S S t S t
F
t P
15.
F1 P
P
p
S S t S t
F
t P
Рассмотрим частицы, величина скорости которых
заключена в интервале от до d , и пусть число их в
единице объема равно dn . Будем считать, что все
частицы движутся только вдоль трех взаимно
перпендикулярных направлений. Следовательно, вдоль
оси OX к площадке S будет двигаться 1/6 всех частиц. Со
стороны одной молекулы, движущейся вдоль оси со
скоростью , стенка получает импульс
P 2m0 .
За промежуток времени t о площадку ударятся все частицы, находящиеся
в объеме
в интервале скоростей (v,v+dv) , поэтому площадка
получит импульс
1
P dn S t 2m0 .
6
16.
11
P dn S t 2m0 . S tm0 2 dn
3
6
Импульс, полученный площадкой в ед. времени от всех молекул, скорости
которых лежат в интервале
max
P
P d
0
p
P
S t
Т.к. 2
Или:
1 1
p
m 0 n S t
S t 3
1
n
max
2
dn , то
0
max
0
dn
n
2
1
2 m0 2
2
p m0 n n
,
3
3
2
(3) – это основное уравнение МКТ для
давления идеального газа.
Рассмотрение более сложной модели, учитывающей всевозможные
направления подлета частиц к стенке, дают такой же результат для
уравнения состояния.
17. 2.3 Закон равномерного распределения энергии молекул по степеням свободы
(1)Запишем систему уравнений:
(2)
Приравняв правые части
(1) и (2), получим:
Среднее значение 2
, или
.
(4)
2 2x 2y 2z 2x 2y 2z ,
равно
а поскольку тепловое движение в равновесии носит полностью
хаотический характер, то 2 2 2 .
x
Следовательно,
2x 2y 2z
y
z
2 3 2x 3 2y 3 2z . Сравнение с (4) дает
kT т.е. в среднем на каждое из трех направлений по
,
m 0 осям координат теплового движения приходятся
равные кинетические энергии:
m 0 2y
m 0 2x
m 0 2z
1
kT. (5)
2
2
2
2
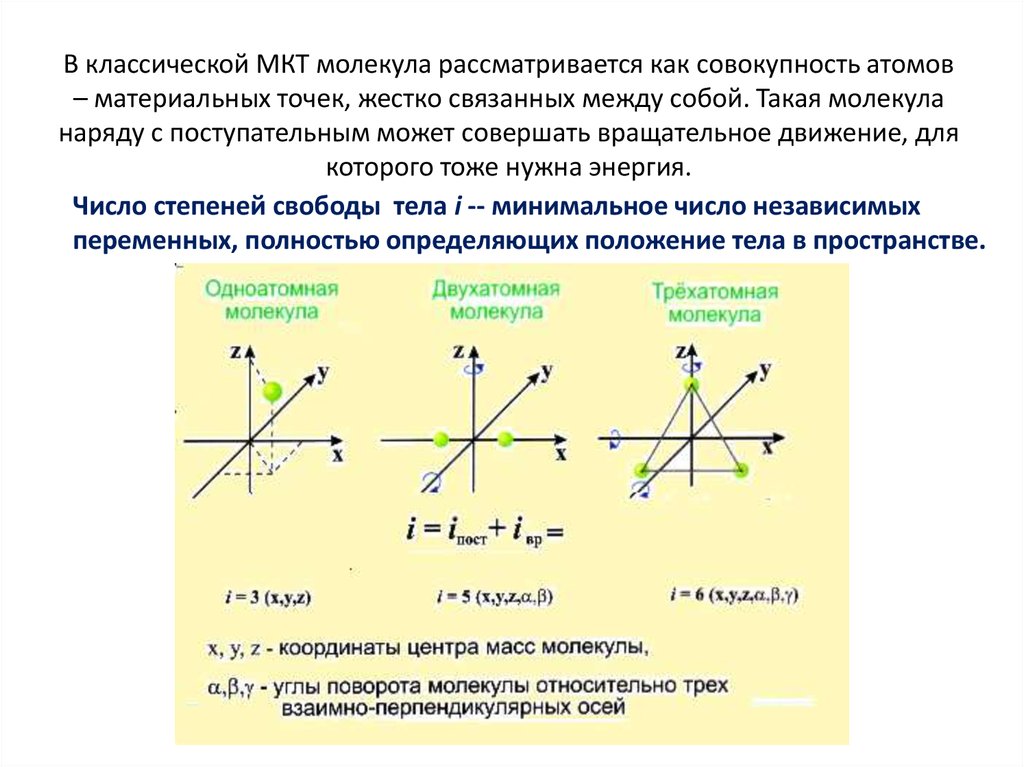
18. В классической МКТ молекула рассматривается как совокупность атомов – материальных точек, жестко связанных между собой. Такая
молекуланаряду с поступательным может совершать вращательное движение, для
которого тоже нужна энергия.
Число степеней свободы тела i -- минимальное число независимых
переменных, полностью определяющих положение тела в пространстве.
19. В статической физике доказывается положение о равномерном распределении энергии по степеням свободы молекулы. На каждую степень
свободы одной молекулы при ее тепловомдвижении приходится в среднем одна и та же энергия, равная
1
1
kT
2
Это положение называется законом равнораспределения энергии по степеням
свободы молекул.
Среднее значение полной энергии теплового движения одной молекулы в
МКТ:
i
i 1
2
kT.
В действительности атомы внутри молекулы могут совершать колебательное
движение относительно друг друга под действием каких-либо «упругих» связей.
Колебательное движение требует вдвое больше энергии, чем поступательное или
вращательное. Для него необходимо наличие кинетической и потенциальной
энергии, причем их средние значения одинаковы. С учетом того, что на
колебательную степень свободы приходится вдвое больше энергии, полное число
степеней свободы реальной молекулы
i iпост iвращ 2iколеб
20. 3. Статистические законы распределения в МКТ.
Статистические законы принципиально отличаются от законов классическоймеханики. Так, закон сохранения импульса в последней на 100% гарантирует
сохранение импульса в замкнутой системе.
Статистический закон выражает наиболее вероятную ситуацию, но не
исключает возможности появления ситуации менее вероятной (флуктуации).
Статистические законы справедливы только для коллективов, состоящих из
большого числа частиц.
3.1 Элементы теории вероятностей
1. Событием называется любое явление, которое в данных условиях
может произойти или не произойти. Событием является и значение какойлибо физической величины, полученное при измерениях.
Если при данном испытании событие обязательно произойдет, то оно
называется достоверным.
Если же событие произойти не может, то оно называется невозможным.
Случайным называется событие, которое при данном испытании
может или произойти, или не произойти
21. 2. Вероятностью случайного события, дающего результат со значением рi , называется отношение числа испытаний Ni , дающих этот
Пусть N раз измеряли величину x, причем значение величины x1 повторялосьN1 раз, ……, значение xk -- Nk раз.
2. Вероятностью случайного события, дающего результат со значением рi
, называется отношение числа испытаний Ni , дающих этот результат, к
общему числу испытаний N, при большом числе испытаний:
Для достоверного события
р=1,
для невозможного
р=0.
3. Условие нормировки: при испытаниях сумма вероятностей всех
возможных событий =1
4. Вероятность одновременного появления двух статистически
независимых событий.
, где
-- вероятность 1 – го,
-- вероятность 2 – го событий.
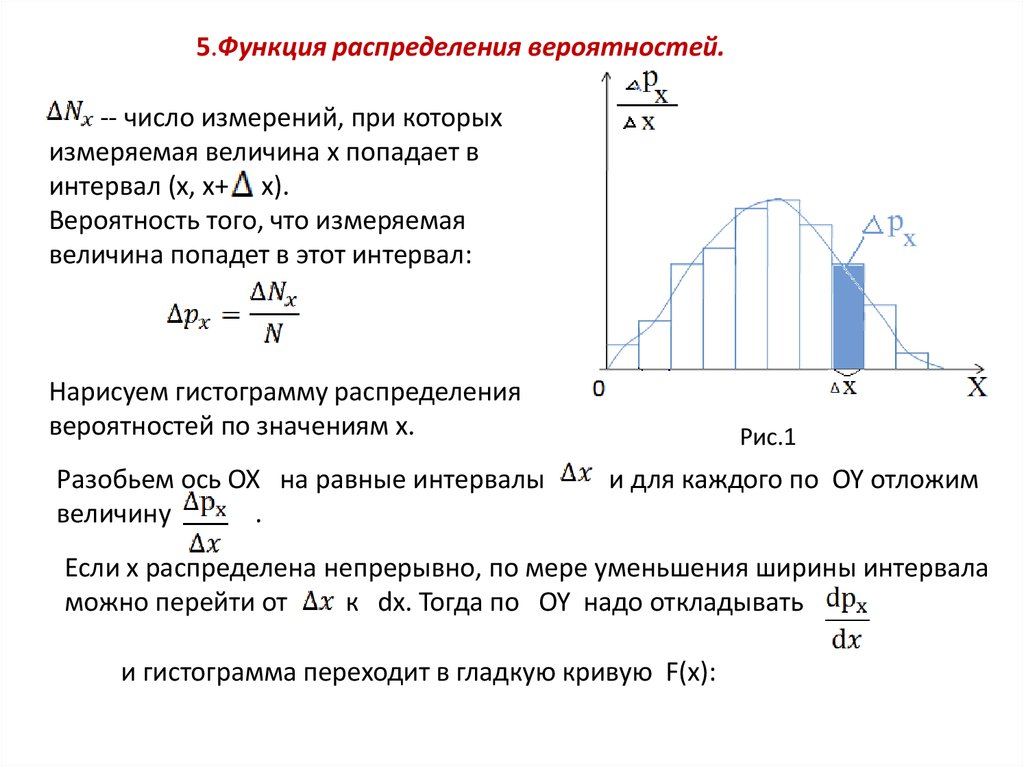
22. 5.Функция распределения вероятностей.
-- число измерений, при которыхизмеряемая величина x попадает в
интервал (x, x+ x).
Вероятность того, что измеряемая
величина попадет в этот интервал:
Нарисуем гистограмму распределения
вероятностей по значениям x.
Разобьем ось OX на равные интервалы
величину
.
Рис.1
и для каждого по OY отложим
Если x распределена непрерывно, по мере уменьшения ширины интервала
можно перейти от
к dx. Тогда по OY надо откладывать
и гистограмма переходит в гладкую кривую F(x):
23.
(*)Отсюда
)
-- функция распределения вероятностей
появления величины x.
Она численно равна относительному числу измерений, которые
попадают в единичный интервал (x, x+dx).
6.Величина
имеет смысл плотности вероятности –это
вероятность появления измеряемой величины в единичном интервале
(x, x+dx).
7. Из
следует условие нормировки
функции распределения вероятностей:
Из него следует, что площадь под кривой распределения равна единице.
24. 8. Согласно , среднее значение непрерывно распределенной величины
Теперь ее можно выразить через функцию распределения вероятностей:при этом интегрирование ведется по всей области изменения величины x.
25.
Нормальное распределение, также называемое гауссовымраспределением или распределением Гаусса — распределение вероятностей,
которое играет важнейшую роль во многих областях знаний, особенно в физике.
Физическая величина подчиняется нормальному распределению, когда она
подвержена влиянию огромного числа случайных помех.
Нормальное распределение часто встречается в природе, нормально
распределёнными являются следующие случайные величины:
отклонение при стрельбе
ошибки при измерениях
рост человека
Нормальное распределение дает хорошую модель для реальных явлений, в
которых:
1) имеется сильная тенденция данных группироваться вокруг центра;
2) положительные и отрицательные отклонения от центра равновероятны;
3) частота отклонений быстро падает, когда отклонения от центра становятся
большими.
26.
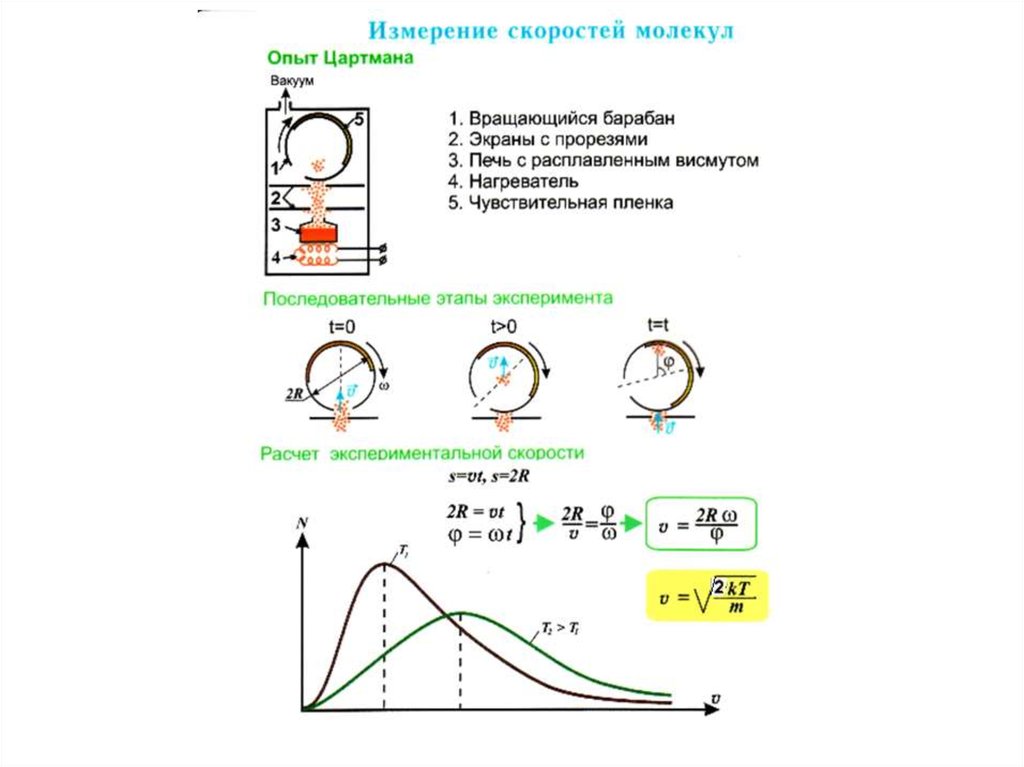
При приеме в аспирантуру на экзамене часто ставились неразрешимыезадачи.
Д.Г.Стокс (1819-1903) поставил задачу Максвеллу о распределении молекул в
газе по скоростям.
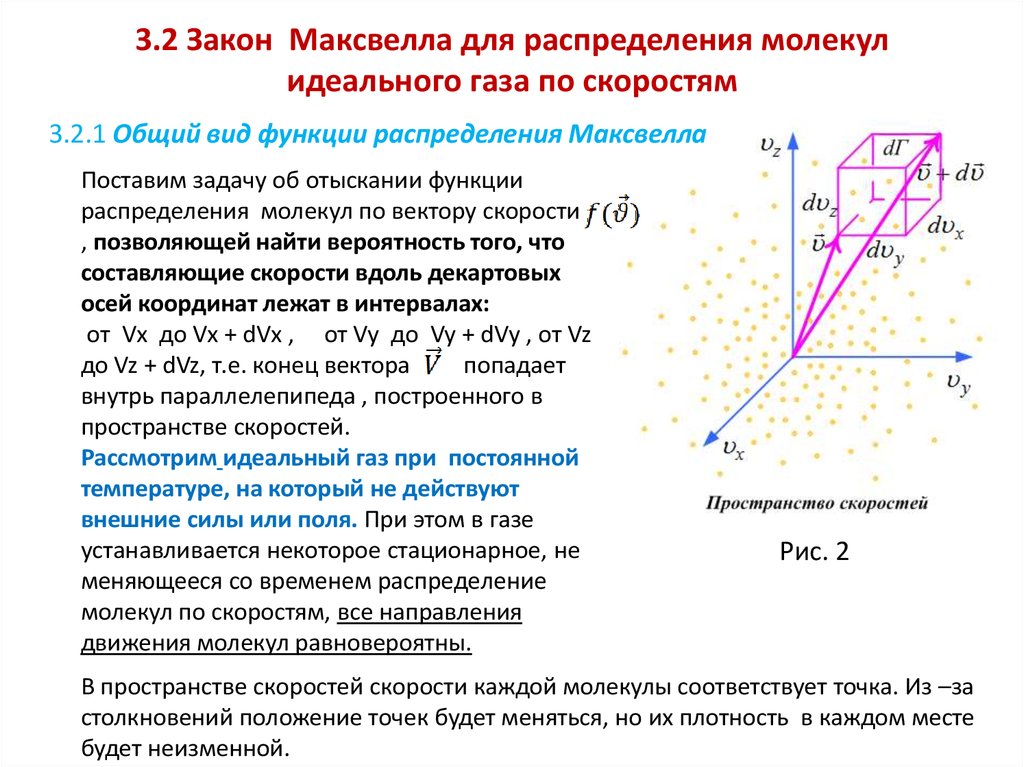
27. 3.2 Закон Максвелла для распределения молекул идеального газа по скоростям
3.2.1 Общий вид функции распределения МаксвеллаПоставим задачу об отыскании функции
распределения молекул по вектору скорости
, позволяющей найти вероятность того, что
составляющие скорости вдоль декартовых
осей координат лежат в интервалах:
от Vx до Vx + dVx , от Vy до Vy + dVy , от Vz
до Vz + dVz, т.е. конец вектора
попадает
внутрь параллелепипеда , построенного в
пространстве скоростей.
Рассмотрим идеальный газ при постоянной
температуре, на который не действуют
внешние силы или поля. При этом в газе
устанавливается некоторое стационарное, не
меняющееся со временем распределение
молекул по скоростям, все направления
движения молекул равновероятны.
Рис. 2
В пространстве скоростей скорости каждой молекулы соответствует точка. Из –за
столкновений положение точек будет меняться, но их плотность в каждом месте
будет неизменной.
28. Обозначим -- вероятность попадания измеренной скорости молекулы в объем (см. рис.2):
(*а)Найдем коэффициент пропорциональности
из следующих
соображений.
1) В равновесном состоянии газа все направления движения молекул
равноправны, в том числе вдоль и против произвольного направления,
поэтому функция распределения зависит лишь
от величины вектора и не зависит от его
2
направления. Можно принять f ( ) f ( )
Рис.3
2) Вероятность появления скорости в объеме
-- вероятность сложного
события, заключающегося в одновременном появлении:
-- в интервале
-- обозначим вероятность этого
события
;
-- в интервале
-- обозначим вероятность этого
события
;
-- в интервале
-- обозначим вероятность этого
события
.
29. В силу равноправия всех направлений в пространстве вид функций должен быть одинаков и отличаться только значениями аргументов:
Т.к. появлениесобытия, то
в объеме
-- статистически независимые
3) Для нашей функции и ее аргумента справедливы соотношения:
Из математики известно, что этим условиям удовлетворяет только
экспоненциальная функция:
30. N/j/ aeyrwbz hfcghtltktybz Vfrcdtkkf gj rjvgjytynt crjhjcnb Т.о. функция распределения Максвелла по компоненте скорости имеет
Т.о. функция распределения Максвелла по компоненте скорости имеетэкспоненциальный вид:
,
(1)
где А и α – параметры, причем
, т.к. при
должно
выполняться условие
(1) дает общий вид функции распределения по компоненте скорости.
Выразим постоянные А и α через физические параметры.
3.2.2 Вычисление параметров в функции распределения Максвелла
А найдем из условия нормировки: т.к. вероятность обнаружения
в интервале
равна единице, то
(2)
Табличный интеграл:
Получим:
, отсюда
.
31. Параметр α найдем из следующих соображений. Согласно закону равнораспределения энергии молекулы по степеням свободы , доля
среднего значения ее кинетической энергии,приходящаяся на поступательное движение вдоль каждой из осей :
, откуда
(3).
С другой стороны,
(4)
Табличный интеграл:
подставляем в (4):
(5)
Приравнивая правые части (3) и (5), получим
(7)
(6)
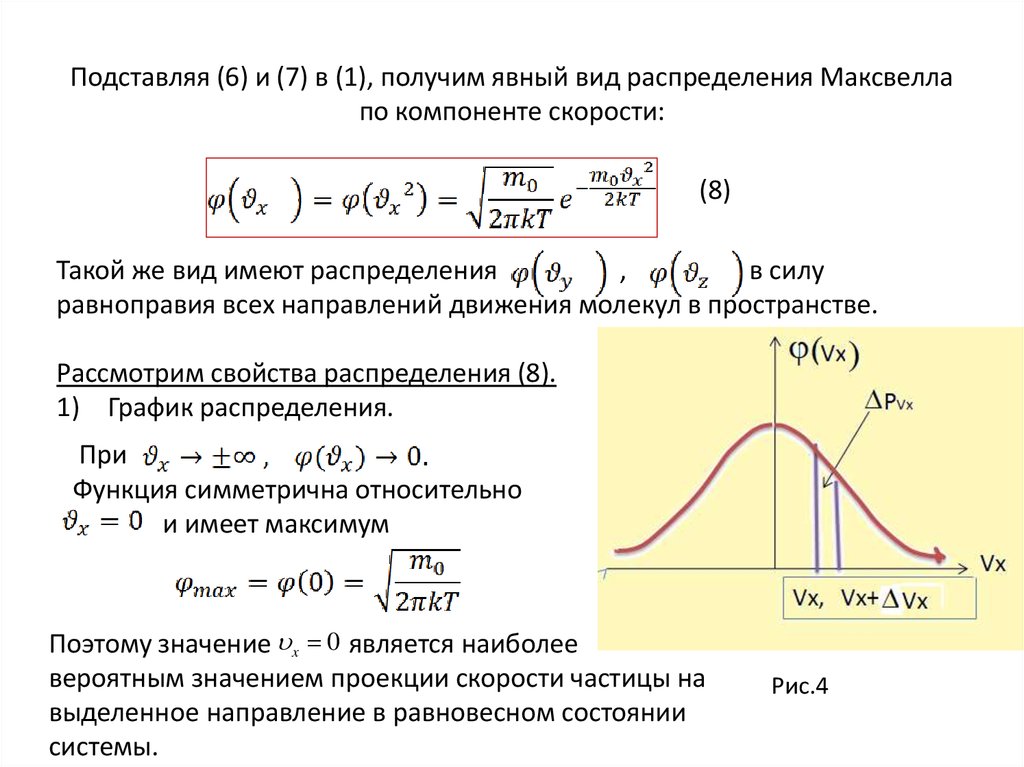
32. Подставляя (6) и (7) в (1), получим явный вид распределения Максвелла по компоненте скорости:
(8)Такой же вид имеют распределения
,
в силу
равноправия всех направлений движения молекул в пространстве.
Рассмотрим свойства распределения (8).
1) График распределения.
При
Функция симметрична относительно
и имеет максимум
Поэтому значение x 0 является наиболее
вероятным значением проекции скорости частицы на
выделенное направление в равновесном состоянии
системы.
Рис.4
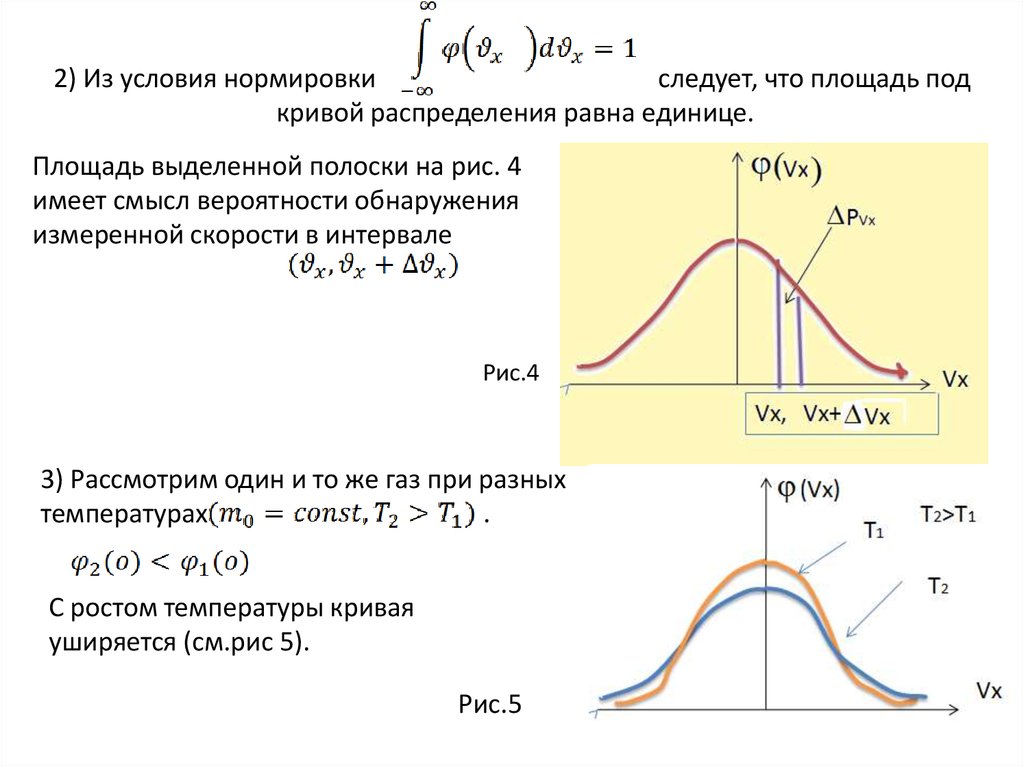
33. 2) Из условия нормировки следует, что площадь под кривой распределения равна единице.
Площадь выделенной полоски на рис. 4имеет смысл вероятности обнаружения
измеренной скорости в интервале
Рис.4
3) Рассмотрим один и то же газ при разных
температурах
.
С ростом температуры кривая
уширяется (см.рис 5).
Рис.5
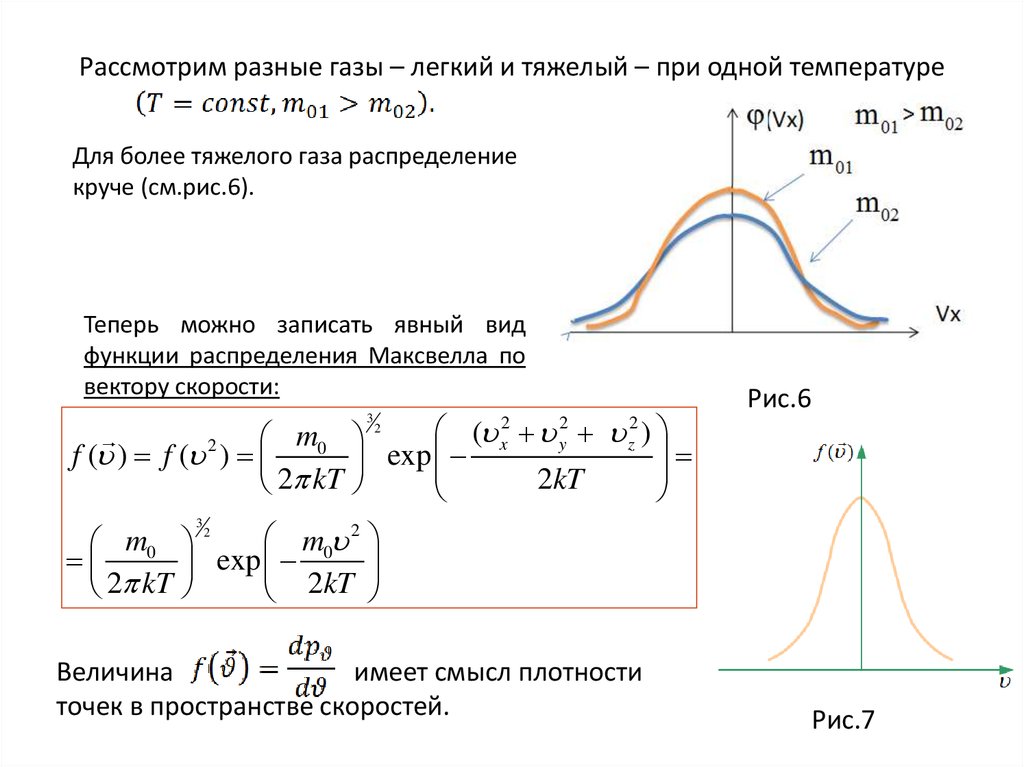
34. Рассмотрим разные газы – легкий и тяжелый – при одной температуре
Для более тяжелого газа распределениекруче (см.рис.6).
Теперь можно записать явный вид
функции распределения Максвелла по
вектору скорости:
2
2
2
2
(
m
x
y
z)
2
0
f ( ) f ( )
exp
2kT
2 kT
3
Рис.6
2
m0 2
m0
exp
2
kT
2 kT
3
Величина
имеет смысл плотности
точек в пространстве скоростей.
Рис.7
35. 3.2.2 Распределение Максвелла по абсолютному значению скорости
В пространстве скоростей (рис.8) концы всехвекторов, имеющих одно и то же абсолютное
значение, лежат на сфере радиуса , а концы
векторов, абсолютные значения которых
заключены в интервале от до d , лежат в
шаровом слое между сферами радиусов
и d . Поэтому для получения вероятности
обнаружения скорости в этом интервале
достаточно в (1а) объем элементарного
параллелепипеда
, изображенного на рис. 2,
заменить объемом этого шарового слоя,
который легко найти: dV 4 2 d
(объем бесконечно тонкого шарового слоя есть
площадь поверхности, умноженная на толщину
слоя ).
Итак
откуда окончательно определяем вид функции распределения молекул по
абсолютному значению (модулю) скорости:
.
.
2
m0 2
m0
2
F ( ) f ( )4
4
exp
2 kT
2kT
3
2
2
2
(9)
36.
2m0 2
m0
2
F ( ) f ( )4
4
exp
2 kT
2kT
3
2
2
2
(9)
Рассмотрим свойства распределения по модулю скорости .
1) Условия F (0) 0, и F ( ) 0 означают, что
как очень малые, так и очень большие значения тепловых скоростей частиц
оказываются маловероятными.
График распределения имеет один
max и изображен на рис. 9.
2) Площадь под
распределением в соответствии
с условием нормировки равна
единице. Площадь
заштрихованного участка равна
относительному числу молекул,
скорости которых лежат в
интервале
:
Рис.9
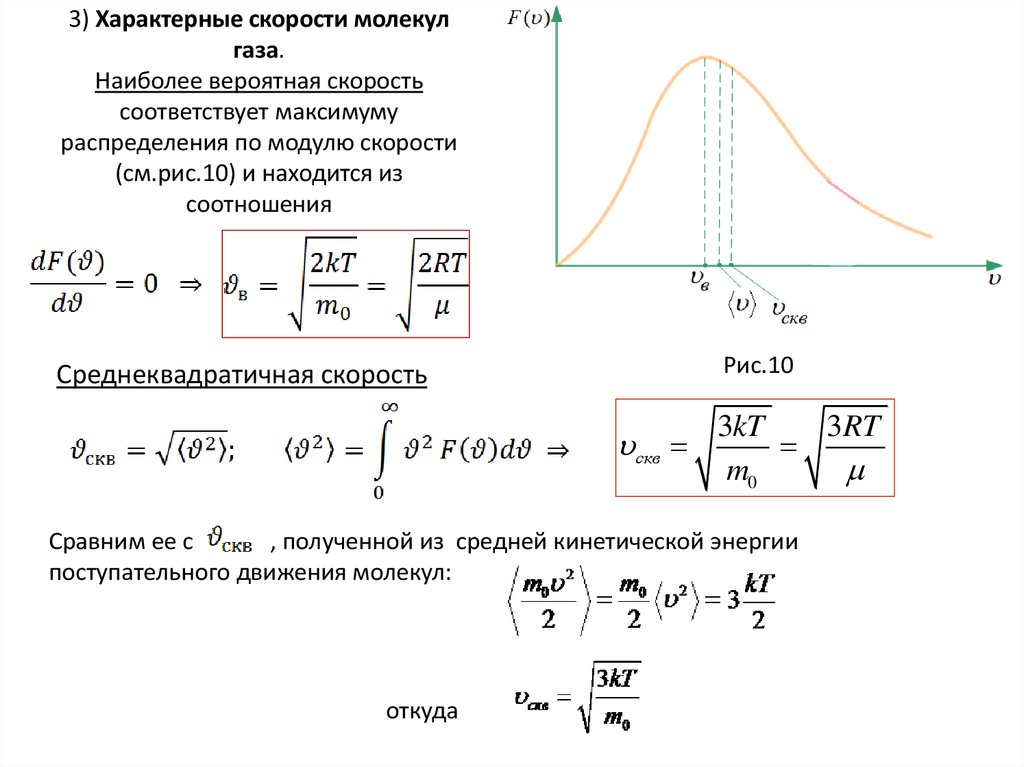
37. 3) Характерные скорости молекул газа. Наиболее вероятная скорость соответствует максимуму распределения по модулю скорости
(см.рис.10) и находится изсоотношения
Рис.10
Среднеквадратичная скорость
скв
3kT
3RT
m0
Сравним ее с
, полученной из средней кинетической энергии
поступательного движения молекул:
откуда
38. Средняя арифметическая скорость
4)8kT
8 RT
m0
39.
40. Распределение Максвелла по модулю скорости можно преобразовать в распределение частиц по значениям кинетической энергии
поступательного движения:
Путем преобразований получим
(10)
Здесь
-- число частиц, кинетическая энергия поступательного
движения которых лежит в интервале
.
41. 3.3.1 Барометрическая формула
3.3 Газы в силовом поле3.3.1 Барометрическая формула
В состоянии равновесия при отсутствии внешних силовых полей давление в системе
частиц всюду одинаково. Если система находится во внешнем силовом поле, это
утверждение становится несправедливым.
Рассмотрим идеальный изотермический газ, находящийся в однородном
поле силы тяжести. Вес любого горизонтального слоя газа должен уравновешиваться
разностью давлений атмосферы сверху и снизу. При этом, если
(высота
dh 0
увеличивается), то dp 0 (давление убывает) (рис.1).
Выделим вертикальный столб газа с площадью поперечного сечения S ,
равной единице, и высотой dh . Тогда перепад давлений между нижним и верхним
основаниями слоя будет равен весу этого слоя, т.е.
p (p dp) gdh ,
(1)
где - плотность газа на высоте h (толщина слоя dh
выбирается такой, чтобы плотность газа можно было
считать в этом слое постоянной), g - ускорение
свободного падения.
.
S=1
42.
m / V p / RTВыражая плотность
подставляя её в (1), получим
из уравнения Менделеева-Клапейрона и
dp p gdh / RT
(2).
Интегрирование приводит к соотношению
ln p gh / RT ln C
где постоянная интегрирования выбрана в виде ln C
(3),
из соображений удобства.
После потенцирования будем иметь
p Ce μgh/RT.
(4)
( p 0 - давление на
Постоянную С определим из условия, что при h 0, p p 0
высоте h 0) .
Окончательно для зависимости давления от высоты имеем формулу
p po e μgh/RT
которая называется барометрической.
(T1 T2 )
(5)
( 1 2 ),
43.
Барометрическую формулу (5) можно записать в другом виде, используясвязь / R m / k , где m 0 - масса одной молекулы :
0
p po e m0 gh/kT
(6)
Из соотношения (6) видно, что на распределение давления газа по высоте
влияют две тенденции : увеличение силы тяжести приводит к тому, что молекулы
стремятся расположиться вблизи h 0, а хаотическое тепловое движение ( kT ) стремится
равномерно распределить молекулы, а следовательно, и давление по всему объему.
Таким образом, барометрическая формула описывает зависимость давления
однокомпонентного идеального газа, находящегося в состоянии равновесия
( T const ) в однородном ( g const ). поле силы тяжести .
.
Отметим, что в случае смеси газов барометрическая формула (6) дает парциальное
давление одного из компонентов смеси, а формула (5) может описать давление смеси
газов, если под подразумевать значение молярной массы смеси газов.
44. 3.3.2 РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА
Нетрудно заметить, что в соотношении (6) выражение m 0 gh в показателе экспонентыявляется потенциальной энергией частицы в поле силы тяжести, т.е. p m 0 gh .
Поэтому, используя уравнение состояния идеального газа p nkT (p 0 n 0 kT),можно
получить связь между концентрацией частиц и их потенциальной энергией в этом
поле.
/kT
(7)
n no e p .
Больцманом было доказано, что выражение (7) справедливо не только для поля силы
тяжести, но и для систем с большим числом частиц, находящихся в любых
неоднородных потенциальных силовых полях в состоянии теплового равновесия.
Поэтому выражение (7) называется распределением Больцмана. Поскольку
n dN( x, y, z) / dV dN( x, y, z) / dxdydz ,
то распределению (7) можно придать другой вид :
dN(x, y, z) n o e
p (x,y,z)/kT
dxdydz.
(8)
Здесь, dN( x, y, z)
число частиц (молекул), попадающих в результате
хаотического теплового движения в элементарный объем dV dxdydz .
45.
Cледует, однако, помнить, что размеры элементарного объема dV не могут быть скольугодно малыми. Этот объем должен удовлетворять двум требованиям : с одной
стороны, он должен быть достаточно малым, чтобы его можно было описать
математическими бесконечно малыми величинами
(т.е. dV V, V- объем всей системы); с другой стороны, в пределах объема должно
находиться достаточно большое число частиц, чтобы можно было применять
статистические методы.
Разделив обе части равенства (8) на полное число частиц системы N ,
получим
/kT
(9)
dN(x,y,z)/N (n 0 /N)e p dxdydz
.
Где
вероятность обнаружения частицы с потенциальной
энергией p в заданном объеме dV dxdydz в окрестности точки с координатами
x, y, z . Теперь
(10)
В выражении (10) соотношение
(n 0 / N)e
p (x,y,z)/kT
f(x, y, z)
(11)
называется функцией распределения Больцмана. Это функция распределения частиц
системы по значениям потенциальной энергии.
46.
(n 0 / N)ep (x,y,z)/kT
f(x, y, z)
47.
Поскольку распределения Максвелла и Больцмана статистически независимы, товероятность обнаружить частицу, обладающую скоростью из интервала
( x , x d x ; y , y d y ; z , z d z )
в объеме dV dxdydz в окрестности точки с
координатами x, y, z, равна
.
Подставляя в это выражение
получим
Учитывая, что
-- полная механическая энергия частицы,
получим, что число частиц, имеющих компоненты скоростей x , y , z и
находящихся в окрестности точки с координатами x, y, z , равно
48.
Равенство для dN , , . ,x , y,zx
y z
Больцмана, а функция
называется распределением Максвелла -
F( x , y , z , x, y, z) n o (mo / 2 kT) 3/ 2 e / kT
(12)
- функцией распределения Максвелла- Больцмана по полной энергии
частиц.
Т.о., для классической системы частиц , находящейся в произвольном
потенциальном силовом поле, функция распределения частиц по
значениям полной энергии имеет простой вид:
(13)
где A=const.





































 Физика
Физика








