Похожие презентации:
Химические свойства одноосновных карбоновых кислот
1.
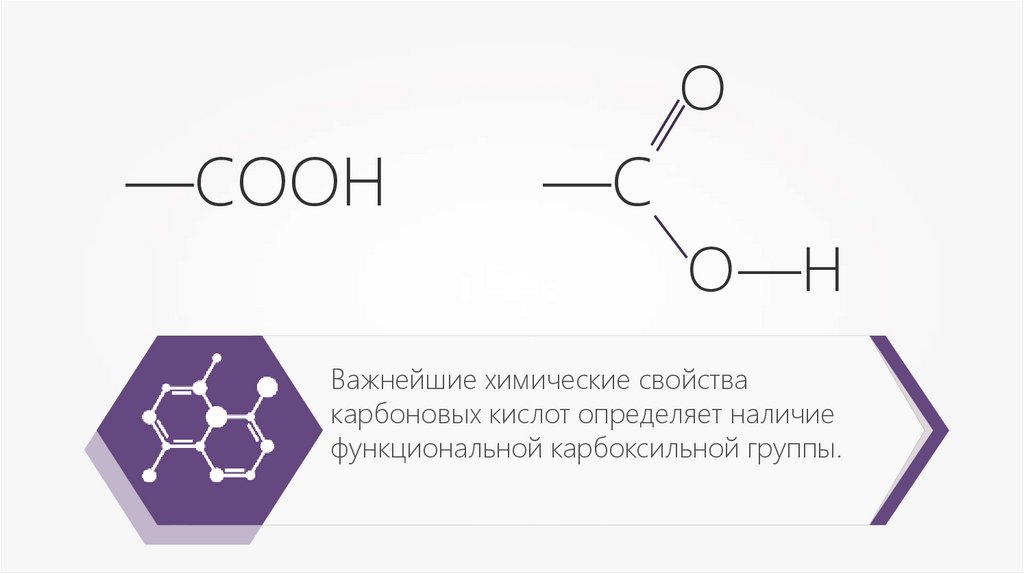
О—СООН
—С
О—Н
Важнейшие химические свойства
карбоновых кислот определяет наличие
функциональной карбоксильной группы.
2.
В отличие от спиртов,растворённые в воде
кислоты имеют характерно
кислый вкус, закрашивают
лакмус в красный цвет,
проводят электрический ток.
3.
О Н→
—С
: :
Упрочнение π-связи
в карбонильной группе приводит
к тому, что реакции
присоединения для карбоновых
кислот не характерны.
О
4.
Реакция горенияCH3COOH + 2О2 → 2СO2 + 2H2O
5.
Реакция диссоциации муравьиной кислотыНСООН → НСОО- + Н+
→
точнее
НСООН + Н2О → НСОО- + Н3О+
→
6.
НСООН → СН3СООН → С2Н5СООНС увеличением числа атомов углерода сила кислот
убывает (из-за снижения полярности связи между
кислородом и водородом).
7.
СН3СООН → СH2СlCООН →Уксусная кислота
Монохлоруксусная кислота
→ СНCl2СООН → СCl3CООН
Дихлоруксусная кислота
Трихлоруксусная кислота
Введение атомов галогена в углеводородный радикал
приводит к возрастанию силы кислоты.
8.
→Mg + 2CH3COOH → (CH3COO)2Mg + H2
CaO + 2CH3COOH → (CH3COO)2Ca + H2O
NaOH + CH3COOH → CH3COONa + H2O
Карбоновые кислоты проявляют все свойства,
присущие слабым кислотам.
9.
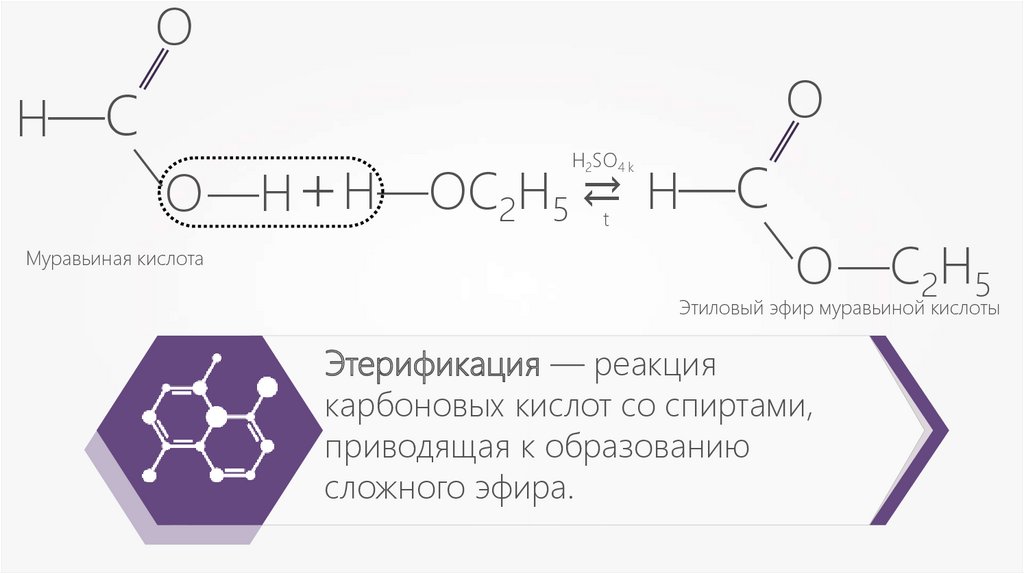
ОН—С
О
О—Н + H—OC2Н5 → Н—С
H2SO4 k
→
t
Муравьиная кислота
О—C2Н5
Этиловый эфир муравьиной кислоты
Этерификация — реакция
карбоновых кислот со спиртами,
приводящая к образованию
сложного эфира.
10.
СН—ОНСН2—ОН
Глицерин
СН2—О—СО—R’
— —
— —
СН2—ОН
СН—О—СО—R’’
СН2—О—СО—R’’
Жир
Сложные эфиры, образованные глицерином и
высшими карбоновыми кислотами (жирными
кислотами) — это жиры.
11.
C15H31COOHПальмитиновая кислота
C17H35COOH
Стеариновая кислота
Предельные жирные кислоты образуют твёрдые жиры
животного происхождения.
12.
C17H33COOHОлеиновая кислота
C17H31COOH
Линолевая кислота
Непредельные жирные кислоты (олеиновая, линолевая и др.)
образуют жидкие жиры (масла) растительного происхождения.
13.
Реакция замещенияCH3—CH2—COOH + Сl2 → CH3—CHCl—COOH + HCl
Пропионовая кислота
α-хлорпропионовая кислота
14.
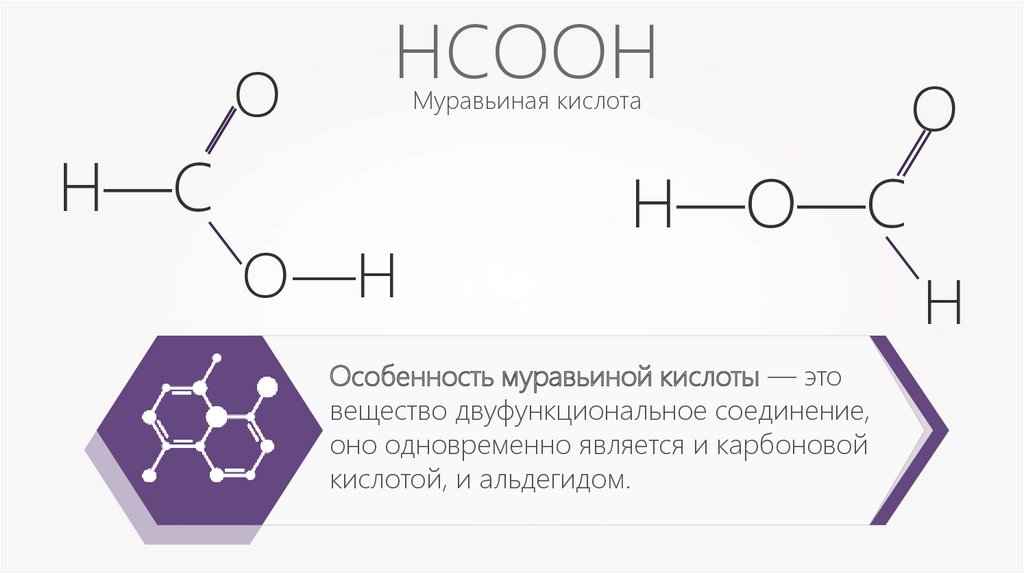
ОНCOOH
Муравьиная кислота
Н—С
О—Н
О
Н—О—С
Особенность муравьиной кислоты — это
вещество двуфункциональное соединение,
оно одновременно является и карбоновой
кислотой, и альдегидом.
Н
15.
tCO2 + H2O+2Ag
HСOOH + Ag2O →
Аммиачный раствор
Муравьиная кислота реагирует и с аммиачным раствором
оксида серебра (реакция серебряного зеркала; качественная
реакция).
16.
Муравьиная кислотаприменяется в текстильной
и кожевенной отраслях
промышленности.
17.
Она используется в качествеобесцвечивающего агента
для различных натуральных и
искусственных волокон и
как восстановитель при окраске
хромовой кожи.
18.
Муравьиная кислотаиспользуется как средство
для удаления извести,
нейтрализующее вещество
в кожевенной промышленности
и как коагулянт для каучукового
латекса.














 Химия
Химия








