Похожие презентации:
Истинные и псевдо-коллоиды
1. НЕДОБУХ ТАТЬЯНА АЛЕКСЕЕВНА Доцент кафедры радиохимии и прикладной экологии ФтИ
Основы ядерной физики,радиохимии и дозиметрии
Лекция 4
ИСТИННЫЕ И ПСЕВДО-КОЛЛОИДЫ
НЕДОБУХ ТАТЬЯНА АЛЕКСЕЕВНА
Доцент кафедры радиохимии и прикладной экологии ФтИ
2. Содержание лекции
Истинные и псевдоколлоиды: определение, условияобразования.
Условия
образования
истинных
коллоидов для случая моноядерного гидролиза.
Природа
процессов,
приводящих
к
образованию
псевдоколлоидов. Современные взгляды на природу
радиоколлоидов. Роль процессов коллоидообразования
в радиохимии и химической технологии.
3. Истинные и псевдоколлоиды
Простейшая модель строения коллоидной частицыAgNO3 KBr (изб.) AgBr KNO3
мицелла
{m[AgBr] · nBr- ·pK+ } ·qK+
m >>n, n = p+q.
агрегат
ядро
частица (гранула)
Коллоидные частицы, агрегаты которых состоят из радионуклидов,
называются истинными радиоколлоидами.
Если радионуклид занимает любое место в двойном электрическом
слое (потенциалопределяющих ионов или противоионов) и не
входит в состав агрегата, то он образует псевдоколлоид.
4. Истинные коллоиды
Для оценки возможности образования истинных коллоидовнеобходимо
провести
анализ
термодинамических
равновесий в системе осадок труднорастворимого
соединения MnLz – водный раствор.
M n Lz M n Lz nM z zLn
aMn z aLnn const ,
a – активность.
В случае разбавленных растворов, при t = const можно
перейти к произведению растворимости
[ M z ]n [ Ln ]z ;
[M z ] M z CM , [ Ln ] Ln CL ;
CM nC p ; CL zC p
5. Термодинамическая вероятность образования осадка MnLz
( M nC p ) n ( L zC p ) z Lkдn h n
n
i
k
h
дi
i 0
lg n(lg M lg n lg C p ) z (lg L lg z lg C p )
1
n
z
lg C p
lg
(lg M lg n)
(lg L lg z )
n z
n z
n z
Если растворимость меньше общей концентрации металла в растворе (Сp
< C0), то раствор является пересыщенным и образование истинных
коллоидов является термодинамически вероятным. При Сp > C0 расствор
является ненасыщенным и образования истинных коллоидов ожидать не
следует.
6. Условия образования осадков гидроксидов для случая моноядерного гидролиза
Уравнение растворимости для гидроксида металла со стехиометрическойформулой M(OH)z будет иметь вид:
Г [ M z ] [OH ]z M C p KW z h z
Г
Cp
M KW z h z
lg C p lg Г z lg KW zpH lg M
где Kw = h ·[OH-], h – концентрация [H+], ПРГ – произведение растворимости
M(OH)z.
Доля истинных коллоидов в растворе в зависимости от рН (для гидроксидов) или
от концентрации лиганда в растворе:
ИК
C0 C p
C0
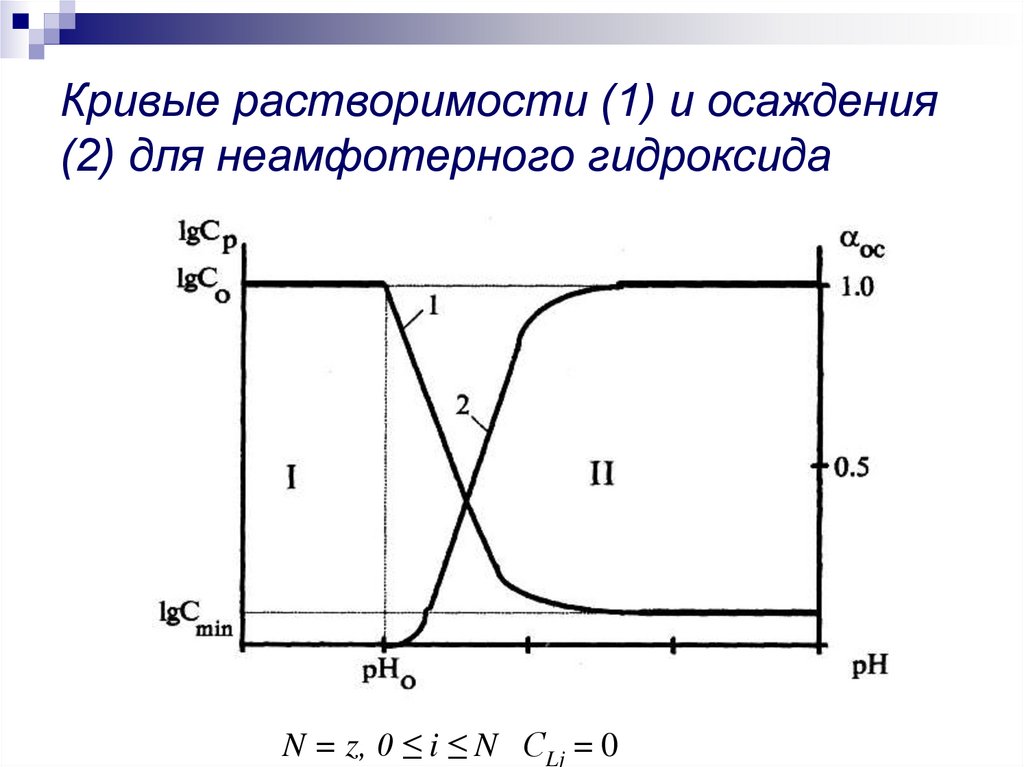
7. Кривые растворимости (1) и осаждения (2) для неамфотерного гидроксида
N = z, 0 ≤ i ≤ N СLj = 08. Кривые растворимости (1) и осаждения (2) для амфотерного гидроксида
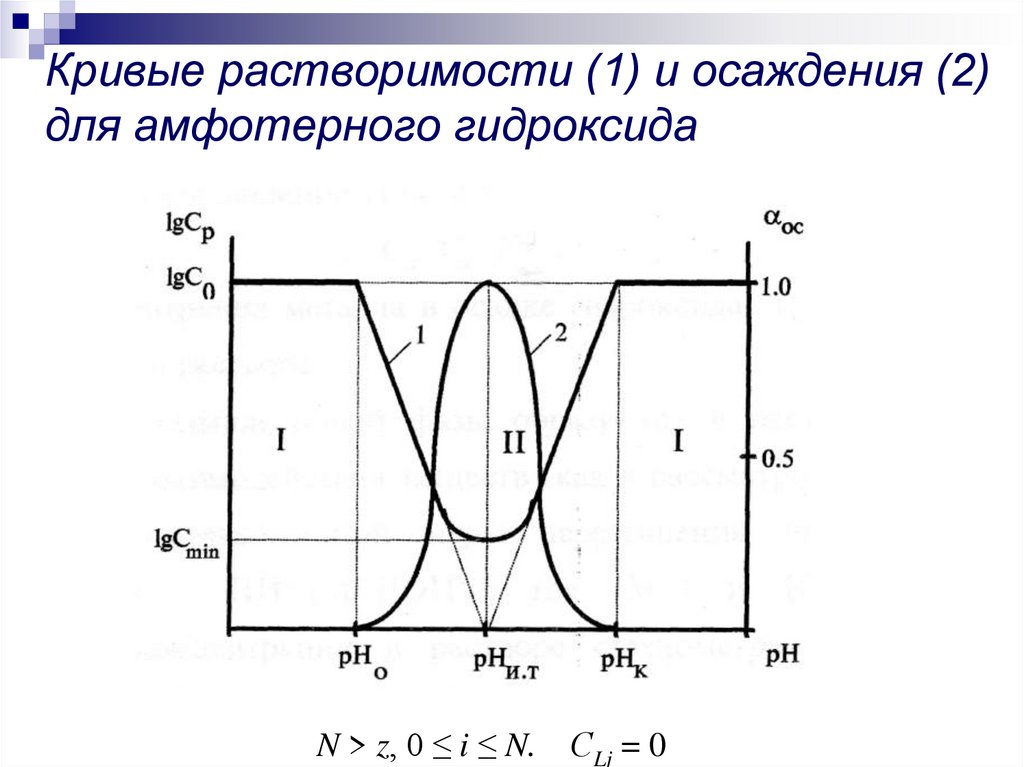
N > z, 0 ≤ i ≤ N.СLj = 0
9. Анализ кривых растворимости
рНо – величина рН начала образования гидроксида. С0 – начальная илиобщая концентрация металла в растворе, моль/л. При рН ≤ рНо раствор
является ненасыщенным (Ср > C0) и коллоидные частицы гидроксида
металла не образуются (αИК = 0). При рН ≥ рНо раствор становится
пересыщенным (Ср ≤ C0) и начинаетя образование коллоидных частиц
гидроксида металла (αИК ≥ 0). Осадки амфотерного гидроксида металла
растворимы в щелочах за счет образования отрицательно заряженных
гидроксокомплексов (M(OH)zz-i, где i > z), полное растворение осадка
произойдет при рН = рНк – величина рН конца растворения осадка
гидроксида. При рН = рНк Ср = C0 и αИК = 0.
Точка минимума кривой растворимости и максимума кривой осаждения и
максимума доли молекулярной формы гидроксокомплекса в растворе
является единственной, соответствует рНит.
Сmin –минимальная концентрация металла, ниже которой осаждения
гидроксида металла не происходит при любых значениях рН раствора.
В области II существует термодинамическая вероятность существования
в растворе самостоятельной фазы гидроксида металла. В области I
радионуклид существует в растворе только в ионодисперсном состоянии.
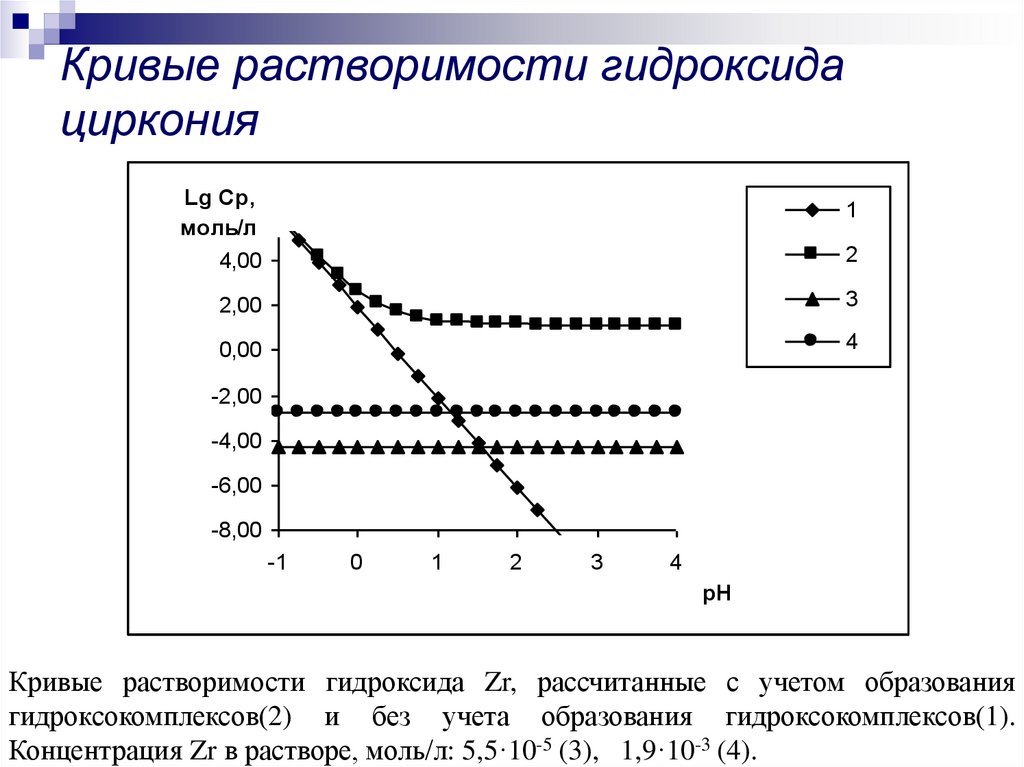
10. Кривые растворимости гидроксида циркония
Lg Cp,моль/л
4,00
1
2
2,00
3
0,00
4
-2,00
-4,00
-6,00
-8,00
-1
0
1
2
3
4
рН
Кривые растворимости гидроксида Zr, рассчитанные с учетом образования
гидроксокомплексов(2) и без учета образования гидроксокомплексов(1).
Концентрация Zr в растворе, моль/л: 5,5·10-5 (3), 1,9·10-3 (4).
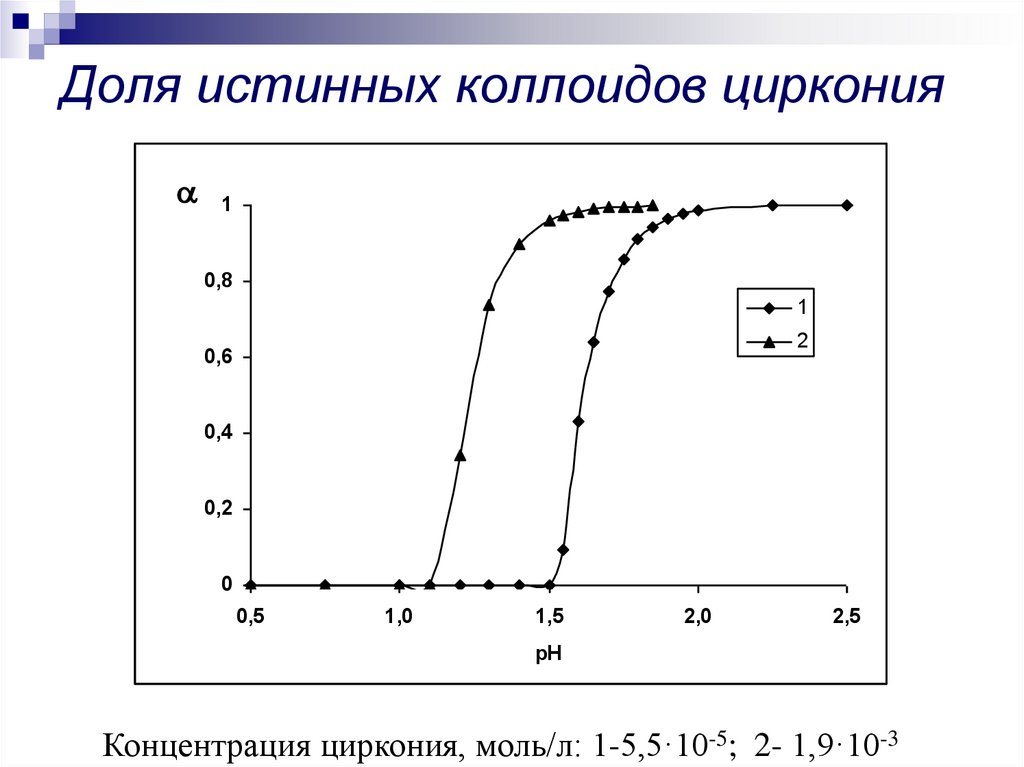
11. Доля истинных коллоидов циркония
10,8
1
2
0,6
0,4
0,2
0
0,5
1,0
1,5
2,0
2,5
рН
Концентрация циркония, моль/л: 1-5,5·10-5; 2- 1,9·10-3
12. Условия образования псевдоколлоидов
1. Раствор по отношению к радионуклиду является ненасыщенным(C0 < Cp).
2. Раствор содержит примесные элементы, для которых существует
термодинамическая вероятность образования истинных
коллоидов: C’0 > C’p, где ’ – признак примесного элемента).
3. Образовывание псевдорадиоколлоидов происходит в результате
сорбции ионодисперсных форм радионуклида поверхностью
коллоидных частиц примесных элементов.
13. Алгоритм расчета доли псевдоколлоидов
Сорбция гидроксидами металлов:Катионный обмен
( z i) R OH M (OH )iz i ( R O) z i M (OH )i ( z i ) H ,
Анионный обмен
(i z ) R OH M (OH )iz i Ri z M (OH )i (i z )OH .
Молекулярная сорбция
OH
H 2O
R
OH
OH
M (OH ) R
0
z
M (OH ) z 1 H 2O
В предположении, что коллоидными частицами примесных элементов
сорбируются только акваионы и гидроксокомплексы, доля радионуклидов в
форме псевдоколлоидов (αПК) :
ПК
1
,
где
S
1 S
- брутто сорбционное отношение;
S
- брутто сорбция
14. Определение природы коллоидов
К 1925 году обозначились две точки зрения на коллоидноесостояние микрокомпонентов – радионуклидов:
1.
2.
Впервые высказанная Панетом в 1913 году заключалась в
том, что радиоэлементы (изучавшиеся в то время Po, Bi, Pb)
могут образовывать истинные коллоидные растворы.
Коллоидное поведение изотопов Po, Bi, Pb в растворах
объясняется их адсорбцией на случайных загрязнениях
(коллоиды гидроксидов, кремниевая кислота, пыль и т.п.).
Приверженцем этого взгляда был Зигмонди.
15. Современные взгляды на природу радиоколлоидов
Гетерогенное зародышеобразование является процессом термодинамическиболее выгодным, чем гомогенное, и должно ему предшествовать,
особенно для ультраразбавленных растворов.
Чем ближе физико-химические свойства вещества подложки и вещества,
выделяющегося в твердую фазу, тем будет меньше работа образования
зародыша. При выделении твердой фазы на поверхности, состоящей из
этого же вещества, работа образования зародыша будет минимальной.
Процессы гетерогенного зародышеобразования могут протекать как на
подложках, специально внесенных в раствор, и стенках сосуда, и на
присутствующих в растворе загрязнениях. В этом случае мы имеем дело с
образованием псевдоколлоидов.
Псевдоколлоиды данного типа можно назвать конденсационными
псевдоколлоидами. Они должны отличаться от псевдоколлоидов
"обычного типа", т.е. адсорбционных псевдоколлоидов, резким снижением
обратимости адсорбции.
В концентрированных растворах образование твердой фазы вследствие
больших пересыщений (С0 >> Cmin) происходит обычно очень быстро и
поэтому, как правило, преобладают процессы гомогенного
зародышеобразования.
16. Процессы образования труднорастворимых соединений
Ультрамикрочастицы имеют размер 20-40 Å,включают в себя до 103 атомов.
Микрочастицы размером в 0,n мкм.
Макрочастицы размером в десятки
микрометров, собирающиеся во
флокулы.
Ультрамикрочастицы длительно сохраняют
свою индивидуальность в объеме
микрочастиц, микрочастицы - в объеме
макрочастиц, а макрочастицы - в объеме
флокул.
Схема иерархической
структуры геля гидроксида
железа
Атомы железа в составе таких полимерных цепей ультрамикрочастиц могут быть
замещены атомами примеси (М) с образованием оловой или оксо-связи, образуя
гетерополиядерные гидроксокомплексы:
H
|
M O Fe или M O Fe .
17. Выводы
Дано определение истинных и псевдоколлоидов.Проанализирована
термодинамическая
возможность
истинных коллоидов на примере гидроксидов металлов.
Проведен анализ кривых растворимостиамфотерных и неамфотерных
гидроксидов металлов в отсутствии процессов комплексообразования.
Рассмотрены процессы, приводящие к образованию псевдоколлоидов.
Показано, что условиями образования псевдоколлоидов являются
возможность образования истинных коллоидов примесными элементами
и сорбция на них целевого компонента.
Рассмотрены современные взгляды на образование радиоколлоидов, в
том числе гетерополиядерных гидроксокомплексов.
образования
18. Библиографический список
Назаренко В.А. Гидролиз ионов металлов в разбавленныхрастворах/ В.А. Назаренко, В.П. Антонович, Е.М. Невская.
Гидролиз ионов металлов в разбавленных растворах. М.:
Атомиздат. 1979. 192с.
Строение и свойства адсорбентов и катализаторов/ Под ред. Б.Г.
Линсена. М.: Мир. 1973. 653 с.
Старик И.Е. Основы радиохимии/ И.Е. Старик. Л.: Наука. 1969.
647 с.
Мелихов И.В. Иерархическая структура сорбентов для
радионуклидов/ И.В. Мелихов, В.Ф. Комаров, А.С.
Келебеев// Радиохимия. 1984. т.26. №5. С.585-593.














 Химия
Химия








