Похожие презентации:
Аналитикалық және физколлоидтық химия
1. Аналитикалық және физколлоидтық химия
Ибатаев Жарқын Абыкеновичх.ғ.к., физика және химия
кафедрасының қауымдастырылған
профессоры м.а.
Биофак, каб. 2305,
тел. 8-702-38-48-0-68 (Whatsapp),
ZharkynAstana@gmail.com
Идентификатор 865 966 3319
2.
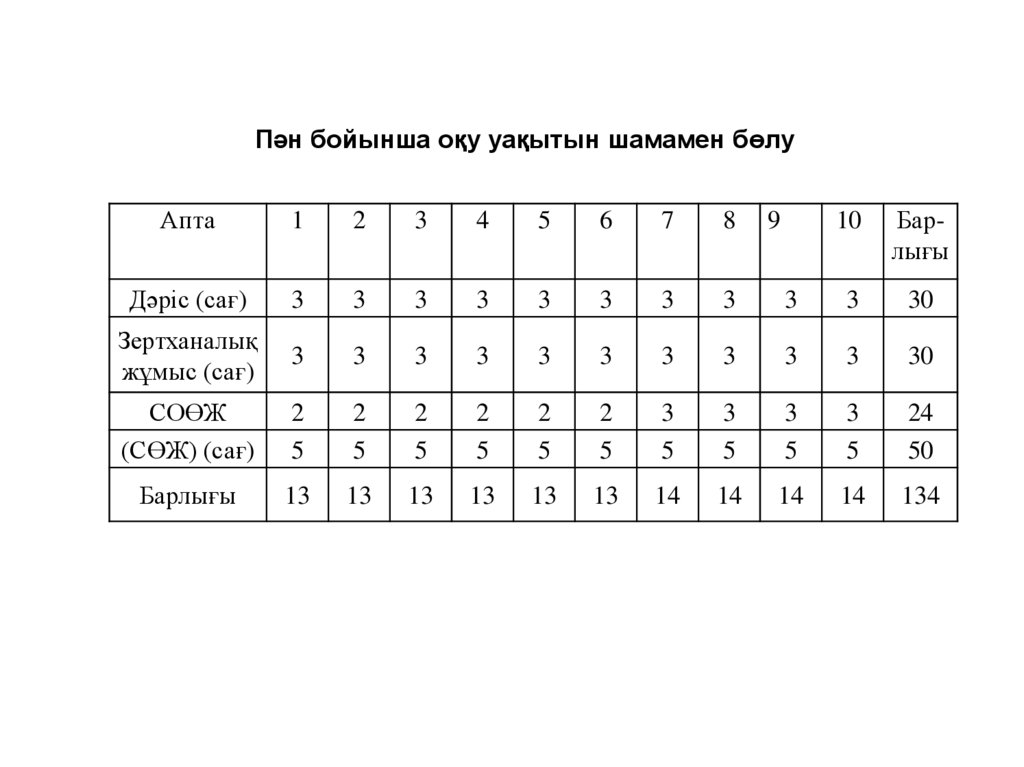
Пән бойынша оқу уақытын шамамен бөлуАпта
1
2
3
4
5
6
7
8
10
Барлығы
Дәріс (сағ)
3
3
3
3
3
3
3
3
3
3
30
Зертханалық
жұмыс (сағ)
3
3
3
3
3
3
3
3
3
3
30
СОӨЖ
(СӨЖ) (сағ)
2
5
2
5
2
5
2
5
2
5
2
5
3
5
3
5
3
5
3
5
24
50
Барлығы
13
13
13
13
13
13
14
14
14
14
134
9
3.
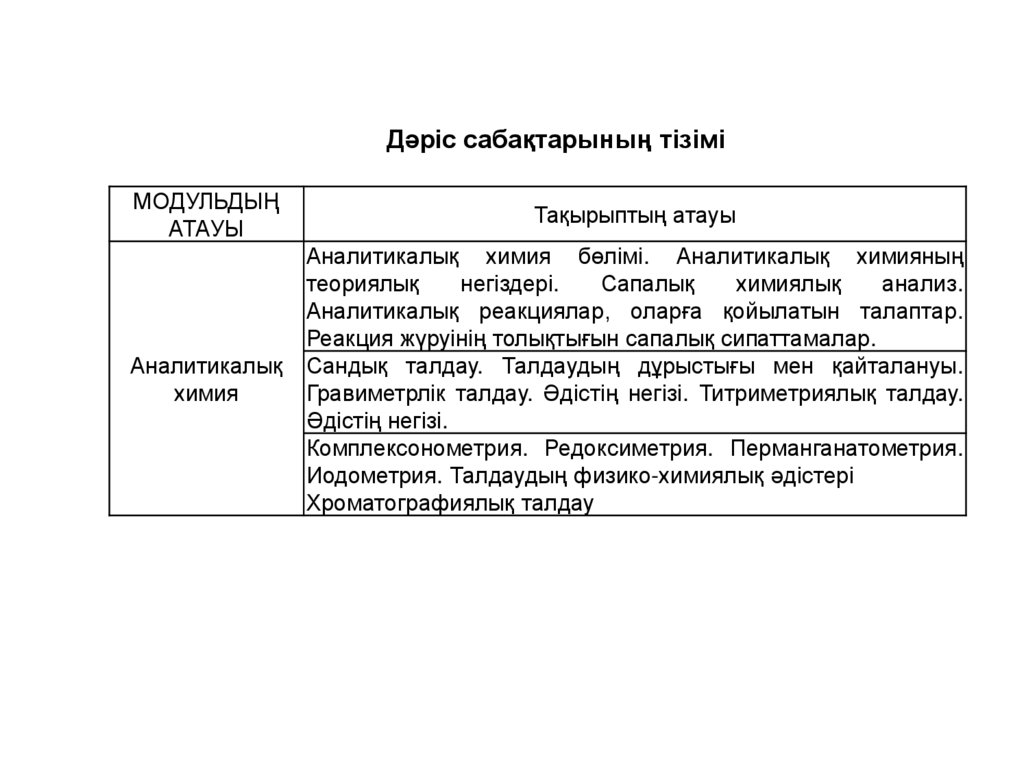
Дәріс сабақтарының тізіміМОДУЛЬДЫҢ
АТАУЫ
Тақырыптың атауы
Аналитикалық
химия
Аналитикалық химия бөлімі. Аналитикалық химияның
теориялық
негіздері.
Сапалық
химиялық
анализ.
Аналитикалық реакциялар, оларға қойылатын талаптар.
Реакция жүруінің толықтығын сапалық сипаттамалар.
Сандық талдау. Талдаудың дұрыстығы мен қайталануы.
Гравиметрлік талдау. Әдістің негізі. Титриметриялық талдау.
Әдістің негізі.
Комплексонометрия. Редоксиметрия. Перманганатометрия.
Иодометрия. Талдаудың физико-химиялық әдістері
Хроматографиялық талдау
4.
МОДУЛЬДЫҢАТАУЫ
Тақырыптың атауы
Физикалық
химия
Химиялық
процестердің
энергетикасы.
Химиялық
термодинамиканың элементтері. Ішкі энергия, энтальпия,
энтропия. Термодинамика заңдары. Гесс заңы. Күй функциялары
және биологиялық процесстер. Химиялық кинетика және оган
әсер ететін факторлар. Химиялық тепе-теңдік.
Электролит және бейэлектролит ерітінділері. Қасиеттері. Рауль,
Осмос заңдары. Осмостық қысым. Вант-Гофф заңы.
Биологиялық
процесстер
үщін
осмостың
маңызы.
Диссоциациялану дәрежесі. Диссоциациялану константасы.
Оствальдтың сұйылту заңы.
Судың электролиттік иондануы, сутектік көрсеткіш рН. Буферлі
ерітінділер туралы түсінік. Буферлі жүйелердің биологиялық
ролі, рН.
Химиялық
анализдағы
ТТР.Электрохимиялық
үрдістер.Электродтық
потенциалдар.
Нернст
теңдеуі.
Гальваникалық
элементтер.
Биологиялық
жүйелердің
электрөткізгіштігі. Биоэлектрлік потенциалдар.
5.
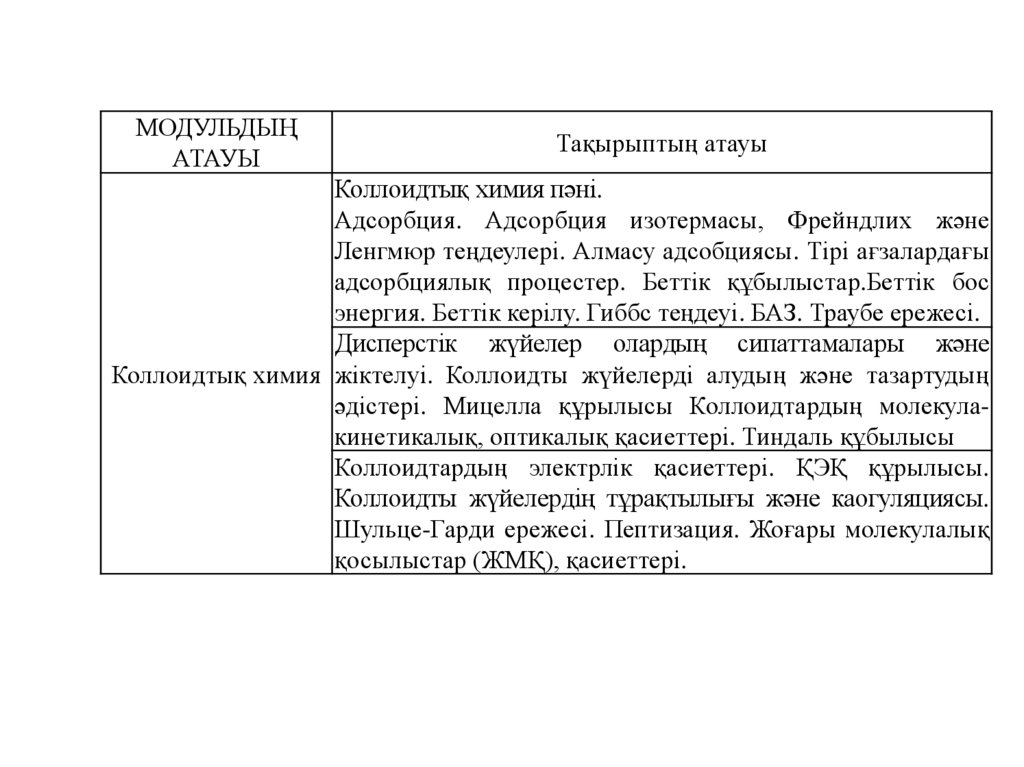
МОДУЛЬДЫҢАТАУЫ
Тақырыптың атауы
Коллоидтық химия пәні.
Адсорбция. Адсорбция изотермасы, Фрейндлих және
Ленгмюр теңдеулері. Алмасу адсобциясы. Тірі ағзалардағы
адсорбциялық процестер. Беттік құбылыстар.Беттік бос
энергия. Беттік керілу. Гиббс теңдеуі. БАЗ. Траубе ережесі.
Дисперстік жүйелер олардың сипаттамалары және
Коллоидтық химия жіктелуі. Коллоидты жүйелерді алудың және тазартудың
әдістері. Мицелла құрылысы Коллоидтардың молекулакинетикалық, оптикалық қасиеттері. Тиндаль құбылысы
Коллоидтардың электрлік қасиеттері. ҚЭҚ құрылысы.
Коллоидты жүйелердің тұрақтылығы және каогуляциясы.
Шульце-Гарди ережесі. Пептизация. Жоғары молекулалық
қосылыстар (ЖМҚ), қасиеттері.
6.
ӘДЕБИЕТТЕР ТІЗІМІНегізгі әдебиет
1. Құлажанов Қ.С. Аналитикалық химия. Алматы, 1994ж
2. Патсаев Ә.Қ. Аналитикалық химия. Шымкент, 2010ж.
3. Патсаев Ә.Қ. Физикалық және коллоидтық химия. Шымкент, 2011ж.
4. Қоқанбаев Ә. Физикалық химияның қысқаша курсы. Алматы, 1996ж.
5. Сейтембетов Т.С. Химия. Алматы, 1998ж.
Қосымша әдебиет
1. Патсаев Ә.Қ., Шитыбаев С.А. Бейорганикалық және физколлоидтық химияның
тәжірибелік – зертханалық сабақтарына қолданба. Шымкент, 2006ж.
2. Шоқыбаев Ж. Анорганикалық және аналитикалық химия. Оқу құралы. Алматы.
Қайнар. 1992ж.
3. Болдырев А.И. «Физическая и коллоидная химия», В.Ш. 1983г.
4. Цитович И.К. Курс аналитической химии, М: «ВШ», 1984г.
5. Себряева, Н. С. Физическая и коллоидная химия Астана : Казахский
государственный агротехнический университет им.С.Сейфуллина, 2005. - 166 с.
6. Гельфман, М. И. Коллоидная химия Лань, 2003. - 336 с.
http://portal.kazatu.kz/e-books/content/zhDMVTme4j2f7rxpOAnS/index.html
http://portal.kazatu.kz/e-books/content/BAE1VrRTDFS0rBaPA6HA/
http://portal.kazatu.kz/e-books/content/yN7zGVfltFtKCldPkRtd/index.pdf
http://portal.kazatu.kz/e-books/content/DLIhUeEy7yTDS5TGuEFf/pages/sod.html
http://portal.kazatu.kz/e-books/content/a6TFTlpKXIG8sptI1ba3/files/file.pdf
http://portal.kazatu.kz/e-books/content/pAz0ENvmH5d9hI9xEDe0/pages/sod.html
7.
Аналитикалық химия – әртүрлі қосылыстар мензаттардың құрамын анализдеу әдістері туралы
ғылым.
Аналитикалық химияның мақсаты - жаңа анықтау
әдістерін зерттеу немесе қолданылып жүрген
әдістерді жетілдіру, сондай-ақ талдауды тәжірибе
жүзінде іске асыру болып табылады.
8.
Аналитикалық химияның теориялық негізінхимияның негізгі заңдары құрайды: зат
массасының және энергиясының сақталу заңы,
зат құрамының тұрақтылығы, әрекеттесуші
массалар, эквиваленттер заңы және т.б.
Аналитикалық химия элементтердің, иондардың
қасиеттеріне және бейорганикалық химияның
теорияларына - электролиттік диссоциация
теориясы, амфотерлік, тұздар гидролизі, тотығутотықсыздану
реакциялар,
комплексті
қосылыстар теорияларына және т.б. сүйенеді.
9.
Аналитикалық химия екі үлкен бөлімге бөлінеді:сапалық және сандық талдау.
Сапалық талдау заттың қандай элементтерден,
иондардан, атомдардан немесе молекулалардан
тұратынын анықтайды. Анализ мақсатында
қолданылатын химиялық процестер аналитикалық
реакциялар деп аталады. Бұл реакцияларда сыртқы
эффект байқалуы тиіс (тұнбаның түзілуі, газдың бөлінуі,
ерітіндінің түсінің өзгеруі т.б.)
Мысалы, натрий ионын анықтау үшін мынадай реакция
қолданылады:
NaCl + K[Sb(OH)6] = Na[Sb(OH)6] + KCl
Реакция нәтижесінде ақ тұнба түзіледі.
10.
Сандық талдау заттар құрамындағыолардың сандық мөлшерін анықтайды.
Сандық талдау әдістерін 3 негізгі топқа
бөлуге болады:
1. химиялық
2. физикалық
3. физика-химиялық
11.
Химиялық әдістер заттар арасында жүретінхимиялық реакцияларға негізделген.
Химиялық анализ ыңғайлығы: оны кез келген
жерде жүргізуге болады, оған тек қолданылатын
реактивтер және қарапайым зертханалық ыдыстар
ғана қажет
Химиялық әдістерді 3 топқа бөледі:
1. Гравиметриялықталдау анықталатын заттың
және реакция нәтижесінде түзілген заттың массасын
өлшеуге негізделген әдіс.
2. Титриметриялық(көлемдік) талдау реакцияға
жұмсалған реактивтің көлемін анықтауға негізделген.
3. Газдық талдау.
12.
Физикалық әдіс – элементтің, ионның тұрақтыфизикалық қасиеттерін анықтауға негізделген (түсі,
спектрі, тығыздығы т.б.) әдіс.
Физика-химиялық әдістер белгілі бір химиялық
реакция барысында түзілетін заттың физикалық
қасиетін
(жарық
сіңіру,
жарықтың
сынуы,
электрөткізгіштік т.б.) анықтауға негізделген. Бұл
әдістер үшін арнайы құрал-жабдықтар қажет,
сондықтан бұл әдістерді тек арнайы зертханада
жасайды.
Физика-химиялық талдау әдістерінің артықшылығы:
1) таңдамалылығы; 2) талдаудың жылдам жасалуы;
3) оңай автоматтандырылуы.
13.
Сандақ талдауда есептеулерді және өлшеуді мұқиятжүргізу керек. Химиялық талдау жасауда есептеулер
дәлдігі
ГОСТпен
немесе
ТШ
/техникалық
шарттар/мен анықталады. Мысалы, гравиметриялық
талдауда аналитикалық таразыда заттың массасы
төрт ондық белгілері бар санға дейін (74,5744г)
өлшенеді. Титриметриялық анализде ерітіндінің
көлемін бюреткамен өлшегенде екі ондық санға
дейін (0,22 мл).
14.
Талдаудың нәтижелері мен өлшемдерінекелесі талаптар қойылады: олар дұрыс, дәл және
қайталанғыш болу керек.
Анализдің дұрыстығы орташа және ақиқат
нәтижелерінің
арасындағы
айырмашылықпен
сипатталады.
Өлшеудің
қайталанғыштығы
әртүрлі
жағдайларда жасаған өлшеулер нәтижелерінің бірбіріне жуықтығын білдіреді, талдау қайталануы,
бірақ дұрыс емес бола алатынын ескеру керек.
Өлшеудің дәлдігі анықтаулар нәтижелерінің
өлшенетін шаманың ақиқат мәніне жуықтығын
бейнелейді. Дәлдік және қайталанғыштық ұғымдары
бірін бірі толықтырады. Қайталанғыштық болмаса
дәлдікке қол жеткізу мүмкін емес, бірақ жақсы
қайталанғыштық та жоғары дәлдікті бере алмайды.
15.
Абсолютті қателік – талдау нәтижесінің жәнеөлшенетін шаманың ақиқат мәнімен айырмасына тең,
яғни ол ақиқат мәнінен қаншалықты ауытқуын көрсетеді:
Салыстырмалы қателік – өлшеудің абсолютті
қателігінің ақиқат мәнге қатынасы:
16.
Жүйелі қателік – өлшеудің әрдайым тұрақтыболып қалатын немесе қайталанатын талдауларда
таңбасы өзгермейтін қателік. Жүйелік қателіктер
әдістемелік, оперативтік (лаборанттың талдауды
жасау
біліктілігіне
байланысты),
лаборанттың
субъективті қасиеттеріне байланысты болады.
Кездейсоқ қателіктер кез келген өлшеуде
кездеседі, олардың саны параллельді өлшеулерді
өткізу нәтижесінде азайтуға болады.
Өрескел қателіктер (оларды мүлт кетулер деп
те атайды) тәжірибені қайтаған сайын елеулі түрде
өзгеріп отырады.
17.
Талдау әдістеріне қойлатын талаптарТалдаудың нәтижелері мен өлшемдеріне келесі
талаптар қойылады: олар дұрыстығы, дәлдігі және
қайталанғыштығы. Анализдің дұрыстығы орташа және
ақиқат нәтижелерінің арасындағы айырмашылықпен
сипатталанады. Өлшемдердің қайталанғыштығы әр
түрлі жағдайларда жасаған өлшеулер нәтижелерінің бірбіріне жуықтығын білдіреді, талдау қайталанымды, бірақ
дұрыс
емес
бола
алатынын
ескерген
жөн.
Өлшемдердің дәлдігі анықтаулар нәтижелерінің
өлшенетін
шаманың
ақиқат
мәніне
жуықтығын
бейнелейді. Дәлдік пен қайталанғыштық бірін бірі
толықтырады. Қайталанғыштық жоқ болғанда дәлдікке
қол жеткізу мүмкін емес, бірақ жақсы қайталанғыштық та
жоғары дәлдікті бере алмайды.
18.
Стандарт үлгілер деп құрамындағы анықталатынэлементтердің мөлшері жоғары дәрежелі дәлдікпен
белгілі болатындай әртүрлі материалдарды айтады,
оларды анализдің дұрыстығын тексеру үшін қолданады.
Анықталу шегі деп берілген реакция арқылы
жеткілікті дәрежеде табылатын заттың минимальды
мөлшерін айтады.
Селективтілік (таңдамалылық) – бұл басқа
заттардың (иондардың) қатысуында белгілі бір нақты
затты (ионды) анықтау мүмкіндігі.
Сезгіштік – аналитикалық дабылдың өзгерісін
көрсететін
шама,
мысалы
анықталатын
зат
концентрациясы өзгерісі кезіндегі ерітіндінің оптикалық
тығыздығының өзгерісі.
19.
Талдау кезеңдеріЗерттелетін заттың анализі бірнеше кезеңнен тұрады.
Сынаманы алу. Егер зерттеуге алынған сынама толық, дұрыс
алынған болса анализдің нәтижесі дұрыс болады. Дұрыс алынбаған
сынаманың анализі заттың құрамы туралы қате мәлімет береді.
Сондықтан сынаманы алу кезеңі үшін өте маңызды. Үлгіден
сынаманы алу заттың үлкен массасынан алғашқы сынаманы алу
және оны әртүрлі әдістермен анализге қажет мөлшерге дейін
азайтудан тұрады. Зеттелетін объектілер әртүрлі агрегаттық күйде
болуы мүмкін: сұйық, газ тәрізді немесе қатты. Бірінші екі жағдайда
объектілер біртекті, сондықтан олардан сынама алу ешқандай
қиындықты туғызбайды. Ол арнайы құрылғылар арқылы жүргізіледі:
вакуумдық колбалар, жинағыштар, бюреткалар және т. б. Қатты
объектілер біріңғай таралмаған әртүрлі компоненттердің гетерогенді
қоспасы болып табылады. Сондықтан оларды механикалық жолмен
немесе ерітумен гомогенді жүйеге ауыстырады.
20.
Сынаманы анализге дайындау. Бұл кезеңніңбасты операциясы – еріту. Ол қатты затты сәйкес
еріткішпен өңдеуден немесе балқымамен ерітіп,
кейін оны ерітінді күйіне жеткізуден тұрады. Кедергі
жасайтын қосымша заттар сынамадан алып
тасталады. Ол үшін экстракция, дистилляция,
хроматография т.б. әдістер қолданылады.
Өлшеу. Сынамаға физикалық немесе химиялық
әсер ету динамикалық белгілердің (бояудың
өзгеруі, фазалардың пайда болуы) пайда болуына
әкеледі. Өлшеудің ақырғы кезеңінде белгілі бір
әдіспен аналитикалық белгілерді тіркейді.
21.
Сапалық талдауЗат құрамын ерітіндіге көшіру арқылы анықтау
"ылғал тәсіл" деп аталады. Қарастырылып отырған
затты ерітіндіге көшірмей талдау жүргізілсе, оны
"құрғақ тәсіл" деп атауға болады.
Талдау әдістері сынама шамасына қарай:
микроталдау (зерттелетін зат массасы 0,001-10-6г),
жартылай
микроталдау
(0,05-0,5г)
және
ультрамикроталдау (10-6-10-9 г) деп жіктеледі.
Табиғатта заттар әртүрлі қоспа, қосылыс күйінде
кездеседі. Шикізат, қосылыс құрамындағы қажетті
затты (элементті) анықтау үшін, сол жүйеден оның
біршама бөлігі талдауға алынады. Осы бөлік сынама
немесе татпа деп аталады.
22.
Заттыңталдауға
алынатын
бөлігі
оның
құрамындағы анықталып отырған заттың мөлшеріне
тікелей байланысты.
Зерттелетін жүйеде қажетті зат шамасы 10% дан артық болса, онда ол негізгі құрам қатарына, ал
0,01-10% аралығында болса, қоспа қатарына жатады.
Керекті зат (элемент) жүйеде 0,01%-дан аз болса,
онда ол өте аз мөлшерде деп қарастырылады. Осы
шамалар және талдау әдісінің мүмкіндіктері ескеріле
отырып, жүйеден сынама алынады.
Талдау тәсілдері арқылы анықтауға мүмкін
болатын заттың (элементтің) ең аз шамасы оны
анықтаудың шекті мәні деп аталады.
23.
Сапалықталдау
негізінде
зерттелетін
зат
құрамындағы катиондар мен аниондарды анықтау
жатыр.
Ерітіндіге
көшкен
катиондар
мен
аниондарды топ-топқа бөліп анықтау үшін, олардың
бойына тән, ұқсас жалпы ортақ қасиеттер негізге
алынады. Әр топқа ортақ реагенттер белгілі
жағдайлар сақталғанда ғана тиісті қасиетті
көрсетеді. Катиондарды жүйелі түрде анықтау
барысында
қышқылды-сілтілік,
аммиактыфосфаттық, күкіртсутек әдістері қолданылады.
Қышқылдық-негіздік
жүйеде
катиондарға
қышқылдармен (күкірт, тұз қышқылдары) сілтілердің
әсері қарастырылады.
24.
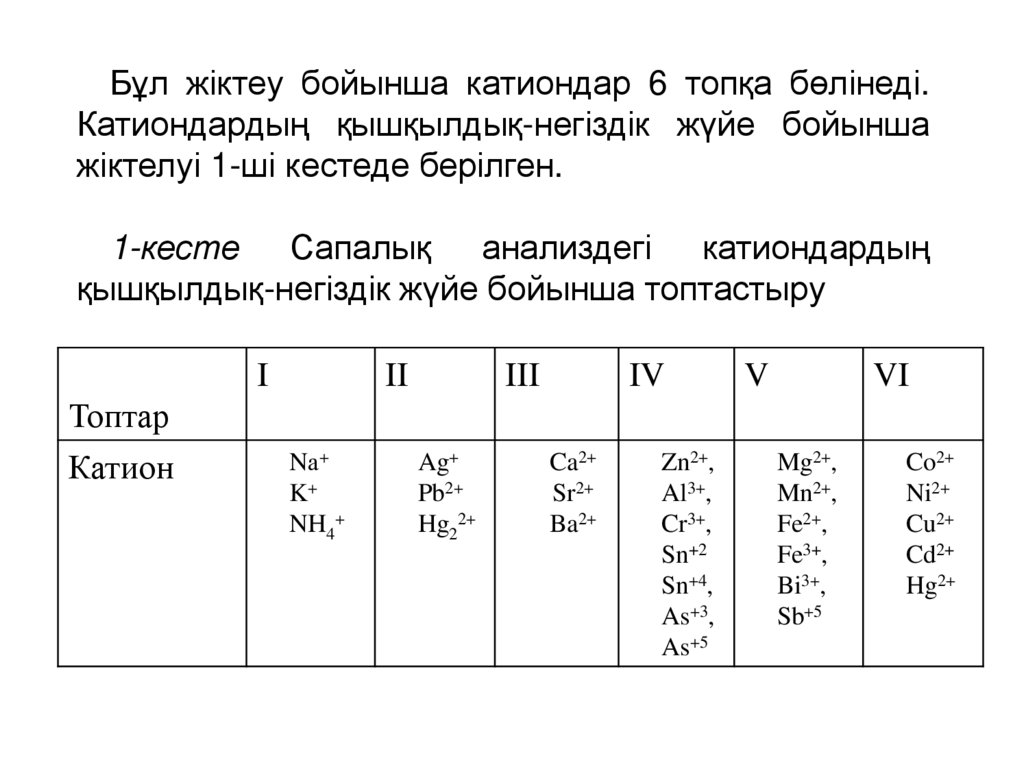
Бұл жіктеу бойынша катиондар 6 топқа бөлінеді.Катиондардың қышқылдық-негіздік жүйе бойынша
жіктелуі 1-ші кестеде берілген.
1-кесте Сапалық анализдегі катиондардың
қышқылдық-негіздік жүйе бойынша топтастыру
I
II
III
IV
V
VI
Топтар
Катион
Nа+
K+
NH4+
Ag+
Pb2+
Hg22+
Ca2+
Sr2+
Ba2+
Zn2+,
Al3+,
Cr3+,
Sn+2
Sn+4,
As+3,
As+5
Mg2+,
Mn2+,
Fe2+,
Fe3+,
Bi3+,
Sb+5
Co2+
Ni2+
Cu2+
Cd2+
Hg2+
25.
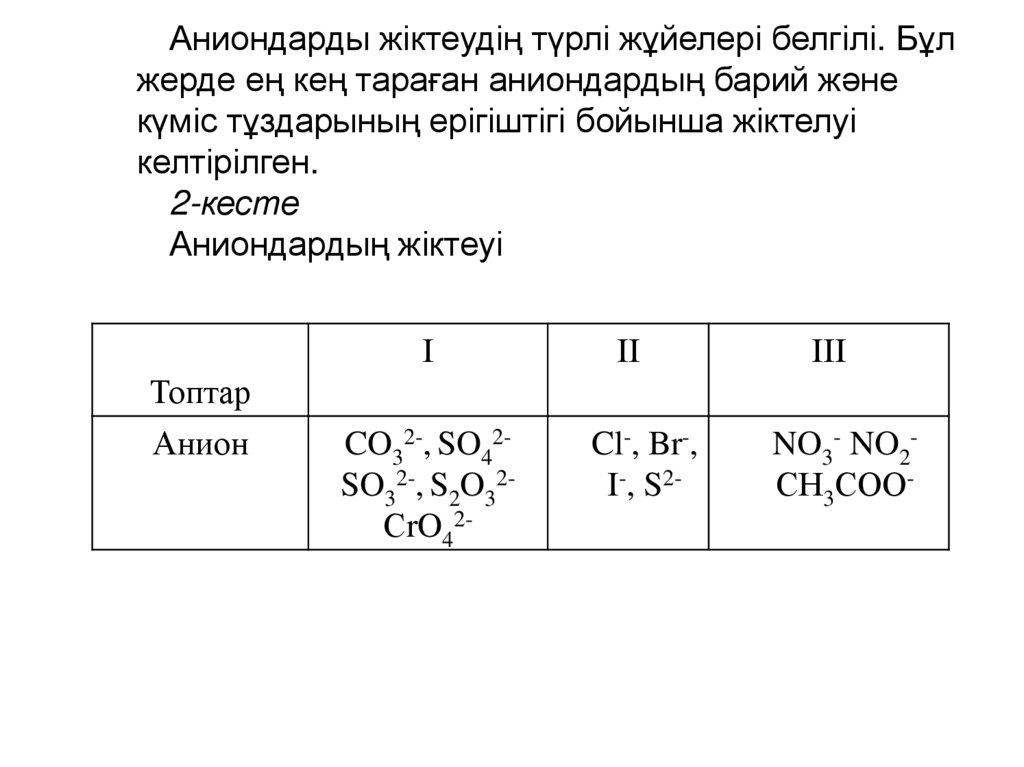
Аниондарды жіктеудің түрлі жұйелері белгілі. Бұлжерде ең кең тараған аниондардың барий және
күміс тұздарының ерігіштігі бойынша жіктелуі
келтірілген.
2-кесте
Аниондардың жіктеуі
І
Топтар
Анион
CO32-, SO42SO32-, S2O32СrO42-
ІІ
Cl-, Br-,
I-, S2-
ІІІ
NO3- NO2СН3СОО-
26.
Сапалық талдау бөлшектік және жүйеліәдістермен жүргізілуі мүмкін.
Жүйелі талдауды орындағанда операциялардың
жасалуының бірізділігін сақтайды, алдымен заттарды
топтарға бөледі, содан соң әрбір затты топ ішінен
бөліп анықтайды. Ол үшін қосылыстар немесе иондар
қасиетінің
ұқсастығына
негізделген
бөлу
реакцияларын пайдаланады. Бұл әдістің кемшілігі –
талдауға көп уақыттың жұмсалуы.
Бөлшектік анализ кезінде тек бір ғана ион
анықталады. Бұл кезде сезгіштігі жоғары селективті
реакциялар қолданылады, олар иондарды бөлетін
ұзақ реакцияларды жойып, анықтауды тезірек және
сенімді өткізуге мүмкіндік жасайды. Бірақ бұл әдістің
кемшілігі – селективті реакциялардың аз болуында,
сондықтан барлық жағдайда қолдану мүмкін емес.





















 Химия
Химия








