Похожие презентации:
«Витамины»
1.
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И
КЛИНИЧЕСКОЙ БИОХИМИИ
Лекция по теме:
«Витамины»
Краснодар
2021
2. Витамины –
низкомолекулярныеорганические соединения, не
синтезирующиеся в организме
человека и животных,
обладающие высокой
биологической активностью и
принимающие непосредственное
участие в метаболических
процессах и выполнении
физиологических функций
3. Общебиологические признаки витаминов
• Не синтезируются в организмечеловека;
• Не являются ни пластическим, ни
энергетическим материалом, но без
витаминов эти процессы невозможны;
• Обладают высокой биологической
активностью (потребность в мг);
• Организм человека чувствителен как к
избытку, так и к недостатку витаминов;
• Как избыток, так и недостаток
витаминов проявляется заболеванием
с характерной клинической картиной.
4. Название витамина:
БуквенноеХимическое
Клиническое
5. Классификация витаминов
ЖирорастворимыеА (ретинол)
Д (холекальциферол,
эргокальциферол)
Е (токоферолы)
К (филлохинон,
нафтохинон)
Водорастворимые
В1 (тиамин)
В2 (рибофлавин)
В3 (пантотеновая
кислота)
В5 (РР, никотиновая
кислота, никотинамид)
В6 (пиридоксин)
В9 (Вс фолиевая кислота)
В12 (кобаламин)
С (аскорбиновая кислота)
6. Витаминоподобные соединения:
Синтезируются в организме человека,но синтез не покрывает потребностей;
Более низкая биологическая активность
по сравнению с витаминами
(потребность в граммах);
Могут использоваться в качестве
энергетического или пластического
материала;
Организм человека чувствителен как к
избытку, так и к недостатку
витаминоподобных соединений, однако
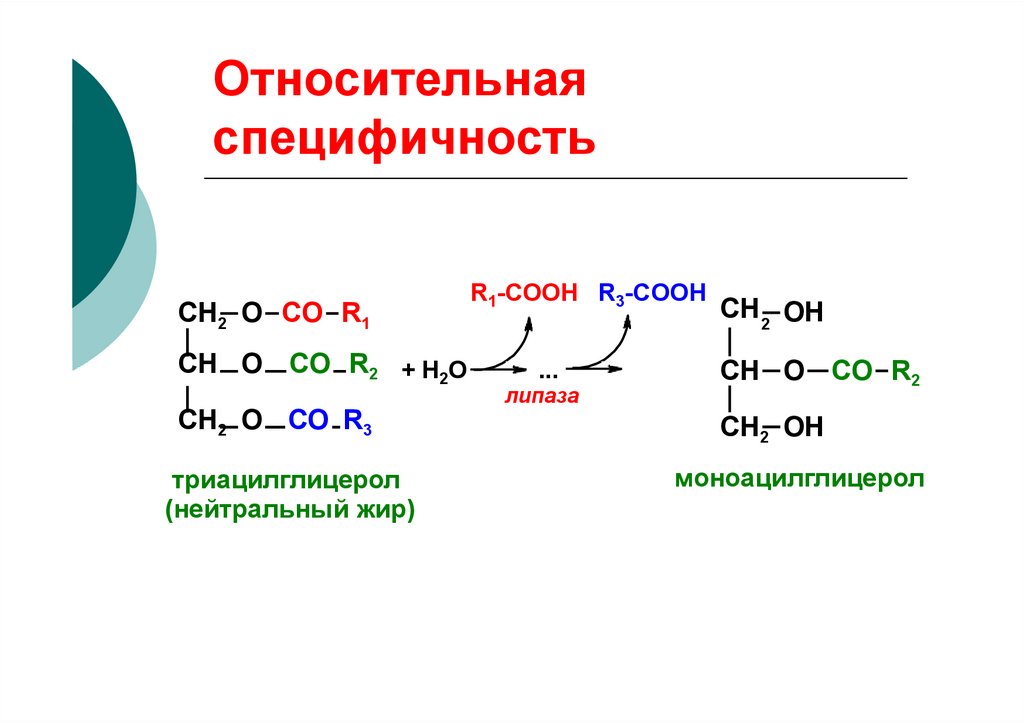
характерной клинической картины не
наблюдается.
7. Витаминоподобные соединения
ЖирорастворимыеВодорастворимые
F (полиненасыщенные жирные
кислоты)
Липоевая кислота
Q (убихинон)
Пангамовая кислота
Оротовая кислота
Инозитол
Холин
Карнитин
8. Антивитамины –
соединения, близкие к витаминампо химическому строению, но
обладающие противоположным
биологическим действием. При
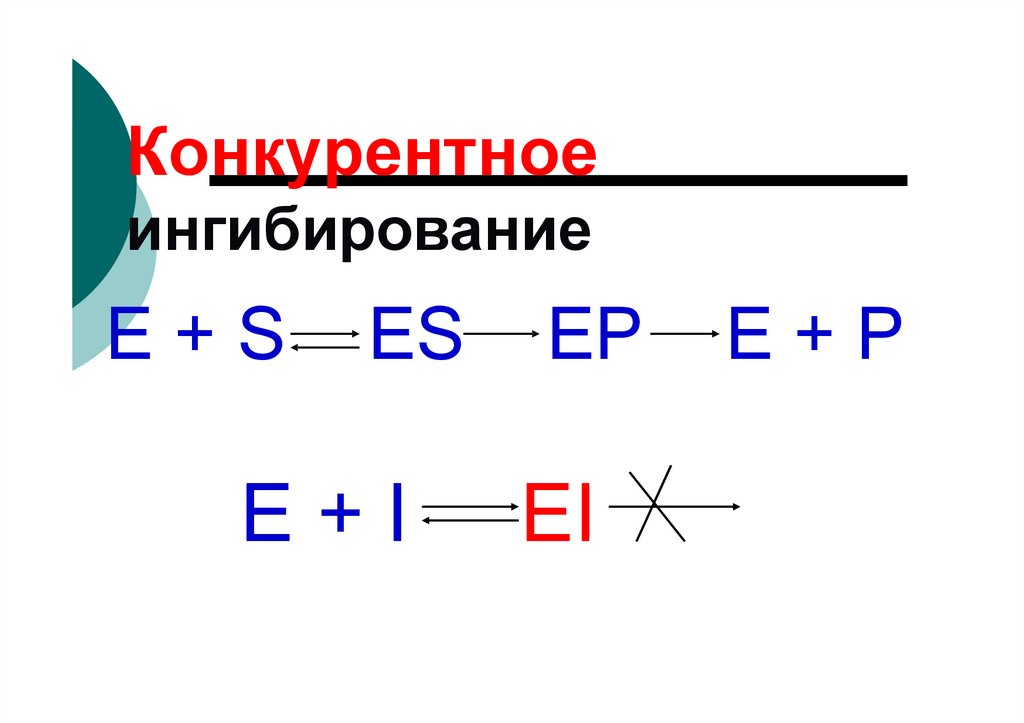
попадании в организм
антивитамины включаются вместо
витаминов в реакции обмена
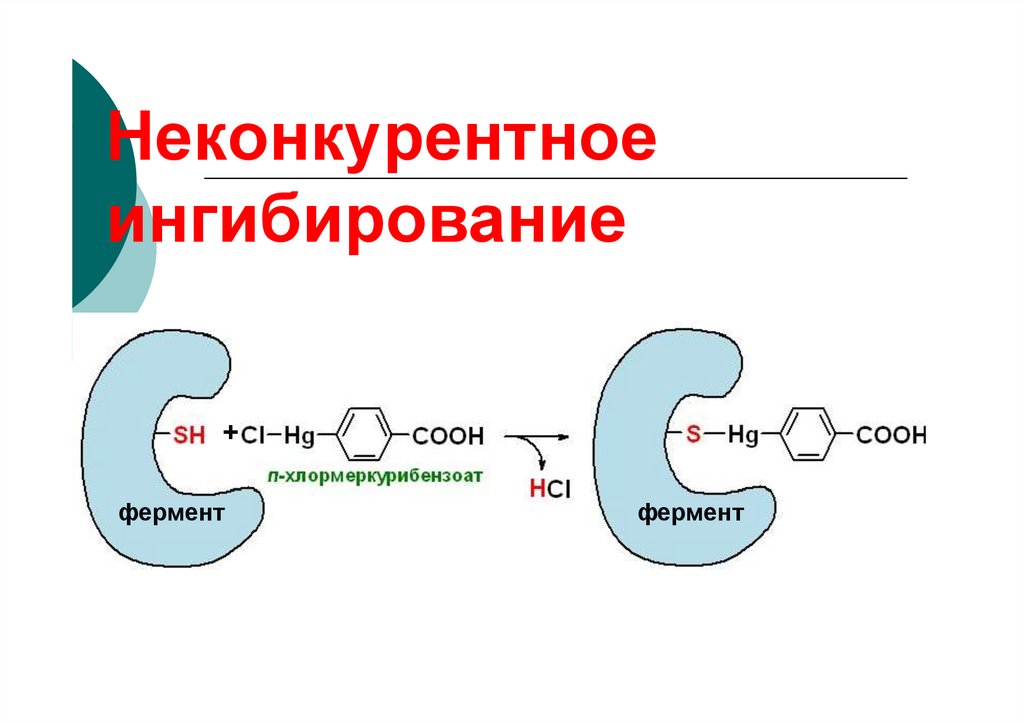
веществ и тормозят или нарушают
их нормальное течение.
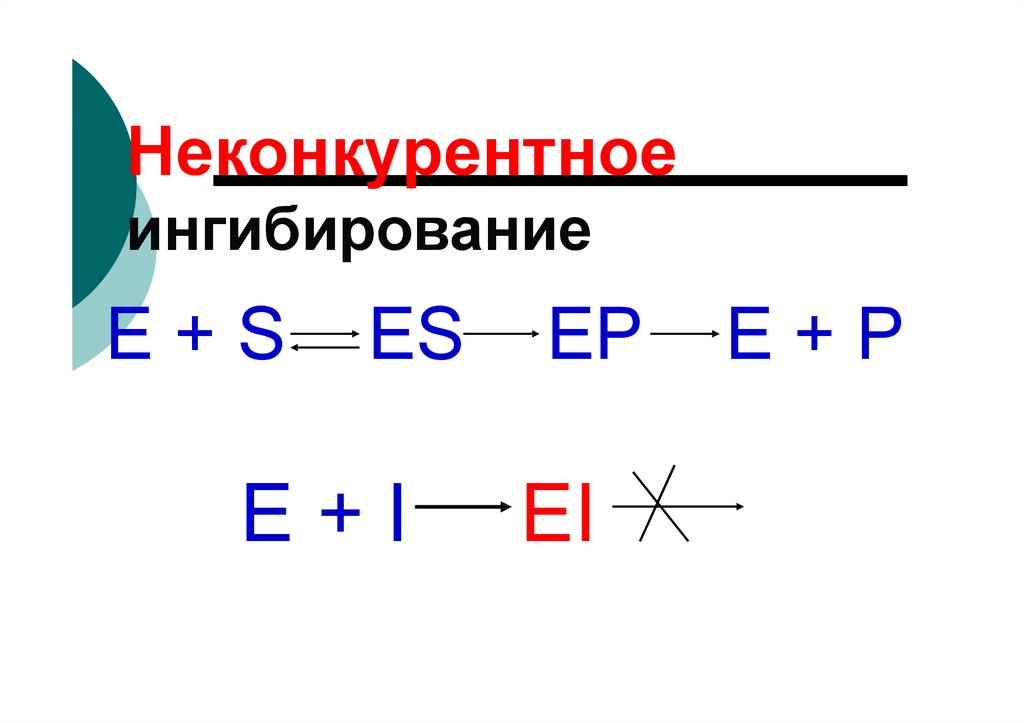
9. Источники витаминов для человека
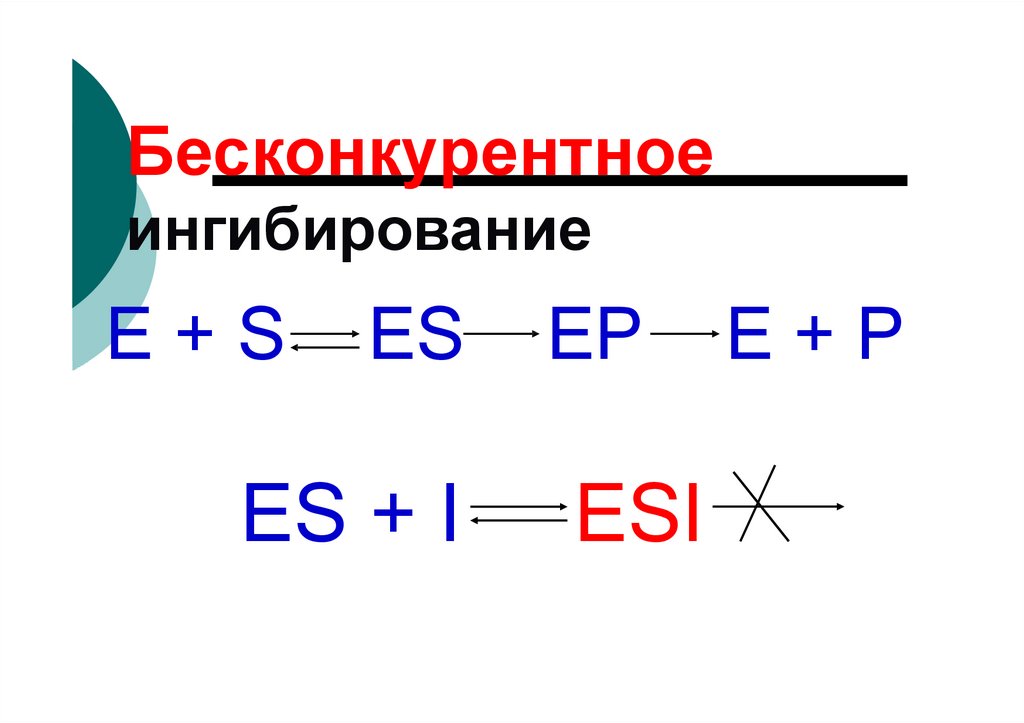
Пища животного ирастительного происхождения;
Провитамины – соединения,
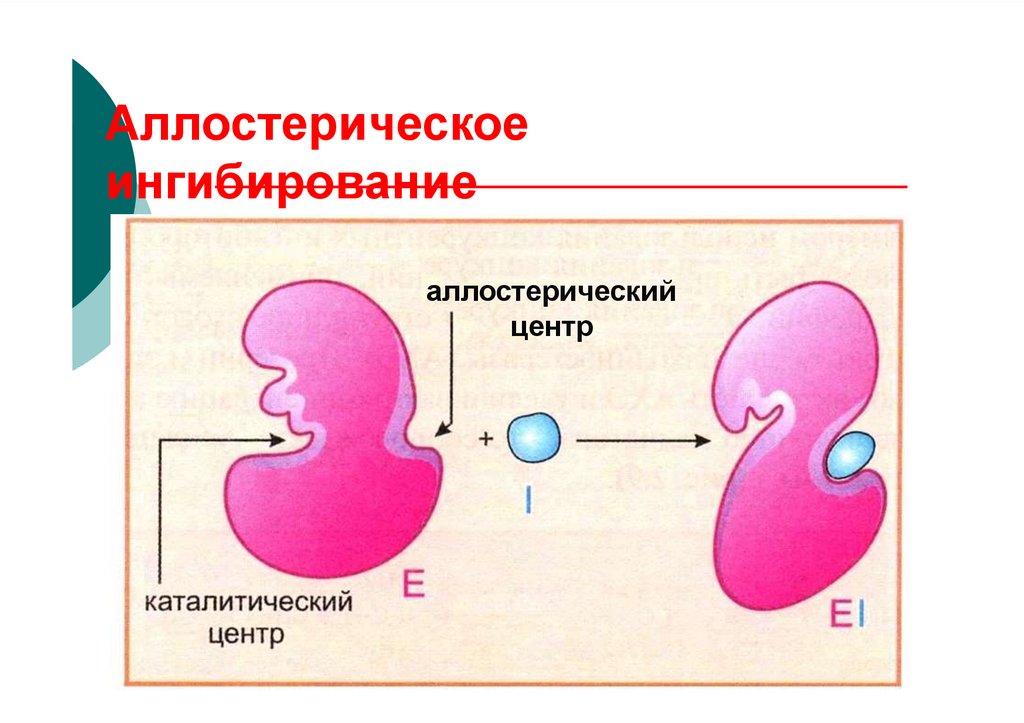
содержащие в своей структуре
витамин, но не обладающие
биологической активностью;
Микрофлора толстого
кишечника;
Медикаментозные формы.
10. Нарушения обмена витаминов
Гипо(а)витаминозы –заболевания, возникающие
вследствие недостатка или
отсутствия витаминов в
организме.
Гипервитаминозы –
переизбыток витаминов в
организме.
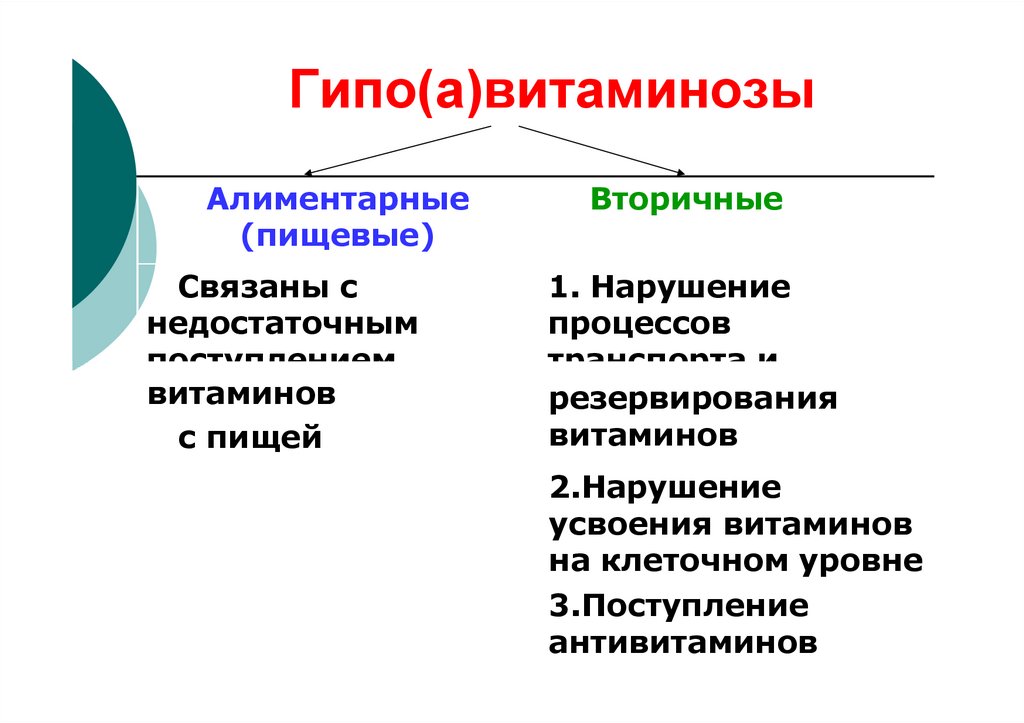
11. Гипо(а)витаминозы
Алиментарные(пищевые)
Связаны с
недостаточным
поступлением
витаминов
с пищей
Вторичные
1. Нарушение
процессов
транспорта и
резервирования
витаминов
2.Нарушение
усвоения витаминов
на клеточном уровне
3.Поступление
антивитаминов
12. Типы гипо(а)витаминозов
Витаминдефицитные состояния –заболевания, обусловленные
дефицитом в пище того или иного
витамина. Это экзогенные гипо- и
авитаминозы. Лечат введением
лечебных доз витамина.
13. Типы гипо(а)витаминозов
Витаминзависимые состояния –заболевания, в основе которых лежит
дефект ферментов, обеспечивающих
превращение витамина в активную
форму, или снижена
чувствительность клеточных
рецепторов к активной форме
витамина. Лечат витаминзависимые
состояния введением сверхбольших
доз витаминов.
14. Типы гипо(а)витаминозов
Витаминрезистентные состояния —генетически обусловленные
заболевания, характеризующиеся
неспособностью организма усваивать
витамин на клеточном уровне
(отсутствие фермента, превращающего
витамин в кофермент или в активную
форму, отсутствие рецепторов,
воспринимающих активную форму
витамина). Лечение витаминами
неэффективно.
15. Общая характеристика жирорастворимых витаминов:
Растворяются в жирах;Легко всасываются, но для их всасывания
необходимы жиры (как растворитель) и
жёлчные кислоты;
В организме человека имеется депо (печень,
жировая ткань);
Возможно развитие как гипер-, так и
гиповитаминоза, но более характерен
гипервитаминоз;
Каждый жирорастворимый витамин работает
по индивидуальному механизму;
Молекулярные аспекты действия некоторых
из них до конца не выяснены.
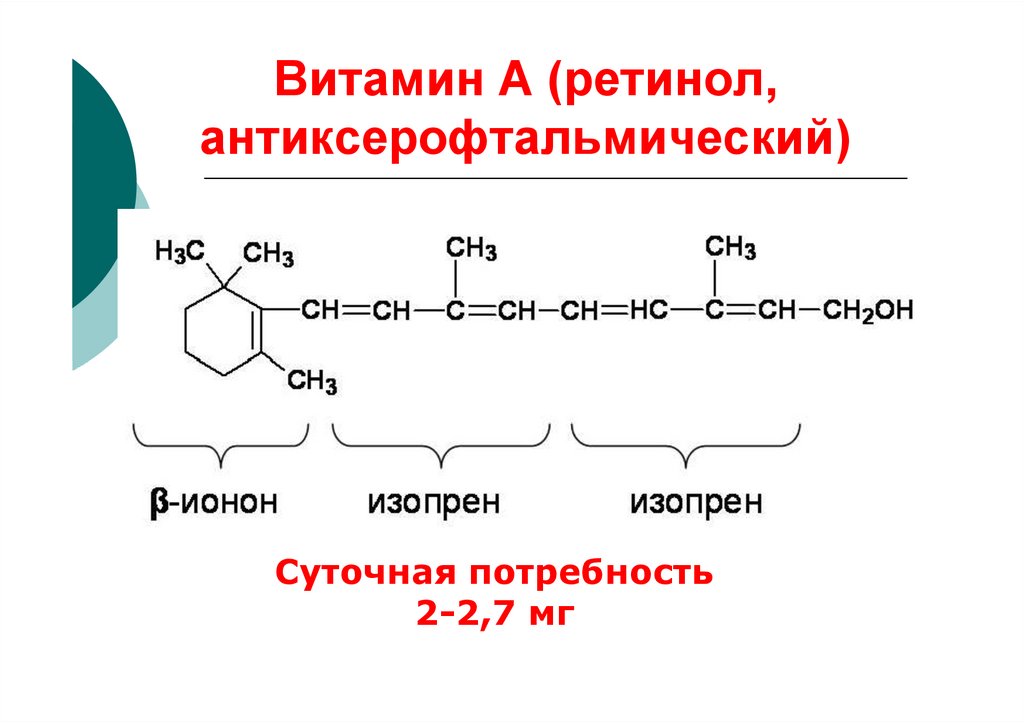
16. Витамин А (ретинол, антиксерофтальмический)
Суточная потребность2-2,7 мг
17. Источники витамина А
Печень крупного рогатого скотаи свиней;
Яичный желток;
Молочные продукты;
Рыбий жир;
В виде провитаминов –
каротиноидов содержится в
моркови, томатах, перце, салате.
18. Биологические функции витамина А
19. Клинические проявления гиповитаминоза
Нарушение сумеречного зрения «куриная слепота» или гемералопия;Сухость роговицы – ксерофтальмия;
Размягчение роговицы –
кератомаляция;
Дерматиты;
Кератоз эпителиальных клеток всех
органов (кожи, эпителия ЖКТ,
мочеполовой системы, дыхательного
аппарата).
20. Гипервитаминоз витамина А
кожные высыпания, шелушение кожи,гиперкератоз
выпадение волос
общее истощение организма
тошнота и рвота
воспаление глаз
увеличение содержания холестерина в
крови
нарушение работы почек и
мочевыводящей системы
тератогенное действие
21. Витамин Е, токоферол, антистерильный (витамин размножения)
Суточная потребность5 мг
22. Источники витамина Е
Растительные масла;Салат;
Капуста;
Семена злаков;
Сливочное масло;
Яичный желток.
23. Биологическая роль витамина Е
Природныйантиоксидант:
Предотвращает
повреждение
липидов мембран и ДНК;
Повышает
биологическую
активность витамина А за счет
предотвращения окисления
его ненасыщенной боковой
цепи.
24. Клинические проявления гиповитаминоза:
Бесплодие;Поражение
нервной
системы, атаксия,
мышечная дистрофия
25.
Гипервитаминоз витамина Еголовная
боль
повышенная
утомляемость
расстройства работы
желудочно-кишечного
тракта
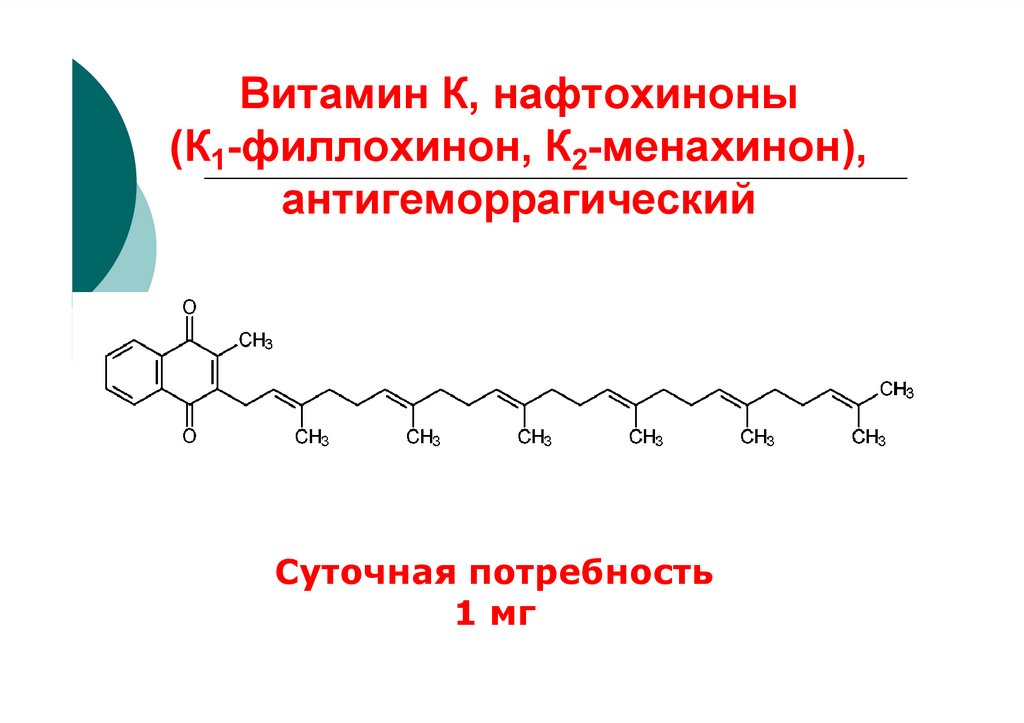
26. Витамин К, нафтохиноны (К1-филлохинон, К2-менахинон), антигеморрагический
Суточная потребность1 мг
27. Источники витамина К
Капуста;Шпинат;
Корнеплоды;
Фрукты;
Печень;
Микрофлора толстого
кишечника.
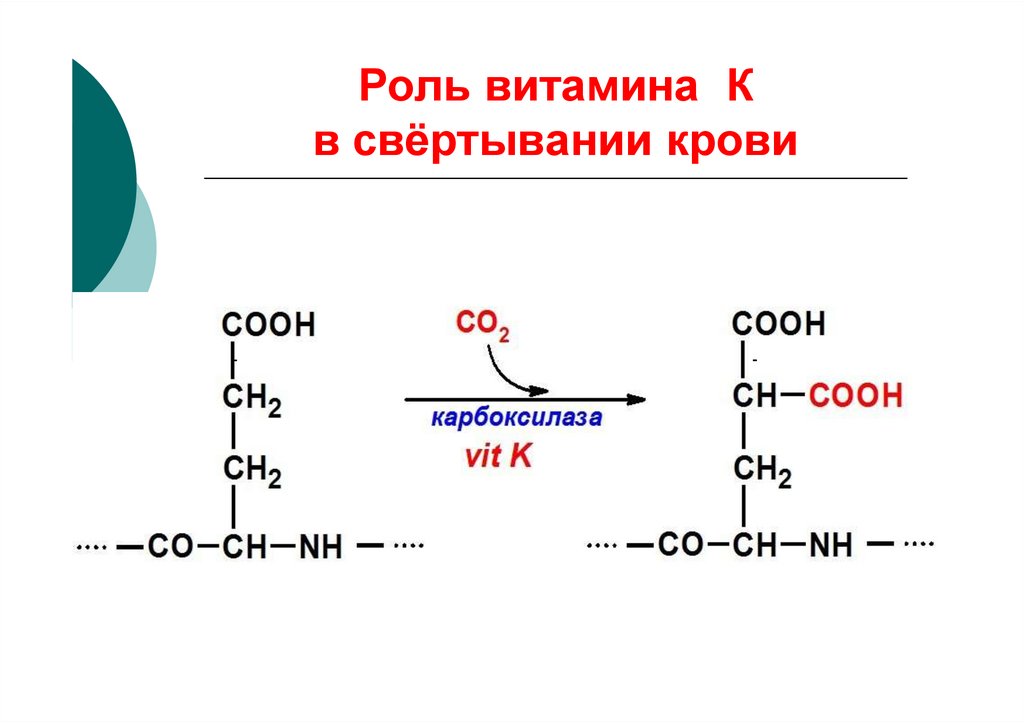
28. Роль витамина К в свёртывании крови
Стимулирует синтез II, VII, IXи X факторов свёртывания
крови в печени
Обеспечивает
карбоксилирование этих
факторов для лучшего
взаимодействия с ионами
Са2+
29. Роль витамина К в свёртывании крови
COOHСН2
СН2
CO СН NН
СО2
карбоксилаза
vit K
COOH
СН COOH
СН2
CO СН NН
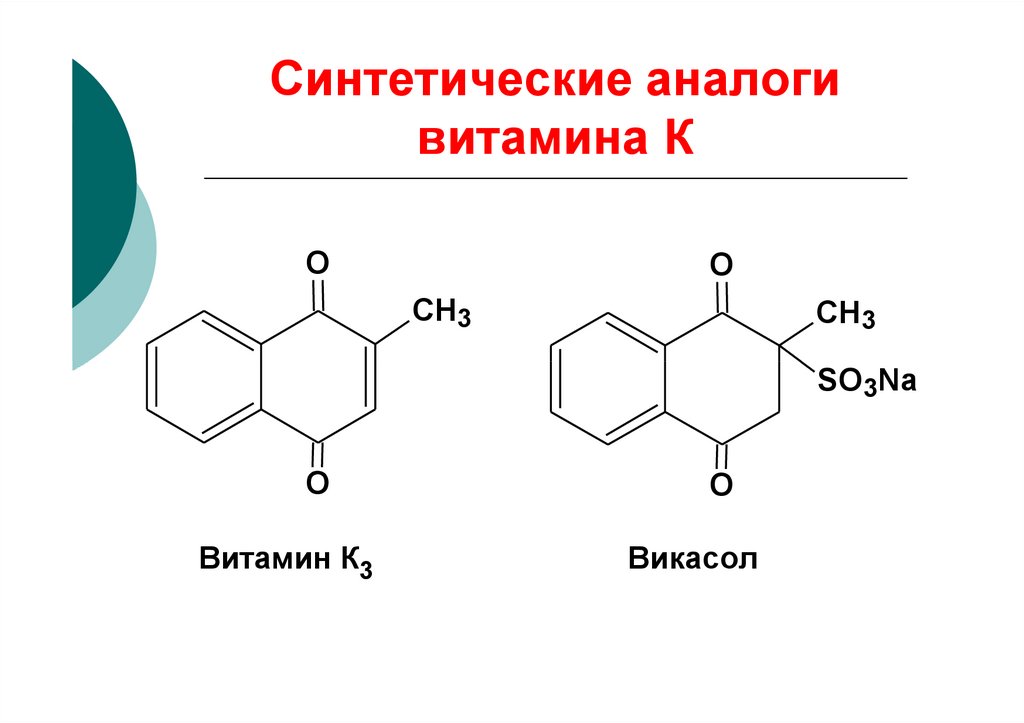
30. Синтетические аналоги витамина К
OO
CH3
CH3
SO3Na
O
Витамин К3
O
Викасол
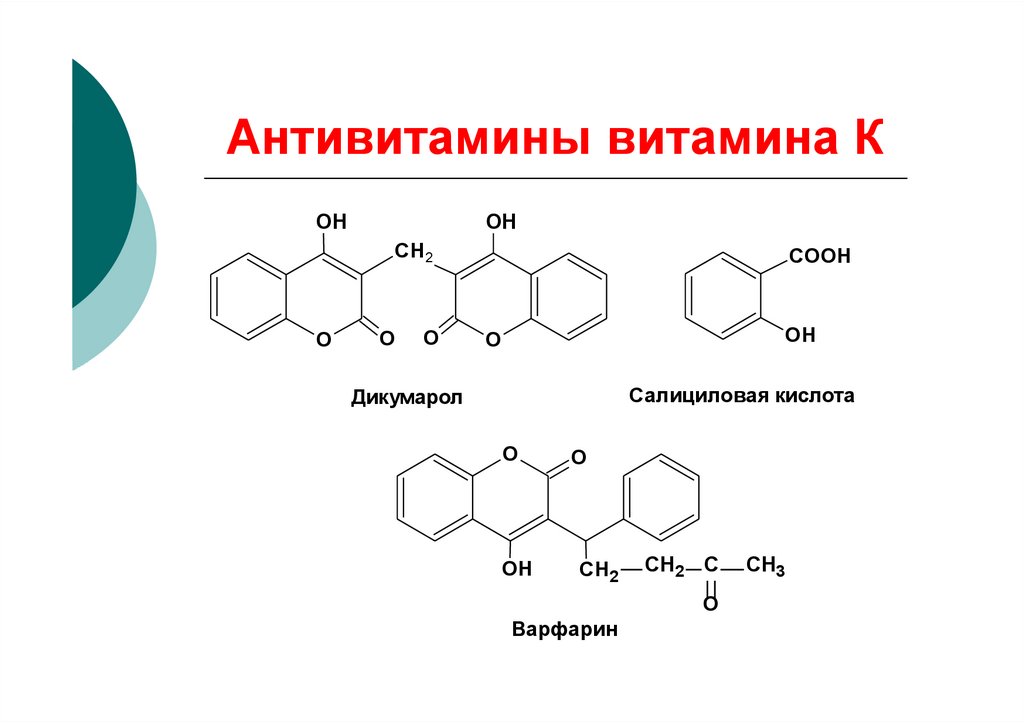
31. Антивитамины витамина К
OHOH
СН2
O
O
O
COOH
OH
O
Салициловая кислота
Дикумарол
O
OH
O
СН2
СН2 С
O
Варфарин
CH3
32. Витамин Д (кальциферолы, антирахитический)
CH3CH3
CH3
H2
CH3
CH2
CH3
HO
CH3
холекальциферол, Д3
CH3
HO
CH3
эргокальциферол, Д2
Суточная потребность
0,01-0,025 мг
CH3
33. Источники витамина Д
СливочноеЖелток
Рыбий
Синтез
масло;
яиц;
жир;
в организме из
7-дегидрохолестерина.
34. Превращение провитаминов в витамины Д
CH3CH3
CH3
УФО
CH3
HO
CH3
H3C
CH2
HO
CH3
CH3
УФО
CH3
CH3
H3C
Витамин Д3
(холекальциферол)
7-дегидрохолестерин
CH3
CH3
CH3
CH2
CH3
HO
H3C
эргостерин
CH3
CH3
HO
H3C
Витамин Д2
(эргокальциферол)
CH3
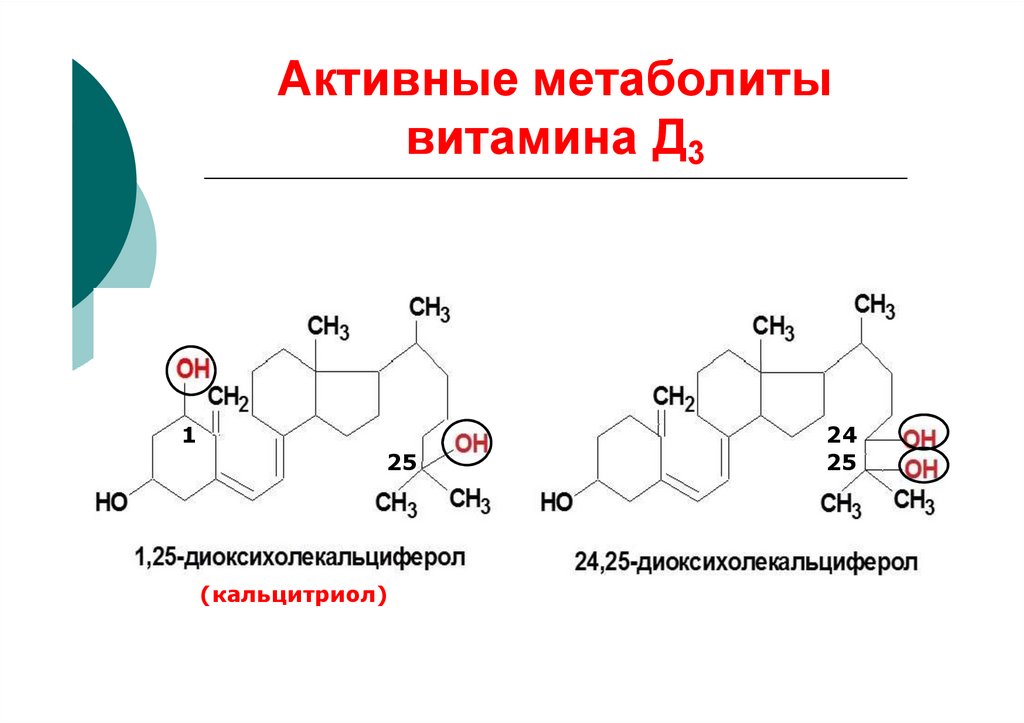
35. Активные метаболиты витамина Д3
125
(кальцитриол)
24
25
36. Метаболизм витамина Д3
кальциферол(Д3)
кишечник
(всасывание Са и Р)
25-оксикальциферол
(кальцидиол)
почки
(реабсорбция Са и Р)
1,25-диоксикальциферол
(кальцитриол)
костная ткань
(регуляция
обмена Са и Р)
37. Гипервитаминоз витамина Д
кальцификациякрупных
артерий, почек, сердца и
легких
в
костях – остеопороз с
отложениями кальция
вокруг суставов
38. Общебиологические свойства водорастворимых витаминов
Не накапливаются в организмечеловека;
Для них более характерны
гипо(а)витаминозы;
Являются составной частью
активного центра ферментов;
Часть из них требуют особых
механизмов всасывания.
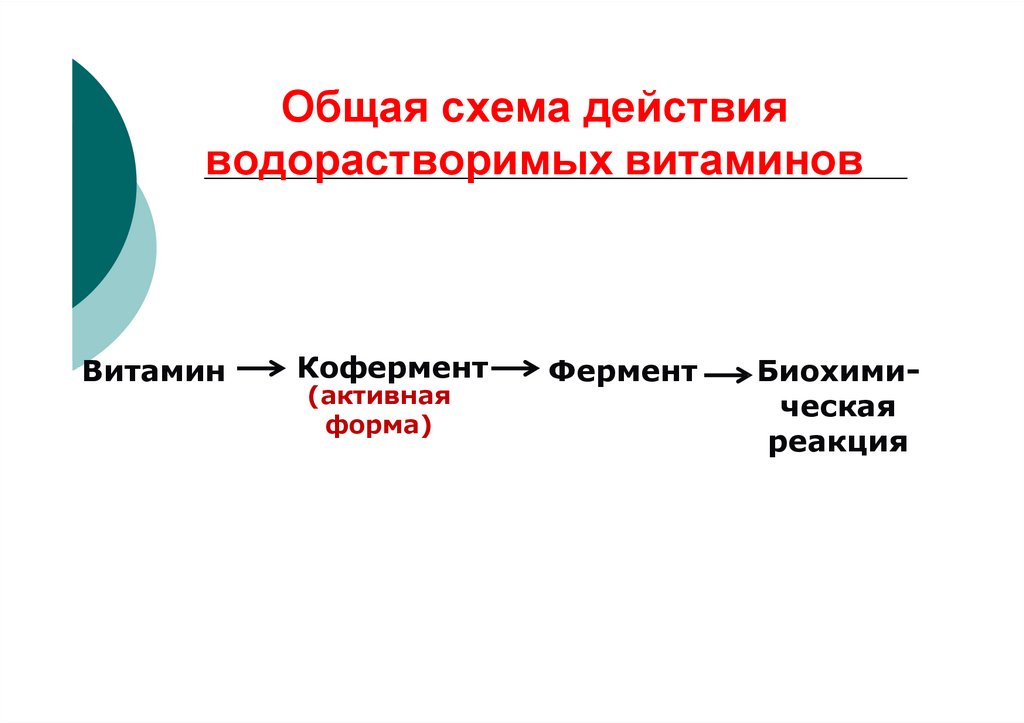
39. Общая схема действия водорастворимых витаминов
ВитаминКофермент
(активная
форма)
Фермент
Биохимическая
реакция
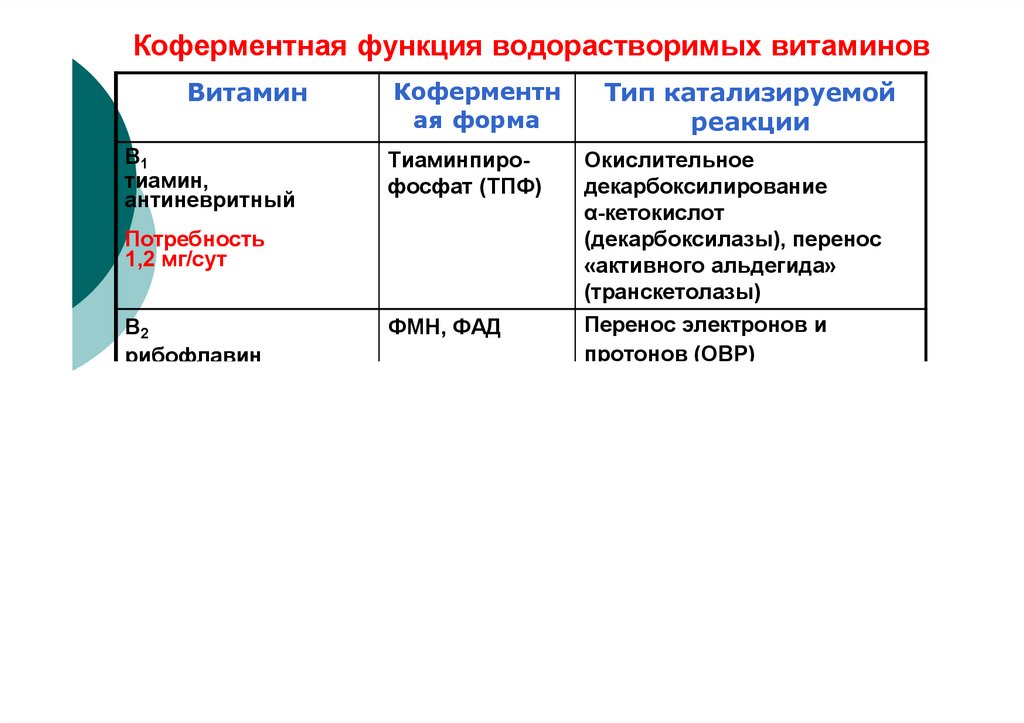
40. Коферментная функция водорастворимых витаминов
ВитаминВ1
тиамин,
антиневритный
Коферментн
ая форма
Тиаминпирофосфат (ТПФ)
Потребность
1,2 мг/сут
Тип катализируемой
реакции
Окислительное
декарбоксилирование
α-кетокислот
(декарбоксилазы), перенос
«активного альдегида»
(транскетолазы)
Перенос электронов и
протонов (ОВР)
(дегидрогеназы и оксидазы)
В2
рибофлавин
1,7 мг/сут
ФМН, ФАД
В3
пантотеновая
кислота,
антидерматитный
3-5 мг/сут
Кофермент
(коэнзим) А
(КоА)
Перенос ацильных групп
(ацилтрансферазы)
В5 (РР) никотиновая
кислота, антипеллагрический
15-18 мг/сут
НАД, НАДФ
Перенос электронов и
протонов (ОВР)
(дегидрогеназы)
41.
В6пиридоксин
антидерматитный
1-2 мг/сут
Пиридоксальфосфат (ПФ)
Перенос аминогрупп
(аминотрансферазы),
декарбоксилирование
аминокислот (декарбоксилазы)
В9
фолиевая кислота,
антианемический
1-2,2 мг/сут
Тетрагидрофолиевая
кислота
(ТГФК)
Перенос одноуглеродный групп
(метилтрансферазы)
В12
кобаламин,
антианемический
0,003 мг/сут
Дезоксиаденозилкобаламин,
метилкобаламин
Изомеризация (изомеразы),
перенос одноуглеродный групп
(метилтрансферазы)
С аскорбиновая
кислота,
антискорбутный
75 мг/сут
Н (ВН)
биотин
антисеборрейный
0,25 мг/сут
Гидроксилирование
(гидроксилазы)
Биотинкофермент
Перенос карбоксильной группы
(транскарбоксилазы),
фиксация СО2 – образование
карбоксильной группы
(карбоксилазы)
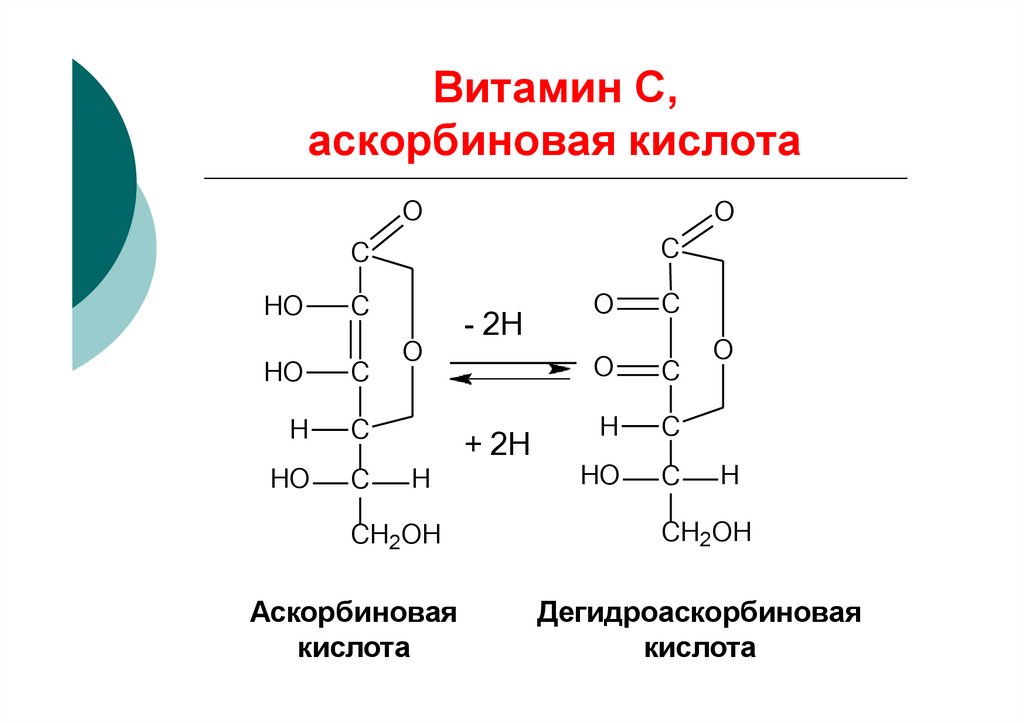
42. Витамин С, аскорбиновая кислота
OO
С
С
HO
С
HO
С
H
С
HO
С
O
- 2Н
+ 2Н
H
СН2ОН
Аскорбиновая
кислота
O
С
O
С
H
С
HO
С
O
H
СН2ОН
Дегидроаскорбиновая
кислота
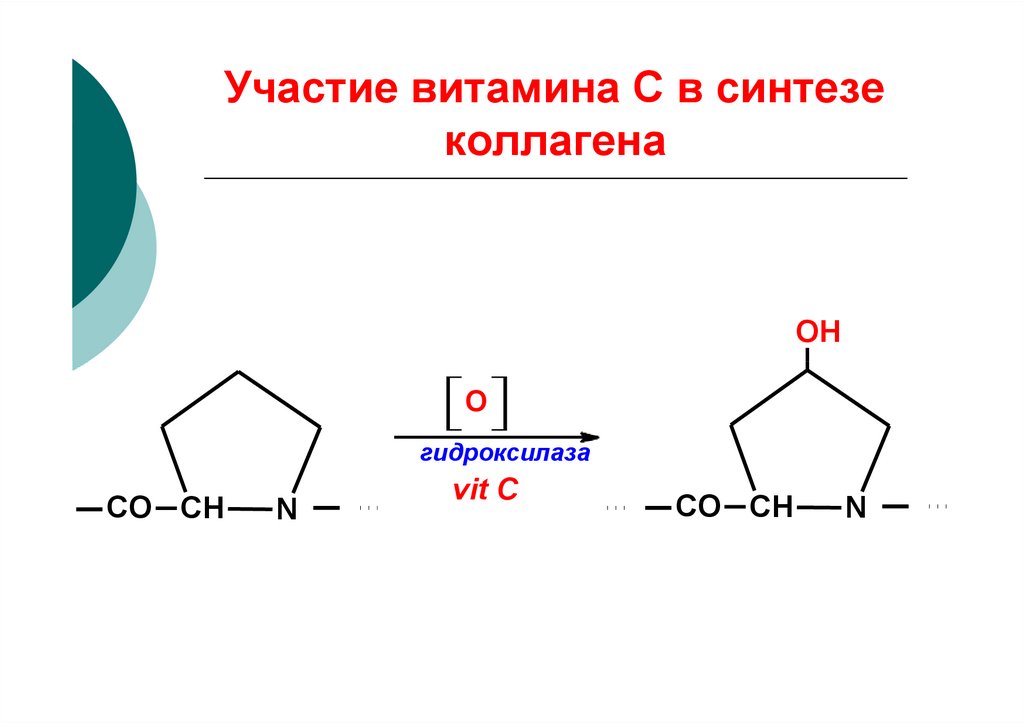
43. Участие витамина С в синтезе коллагена
OHО
гидроксилаза
CO СН
N
vit С
CO СН
N
44. Проявления гиповитаминоза С
45.
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ
БИОХИМИИ
ЛЕКЦИЯ по теме:
ФЕРМЕНТЫ – 1
КРАСНОДАР
2016
46. Ферменты –
это биокатализаторыбелковой природы,
изменяющие скорость
химических реакций в
живых клетках
47. Свойства ферментов как белков
Имеют высокую молекулярнуюмассу
Образуют коллоидные растворы
Термолабильны
Обладают высокой вязкостью,
оптическими свойствами
Могут обратимо и необратимо
осаждаться и т.д.
48. Свойства ферментов как катализаторов
Катализируют только термодинамическивозможные реакции
Не потребляются в ходе реакции и не входят
в состав конечных продуктов
В случае обратимости реакции ускоряют и
прямую и обратную реакции
Ведут реакцию «в обход энергетического
барьера»
Чувствительны к изменению параметров
проведения реакции (температуре, рН,
концентрации катализатора и реагирующих
веществ)
Чувствительны к действию эффекторов –
активаторов и ингибиторов
49. Собственные свойства ферментов
Высокая биологическая активностьФерментная специфичность
действия
субстратная
Иная зависимость от факторов,
влияющих на скорость реакции
Наличие механизмов регуляции
активности
50.
51. Ферменты
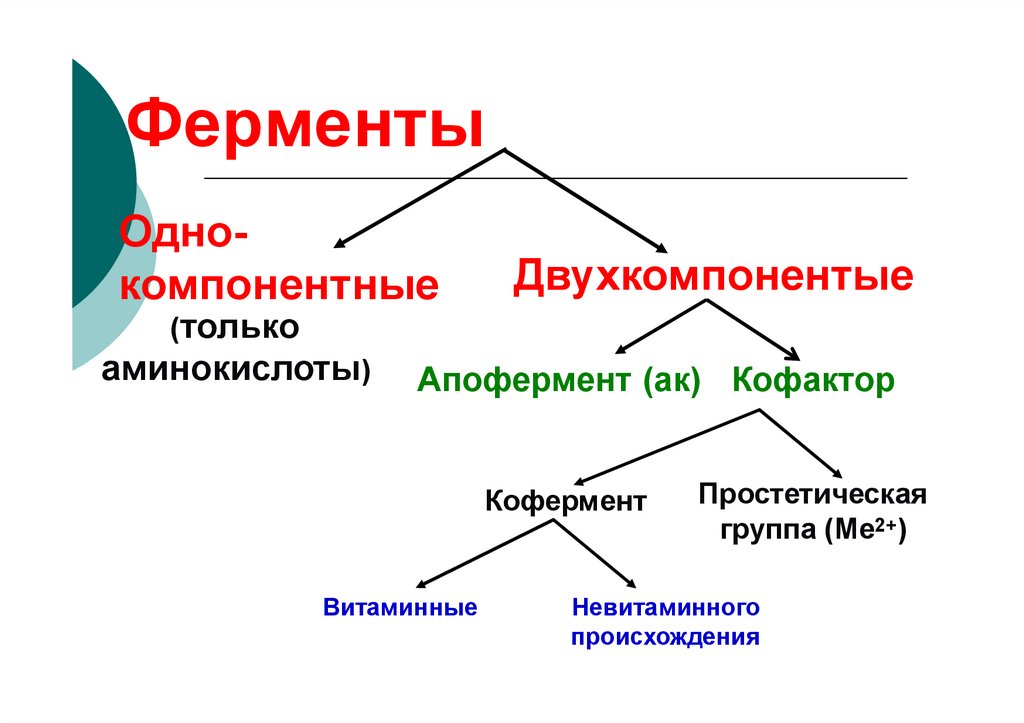
ОднокомпонентныеДвухкомпонентые
(только
аминокислоты)
Апофермент (ак) Кофактор
Кофермент
Витаминные
Простетическая
группа (Ме2+)
Невитаминного
происхождения
52. Строение активного центра фермента
субстратучасток
связывания
каталитический
участок
активный центр
фермент
53. Активный центр –
участок молекулы фермента, вкотором происходит узнавание,
связывание и химическое
превращение молекулы субстрата.
У однокомпонентного фермента
активный центр образован
радикалами аминокислот, у
двухкомпонентного – и
радикалами аминокислот, и
кофактором
54. Активный центр фермента
55. Образование фермент- субстратного комплекса согласно модели «жесткой
Образование ферментсубстратного комплексасогласно модели «жесткой
матрицы» Фишера
E
S
ES
56.
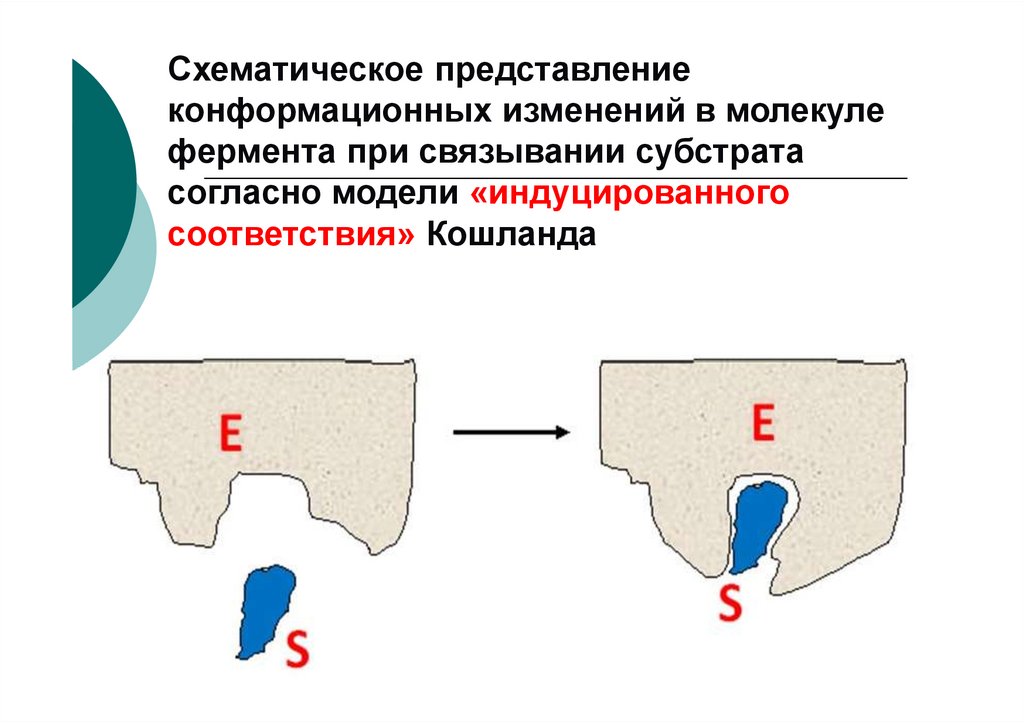
Схематическое представлениеконформационных изменений в молекуле
фермента при связывании субстрата
согласно модели «индуцированного
соответствия» Кошланда
57.
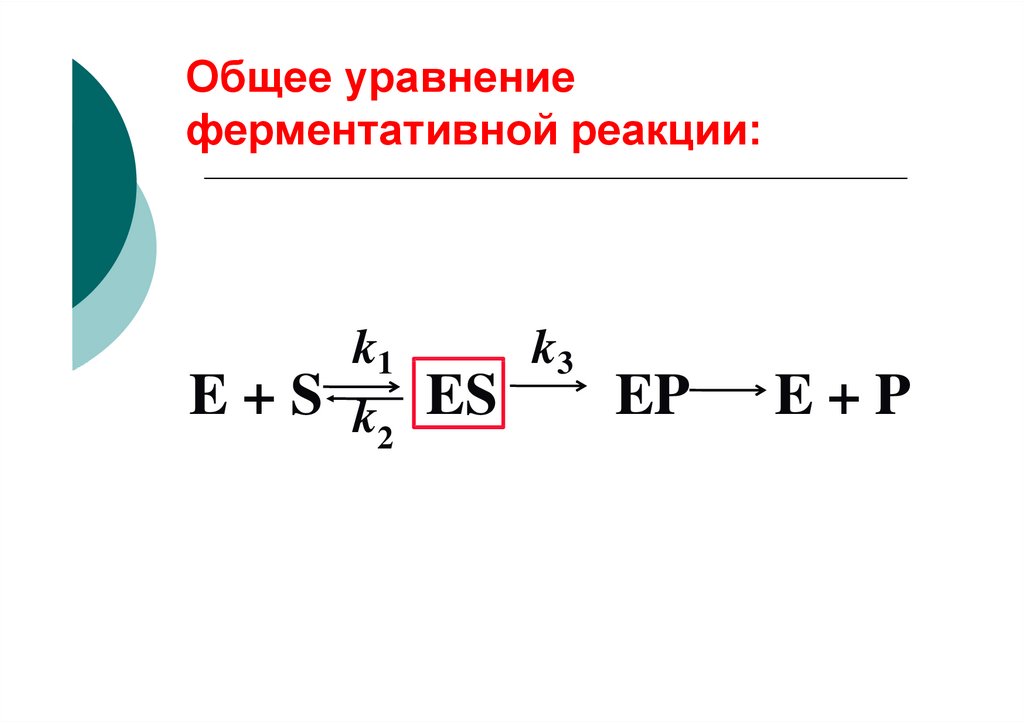
Общее уравнениеферментативной реакции:
k1
E + S k ES
2
k3
EP
E+P
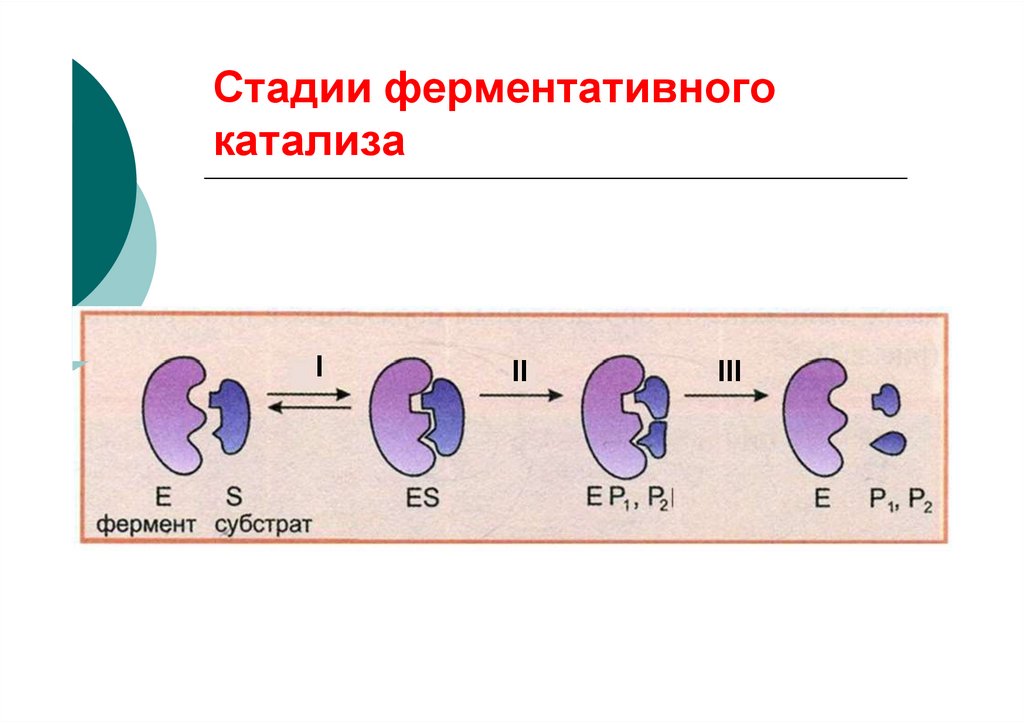
58. Стадии ферментативного катализа
III
III
59. Эффекты активного центра
1. Эффект напряжения («дыбы»)2. Эффект концентрации
3. Эффект ориентации
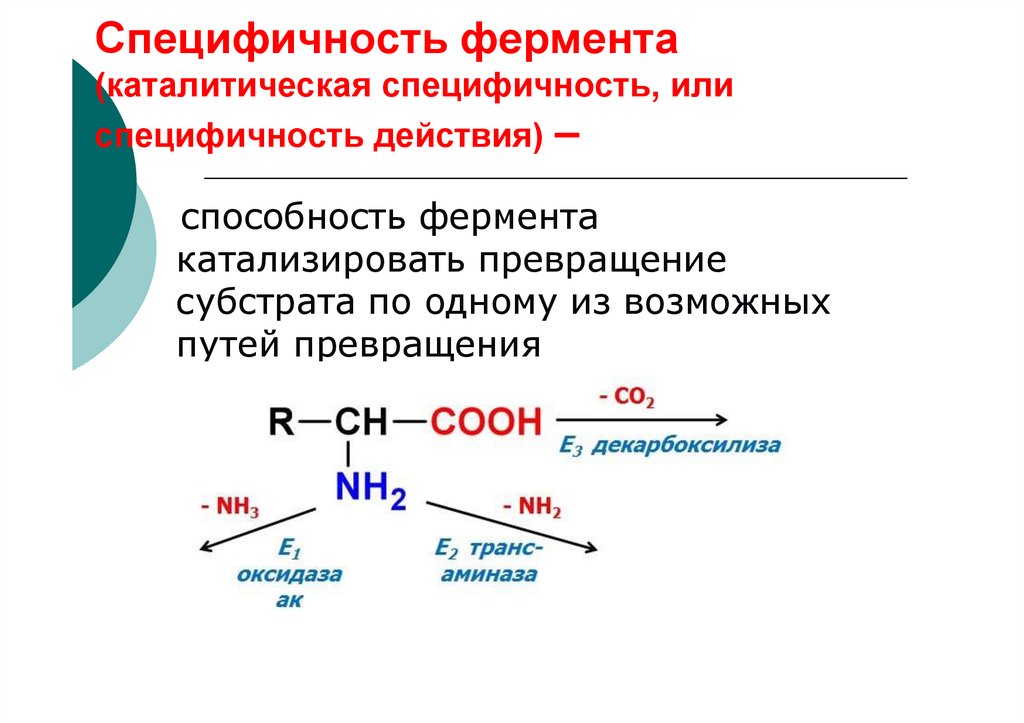
60. Специфичность фермента (каталитическая специфичность, или специфичность действия) –
способность ферментакатализировать превращение
субстрата по одному из возможных
путей превращения
61. Специфичность фермента
(субстратная специфичность) –способность фермента
узнавать, связывать и
катализировать превращение
только определённых
субстратов, м.б.
• абсолютная,
• относительная,
• стереоспецифичность.
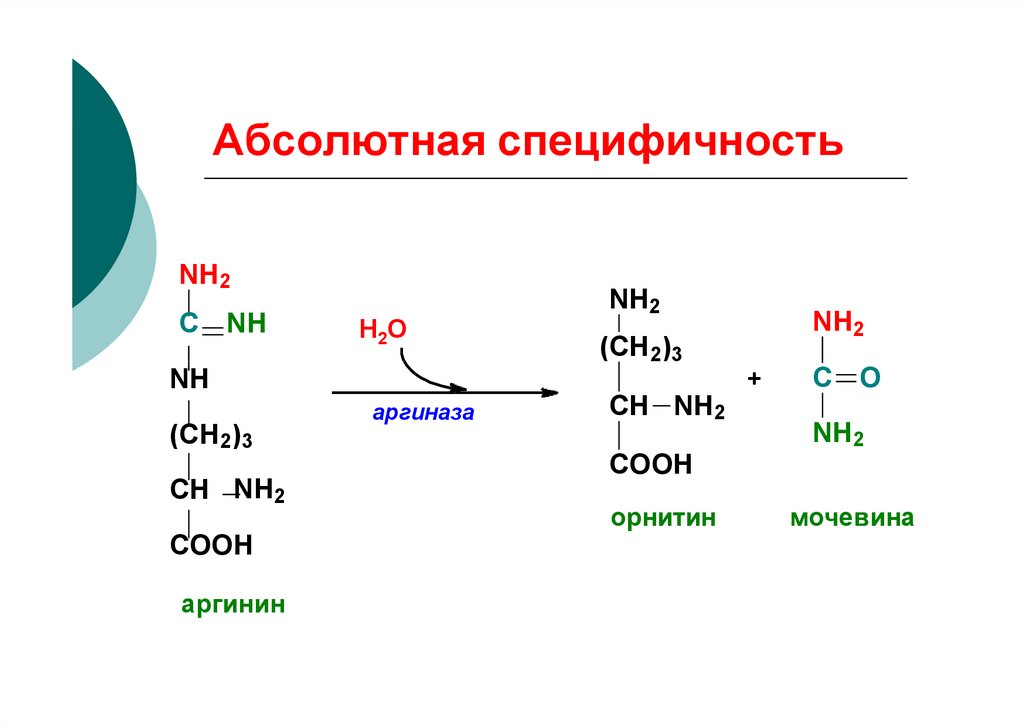
62. Абсолютная специфичность
NH2С
NH
Н2 О
NH
(СН2)3
СН NH2
COOH
аргинин
аргиназа
NH2
NH2
(СН2)3
СН NH2
+
С O
NH2
COOH
орнитин
мочевина
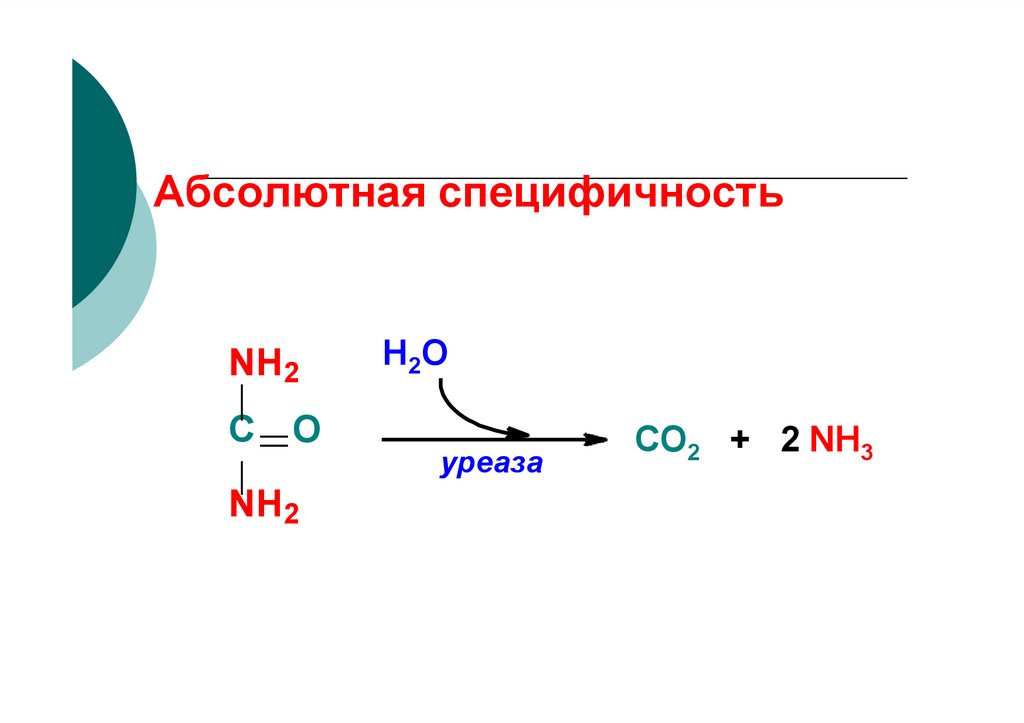
63. Абсолютная специфичность
NH2С O
NH2
Н 2О
уреаза
СО2 + 2 NH3
64. Относительная специфичность
СН2 O CО R1СН O CО R2 + Н2О
СН2 O СО R3
триацилглицерол
(нейтральный жир)
R1-COOH R3-COOH
...
липаза
СН 2 OH
СН O CО R2
СН2 OH
моноацилглицерол
65. Стереоспецифичность
66.
Общее уравнениеферментативной реакции:
E+S
k1
k2
ES
k3
EP
E+P
67. Константа Михаэлиса
68. Зависимость скорости ферментативной реакции от
концентрации субстрата69.
70. График зависимости скорости ферментативной реакции от концентрации субстрата
71. Зависимости скорости ферментативной реакции от концентрации фермента
VE
72. Зависимость скорости ферментативной реакции от температуры
opt to≈ 40oC73. Зависимость скорости ферментативной реакции от рН среды
Vколоколообразная
зависимость
pH opt
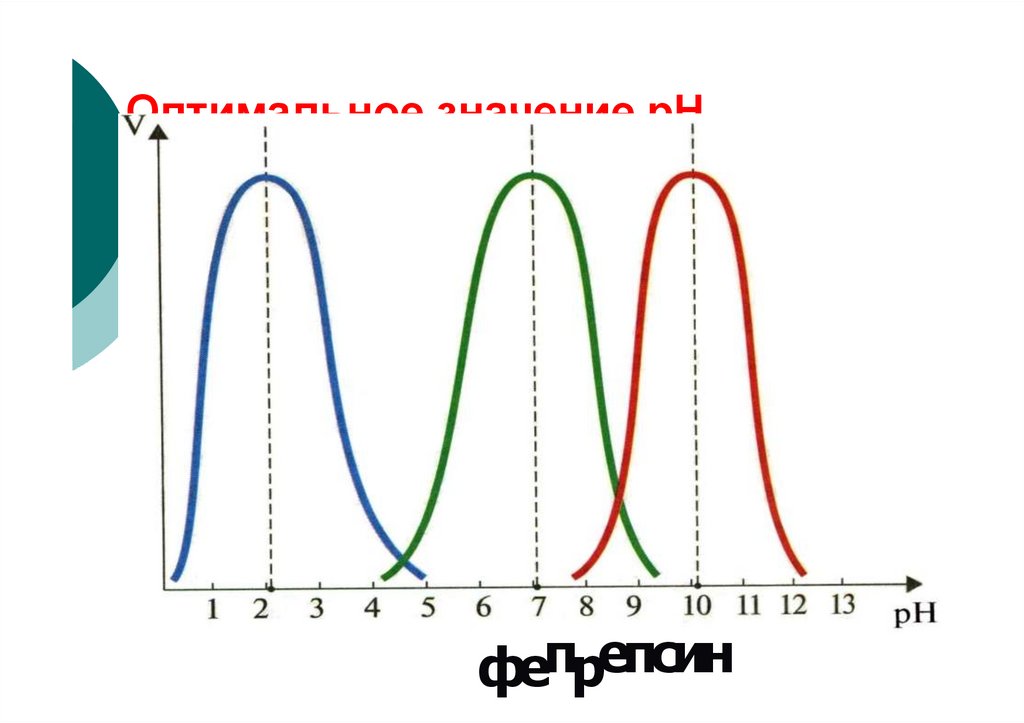
pH
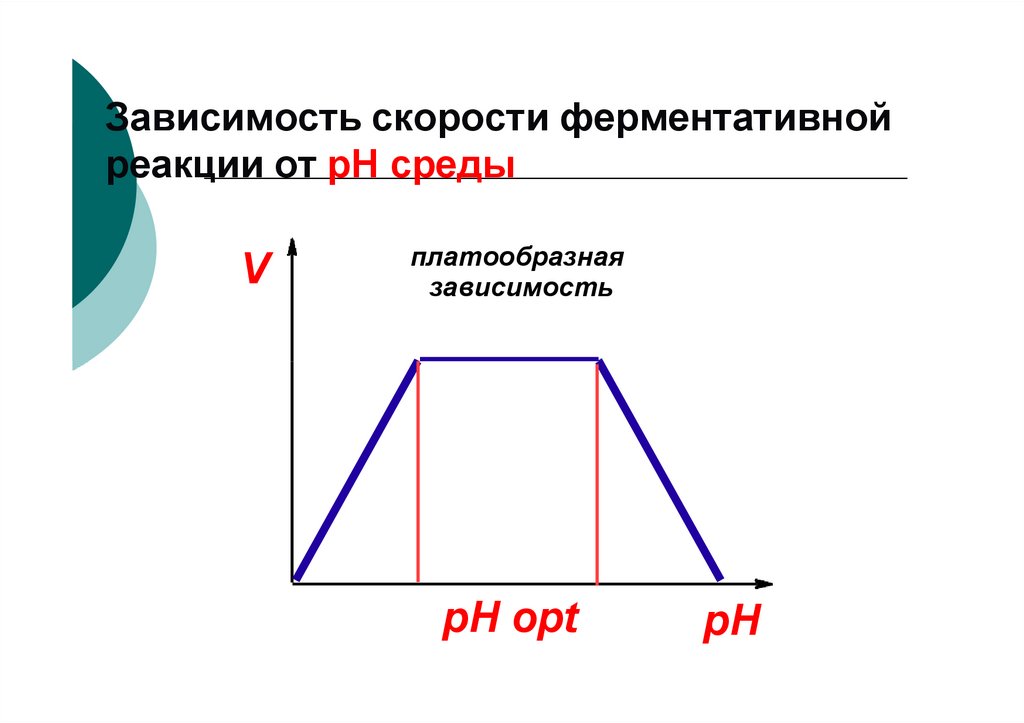
74. Зависимость скорости ферментативной реакции от рН среды
Vплатообразная
зависимость
pH opt
pH
75.
Зависимость скоростиферментативной реакции от рН среды
V
пикообразная
зависимость
pH opt
pH
76.
Оптимальное значение рНфепрепсин
77.
активаторыобратимые
ингибиторы
необратимые
78.
Неорганическиевещества
Низкомолекулярны
е органические
вещества
Белки
79. Основные механизмы действия активаторов
Площадкадля
взаимодействия
фермента и субстрата
Повышение
сродства
фермента и субстрата
Отщепление
ингибитора
80. Механизмы ингибирования
КонкурентноеНеконкурентное
Бесконкурентно
е
Субстратное
Аллостерическо
81. Конкурентное ингибирование
82.
Конкурентноеингибирование
E+S
ES
E+I
EP
EI
E+P
83. Фолиевая кислота (В9)
OHN
N
СН2 NH
СО NH СН (СН2)2 COOH
COOH
H2N
N
N
и её антивитамины
H 2N
SО2 NH R
Сульфаниламид
84. Неконкурентное ингибирование
85. Неконкурентное
ингибирование+
фермент
фермент
86.
Неконкурентноеингибирование
E+S
ES
E+I
EP
EI
E+P
87.
Бесконкурентноеингибирование
E+S
ES
ES + I
EP
ESI
E+P
88. Субстратное ингибирование
89.
Аллостерическоеингибирование
аллостерический
центр
90. Ферменты
ОднокомпонентныеДвухкомпонентые
(только
аминокислоты)
Апофермент (ак) Кофактор
Кофермент
Витаминные
Простетическая
группа (Ме2+)
Невитаминного
происхождения
91. Металлы, содержащиеся в ферментах
Алкогольдегидрогеназа,карбоангидраза
Аргиназа, аминопептидаза
Дипептидаза
Zn
Mn
Co
Фосфатаза, фосфокиназа
Mg
Тирозиназа
Cu
Сукцинатдегидрогеназа
Fe
Ксантиноксидаза
Mo
92. Классификация коферментов По химическому строению
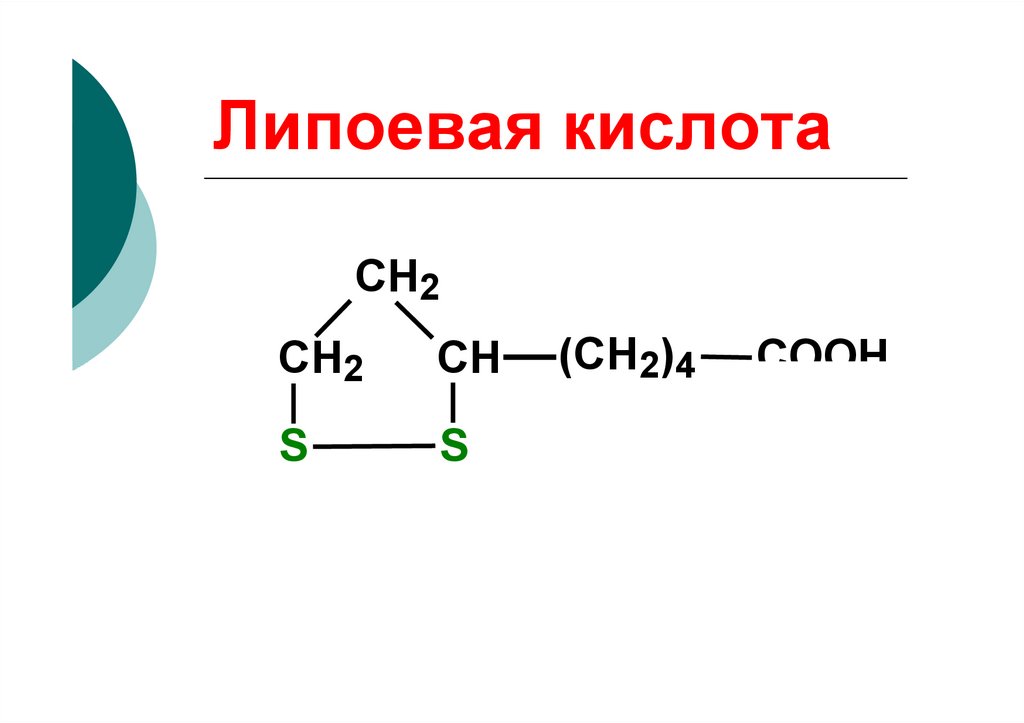
Алифатические (липоеваякислота);
2. Ароматические (коэнзим Q);
3. Гетероциклические (ТПФ, ПФ);
4. Нуклеотиды (НАД, НАДФ, ФАД,
ФМН)
1.
93. Липоевая кислота
CH2СН2
СН
S
S
(СН2)4
COOH
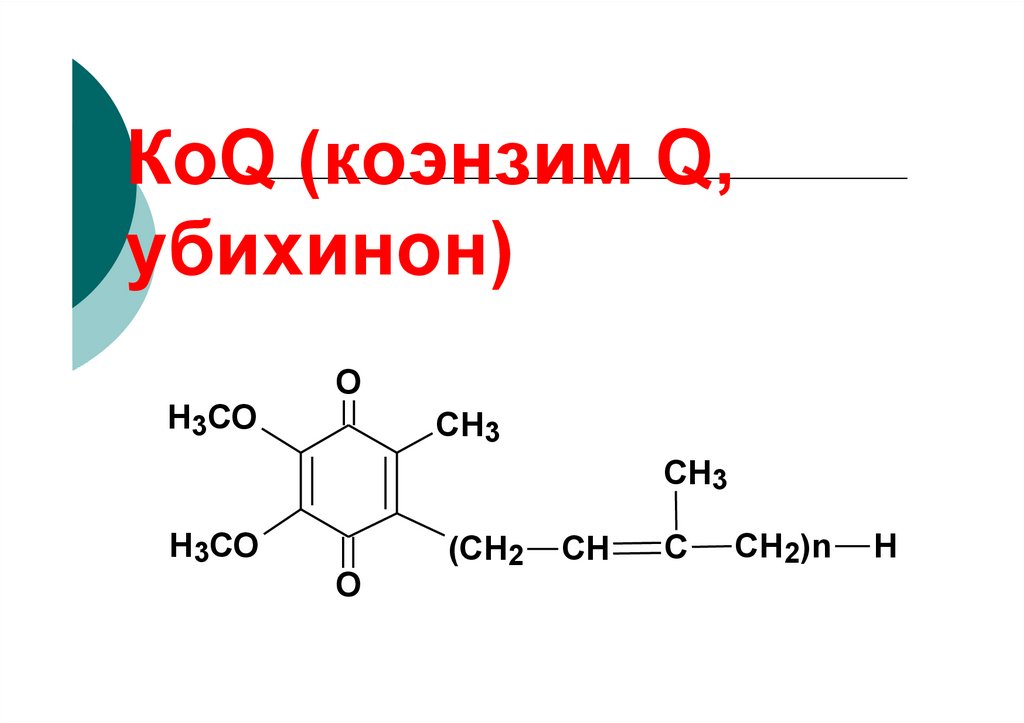
94. КоQ (коэнзим Q,
убихинон)Н3СО
O
CH3
CH3
Н3СО
(СН2
O
СН
С
СН2)n
Н
95. Тиаминпирофосфат (ТПФ)
CH2N
H3C
N
NH2
+
N
CH3
O
O
CH2 CH2 O P O P OH
S
OH
OH
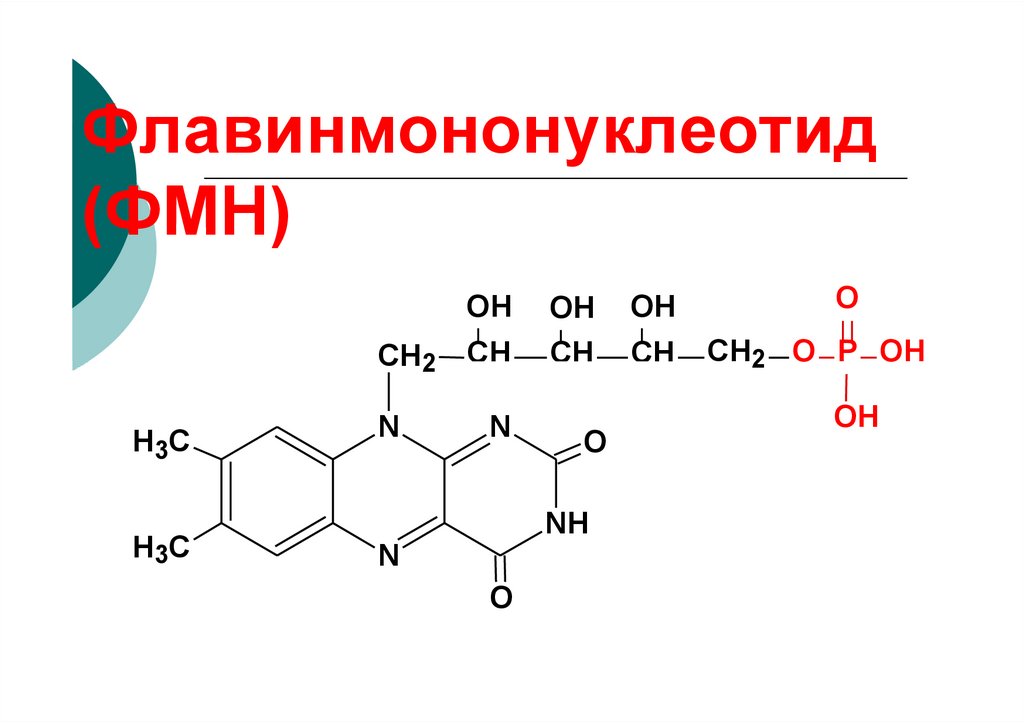
96. Флавинмононуклеотид (ФМН)
OHCH2
H3C
H3C
N
CH
N
OH
CH
O
NH
N
O
OH
CH
O
CH2 O P OH
OH
97.
По выполняемым функциям1.
2.
3.
Переносчики протонов и
электронов (НАД, ФАД, Ко Q);
Переносчики групп (ТПФ,
ПФ, КоА);
Коферменты синтеза и
изомеризации
98. По механизму действия
1.2.
3.
Коферменты с высоким
потенциалом переноса энергии
(переносчики энергии);
Коферменты, участвующие в
окислительно-восстановительных
реакциях;
Коферменты, формирующие
активный центр фермента.
99. А + В Н2
Классификация ферментов1. Оксидоредуктазы
А Н2 + В
А + В Н2
2. Трансферазы
А Х + В
А+ В Х
3. Гидролазы
А В + Н2О
А Н + В ОН
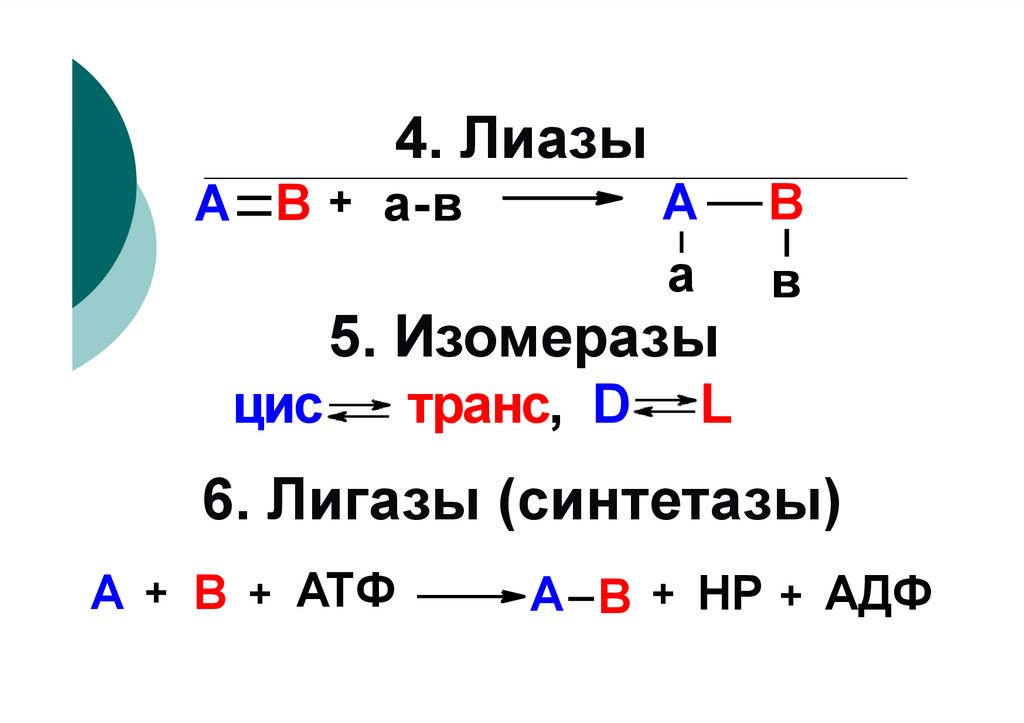
100. 4. Лиазы
Аа
А В + а-в
В
5. Изомеразы
цис
транс, D
в
L
6. Лигазы (синтетазы)
А + В + АТФ
А В + НР + АДФ
101.
классподкласс
катализируемая
реакция
Гидрогенизация и
дегидрогенизация
1.оксидоредуктазы
1.1
1.2
1.3
1.4
1.5
СН OH
H
С O
СН
СН
СН NH2
H
СН NН
H
1.6 НАДН, НАДФН
102.
классподкласс
катализируемая реакция
перенос функциональных
групп
2.трансферазы
2.1
Одноуглеродных групп
2.2
Альдегидной или кетогруппы
2.3
Ацила
2.4
Гликозила
2.5
2.6
Алкильной (но не метила) или
арильной группы
Азотсодержащей группы
2.7
Фосфатсодержащей группы
2.8
Серосодержащей группы
103.
классподкласс
3.гидролазы
катализируемая реакция
гидролитические реакции
3.1
3.2
Сложных эфиров
Гликозидов
3.3
3.4
3.5
3.6
Простых эфиров
Пептидов
Других С—N-связей
Ангидридов кислот
104. Шифр ферментов
105.
OСН2О
СН2ОН
O
O
+ АТФ
OH
HO
HO
ЕС 2. 7. 1. 1
класс 2 –
трансфераза
O
+ АДФ
OH
гексокиназа
OH
OH
глюкоза
P OH
OH
OH
глюкозо-6-фосфат
подподкласс 1 –
акцептором фосфата
является ОН-группа
подкласс 7 –
перенос фосфата
D-гексозо-6-фосфотрансфераза
106. Изоферменты ЛДГ
СердцеПочки
Печень
Мышцы
ЛДГ5 ЛДГ4
ЛДГ3 ЛДГ2
ЛДГ1
107. в в
Изоферменты креатинкиназыв в
МОЗГ
в м
СЕРДЦЕ
КК1
КК2
м м
МЫШЦЫ
КК3
108.
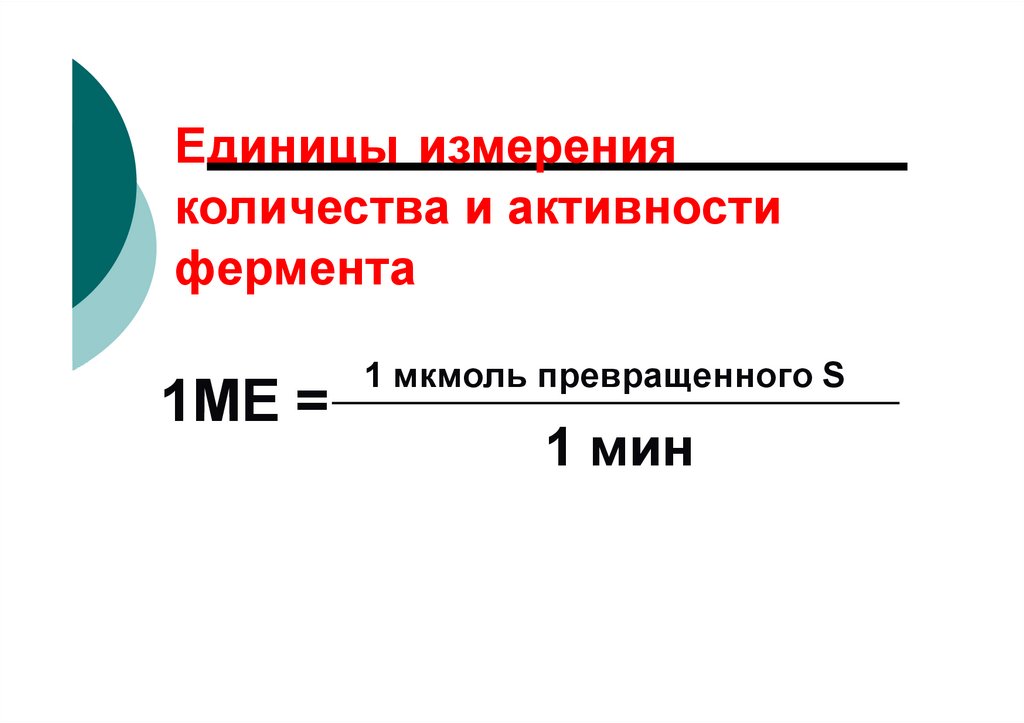
Единицы измеренияколичества и активности
фермента
1МЕ =
1 мкмоль превращенного S
1 мин
109. nМЕ – количество
единиц активностиnМЕ =
Кол-во превращенного S (мкмоль)
Время (мин)
110. Катал
моль превращенного1 катал =
1 секунда


















































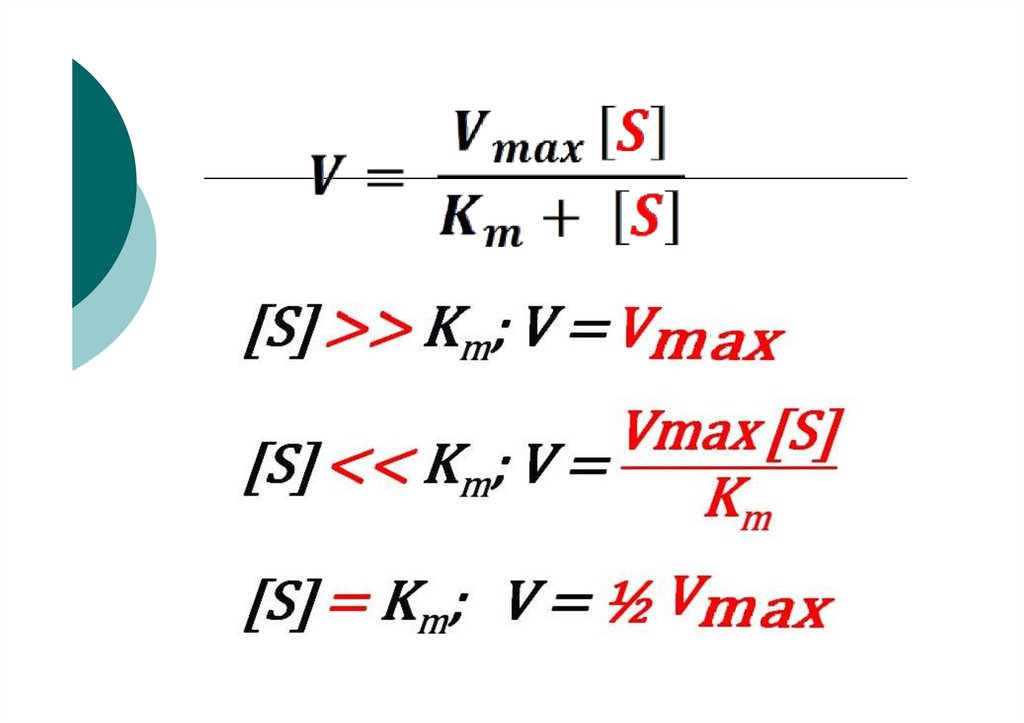





























 Биология
Биология








