Похожие презентации:
Свойства солей
1. Свойства солей
Лекция №14Подготовка к ЕГЭ
2. Ряд напряжений металлов:
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al,Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn,
Pb,H,Sb, Bi, Cu, Hg, Ag, Pd, Pt,
Au
3.
Свойства1)
Диссоциация
в водных
растворах.
Примеры
1.Средние, двойные, смешанные
соли диссоциируют полностью:
(α = 1)
NaCl Na+ + Cl–
КNaSO4 К+ + Na+ + SO42–
CaClBr Ca2+ + Cl–+ Br–
2. Кислые соли:
КHSO4 К+ + НSO4– (α = 1)
HSO4– ⇄ H+ + SO42– (α <1)
3. Основные соли:
FeOHCl FeOH+ + Cl– (α = 1)
FeOH+ ⇄ Fe2+ + OH–( α <1)
4. Комплексные соли:
[Cu(NH3)4]SO4 [Cu(NH3)4]2++SO42–
(α = 1)
[Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3 (α <1)
Примеча
ния
4.
СвойстваПримеры
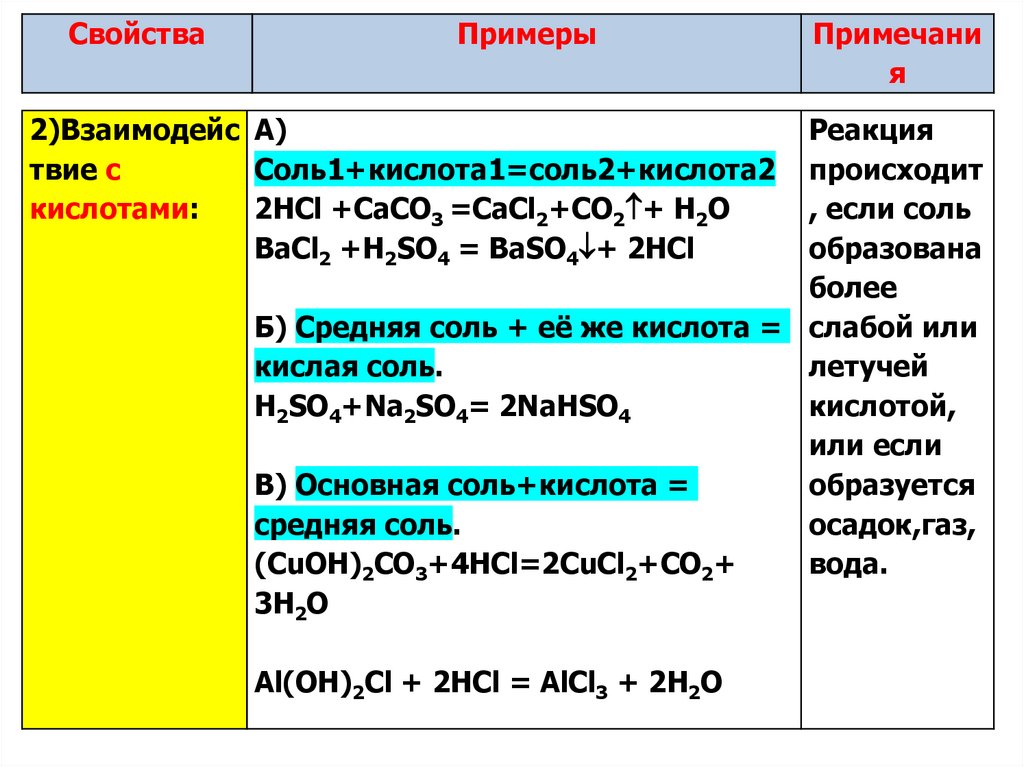
2)Взаимодейс А)
твие с
Cоль1+кислота1=соль2+кислота2
кислотами:
2HCl +СаCO3 =СаCl2+CO2 + H2O
ВaCl2 +H2SO4 = ВaSO4 + 2HCl
Примечани
я
Реакция
происходит
, если соль
образована
более
Б) Средняя соль + её же кислота = слабой или
кислая соль.
летучей
H2SO4+Na2SO4= 2NaHSO4
кислотой,
или если
В) Основная соль+кислота =
образуется
средняя соль.
осадок,газ,
(СuOH)2CO3+4HCl=2CuCl2+CO2+
вода.
3H2O
Al(OH)2Cl + 2HCl = AlCl3 + 2H2O
5.
Свойства3)
Взаимодей
ствие с
кислотны
ми и
амфотер
ными
оксидами.
Примеры
Na2CO3 + SiO2 →
t СО2 ↑+
Na2SiO3
Na2CO3 + Al2O3 →
t СО2↑+
NaAlO2
Примечан
ия
Вытесне
ние
твёрдым
оксидом
летуче
го
оксида
при
сплавле
нии.
6.
Свойства4)
Взаимодей
ствие
раствори
мых солей
со
щелочами.
Примеры
CuSO4 + 2NaOH
=Cu(OH)2 +Na2SO4
NH4Cl + KOH = KCl + NH3 +
H2 O
Кислые соли при действии
щелочей превращаются в
средние:
KHCO3 + KOH = K2CO3 + H2O
Кислая соль может
реагировать с аммиаком:
NH4HSO4 + NH3 = (NH4)2SO4
Примечания
Реакция
происхо
дит,
если
образует
ся
осадок,
газ или
вода.
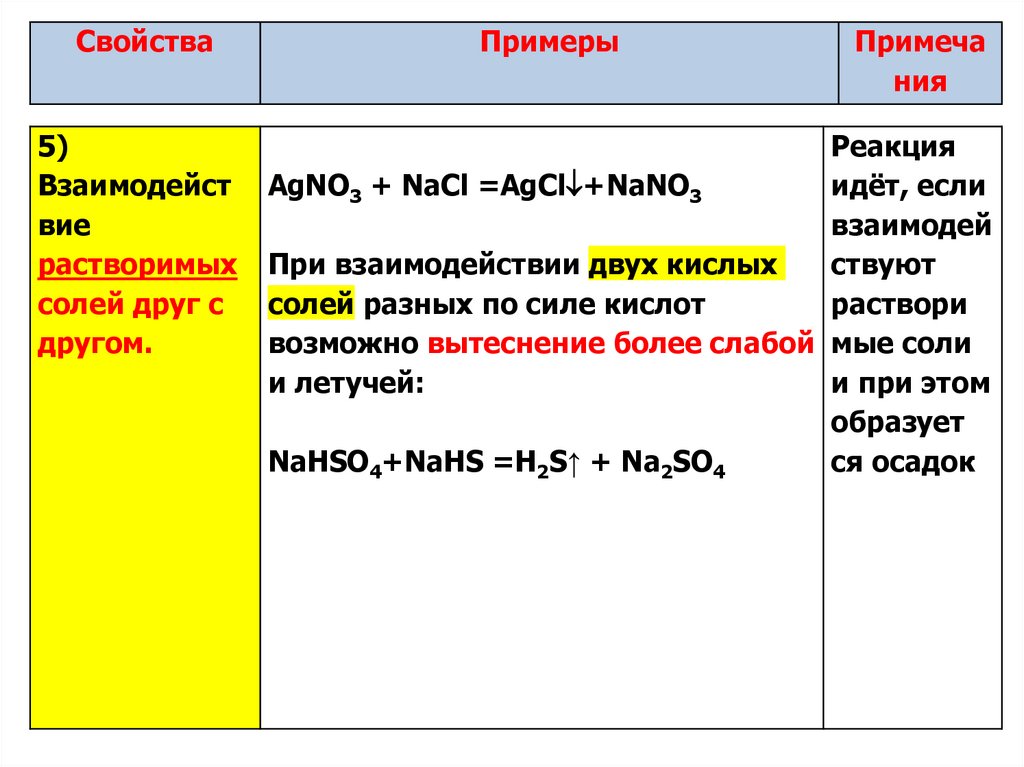
7.
Свойства5)
Взаимодейст
вие
растворимых
солей друг с
другом.
Примеры
Примеча
ния
Реакция
AgNO3 + NaCl =AgCl +NaNO3
идёт, если
взаимодей
При взаимодействии двух кислых
ствуют
солей разных по силе кислот
раствори
возможно вытеснение более слабой мые соли
и летучей:
и при этом
образует
NaHSO4+NaHS =H2S↑ + Na2SO4
ся осадок
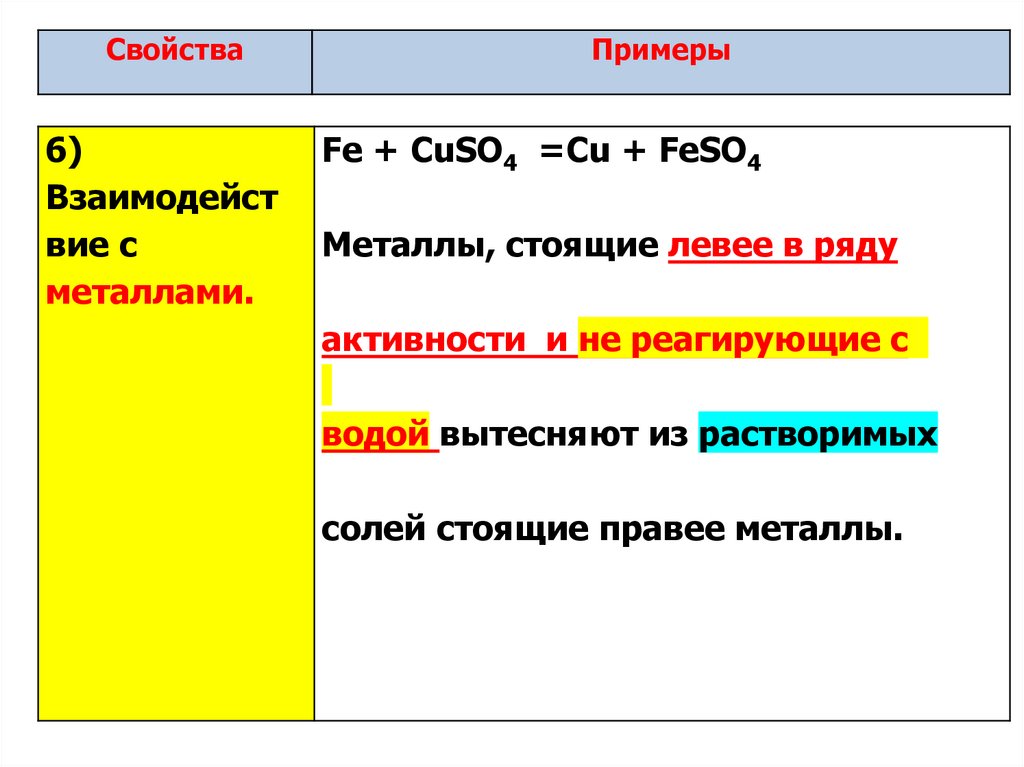
8.
Свойства6)
Взаимодейст
вие с
металлами.
Примеры
Fe + CuSO4 =Cu + FeSO4
Металлы, стоящие левее в ряду
активности и не реагирующие с
водой вытесняют из растворимых
солей стоящие правее металлы.
9.
СвойстваПримеры
7) Разложе А) карбонаты и
ние при
гидрокарбонаты.
нагревании Карбонаты(кроме Na,K,Rb,Cs) разлагаются на 2 оксида.
СаСO3 →
t СаO + СО2↑
Гидрокарбонаты - до
карбонатов.
2КНСО3 →
t К2СО3 + СО2↑ + Н2О
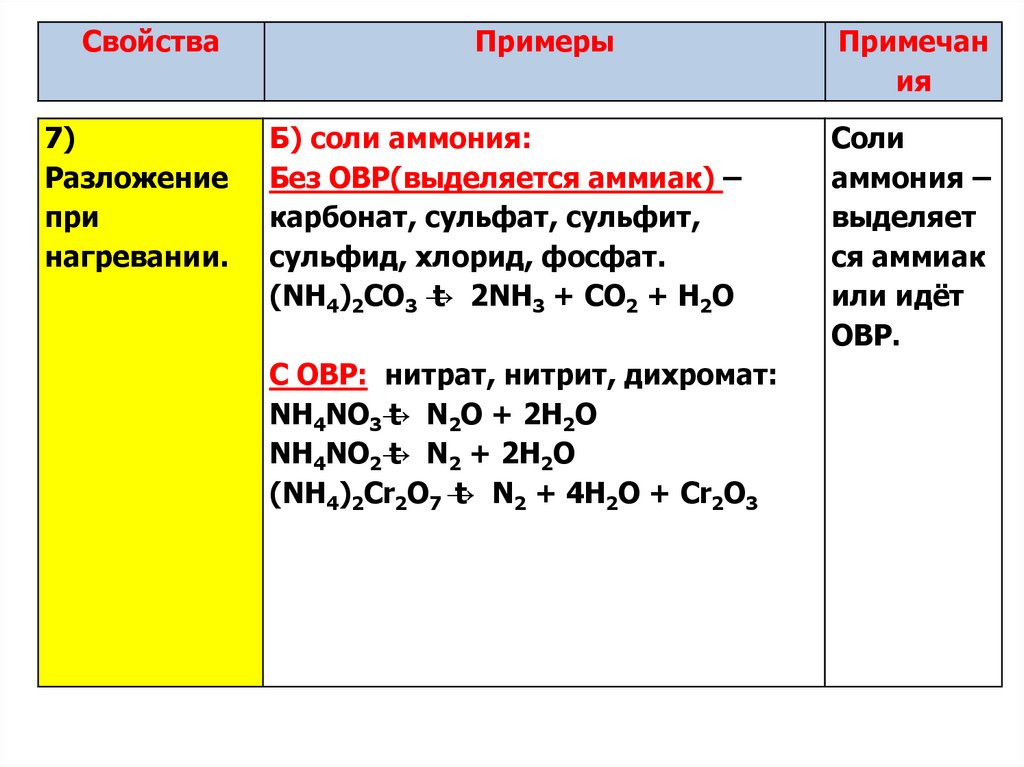
10.
Свойства7)
Разложение
при
нагревании.
Примеры
Б) соли аммония:
Без ОВР(выделяется аммиак) –
карбонат, сульфат, сульфит,
сульфид, хлорид, фосфат.
(NH4)2CO3 →
t 2NH3 + CO2 + H2O
С ОВР: нитрат, нитрит, дихромат:
NH4NO3→
t N2O + 2H2O
NH4NO2→
t N2 + 2H2O
(NH4)2Cr2O7 →
t N2 + 4H2O + Cr2O3
Примечан
ия
Соли
аммония –
выделяет
ся аммиак
или идёт
ОВР.
11.
Свойства7)
Разложение
при
нагревании
Примеры
В) Галогениды (кроме фторидов):
2AgCl →
t 2Ag + Cl2
Г) Нитраты:
Левее магния (кроме лития)
2КNO3 →
t 2КNO2+ O2
От магния до меди включительно +
литий
2Cu(NO3)2→
t 2CuO + 4NO2 + O2
После меди: 2AgNO3→
t 2Ag +2NO2 + O2
12. Источники
• http://egeigia.ru/all-ege/materialyege/himiya/566-ege-him-2012-513.
• Автор: Калитина Тамара Михайловна• Место работы: МБОУ СОШ №2
с.Александров-Гай Саратовской области
• Должность: учитель химии, биологии,
экологии.
• Дополнительные сведения: сайт
http://kalitina.okis.ru/
• Мини-сайт http://www.nsportal.ru/kalitinatamara-mikhailovna









 Химия
Химия








