Похожие презентации:
Соли. Классификация и свойства солей
1. Соли.
LOGOПрезентация для учащихся 8 класса
Соли.
Гаврилова Светлана Викторовна
учитель химии
МБОУ лицей «Престиж»
городского округа Самара
2.
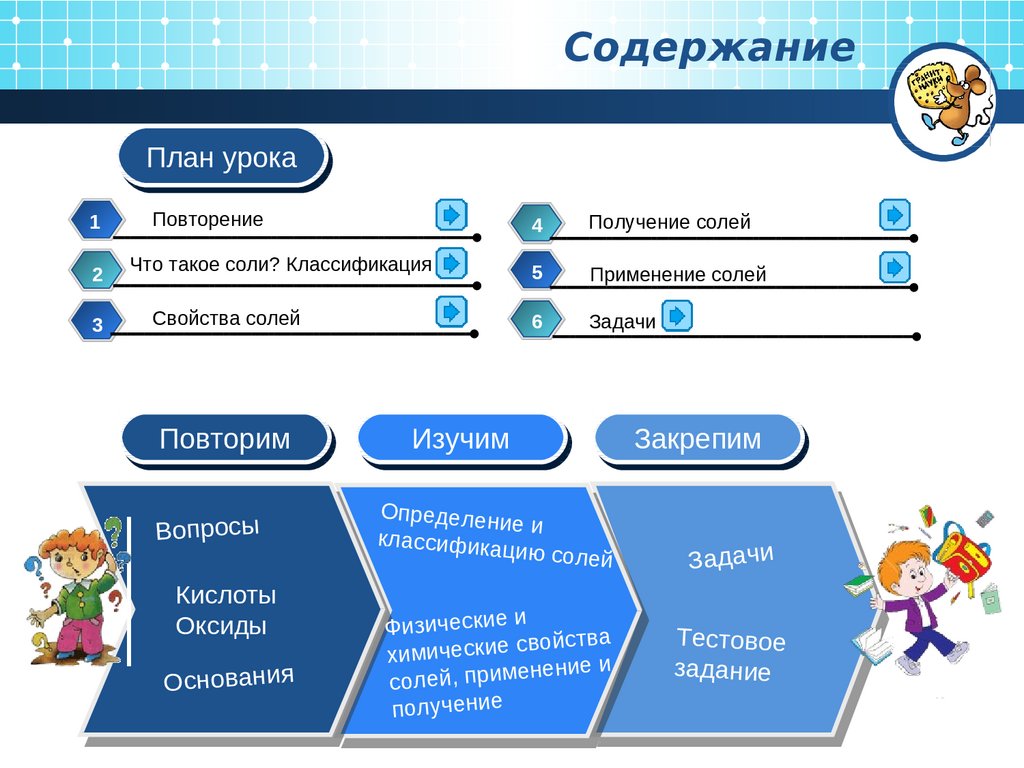
СодержаниеПлан
План урока
урока
1
2
3
Повторение
Что такое соли? Классификация
Свойства солей
Повторим
Повторим
Вопросы
Кислоты
Оксиды
Основания
4
Получение солей
5
Применение солей
6
Задачи
Изучим
Изучим
Определен
ие и
классифика
цию
Закрепим
Закрепим
солей
Физические и
войства
химические с
нение и
солей, приме
получение
Задачи
Тестовое
задание
3.
Повторим1. К какому классу соединений относятся вещества: CO2, Al2O3, CO, N2O5,
оксиды
FeO
2. Назовите вещество, которое составляет основу строительного раствора
гидроксид кальция
3. Какую окраску имеет осадок гидроксида меди (II)
4. Растворимые основания – это …
голубую
щелочи
5. Охарактеризуйте серную кислоту – H2SO4
двухосновная, кислородсодержащая, сильная
кислота
содержание
4.
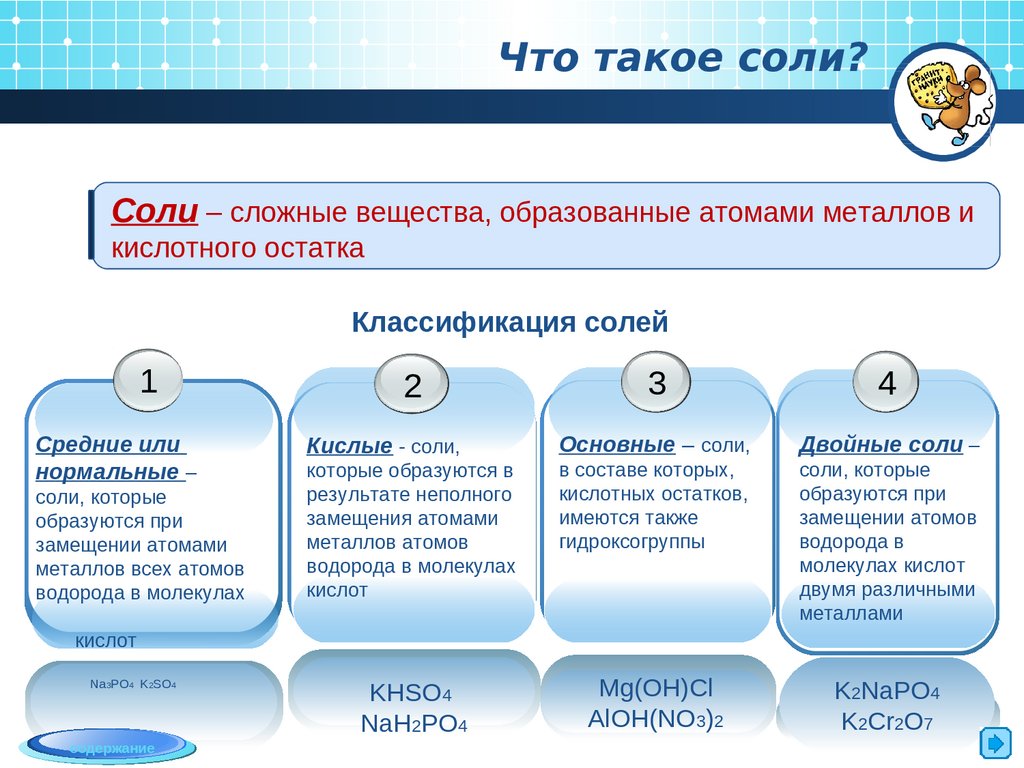
Что такое соли?Соли – сложные вещества, образованные атомами металлов и
кислотного остатка
Классификация солей
1
Средние или
нормальные –
соли, которые
образуются при
замещении атомами
металлов всех атомов
водорода в молекулах
3
4
Кислые - соли,
Основные – соли,
Двойные соли –
которые образуются в
результате неполного
замещения атомами
металлов атомов
водорода в молекулах
кислот
в составе которых,
кислотных остатков,
имеются также
гидроксогруппы
соли, которые
образуются при
замещении атомов
водорода в
молекулах кислот
двумя различными
металлами
KHSO4
NaH2PO4
Mg(OH)Cl
AlOH(NO3)2
K2NaPO4
K2Cr2O7
2
кислот
Na3PO4 K2SO4
содержание
5. Свойства солей
Физические свойстваСоли - твердые вещества разного цвета.
Растворимость их различна.
Некоторые хорошо растворимы, например все нитраты.
Другие же, например: CaCO3, BaSO4 - практически нерастворимы.
Нитраты – все растворимы
Сульфаты – все, кроме CaSO4, SrSO4, BaSO4, PbSO4, Ag2SO4
Хлориды – все, кроме AgCl, PbCl2
Сульфиды, карбонаты, силикаты, фосфаты – все соли
нерастворимые, кроме солей K, Na и групп NH4
содержание
6.
Химические свойстваСоли реагируют с металлами ( исключения активные
металлы: Li, Na, K, Ca, Ba - которые при обычных условиях
реагируют с водой):
Fe + CuSO4 = FeSO4 + Cu
Соли реагируют с кислотами:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Карбонаты, сульфиты разлагаются при нагревании:
СaCO3 = CaO + CO2
Некоторые соли способны реагировать с водой с
образованием кристаллогидратов:
CuSO4 + 5H2O = CuSO4 5H2O + Q
7.
Соли реагируют с некоторыми кислотными оксидами:CaCO3 + SiO2 = CaSiO3 + CO2
Соли реагируют с неметаллами, стоящими в ряду,
составленным Н. Н. Бекетовым правее, чем неметалл
входящий в состав соли:
2NaBr + Cl2 = 2NaCl + Br2
Соли реагируют с другими солями с образованием новых
нерастворимых солей:
Na2SO4 + BaCl2 = BaSO4 + 2NaCl
Соли реагируют с растворимыми основаниями с
образованием нерастворимого основания:
AlCl3 + 3KOH = Al(OH)3 + 3KCl
8.
Получение солейВзаимодействие металлов и неметаллов:
2Fe + 3Cl2 = 2FeCl3
Взаимодействие кислотных оксидов с основными и
амфотерными оксидами:
CaO + CO2 = CaCO3
ZnO + SiO2 = ZnSiO3
Взаимодействие двух разных солей с образованием новой
нерастворимой соли:
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
Взаимодействие оснований и кислот:
NaOH + HCl = NaCl + H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 +6H2O
Ca(OH)2 + CO2 = CaCO3 + CO2
Взаимодействие более активного металла с солями:
FeCl2 + Zn = ZnCl2 + Fe
Действие кислот - неокислителей на металлы, стоящие в ряду
напряжений металлов до водорода:
содержание
Zn + 2HCl = ZnCl2 + H2
9.
Применение солейЗначение солей для человека
Название солей
Продукты
содержания
Влияние на
человеческий
организм
Заболевания при
нехватке солей
Соли кальция
Молоко, рыба, овощи
Повышают рост и
прочность костей
Плохой рост скелета,
разрушение зубов
Соли железа
Яблоки, абрикосы
Входят в состав
гемоглобина
Малокровие
Соли магния
Горох, курага
Улучшают работу
кишечника
Ухудшение работы
пищеварительной
системы
10.
ЗадачиВ результате реакции с азотной кислотой
прореагировало 0,1 моль оксида меди (II). Найдите
массу и количество вещества нитрата меди (II),
получившегося в результате реакции
m = 18,8 г n = 0,1 моль
Составьте уравнения реакций, схема которой дана
ниже:
CaCO3
CaO
Ca(OH)2
CaCO3
Ca(NO3)2
ответ
содержание
11. Решение задачи
Дано:n (CuO) = 0,1 моль
HNO3
Решение:
CuO + 2HNO3 = Cu(NO3)2 + H2O
n = 1 моль
n = 1 моль
_________________________
m (Cu(NO3)2) - ?
n (Cu(NO3)2) - ?
n (CuO) = n (Cu(NO3)2 = 0,1 моль
m=nХM
M (Cu(NO3)2 = 64 + 2(14 + 3 Х16) = 188
(г/моль)
m (Cu(NO3)2 = 0,1 моль Х 188 г/моль = 18,8 (г)
Ответ: масса нитрата меди (II) равна 18,8 грамм, а его количество
вещества – 0,1 моль.
12. Решение генетической цепочки
СaCO3 = CaO + CO2CaO + H2O = Ca(OH)2
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 + 2HNO3 = Ca(NO3)2 + 2H2O
13. Список литературы
Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. 8класс: Учебник для общеобразовательных учреждений – М.:
Просвещение, 2011. – 176 с.
Презентация «Полупроводники» – Жуков В.В., учитель
Новлянской СШ Заволжского района Ивановской области.











 Химия
Химия








