Похожие презентации:
Электрохимические процессы
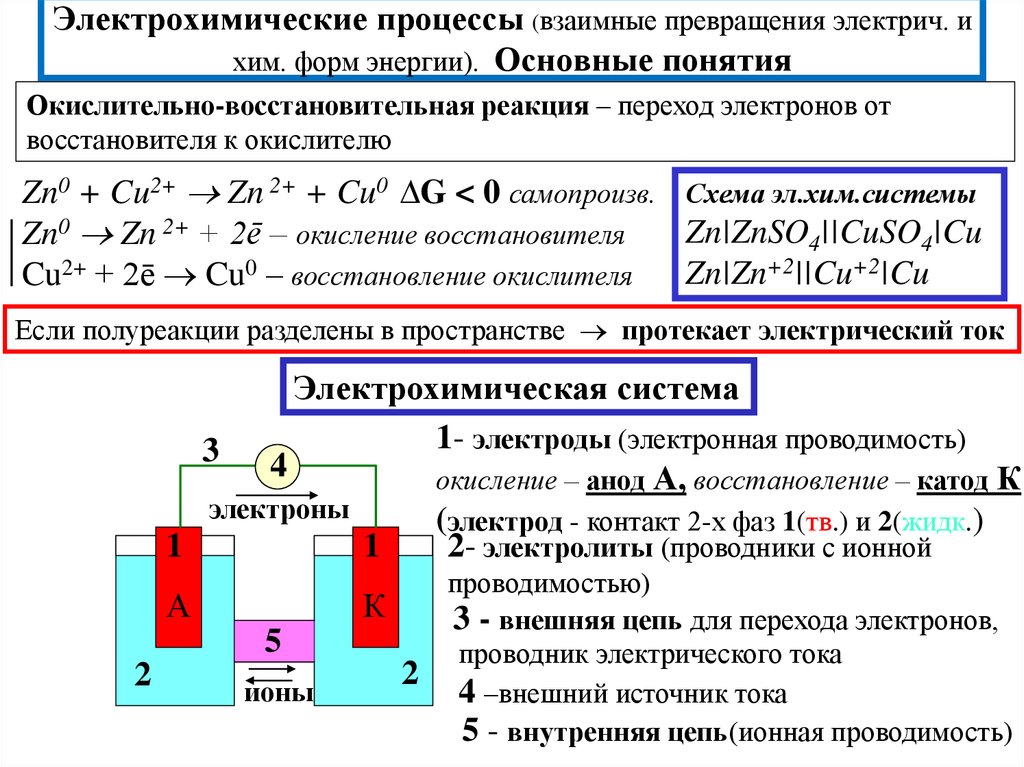
1. Электрохимические процессы (взаимные превращения электрич. и хим. форм энергии). Основные понятия
Окислительно-восстановительная реакция – переход электронов отвосстановителя к окислителю
Zn0 + Cu2+ Zn 2+ + Cu0 ∆G < 0 самопроизв. Схема эл.хим.системы
Zn|ZnSO4||CuSO4|Cu
Zn0 Zn 2+ + 2ē – окисление восстановителя
Zn|Zn+2||Cu+2|Cu
Cu2+ + 2ē Cu0 – восстановление окислителя
Если полуреакции разделены в пространстве протекает электрический ток
Электрохимическая система
1- электроды (электронная проводимость)
3 4
окисление – анод А, восстановление – катод К
электроны
(электрод - контакт 2-х фаз 1(тв.) и 2(жидк.)
1
1
2- электролиты (проводники с ионной
А
5
2
ионы
проводимостью)
К
3 - внешняя цепь для перехода электронов,
проводник электрического тока
2
4 –внешний источник тока
5 - внутренняя цепь(ионная проводимость)
2. Электрохимическая система
При равновесии G = 0 , то ток в цепи: I = 0G= rG + Wэ; rG-протекание хим.реакции; Wэ- работа
переноса электрических зарядов
Wэ = n F E
E = ∆φ = К – А разность потенциалов
F = NA ē 96500 Кл/моль - число Фарадея
rG
E
n – число молей электронов
n F
I 0
rG 0
Самопроизвольн. процесс - rG 0,→Е>0 К > А
гальванический элемент (химический источник тока ХИТ)получение электрической энергии в результате
протекания О-ВР. Потенциалы: Катод «+», Анод «-»
Вынужденный процесс - rG >0,→Е<0 К < А
электролизер (электролиз)за счет электрической энергии
внешнего источника тока протекают вынужденные
окислит.-восст.реакции. Потенциалы: Катод «-», Анод «+»
3. Соотношение количество вещества - величина тока в электрохимических(электродных) процессах
анодный процесскатодный процесс
Ме1 Mе1+n + nē
Ме2+n+ nē Mе2
Ме1 – nē Mе1+n
Превращение 1 атома
1 моль q = n ē NA = n F (Кл/моль);
q = n ē (Кл) [единичный акт]
за время t (с) при токе в системе I (А) q = I t (Кл) и превратится ν моль
веществ
I t
ХИТ(ГЭ): I t n F
моль
Электролиз:
n F
M I t
m
[г
n F
- коэффициент выхода по току
=m/mp ; М- мол.масса
n
q m F
[ККл
M
> - коэффициент
использования материалов
=q/qp, ν = m / M
Кл А час – емкость ХИТ
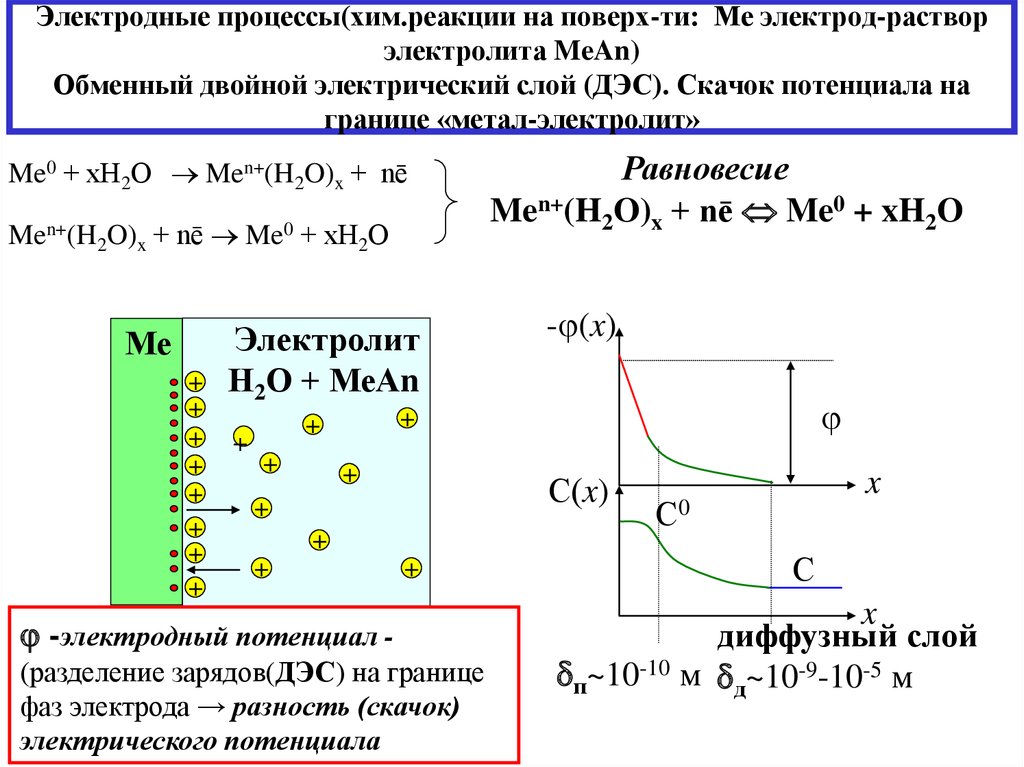
4. Электродные процессы(хим.реакции на поверх-ти: Ме электрод-раствор электролита MeAn) Обменный двойной электрический слой (ДЭС). Скачок потенц
Электродные процессы(хим.реакции на поверх-ти: Ме электрод-растворэлектролита MeAn)
Обменный двойной электрический слой (ДЭС). Скачок потенциала на
границе «метал-электролит»
Me0 + хН2О Men+(H2O)x + nē
Men+(H2O)x + nē Me0 + хН2О
Ме
+
+
+
+
+
+
+
+
Электролит
Н2О + МеАn
+
- (x)
+
+
+
Равновесие
Men+(H2O)x + nē Me0 + xH2O
+
С(x)
+
+
+
+
-электродный потенциал (разделение зарядов(ДЭС) на границе
фаз электрода → разность (скачок)
электрического потенциала
x
С0
С
x
диффузный слой
п~10-10 м д~10-9-10-5 м
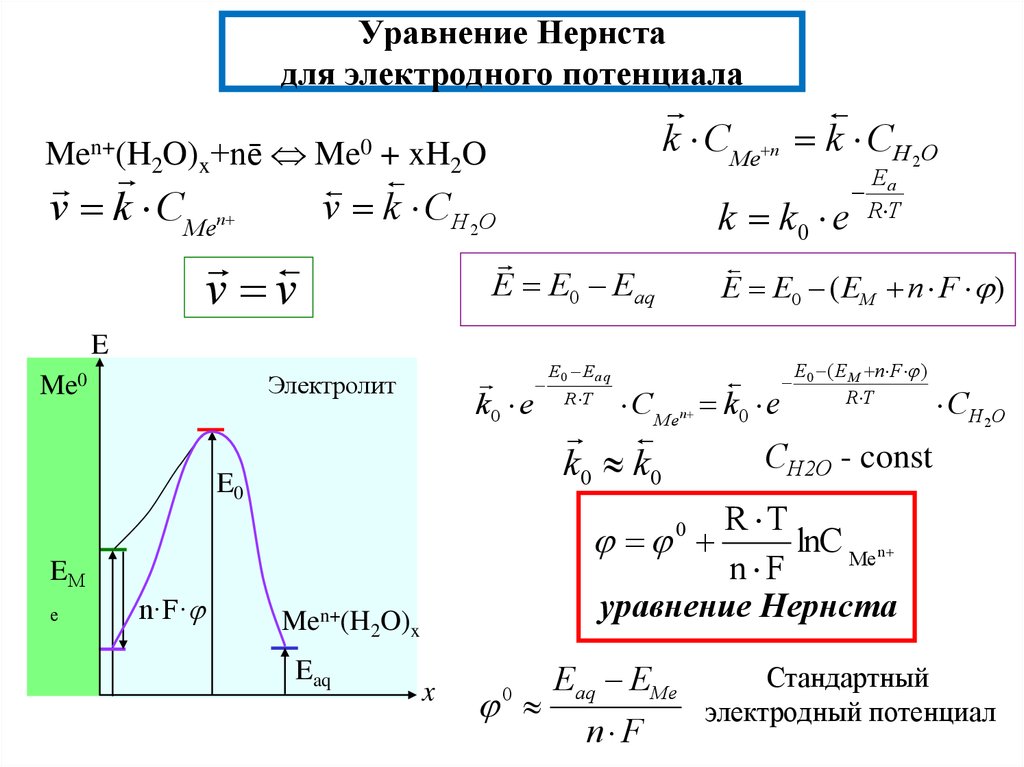
5. Уравнение Нернста для электродного потенциала
k CMe n k СH 2OMen+(H2O)x+nē Me0 + xH2O
v k СMen
v v
v k С H 2O
E E0 Eaq
E
Ea
R T
E E0 ( EM n F )
E0 ( EM n F )
E0 Eaq
R T
СH 2O
k0 e R T СMen k0 e
Электролит
Me0
k k0 e
k0 k0
E0
СН2О - const
R T
lnC Me n
n F
уравнение Нернста
0
EМ
е
n·F·
Men+(H2O)x
Eaq
x
0
Eaq EMe
n F
Стандартный
электродный потенциал
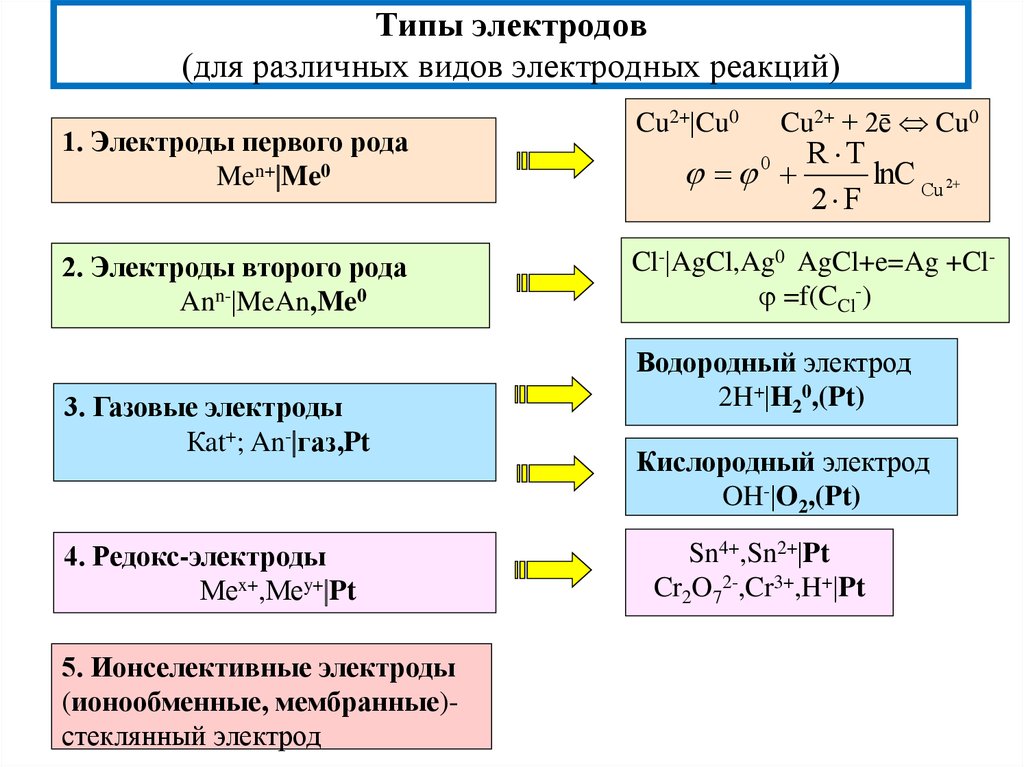
6. Типы электродов (для различных видов электродных реакций)
1. Электроды первого родаMen+ Me0
2. Электроды второго рода
Ann- MeAn,Me0
3. Газовые электроды
Кat+; An- газ,Pt
4. Редокс-электроды
Меx+,Меy+ Pt
5. Ионселективные электроды
(ионообменные, мембранные)стеклянный электрод
Cu2+ Cu0
Cu2+ + 2ē Cu0
R T
lnC Cu 2
2 F
0
Cl- AgCl,Ag0 AgCl+e=Ag +Cl =f(CCl-)
Водородный электрод
2H+ H20,(Pt)
Кислородный электрод
OH- O2,(Pt)
Sn4+,Sn2+ Pt
Cr2O72-,Cr3+,H+ Pt
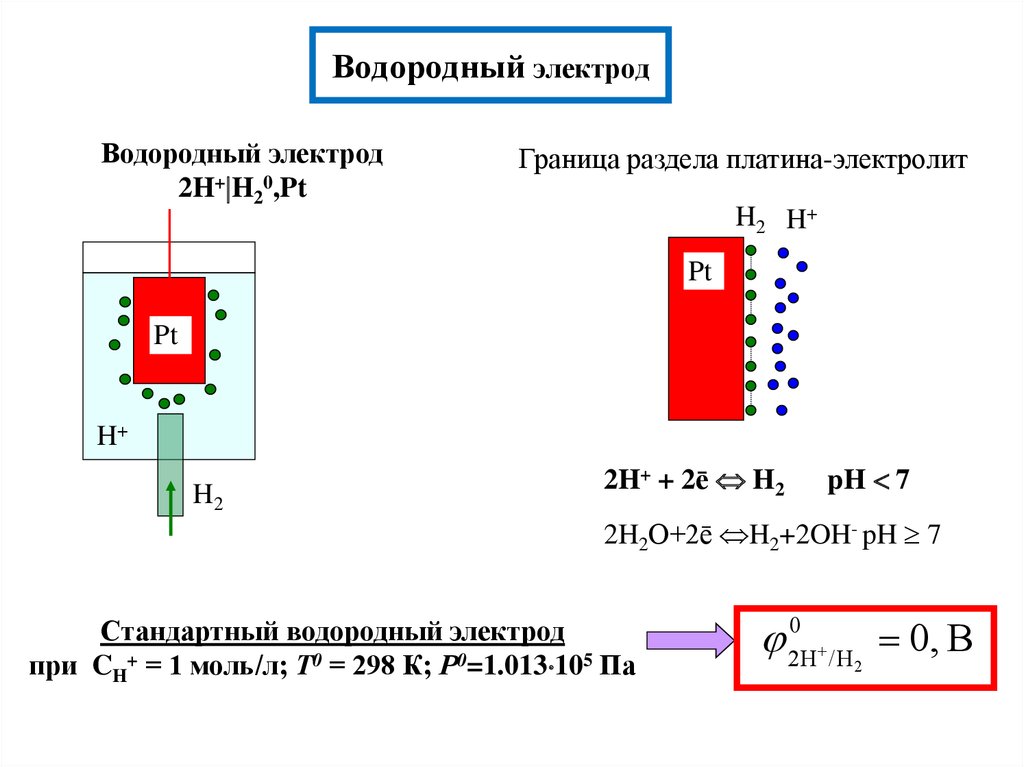
7. Водородный электрод
Водородный электрод2H+ H20,Pt
Граница раздела платина-электролит
H2 H +
Pt
Pt
H+
H2
2H+ + 2ē H2
pH 7
2H2O+2ē H2+2OH- pH 7
Стандартный водородный электрод
при CH+ = 1 моль/л; Т0 = 298 К; Р0=1.013 105 Па
0
2H
0, В
/H
2
8. Водородная шкала электродных потенциалов
А( ) Me0|Men+||2H+|H20(Pt) (+)Кесли
Е
0
2H / H2
или
А( ) (Pt)H20, |2H+||Men+|Me0 (+)К
CH+ = 1 моль/л; Т0 = 298 К; Р0=1.013 105 Па; I = 0, А
CМе+ = 1 моль/л
0
0
2H
/ H2
0 Men+/ Me0
0
= Е
Е 0 20H / H
Стандартные электродные потенциалы ( 0, В)
Электрод
Электродная реакция
Na+ + ē Na 0
Na+ Na0
Al3+ + 3ē Al0
Al3+ Al0
Zn2+ + 2ē Zn0
Zn2+ Zn0
Fe2+ + 2ē Fe0
Fe2+ Fe0
Pb2+ + 2ē Pb0
Pb2+ Pb0
2H+ H20,Pt
2H+ + 2ē H2
Cu2+ + 2ē Cu0
Cu2+ Cu0
OH- O2,Pt
О2 + 2H2O + 4ē 4OHpH 7
NO3-,NO2,H+ Pt NO3- + 2H+ + ē NO2 + H2O
0, В
-2.71
-1.67
-0.76
-0.44
-0.13
0.00
+0.34
+0.40
+0.80
2
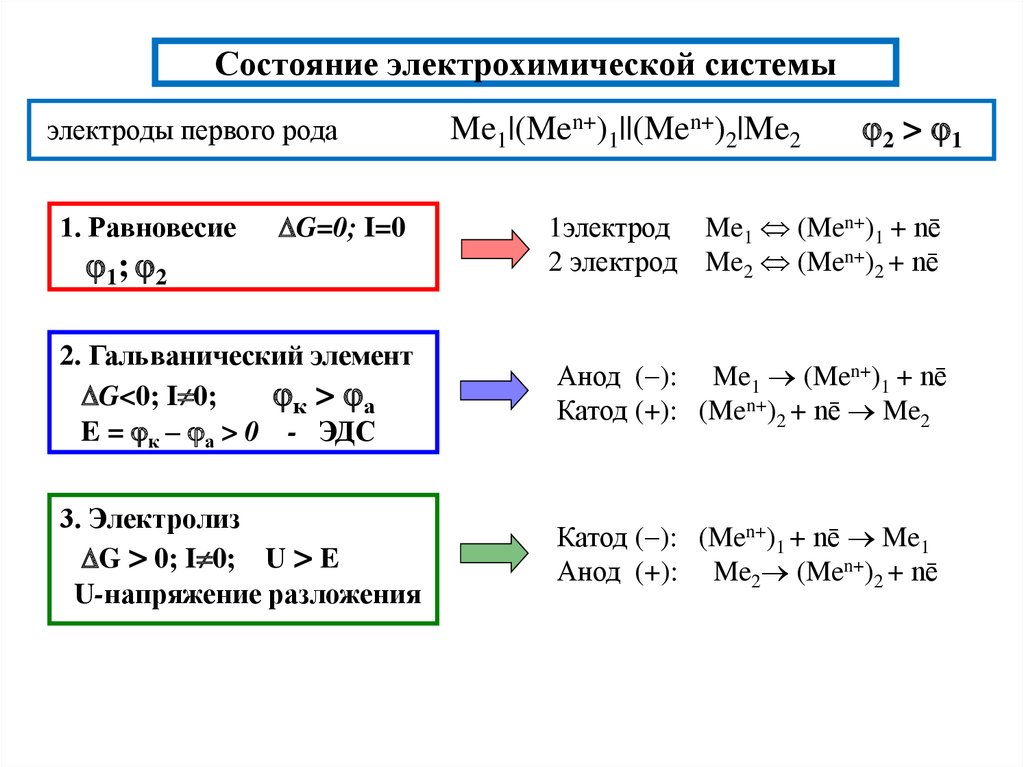
9. Состояние электрохимической системы
электроды первого рода1. Равновесие
1; 2
G=0; I=0
Me1|(Men+)1||(Men+)2|Me2
2 > 1
1электрод Me1 (Men+)1 + nē
2 электрод Me2 (Men+)2 + nē
2. Гальванический элемент
G<0; I 0;
к > а
E = к – а > 0 - ЭДС
Анод ( ): Me1 (Men+)1 + nē
Катод (+): (Men+)2 + nē Me2
3. Электролиз
G > 0; I 0; U > E
U-напряжение разложения
Катод ( ): (Men+)1 + nē Me1
Анод (+): Me2 (Men+)2 + nē
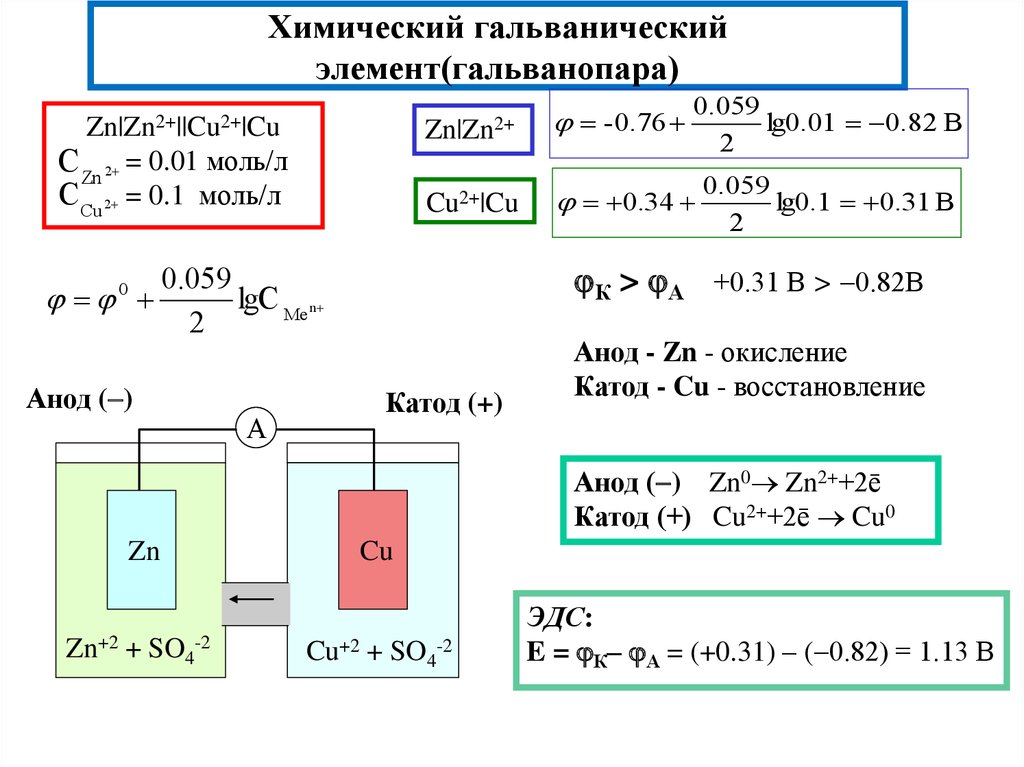
10. Химический гальванический элемент(гальванопара)
Zn|Zn2+||Cu2+|CuС Zn 2 = 0.01 моль/л
С Cu 2 = 0.1 моль/л
-0.76
Cu2+|Cu
0.34
А
0.059
lg0.1 0.31 В
2
К > А +0.31 В > 0.82В
0.059
lgC Me n
2
0
Анод ( )
0.059
lg0.01 0.82 В
2
Zn|Zn2+
Катод (+)
Анод - Zn - окисление
Катод - Cu - восстановление
Анод ( ) Zn0 Zn2++2ē
Катод (+) Cu2++2ē Cu0
Cu
Zn
Zn+2
+ SO4
-2
Cu+2 + SO4-2
ЭДС:
E = К– А = (+0.31) – ( 0.82) = 1.13 В
11. Концентрационный гальванический элемент
Cu2+|Cu || Cu2+|CuС Cu 2 = 0.01 моль/л
С Cu 2 = 0.1 моль/л
1-
Cu2+|Cu
2 - Cu2+|Cu
0.059
lg0.01 0.28 В
2
0.059
0.34
lg0.1 0.31 В
2
0.34
К > А +0.31 В > +0.28 В
Анод (-)
Cu
А
Катод (+)
Cu
Анод - Cu 1 - окисление
Катод - Cu 2 - восстановление
Анод ( ) Cu0 Cu2++2ē
Катод (+) Cu2++2ē Cu0
ЭДС:
Cu +2 + SO 4-2
Cu +2 + SO 4-2
Е = К - А = (+0.31) – (+0.28) = 0.03 В
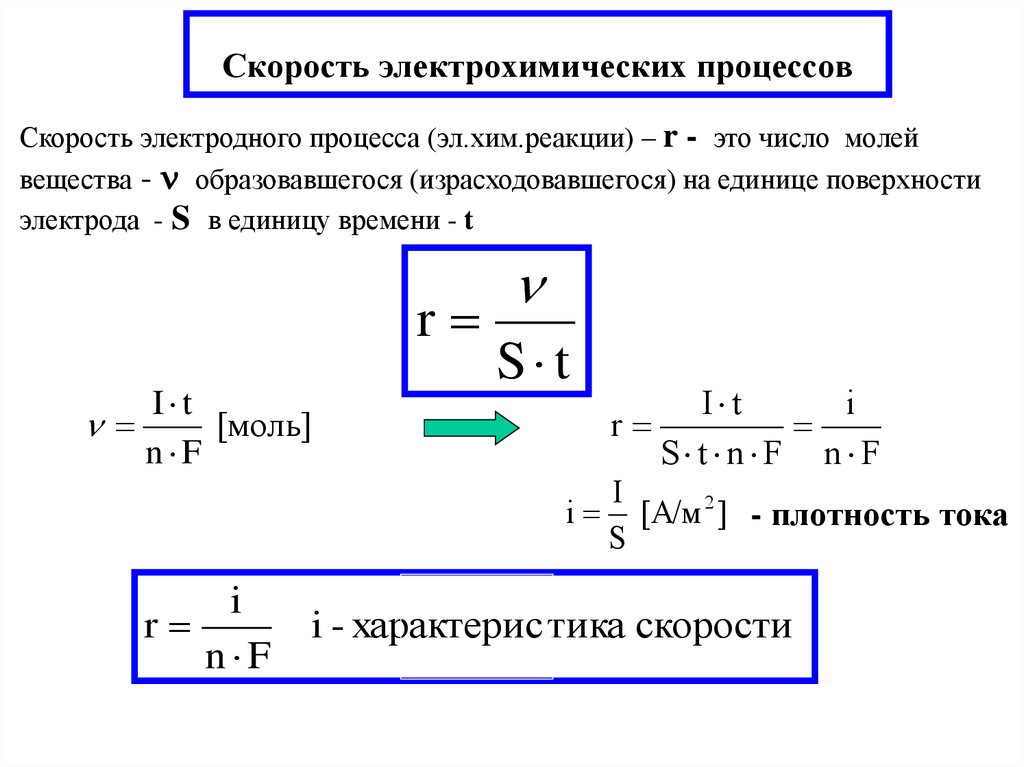
12. Скорость электрохимических процессов
Скорость электродного процесса (эл.хим.реакции) – r - это число молейвещества - образовавшегося (израсходовавшегося) на единице поверхности
электрода - S в единицу времени - t
r
I t
[моль]
n F
S t
i
i
r
n F
I t
i
r
S t n F n F
I
[А/м 2 ] - плотность тока
S
i - характерис тика скорости
13. Поляризация электродов – [] (сближение потенциалов катода и анода и уменьшение ∆φ) при работе ГЭ
Поляризация электродов – [ ](сближение потенциалов катода и
анода и уменьшение ∆φ) при работе ГЭ
= I
явл.[f(i)]
Поляризация-разность
потенциалов
электрода
при прохождении тока I и
равновесным значением
Диффузионная(концентрациЭлектрохимическая
Фазовые
онная) поляризация;
(катодная)поляризация;
превращения
перенапряжение(для
перенапряжение
лимитирующей стадии)
Стадии электрохимического процесса (сложной гетерогенной хим.реакции),
определяющего потенциал электродов:
1) подвод реагирующих частиц(диффузия)
из объема электролита к поверхности электрода (ур. Нернста);
2) собственно электрохимическая реакция на электродах (сближение
потенциалов электродов);
3) отвод продуктов реакции(диффузия) от электрода (ур. Нернста).
[Скорость переноса электронов во внешней цепи выше скорости отдельных
стадий → изменение
Анод
>0
I = + (i)
потенциалов электродов →
Катод
<0
I = - (i)
поляризация]
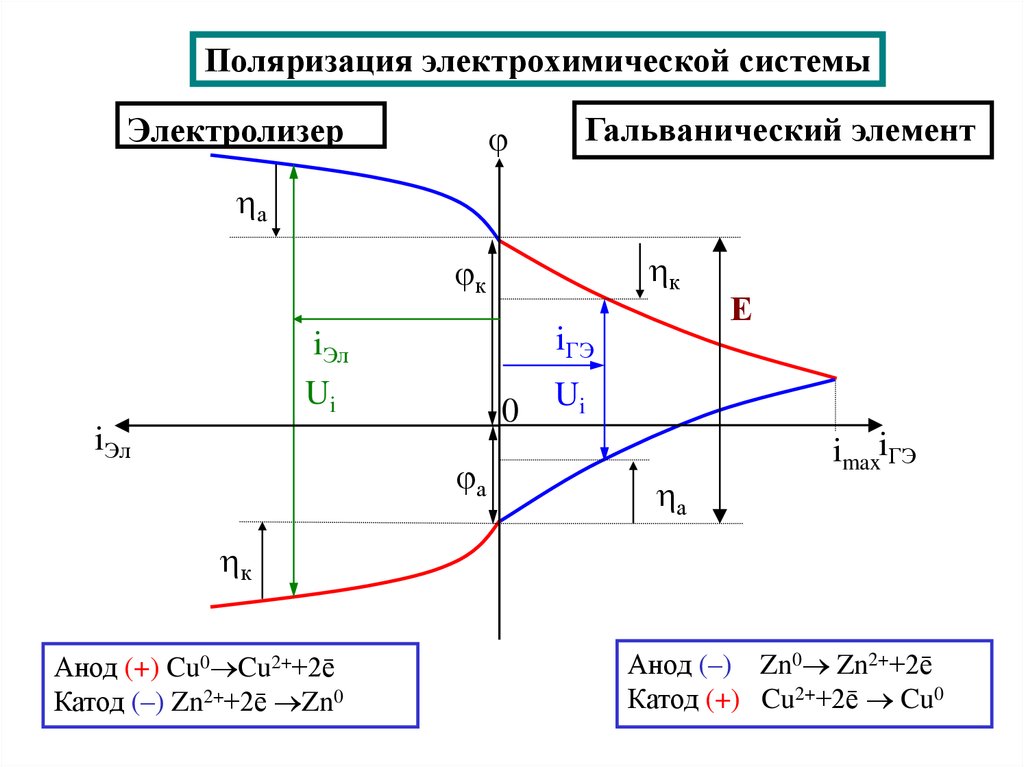
14. Поляризация электрохимической системы
ЭлектролизерГальванический элемент
а
к
к
iГЭ
iЭл
Ui
iЭл
0
а
Е
Ui
а
imaxiГЭ
к
Анод (+) Cu0 Cu2++2ē
Катод (–) Zn2++2ē Zn0
Анод (–) Zn0 Zn2++2ē
Катод (+) Cu2++2ē Cu0
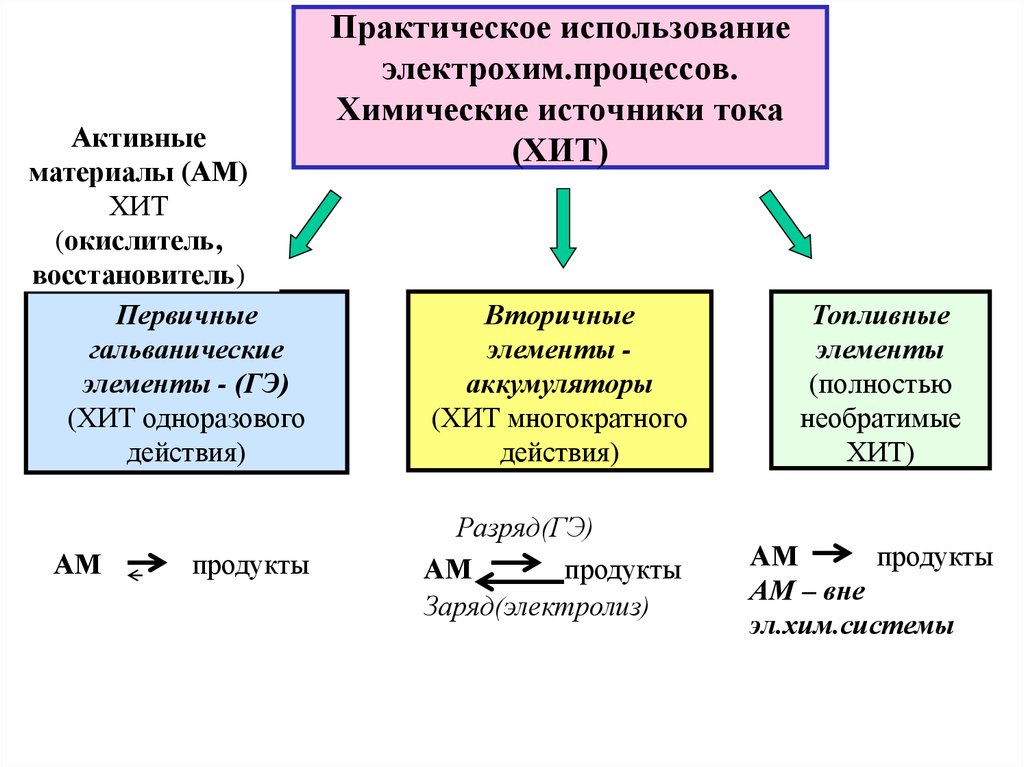
15. Практическое использование электрохим.процессов. Химические источники тока (ХИТ)
Активныематериалы (АМ)
ХИТ
(окислитель,
восстановитель)
Первичные
гальванические
элементы - (ГЭ)
(ХИТ одноразового
действия)
АМ
продукты
Практическое использование
электрохим.процессов.
Химические источники тока
(ХИТ)
Вторичные
элементы аккумуляторы
(ХИТ многократного
действия)
Разряд(ГЭ)
АМ
продукты
Заряд(электролиз)
Топливные
элементы
(полностью
необратимые
ХИТ)
АМ
продукты
АМ – вне
эл.хим.системы
16. Основные характеристики ХИТ
• ЭДС гальванического элемента (Е, В) -напряжение без нагрузки• Номинальное напряжение (U, В) -напряжение в средней части разрядной
характеристики (учитывает поляризацию ГЭ)
• Номинальная ёмкость(C)-ампер-час А ч - кол-во эл-ва, отдаваемое ХИТ
во внешнюю цепь; также используется для характеристики ёмкости ХИТ
удельная энергия (Вт ч/кг)
• Удельная мощность(N, Вт/кг) – макс.допустимая разрядная мощность
(показывает макс.возможный ток при номинальном напряжении)
•Срок хранения (Тхр) –время, когда ёмкость ХИТ существенно не
уменьшается из-за саморазряда(хим.процессы на элетродах с потреблением
АМ без генерирования эл.тока)
•Число циклов разряд-заряд(для аккумуляторов); ресурс работы - ТЭ
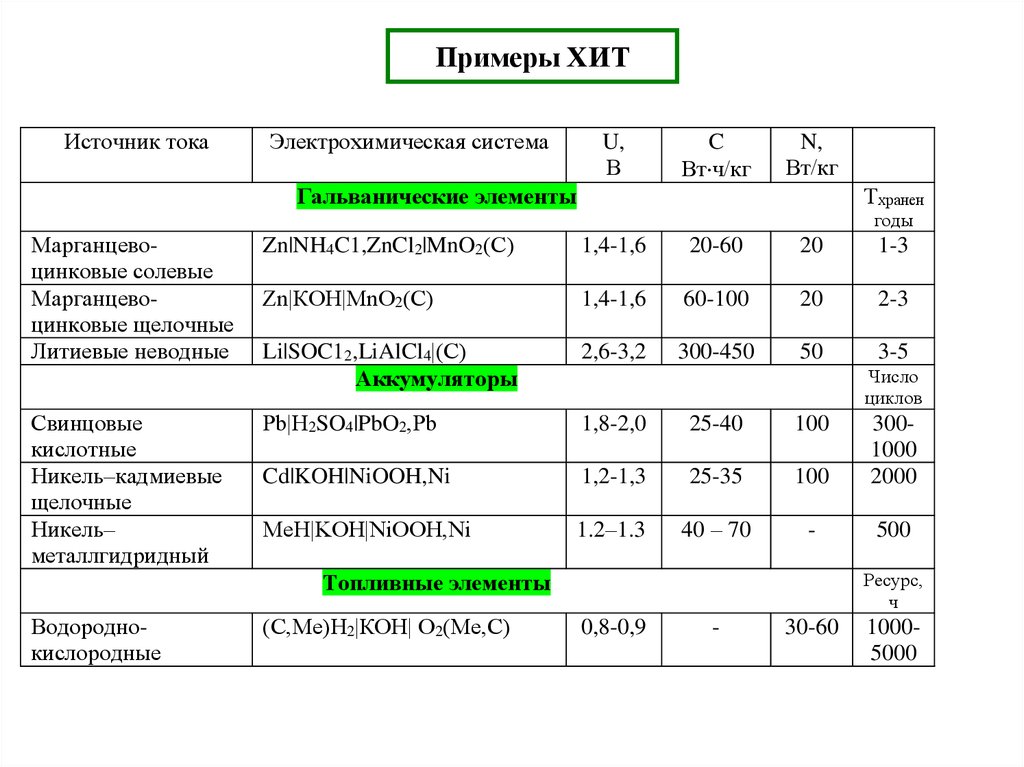
17. Примеры ХИТ
Источник токаЭлектрохимическая система
U,
В
C
Вт ч/кг
N,
Вт/кг
Тхранен
Гальванические элементы
годы
Марганцевоцинковые солевые
Марганцевоцинковые щелочные
Литиевые неводные
Свинцовые
кислотные
Никель–кадмиевые
щелочные
Никель–
металлгидридный
Zn|NH4C1,ZnCl2|MnO2(С)
1,4-1,6
20-60
20
1-3
Zn|КОН|MnO2(С)
1,4-1,6
60-100
20
2-3
Li|SOC12,LiAlCl4|(С)
Аккумуляторы
2,6-3,2
300-450
50
3-5
Рb|H2SO4|PbO2,Рb
1,8-2,0
25-40
100
Cd|KOH|NiOOH,Ni
1,2-1,3
25-35
100
3001000
2000
МеН|KOH|NiOOH,Ni
1.2–1.3
40 – 70
-
500
Число
циклов
Ресурс,
ч
Топливные элементы
Водороднокислородные
(C,Ме)H2|КОН| O2(Ме,C)
0,8-0,9
-
30-60
10005000
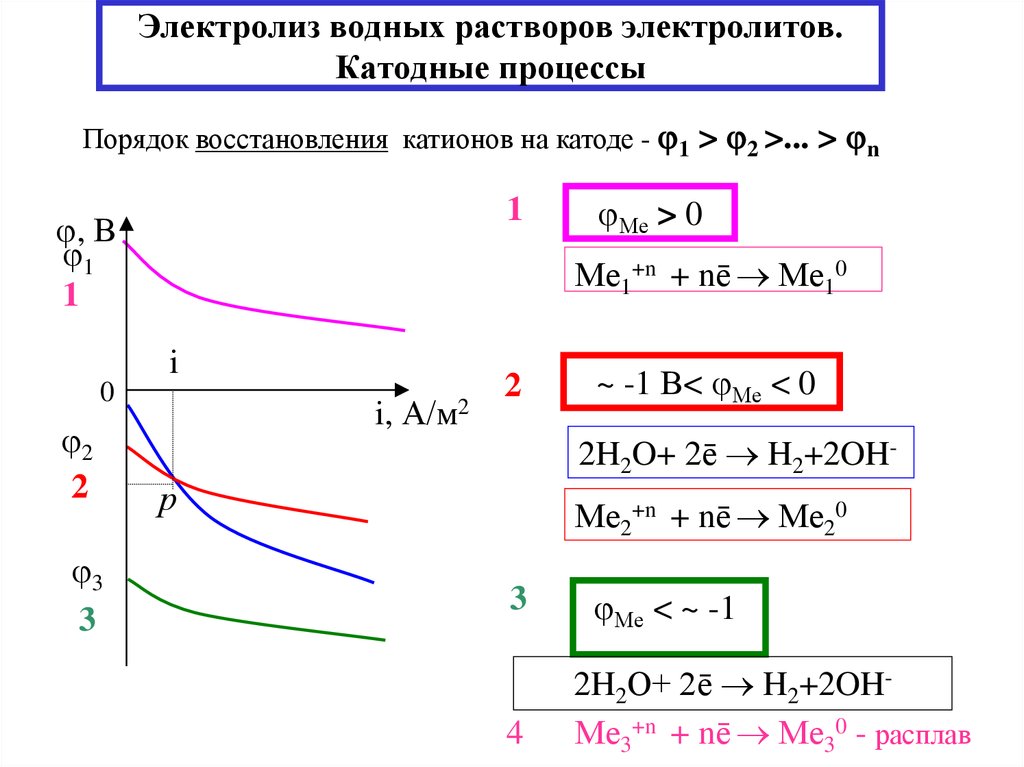
18. Электролиз водных растворов электролитов. Катодные процессы
Порядок восстановления катионов на катоде - 1 > 2 >... > n1
, В
1
1
Ме1+n + nē Ме10
i
0
2
2
3
3
Ме > 0
i,
А/м2
2
~ -1 В< Ме < 0
2H2O+ 2ē H2+2OH-
р
Ме2+n + nē Ме20
3
4
Ме < ~ -1
2H2O+ 2ē H2+2OHМе3+n + nē Ме30 - расплав
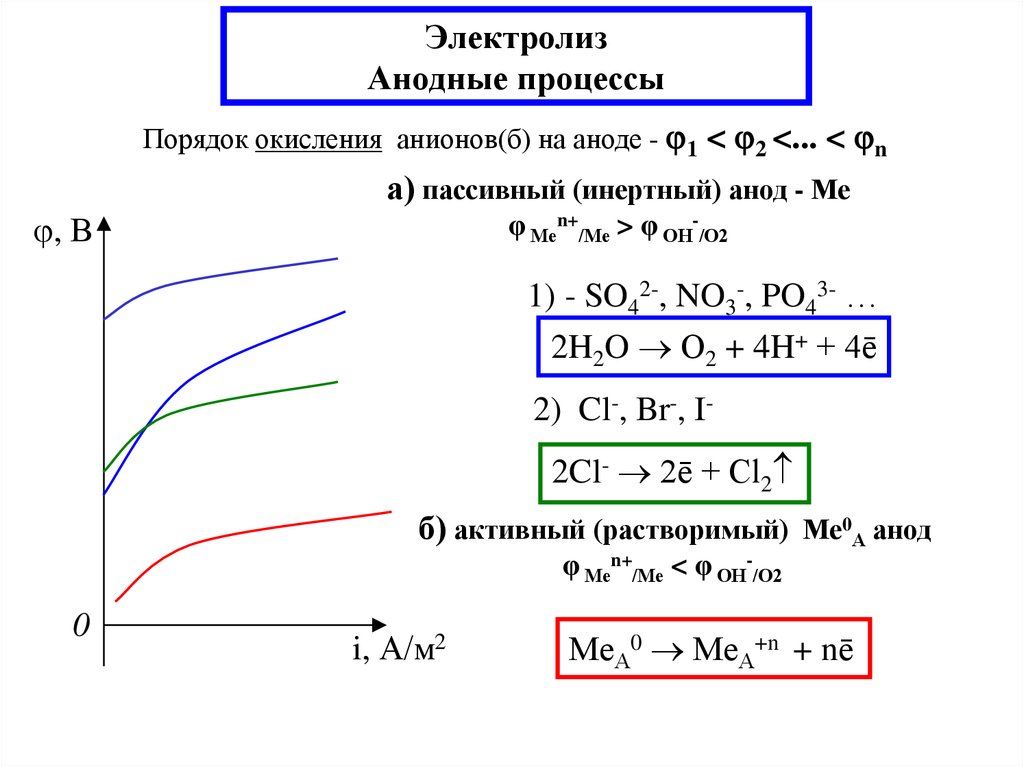
19. Электролиз Анодные процессы
Порядок окисления анионов(б) на аноде - 1 < 2 <... < nа) пассивный (инертный) анод - Ме
, В
φ Меn+/Ме > φ ОН-/О2
1) - SO42-, NO3-, PO43- …
2H2O О2 + 4H+ + 4ē
2) Cl-, Br-, I2Cl- 2ē + Cl2
б) активный (растворимый) Ме0А анод
φ Меn+/Ме < φ ОН-/О2
0
i, А/м2
МеА0 МеА+n + nē




![Поляризация электродов – [] (сближение потенциалов катода и анода и уменьшение ∆φ) при работе ГЭ Поляризация электродов – [] (сближение потенциалов катода и анода и уменьшение ∆φ) при работе ГЭ](https://cf.ppt-online.org/files/slide/8/8MDeYW9vAGTtBIbwjUp1OHf5P6QFcEyk4V3un7/slide-12.jpg)

 Химия
Химия