Похожие презентации:
Электрохимическое и химическое восстановление металлов из растворов
1. Исследовательский проект ЭЛЕКТРОХИМИЧЕСКОЕ И ХИМИЧЕСКОЕ ВОССТАНОВЛЕНИЕ МЕТАЛЛОВ ИЗ РАСТВОРОВ
Автор: Галкина Анастасия,учащаяся 11 класса
МБОУ СОШ с. Большие Озерки
2. ЦЕЛЬ: получение покрытия из других металлов на токопроводящих предметах электрическим током и контактным вытеснением металлов
из растворових солей более активными металлами
ЗАДАЧИ: 1) изучение условий проведения электролиза и их влияния
на процесс;
определение природы растворимых электродов;
демонстрация тесной межпредметной связи между химией
и физикой;
2) сопоставление окислительно-восстановительной
активности металлов в водных растворах и расположение
их в ряд активности;
3) ознакомление с практическим значением химических
процессов восстановления металлов
3. АКТУАЛЬНОСТЬ ВЫБРАННОЙ ТЕМЫ: методами химического и электрохимического восстановления осаждают защитные, декоративные,
жаростойкие, коррозийно-устойчивые, износостойкие,токопроводящие покрытия, получают готовые изделия нужной
формы (процесс гальванопластики), извлекают металлы из
растворов, регенерируя таким образом металлы, получают порошки
для последующего формирования из них металлоизделий или
восстановления изношенных деталей
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ: подготовка и выступление на
научно-проектной конференции. Использовать материалы
работы на уроках химии в качестве дидактического материала при
изучении темы: Электролиз
МЕТОДЫ, ПРИМЕНЯЕМЫЕ ПРИ ВЫПОЛНЕНИИ РАБОТЫ:
изучение литературы по данной теме;
практическое применении различных способов получения покрытий
металлами на поверхности токопроводящих предметов;
наблюдение за результатами химических процессов на каждом
этапе, фотографирование с последующим описанием;
объяснение и обобщение результатов проведенных опытов
4. ПЛАН:
1. I ЧАСТЬ: ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ СОЛЕЙ1.1. Покрытие стального токопроводящего предмета (монеты)
слоем меди электрическим током с погружением в раствор
электролита
1.2. Нанесение на алюминиевый предмет (ложку) слоя меди
электрическим током без погружения в раствор электролита
1.3. Установление природы металлических стержней
1.4. Нанесение слоя цинка на стальную пластинку электрическим
током
2. II ЧАСТЬ: КОНТАКТНОЕ ВЫТЕСНЕНИЕ МЕДИ ИЗ РАСТВОРА
ПРИ ИСПОЛЬЗОВАНИИ РАЗЛИЧНЫХ ВОССТАНОВИТЕЛЕЙ
3. III ЧАСТЬ: ПРИМЕНЕНИЕ ПРОЦЕССОВ ВОССТАНОВЛЕНИЯ
МЕТАЛЛОВ
4. ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА
5.
1. I ЧАСТЬ: ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВСОЛЕЙ
1.1. Покрытие стального токопроводящего предмета
(монеты) слоем меди электрическим током с
погружением в раствор электролита
Электролиз - (от электро... и греч. lysis - разложение, растворение,
распад), совокупность процессов электрохимического окислениявосстановления на погруженных в электролит электродах при
прохождении через него электрического тока.
Анод – положительный электрод
Катод – отрицательный электрод
Особенность электролиза - пространственное разделение
процессов окисления и восстановления: электрохимическое окисление
происходит на аноде, восстановление - на катоде.
6.
Электролизможет быть легко
осуществим при
растворении в
воде солей,
диссоциирующих
на
ионы
CuSO4 → Cu²+ + SO4²‾.
Процессы
окислениявосстановления в
растворах
проходят глубже,
если среда
раствора кислая.
Для повышения
рН раствора
необходимо
добавить серную
кислоту.
В качестве
7.
В качестве источникаэлектропитания можно использовать как
стационарный источник постоянного
тока, так и электрическую батарейку,
которая дает напряжение 4 – 10 В.
полюсу
Монета с помощью проволоки Источни
присоединена к отрицательному ка
_ +
питания.
Монета
– катод.
Медный
провод
соедине
нс
К
положит
ельным
полюсом
CuSO4
источни
ка
А
питания
и
8.
При проведенииэлектролиза электроды
должны быть погружены в
растворы, содержащие
ионы, т. е. в электролиты.
К
А
9.
Площадь анода необходимо увеличить, наматывая на негоспиралью медную проволоку. Расстояние между электродами – не
меньше 8 см.
К
А
10.
Процессы, протекающие на электродах при электролизе растворовКатод (+)
Не зависят от материала катода;
зависят от положения
металла в ряду напряжений
Анод (-)
Зависят от материала анода и природы анионов
Анод нерастворимый (инертный),
т.е. изготовлен из угля графита, Pt,
Au
Анод растворимый, изготовлен из Сu, Ag, Zn,
Ni, Fe и др. (кром. Pt, Au)
1. В первую очередь восстанавлива
ются катионы металлов, стоящие в
ряду напряжений после H2:
Men+ + nē → Me0
1. В первую очередь окисляются
анионы бескислородных кислот
(кроме F- ):
Am- - mē → A0
Анионы не
окисляются.
2. Катионы металлов средней
активности, стоящие между Al и H2,
восстанавливаются одновременно с
водой:
Men+ + nē →Me°
2H2O + 2ē → H2↑ +2OH-
2. Анионы оксокислот (SO42-, CO32-,..)
и F- не окисляются, идёт окисление
молекул H2O:
2H2O - 4ē → O2↑ +4H+
3. Катионы активных металлов
от Li до Al (включительно) не восста
навливаются, а восстанавливаются
молекулы H2O:
2H2O + 2ē →H2↑ + 2OH-
3. При электролизе растворов
щелочей окисляются ионы OH-:
4OH- - 4ē → O2↑ +2H2O
4. При электролизе растворов кислот
восстанавливаются катионы H+:
2H + + 2ē → H20↑
Идёт окисление
атомов металла анода:
Me° - nē → Men+
Катионы Men+
переходят в раствор.
Масса анода
уменьшается.
11.
КА
На катоде в результате электролиза происходит восстановление
ионов электролита. Катионы принимают электроны и превращаются в
атомы
К:
Cu2+ + 2ē → Cu0
На аноде в результате электролиза происходит окисление
молекул, принадлежащих материалу анода (анод растворяется)
А:
Cu0 → Cu2+ + 2ē
12.
Электролиз сводится кпереносу меди с анода на
катод
Cu2+ + Cu0 → Cu0 + Cu2+
Изменение окраски на
катоде протекает быстро: от
нескольких секунд до
нескольких минут.
13.
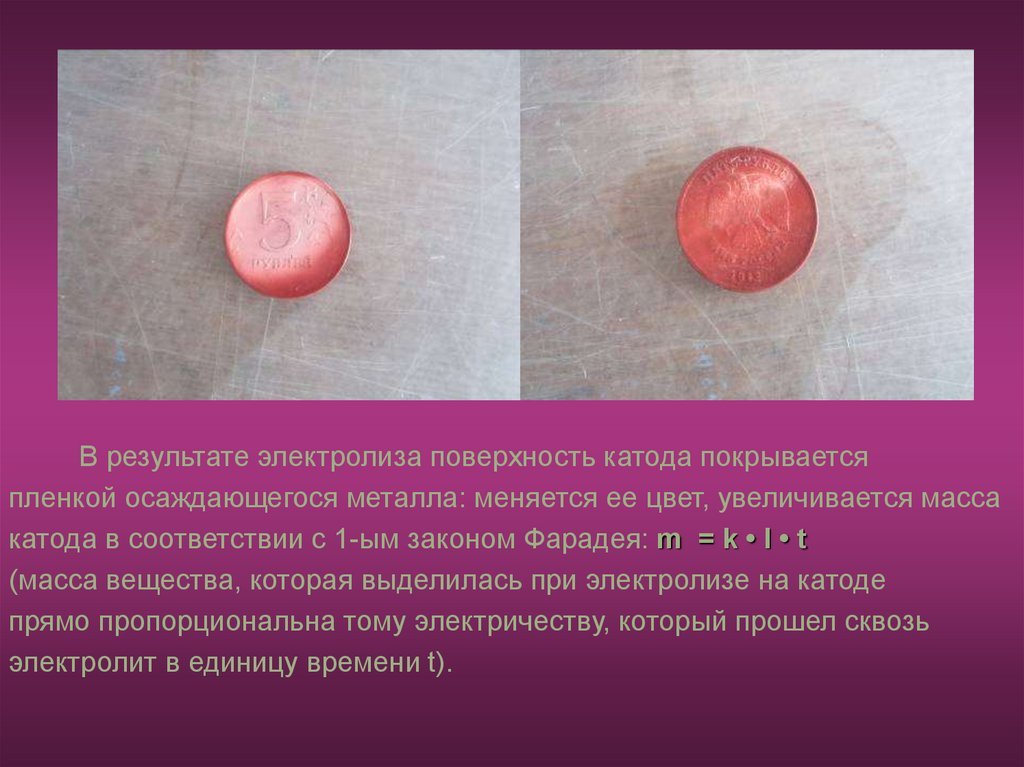
В результате электролиза поверхность катода покрываетсяпленкой осаждающегося металла: меняется ее цвет, увеличивается масса
катода в соответствии с 1-ым законом Фарадея: m = k • I • t
(масса вещества, которая выделилась при электролизе на катоде
прямо пропорциональна тому электричеству, который прошел сквозь
электролит в единицу времени t).
14.
1.2. Нанесение на алюминиевый предмет (ложку)слоя меди электрическим током без погружения в
раствор электролита
15. Поверхность алюминиевой ложки необходимо очистить от оксидной пленки наждачной бумагой и обезжирить раствором соды технической,
затем ложку поместить в пустую стеклянную емкость и присоединитьпроводом к
отрицательному
полюсу источника
питания.
К
16.
Медный провод необходимо распределить между щетинкамизубной щетки и другим концом соединить с «+» источника питания.
Необходимо приготовить насыщенный подкисленный раствор
медного
купороса.
17.
Между поверхностью обрабатываемой детали (катода) и меднымпроводом (анода) всегда должен быть слой электролита, поэтому
импровизированную кисть необходимо помещать в раствор электролита
постоянно.
18.
Во время работы медный провод не должен касаться ложки,замыкать электрическую цепь должен раствор электролита.
19.
Процесс детального покрытия ложки медью длился несколько минут.Избирательное нанесение медного покрытия применяется в
дизайнерских проектах.
20. 1.3. Определение природы металлических стержней
21.
Необходимоприготовить насыщенный
раствор электролита из
поваренной соли.
NaCl
22.
Металлическиестержни необходимо
погрузить в раствор
электролита и подключить
к источнику питания.
А
К
23.
КА
Наблюдаю бурное выделение газа на катоде и небольшое
изменение цвета на аноде.
24.
КА
При дальнейшем проведении электролиза наблюдаю бурную
реакцию с выделением газа на электродах и все более
интенсивную серо-зеленую окраску вблизи анодной области.
25.
В растворе без подкисления образуется зеленоватыйгелеобразный осадок.
26.
При дальнейшем воздействииэлектрического тока осадок
меняет цвет на коричневый.
Наблюдаемыми свойствами –
придавать электролиту зеленый
цвет вблизи анода – обладают
ионы железа:
А: Fe0 → Fe2+ + 2ē
Fe(OH)2 при дальнейшем электролизе окисляется до Fe(OH)3
бурого цвета:
А: Fe2+ → Fe3+ + ē
Т.к. в растворе присутствуют ионы хлора (NaCl → Na+ + Cl-),
параллельно с образованием осадка выделяется газ Cl2 со
специфической окраской и запахом:
А: 2Cl- + 2ē → Cl2↑
На катоде в результате электролиза происходит восстановление
ионов электролита с образованием новых продуктов. Катионы принимают
электроны и превращаются в ионы более низкой степени окисления
К: Fe3+ + ē → Fe2+ (катод принял цвет осадка – серо-зеленый)
и 2H+ + 2ē → H2↑ из воды (выделение газа).
27.
Вывод: данные стержни из стали - сплава на основе железа.Сопутствующие выводы: масса анода уменьшилась, анод стал
тоньше, на его поверхности рыхлый слой Fe(OH)3 коричневого цвета из
раствора, я оставила его для более наглядного восприятия;
масса катода увеличилась, катод принял зеленовато-серый цвет
осадившегося Fe(OH)2 . Процесс длился два часа.
28.
1.4. Нанесение слоя цинка на стальную пластинкуэлектрическим током
29.
Необходимо приготовить электролит, содержащий соль цинка.Zn
Zn
Zn
30.
Помещаю пластинки цинка в раствор серной кислоты.31.
Наблюдаю выделение газа с поверхности пластинок цинка:Zn + H2SO4 = ZnSO4 + H2↑
Необходимо дождаться окончания реакции и перелить электролит в
гальваническую ванну.
32.
При изучении влияний условия на процесс (изменение силы тока вцепи) в электрическую цепь необходимо включить амперметр и реостат.
К
_
А
ZnSO4
+
33.
КZn²+
А
На катоде: Zn2+ + 2ē → Zn0
и 2H+ + 2ē → H2↑ из воды (выделение газа)
на аноде: Zn0 → Zn2+ + 2ē растворение материала анода
(цинковой пластинки).
Происходит перенос вещества с анода на катод. Масса катода
увеличивается.
34.
R увел.1. Я увеличила сопротивление
(R) электрической цепи, т.о. сила
тока (I) уменьшилась (I закон
Ома):
I = U/R,
скорость растворение анода
небольшая)
R уменьш
(
.
2. Сопротивление (R) уменьшила,
сила тока (I) увеличилась,
растворение цинковой пластинки
скорость растворения Zn увеличилась
происходит интенсивнее и с большей
скоростью, но качество покрытия
катода ухудшается, становится
рыхлым.
35. (
Стальную пластинку я погружала в раствор электролита неполностью, чтобы результат был очевиден. Процесс цинкования
пластинки длился несколько часов. Покрытие получилось прочным.
36.
ВЫВОДЫ:I. Скорости электродных реакций зависят от:
1. состава и концентрации электролита
2. материала электрода
3. плотности тока – силы тока, действующей на единицу площади
II. Масса и качество осажденного металла зависят от:
1. материала электрода
2. плотности тока
3. времени процесса
III. В процессе электролиза получено избирательное покрытие
предмета другим металлом
IV. В процессе электролиза установлен качественный состав
электродов
V. Электролиз – физико-химический процесс, теоретической
основой которого являются законы М.Фарадея, позволяющие
рассчитать выход продукта по массе, спрогнозировать необходимый
результат и повлиять на ход процесса.
37. ВЫВОДЫ:
2. ЧАСТЬ II. КОНТАКТНОЕ ВЫТЕСНЕНИЕ МЕДИ ИЗРАСТВОРА ПРИ ИСПОЛЬЗОВАНИИ РАЗЛИЧНЫХ
ВОССТАНОВИТЕЛЕЙ
CuSO4
Pb Sn Zn Fe
38.
1-ый день: я поместила образцы металлов в пробирки сконцентрированным раствором медного купороса.
39.
PbZn
Fe
Sn
2-ой день: в пробирках №2 и №3 изменился цвет раствора.
40.
При детальном рассмотрении установлено, что реакциязамещения началась в пробирках с образцами цинка и железа:
Zn0 + Cu2+SO4 = Zn2+SO4 + Cu0
Fe0 + Cu2+SO4 = Fe2+SO4 + Cu0
41.
3-ий день дал следующие результаты:1. ионы меди восстановились в первую очередь на цинковой пластинке:
Cu2+ + 2ē → Cu0 – раствор стал прозрачным;
2. во вторую очередь
ионы меди
восстановились на
железном гвозде –
раствор приобрел
бледно-голубую окраску;
Pb Zn Fe Sn
3. начало реакции
замещения в 4-й
пробирке:
Sn0 + Cu2+SO4 =
Sn2+SO4 + Cu0,
о чем свидетельствует
слабое изменение цвета
образца олова.
42.
Zn FeSn Pb Cu
ВЫВОДЫ:
1. Скорость выделения меди из раствора при использовании
различных восстановителей различна, а значит:
2. восстановительные свойства металлов различны.
3. Расположение исследуемых металлов в ряд активности.
4. Преимущества электролиза перед химическим методом
получения целевых продуктов заключаются в возможности
сравнительно просто (регулируя ток) управлять скоростью и
селективной направленностью реакций. Условия электролиза легко
контролировать, благодаря чему можно осуществлять процессы как
в самых «мягких», так и в наиболее «жестких» условиях.
43.
3. III ЧАСТЬ: ПРИМЕНЕНИЕ ПРОЦЕССОВВОССТАНОВЛЕНИЯ МЕТАЛЛОВ
КАТОД, ПРОЦЕССЫ НА КАТОДЕ
МЕТАЛЛУР Получение чистых металлов: Na, Ca, Mg, Al,
ГИЯ
Zn, Cu, Ni, Cd, Co, Mn
АНОД, ПРОЦ. НА АН.
Нерастворимый анод:
угольный, графитовый
Очищение: Сu, Ni, Sn, Pb, Ag, Pt
Очищаемый металл
ГАЛЬВАНО
СТЕГИЯ
Защита изделий от коррозии, придания им
эстетического оформления: Cr, Ni, Ag, Au,Pt
ГАЛЬВАНО
ПЛАСТИКА
Получение точных копий с рельефных
предметов (изготовление бюстов, статуй)
Пластины из того
металла, который
осаждается на катоде
ХИМИЧЕС
КАЯ ПР-ТЬ
H2
Cl2, O2, анилин и другие
ОЧИСТКА
СТОЧ. ВОД
Нерастворимые аноды;
растворимые (Al, Fe)
ЭЛ.ХИМИЧ
ПОЛИРОВ
КА МЕТАЛ
ЛОВ
Резное изделие, соеди
ненное с «+» выравни
вается, т.к. наиболее
интенсивно ē покидают
именно выступы
44. 3. III ЧАСТЬ: ПРИМЕНЕНИЕ ПРОЦЕССОВ ВОССТАНОВЛЕНИЯ МЕТАЛЛОВ
ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА:1. Большая советская энциклопедия, БСЭ. 2012
2. Реми Г. Курс неорганической химии. Т. 1, 2. М. : Мир, (1972).
3. Рэмсден Э. Н. Начала современной химии. Л.:Химия, (1989)
4. Гроссе Э., Вайсмантель Х. Химия для любознательных.
Л: Химия, (1987)
5. Манкевич Н.В. Неорганическая химия. Весь школьный
курс в таблицах. Минск «Букмастер» «Кузьма», 2013
6. Шульпин Г.Б. Химия для всех. Издательство «Знание»,
Москва, 1987
7. Фадеев Г.Н. Химические реакции. Пособие для учащихся.
Москва «Просвещение», 1980











































 Химия
Химия