Похожие презентации:
Электрохимическая система
1. эхп
2.
3. Электрохимическая система (с одним электролитом)
4. Электрохимическая система (с двумя электролитами)
5. Электрохимическая схема
Система с одним электролитом –электрод1| электролит | электрод2
Система с двумя электролитами –
электрод1| электролит1 ¦¦ электролит2 | электрод2
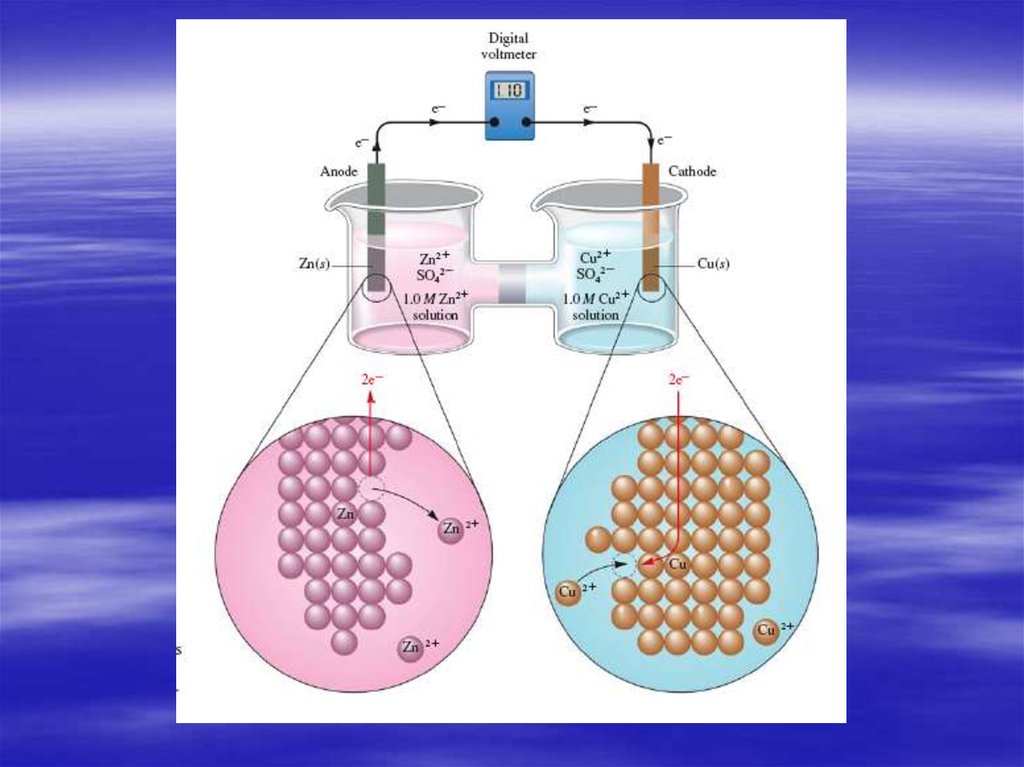
6. Гальванический элемент Даниэля
7. Электрохимические термины и процессы в гальваническом элементе
Анод – электрод, на котором происходитокисление.
Катод - электрод, на котором происходит
восстановление.
1) Окисление восстановителя анодная реакция : Zn – 2 ē → Zn2+
2) Восстановление окислителя –
катодная реакция : Cu2+ + 2 ē → Cu
3) Движение ионов в растворе
4) Движение электронов во внешней цепи
Токообразующая реакция (ТОР) - сумма
катодной и анодной реакций
Zn + Cu2+
Zn2+ + Cu
8.
Схема:анод| электролит1 ¦¦ электролит2 | катод
Полная: Zn | ZnSO4 ¦¦ CuSO4 | Cu
Краткая:
Zn| Zn2+ ¦¦ Cu2+ | Cu
9.
Электродвижущая сила (ЭДС) – разностьпотенциалов (напряжение) между
электродами: E = φ2 - φ1.
E связана с ΔG: E = - ΔG/nF
n – количество электронов в ТОР
F - число Фарадея = 96500 Кл/моль
10. Измерения электродных потенциалов
E = φкатода – φанодаПринято: электродный потенциал =
= E = φэлектрода – φэлектрода сравнения
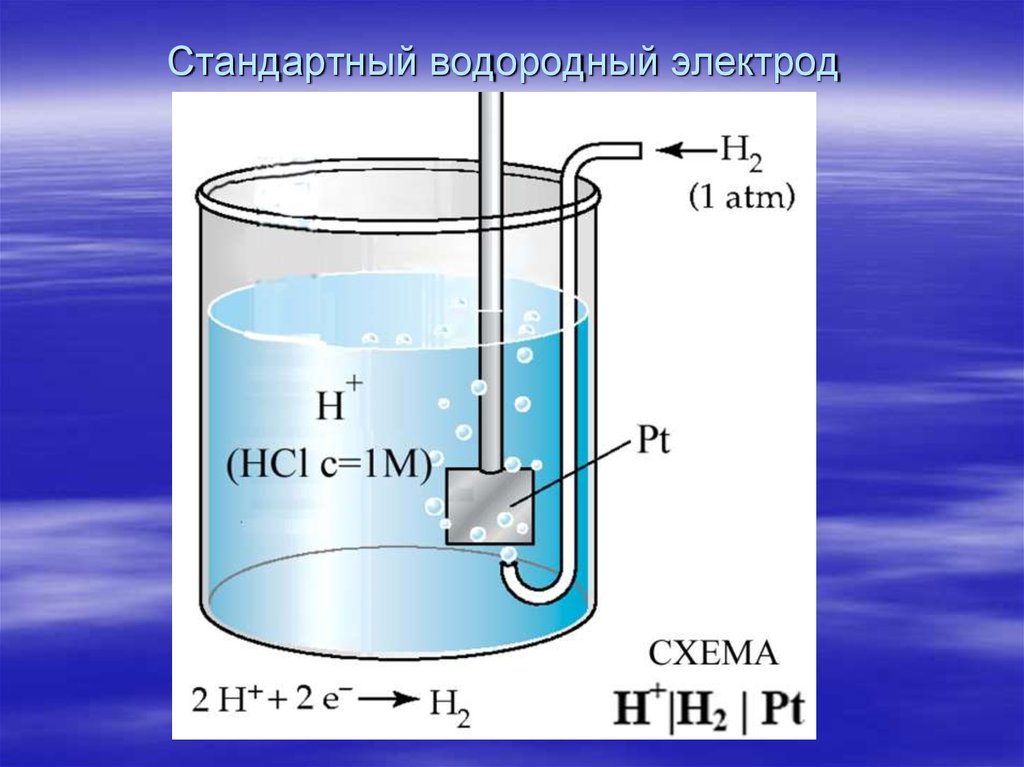
11. Стандартный водородный электрод
12. Установка для измерения потенциалов
A: Zn – 2 ē = Zn2+K: 2 H+ + 2 ē = H2
Схема: Zn| Zn2+ ¦¦ H+ | H2 | Pt
13. Стандартный электродный потенциал
Измеряется Е = φэлектрод – φСВЭ == ЕOx/Red
ЕOx/Red = f(природы реагентов, с, Т)
Стандартный электродный потенциал Е0Ox/Red = ЕOx/Red (cOx= 1 моль/л, cRed= 1 моль/л)
Пример:
Е0Zn2+/Zn
Для Т = 25 0С (298 К) Е0Ox/Red в таблицах
14.
15. Ряд напряжений металлов
16.
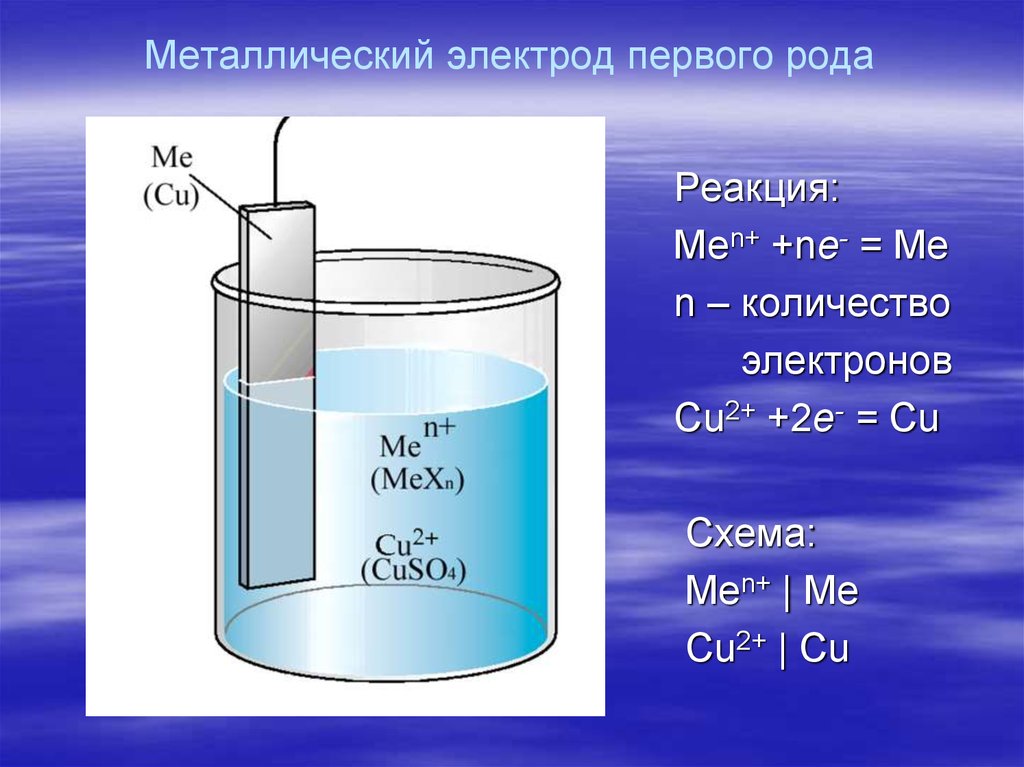
17. Металлический электрод первого рода
Реакция:Men+ +ne- = Me
n – количество
электронов
Cu2+ +2e- = Cu
Схема:
Men+ | Me
Cu2+ | Cu
18. Зависимость Е от с
E E Men / Me0
RT
ln cMen - уравнение Нернста
nF
F – число Фарадея
F = 96500 Кл/моль
При Т = 25 0С (298 К)
E E Men / Me
0
0.059
lg cMen
n
RT
E ECu2 /Cu
ln cCu2
nF
0
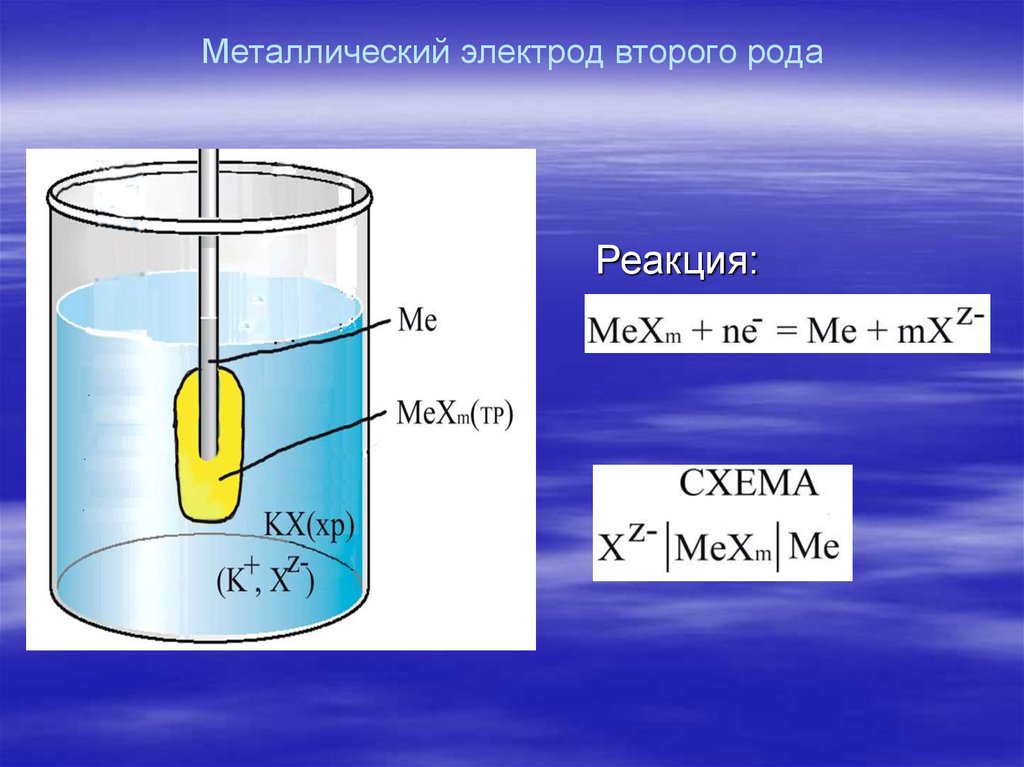
19. Металлический электрод второго рода
Реакция:20.
Уравнение потенциала:EMeA m/Me,Az E
E
o
MeA m/Me, Az
o
MeA m/Me, Az
E
o
Men /Me
RT lnc z
z F A
RT ln ПРMeA
m
nF
21. хлорсеребряный электрод Ag AgCl Cl- AgCl + ē = Ag + Cl-
хлорсеребряный электродAg AgCl ClAgCl + ē = Ag + Cl-
EAgCl/Ag,Cl E
o
AgCl/Ag, Cl
RT lnc
Cl
F
кадмий-оксидный электрод
Cd CdO OHCdO +H2O + 2 ē = Cd + 2 OH-
ECdOH/Cd,OH E
o
CdOH/Cd,OH
RT lncOH
F
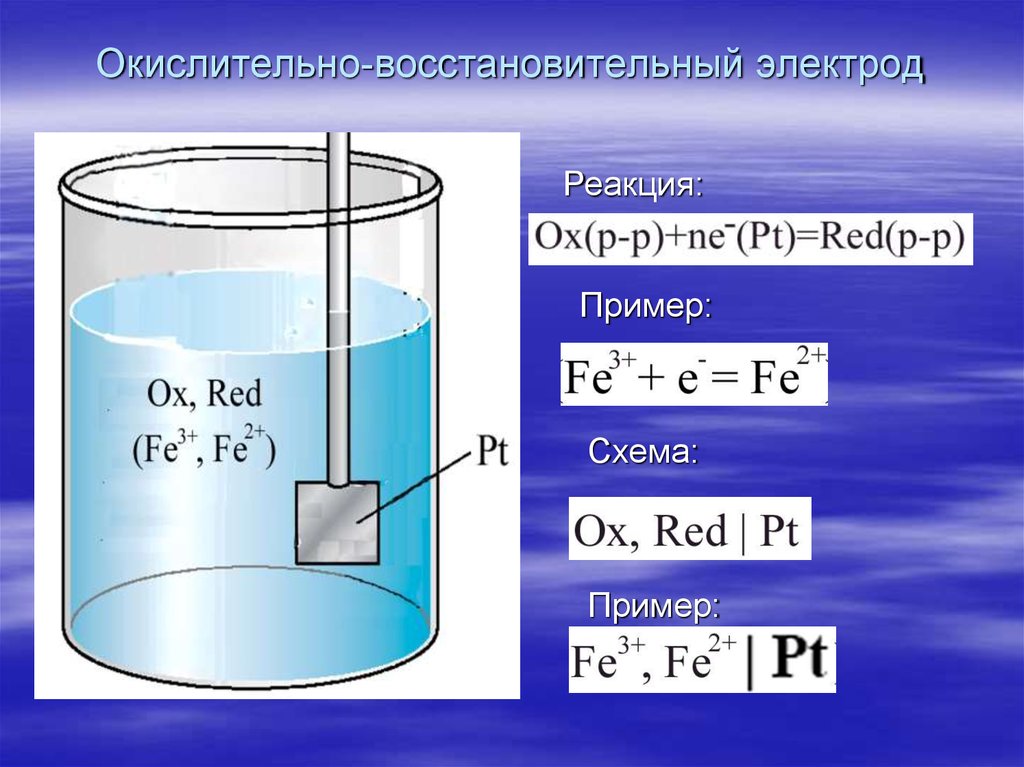
22. Окислительно-восстановительный электрод
Реакция:Пример:
Схема:
Пример:
23. Уравнение потенциала
EOx/Red Eo
Ox/Red
C
RT ln Ox
F C
Red
Пример:
EFe3 /Fe2 E
o
Fe3 /Fe2
C
RT ln Fe3
F C
Fe
2
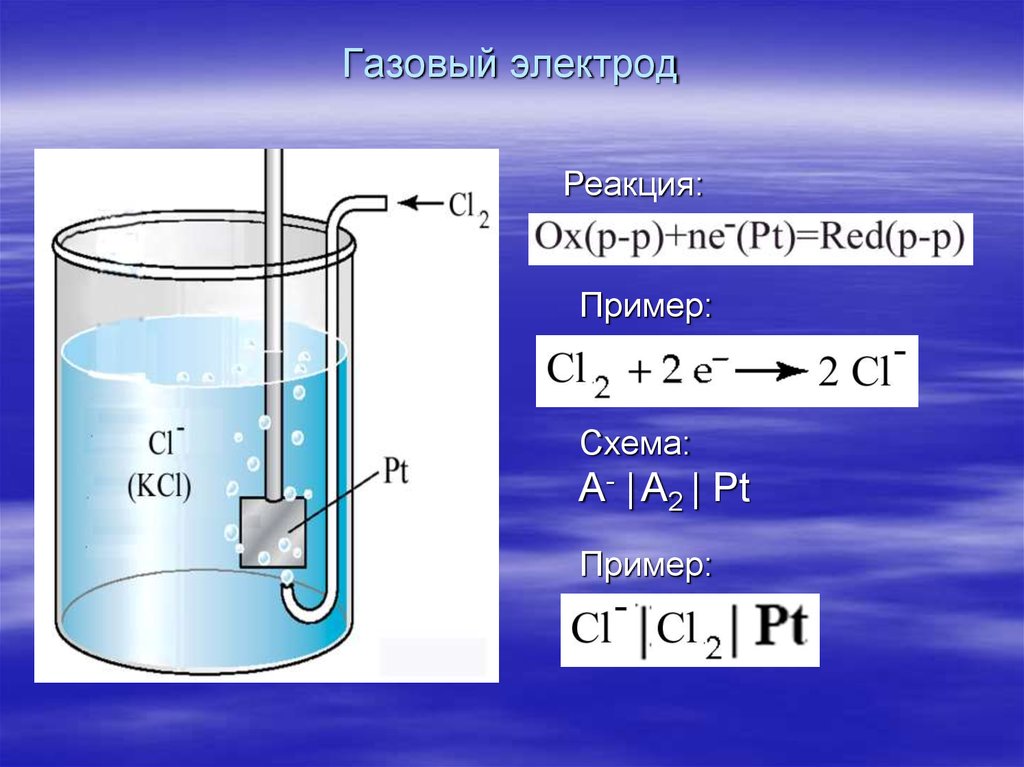
24. Газовый электрод
Реакция:Пример:
Схема:
A- | A2 | Pt
Пример:
25. Уравнение потенциала
ECl /Cl- E2
o
Cl2/Cl-
RT ln P Cl 2
2F C2 Cl-
кислородный электрод
Pt | О2 | OHO2 + 2Н2O + 4e- = 4OH-
EO /OH- E
2
o
O2/OH-
RT ln P O 2
4F C4 OH -
26.
27.
28. каломельный электрод Hg Hg2Cl2 Cl- Hg2Cl2 + 2 ē = 2Нg + 2 Cl-.
каломельный электродHg Hg2Cl2 ClHg2Cl2 + 2 ē = 2Нg + 2 Cl-.






















 Химия
Химия








