Похожие презентации:
Непредельные углеводороды
1. Непредельные углеводороды
CHH ≡C
C
H
CH2=CH-CH=CH2 ≡C CH2=CH-CH=CH2
H
H
C
CH CH =
H
≡
2
C
H
CH≡C
C
=
2 CH
H
CH
≡
C
2
CH≡C
2
C
H2 = H 2=CH H 2 CH
H
2
H
C
H
=
H
C
C
C
H
C
CH H 2= 2= =CHΞ
C
H
C
CH 2
≡
H
C
2
H
C
H2
C
CH2=CH-CC
=
C
H2 =H CH 2 CH≡CH
H=CH
CH
2
2
H
C
2
=
2
CHНепредельные
углеводороды
10 класс, базовый уровень
CH≡C
CH≡CH
2
H
C
CH≡
=
2
H
C CH2H=CHC
2
C
H
2
2 =CH
H
-CH=C
H
2
H
2
C
H
C
2
≡
C
H
H
=
CCH =CH-CH=CH
2
2
CH 2
=C
Трухина О.Е.
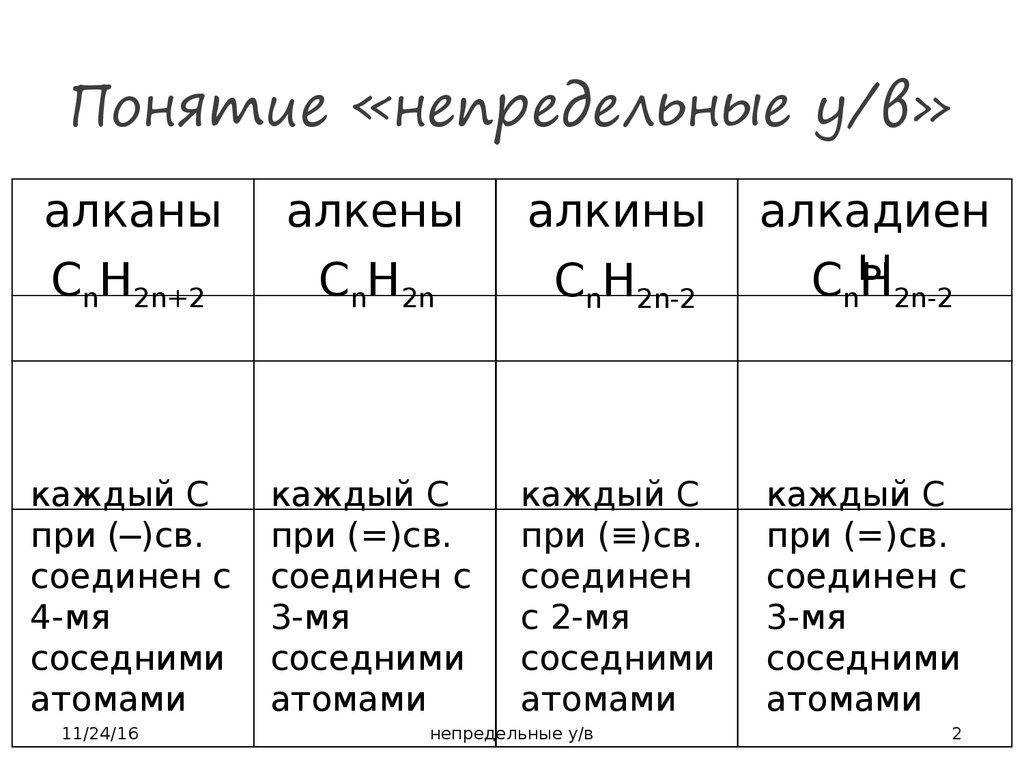
2. Понятие «непредельные у/в»
алканыалкены
алкины
CnH2n+2
CnH2n
CnH2n-2
алкадиен
Cы
H
каждый С
при (─)св.
соединен с
4-мя
соседними
атомами
каждый С
при (=)св.
соединен с
3-мя
соседними
атомами
каждый С
при (≡)св.
соединен
с 2-мя
соседними
атомами
каждый С
при (=)св.
соединен с
3-мя
соседними
атомами
11/24/16
непредельные у/в
n
2n-2
2
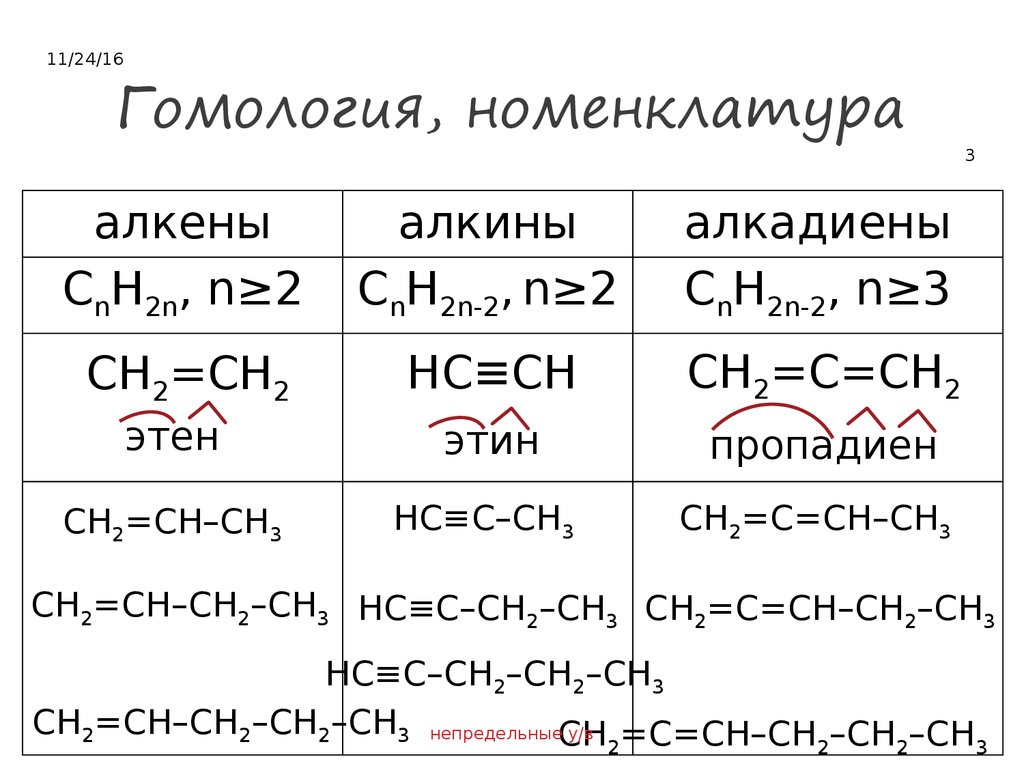
3. Гомология, номенклатура
11/24/16Гомология, номенклатура
алкены
CnH2n, n≥2
алкины
CnH2n-2, n≥2
алкадиены
CnH2n-2, n≥3
CH2=CH2
HC≡CH
CH2=C=CH2
этен
этин
пропадиен
CH2=CH–CH3
HC≡C–CH3
CH2=C=CH–CH3
3
CH2=CH–CH2–CH3 HC≡C–CH2–CH3 CH2=C=CH–CH2–CH3
HC≡C–CH2–CH2–CH3
CH2=CH–CH2–CH2–CH3 непредельныеCH
у/в
2=C=CH–CH2–CH2–CH3
4. Номенклатура ИЮПАК
1алкан
2
5
2
3
4
5
пентен- CH2=CH-CH2-CH2-CH3
1
2
3
4
5
пентин-2 CH3―CΞC―CH2-CH3
алкадиен
пентадиен-1,3
1
11/24/16
4
пентан CH3-CH2-CH2-CH2-CH3
1
алкен
1
алкин
3
2
3
4
5
CH2=CH-CH=CH2-CH3
непредельные у/в
4
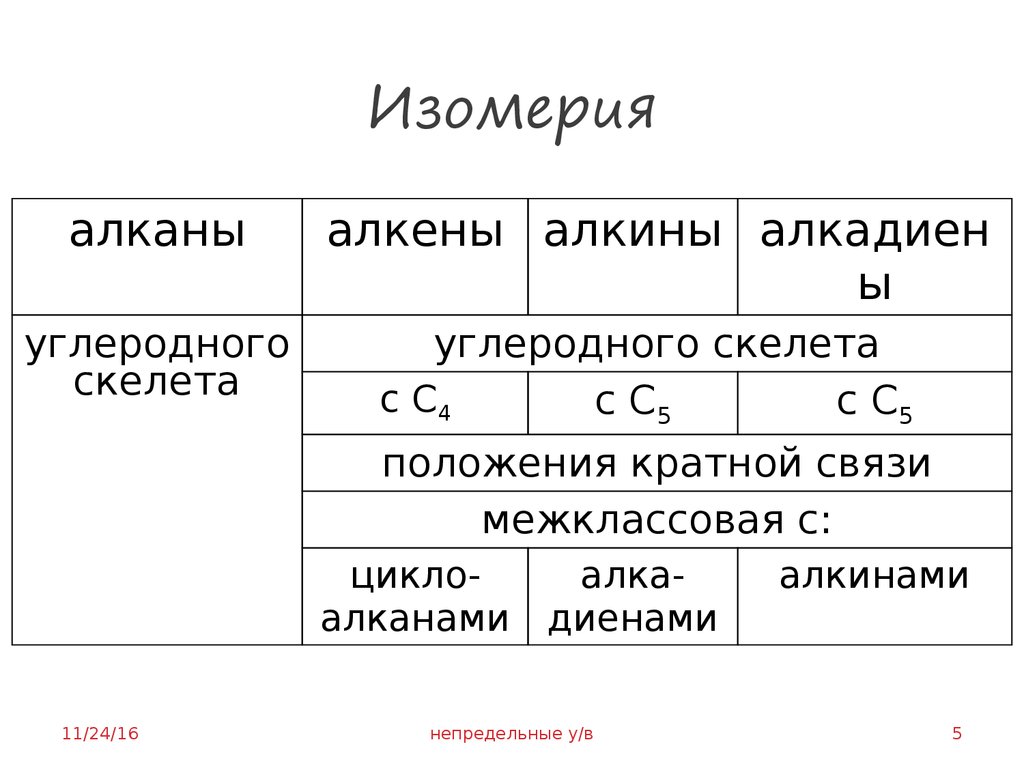
5. Изомерия
алканыалкены алкины алкадиен
ы
углеродного
скелета
углеродного скелета
с С4
с С5
с С5
положения кратной связи
межклассовая с:
циклоалканами
11/24/16
алкадиенами
непредельные у/в
алкинами
5
6. Упражнение:
алкеныалкины
алкадиены
даны вещества:
2-метилбутен- пентин- 3-метилбутадиен-1,2
1
1
составьте структурные формулы и назовите
по одному изомеру каждого типа для этих
веществ
11/24/16
непредельные у/в
6
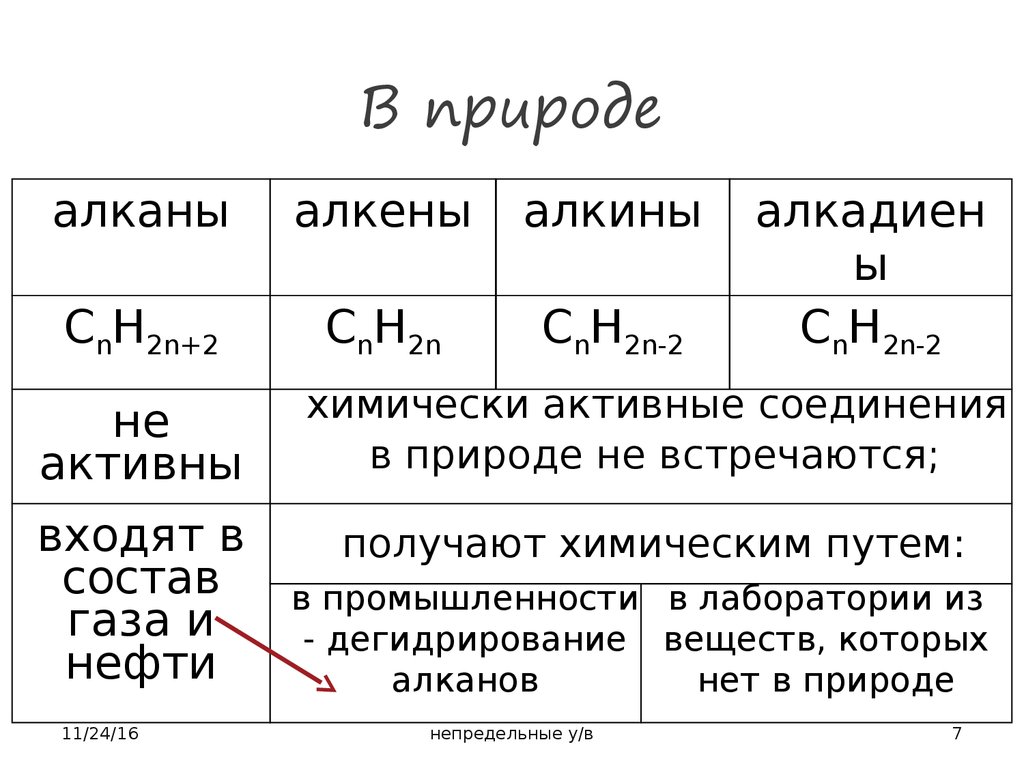
7. В природе
алканыалкены
алкины
CnH2n+2
CnH2n
CnH2n-2
алкадиен
ы
CnH2n-2
не
активны
химически активные соединения
в природе не встречаются;
входят в
состав
газа и
нефти
получают химическим путем:
11/24/16
в промышленности в лаборатории из
- дегидрирование веществ, которых
алканов
нет в природе
непредельные у/в
7
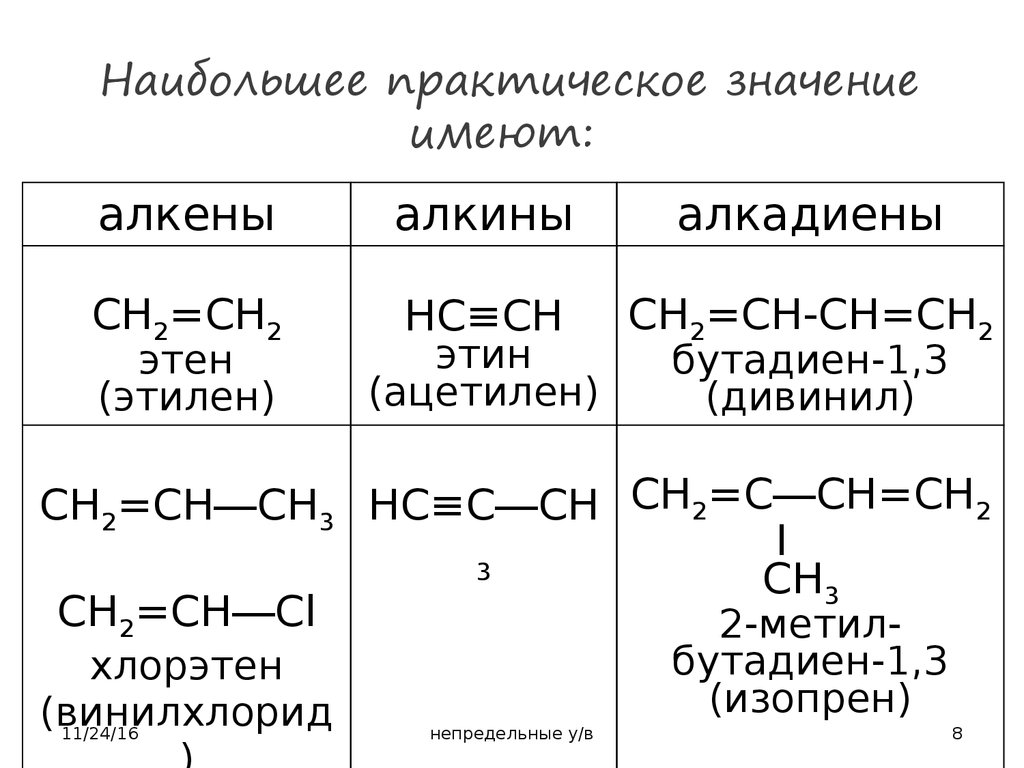
8. Наибольшее практическое значение имеют:
алкеныалкины
алкадиены
CH2=CH2
HC≡CH
CH2=CH-CH=CH2
этен
(этилен)
этин
(ацетилен)
бутадиен-1,3
(дивинил)
CH2=CH―CH3 HC≡C―CH CH2=C―CH=CH2
I
3
CH3
CH2=CH―Cl
2-метилхлорэтен
(винилхлорид
11/24/16
бутадиен-1,3
(изопрен)
непредельные у/в
8
9. Получение в промышленности
пиролиз метана (метановый метод)15000С
2CH4 → C2H2 + 3H2
с 1936г. – промышленный способ
получения ацетилена.
дегидрирование алканов:
CH3―CH3 → CH2=CH2 + H2
этан
этен (этилен)
CH3―CH2―CH3 → CH2=CH-CH3 + H2
11/24/16
пропан
пропен (пропилен)
непредельные у/в
9
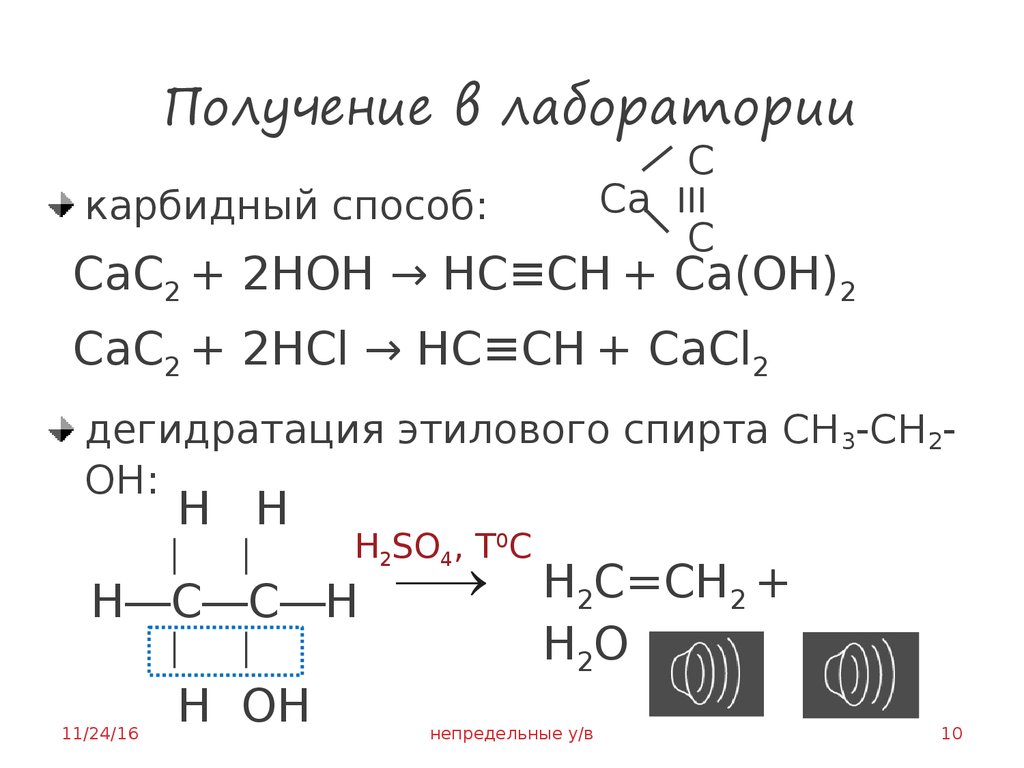
10. Получение в лаборатории
CCa III
C
карбидный способ:
CaC2 + 2HOH → HC≡СН + Ca(ОH)2
CaC2 + 2HCl → HC≡СН + CaCl2
дегидратация этилового спирта СН3-СН2ОН:
H H
│
│
│
│
H2SO4, T0С
Н―С―С―Н
11/24/16
Н ОН
Н2С=СН2 +
Н2О
непредельные у/в
10
11. Получение диеновых у/в
1932гС.В. Лебедев
сырьё –
СН3-СН2-ОН этиловый спирт
H H
H H
│
│
│
│
Н―С―С―Н Н―С―С―Н
│
│
+
│
│
Н ОН
kat=Al
Н2OОН
3+ZnO
Н2С=СН-СН=СН2 + 2Н2О +
Н2
11/24/16
непредельные у/в
11
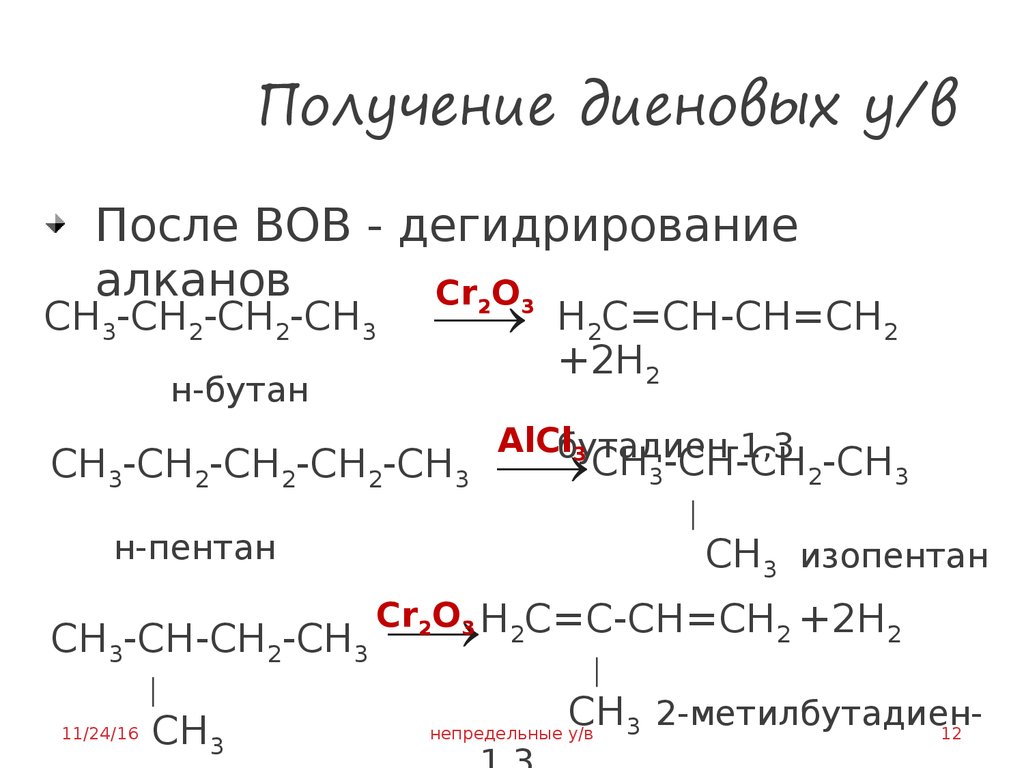
12. Получение диеновых у/в
После ВОВ - дегидрированиеалканов
Cr2O3
СН3-СН2-СН2-СН3
Н2С=СН-СН=СН2
+2Н2
н-бутан
AlClбутадиен-1,3
3
СН3-СН2-СН2-СН2-СН3 СН3-СН-СН2-СН3
│
н-пентан
СН3 изопентан
Cr2O3 Н2С=С-СН=СН2 +2Н2
СН3-СН-СН2-СН3
│
11/24/16
СН3
│
СН3 2-метилбутадиен12
непредельные у/в
13. Химические свойства
реакции присоединенияреакции полимеризации
горение и окисление
реакции замещения
11/24/16
непредельные у/в
13
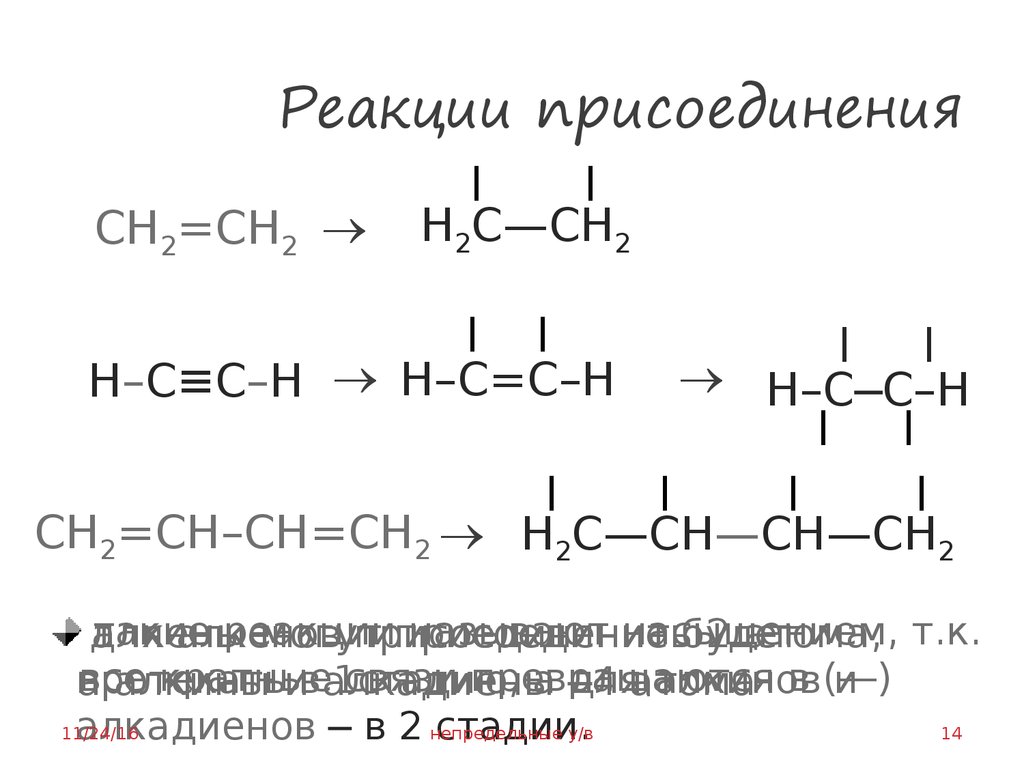
14. Реакции присоединения
CH2=CH2l
l
H2C—CH2
l l
H–C≡C–H H–C=C–H
l
l
H–C─C–H
l
l
l
l
l
l
CH2=CH–CH=CH2 H2C—CH—CH—CH2
такие
реакции
называют насыщением,
алкены
могут
присоединить
2 атома, т.к.
для
алкенов
присоединение
будет
все
кратные
связи превращаются
в (―)
протекать
1стадию,
а ─4
дляатома
алкинов
и
а
алкины
ив алкадиены
11/24/16
у/в
14
алкадиенов ─ в 2 непредельные
стадии.
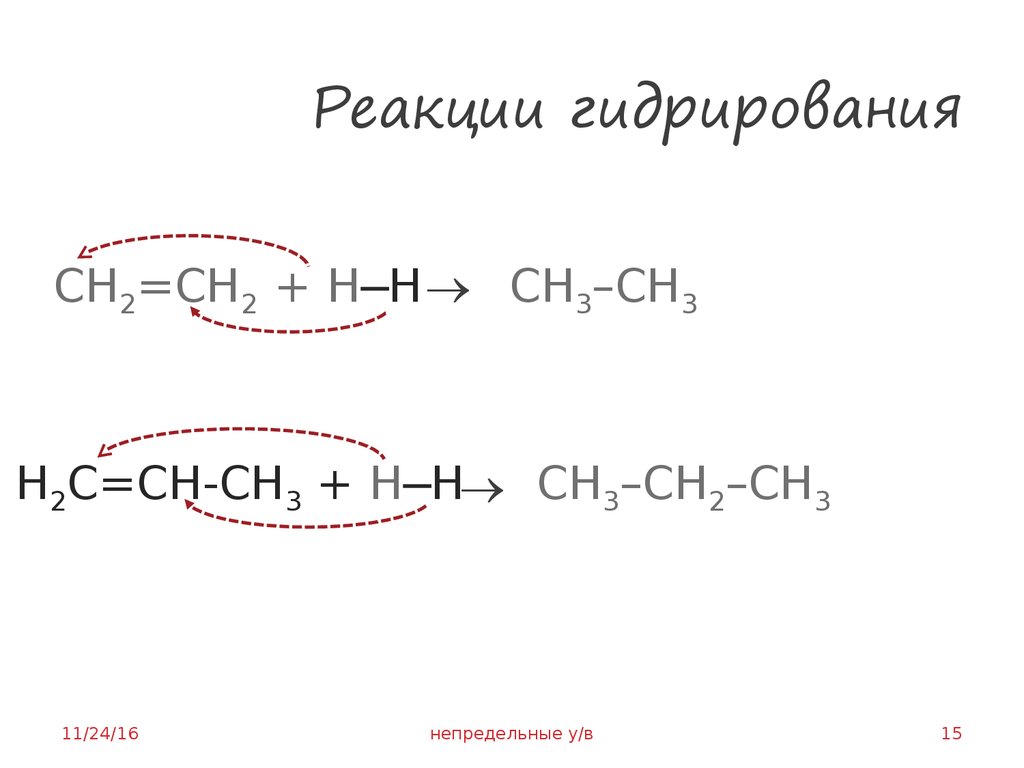
15. Реакции гидрирования
CH2=CH2 + H─Н CH3–CH3H2C=CН-СH3 + H─Н CH3–CH2–CH3
11/24/16
непредельные у/в
15
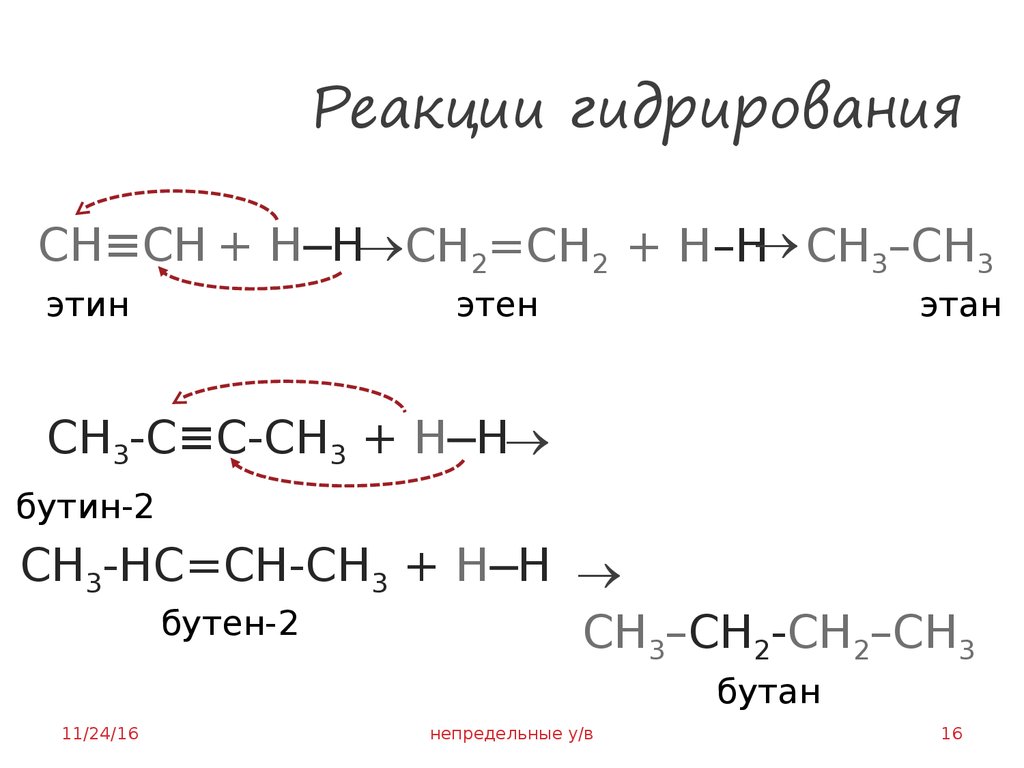
16. Реакции гидрирования
CH≡CH + H─Н CH2=CH2 + H–Н CH3–CH3этин
этен
этан
СH3-C≡C-СH3 + H─Н
бутин-2
СH3-НC=CН-СH3 + H─Н
бутен-2
CH3–СH2-CH2–CH3
бутан
11/24/16
непредельные у/в
16
17. Реакции гидрирования
H2C=СН–CН=СH2CH3–СН=CН–СH3
1,4 - 80%
1
2
3
4
1
2
3
4 2–СН–CН–СH2 + Н–Н
CH
l
l
11/24/16
l
1
2
3
4 3–СН2–СН=СН2
1,2 - 20% СН
l
непредельные у/в
17
18. Реакции галогенирования
качественные реакции на кратные связиCH2=CH2 + Br2
+ Br2
H-C≡C-H + Br2
CH2=CH-CH=CH2 + Br2
11/24/16
непредельные у/в
+
Br2
18
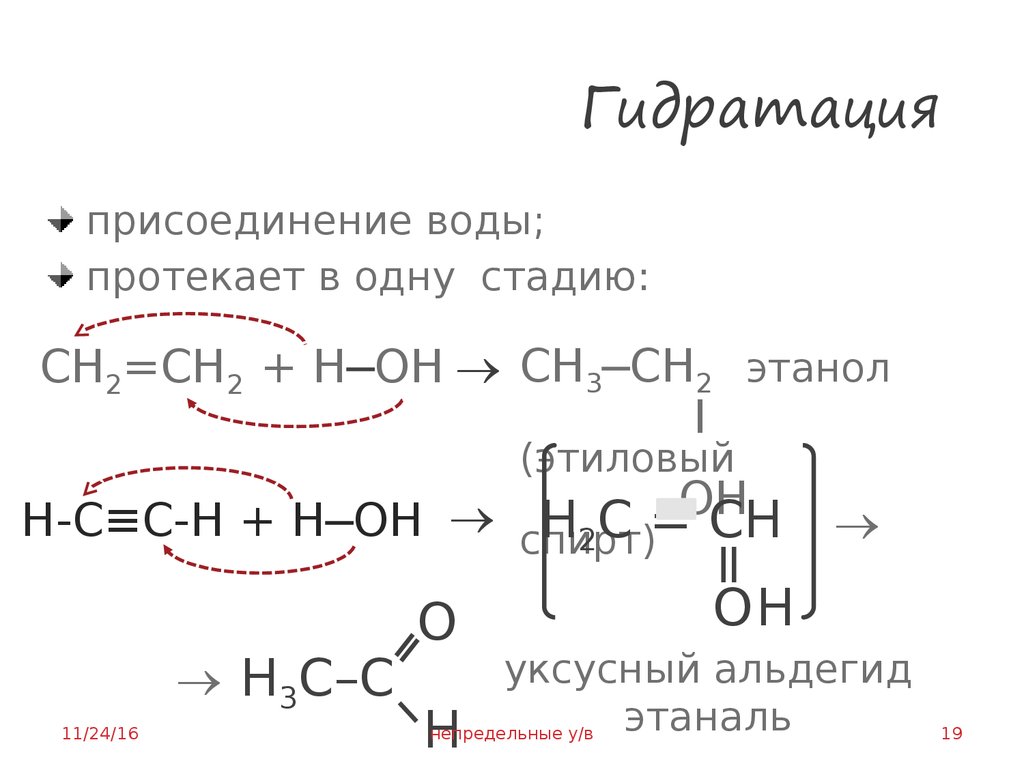
19. Гидратация
присоединение воды;протекает в одну стадию:
CH2=CH2 + H─ОН CH3─CH2 этанол
I
(этиловый
OH
H-C≡C-H + H─ОН
H2C = CН
спирт)
H3C–C
11/24/16
О
ОН
уксусный альдегид
этаналь
непредельные у/в
Н
19
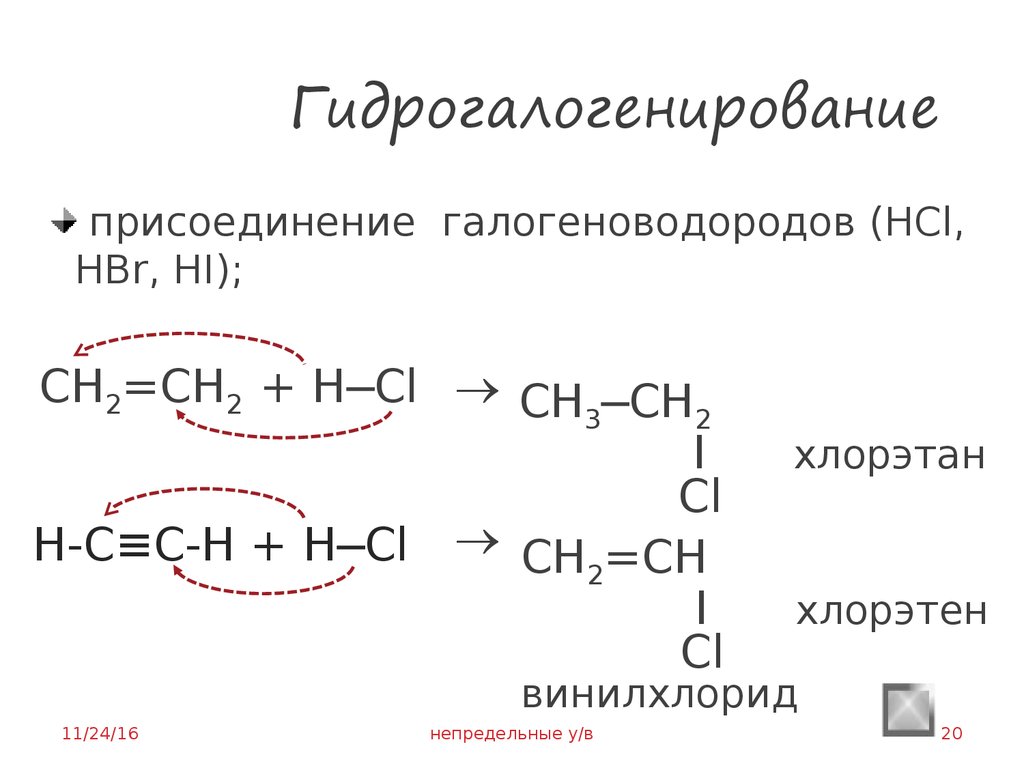
20. Гидрогалогенирование
присоединение галогеноводородов (HCl,HBr, HI);
CH2=CH2 + H─Cl CH ─CH
3
2
I
Cl
H-C≡C-H + H─Сl CH =CH
2
I
Cl
хлорэтан
хлорэтен
винилхлорид
11/24/16
непредельные у/в
20
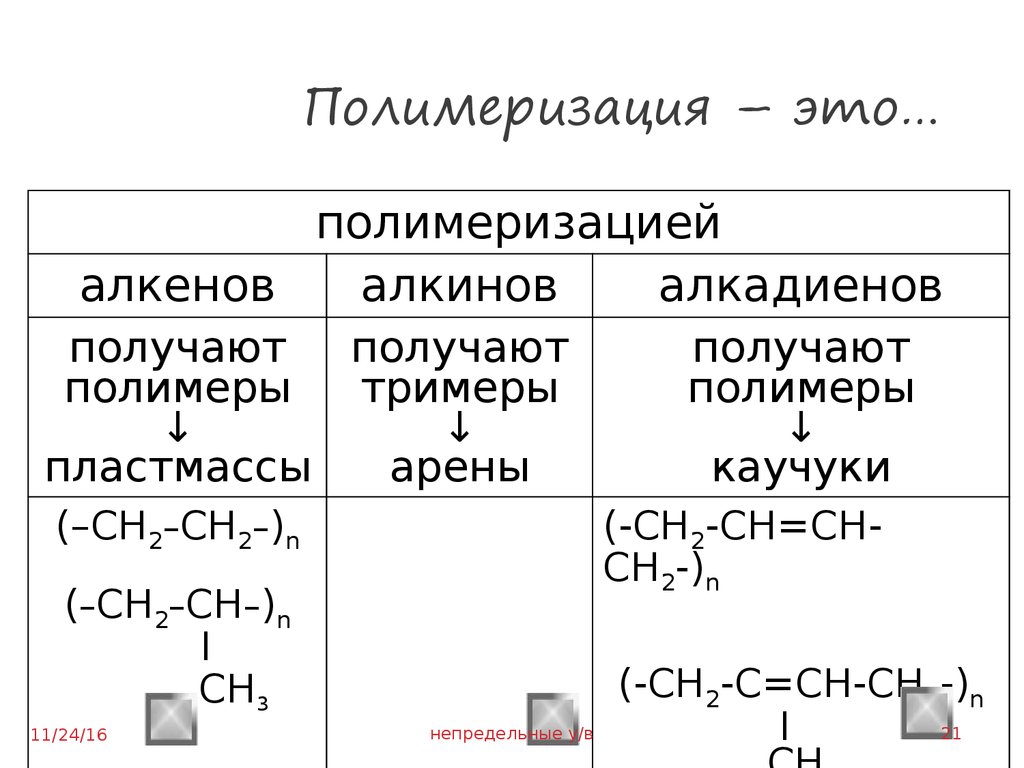
21. Полимеризация – это…
полимеризациейалкенов
алкинов
алкадиенов
получают получают
полимеры
тримеры
↓
↓
пластмассы
арены
(–CH2–CH2–)n
(-CH2-CH=CHCH2-)n
(–CH2–CH–)n
I
CH3
11/24/16
получают
полимеры
↓
каучуки
непредельные у/в
(-CH2-C=CH-CH2-)n
21
I
22. Полимеризация
+…+
…+
+
+
+
+…
+…
…―CH2―CH2―CH2―CH2―CH2―CH2―…
сокращенное уравнение реакции
n(CH2=CH2) (―CH2―CH2―)n
этилен-мономер
11/24/16
полиэтилен-полимер
непредельные у/в
22
23. Полипропилен
n(CH2=CH) (―CH2―CH―)nI
I
CH3
CH3
пропилен
11/24/16
полипропилен
непредельные у/в
23
24. Поливинилхлорид
n(CH2=CH) (―CH2―CH―)nI
I
Сl
Cl
хлорэтен
(винилхлорид)
(поливинилхлорид)
ПВХ
это пластик, который в
промтоварном магазине
называется ПВХ.
11/24/16
непредельные у/в
24
25. Полимеризация
+Полимеризация
у диеновых протекает по принципу
«присоединение 1,4»
1
2
3
4
1
2
3
+ 4
1
2
3
4
+
1
2
3
+
4
1 2
3
4
1
2
3
4
n(H2C=СН–CН=СH2) (―CН2–CН=СH–СН2 ―)n
11/24/16
дивиниловый каучук
25
непредельные у/в
+
26. Полимеризация
Запишите реакции полимеризации:n(H2C=С–CН=СH2)
l
СН3
изопреновый каучук
11/24/16
непредельные у/в
26
27. Полихлоропрен (спец.Каучук)
n(H2C=С–CН=СH2)l
Сl
хлоропреновый каучук
11/24/16
непредельные у/в
27
28. Вулканизация
11/24/16непредельные у/в
28
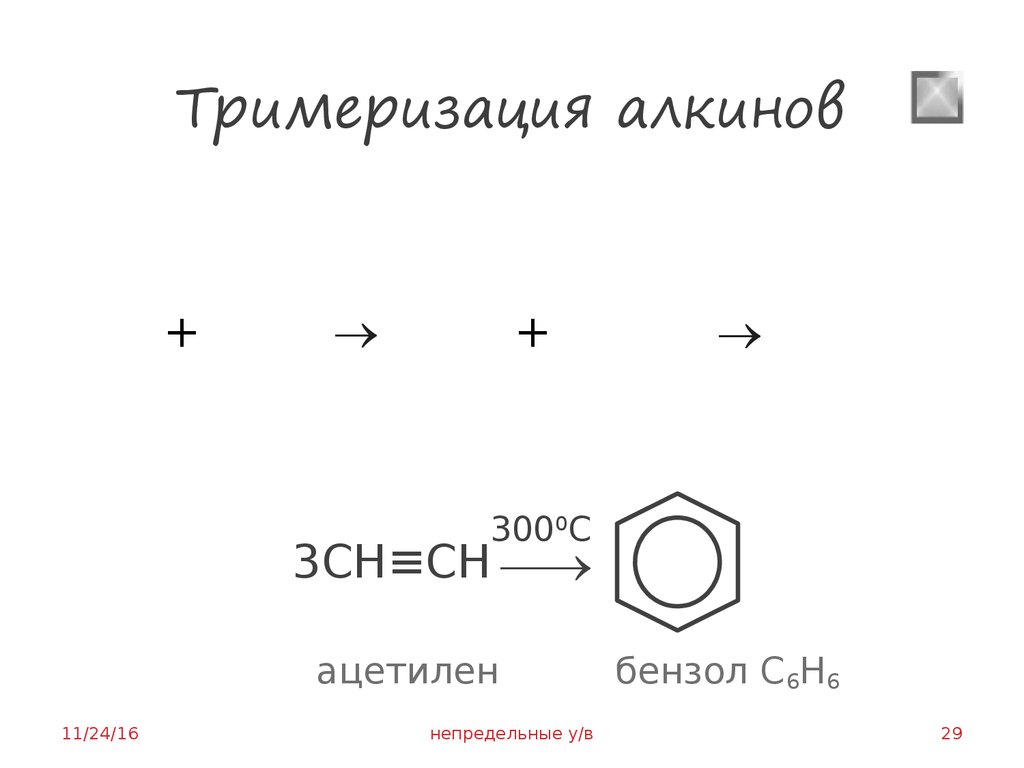
29. Тримеризация алкинов
++
3000С
3СН≡СН
ацетилен
11/24/16
непредельные у/в
бензол С6Н6
29
30. Горение и окисление
все непредельные хорошо горят:CH2=CH2 + 3О2 → 2 CО2 + 2H2О
этен
C4H6 + 5,5О2 → 4CО2 + 3H2О
бутадиен-1,3
11/24/16
непредельные у/в
30
31. Горение и окисление
на воздухе ацетилен гориткоптящим пламенем:
C2H2 + О2 → С + CО + H2О
этин
сажа
угарный газ
в кислороде бледно-голубым
пламенем (Т=2500-30000С)
2C2H2 + 5О2 → 4CО2 + 2H2О
этин
с 1906г ацетилен стали
использовать для сварки и резки
металлов
11/24/16
непредельные у/в
31
32. Физические свойства
ацетилен хорошо растворим вацетоне (25л в 1л ацетона при
15°С и 300л при Р=12атм);
взрывоопасен, поэтому его
хранят в баллонах,
наполненных пористым
инертным материалом,
который пропитан ацетоном.
11/24/16
непредельные у/в
32
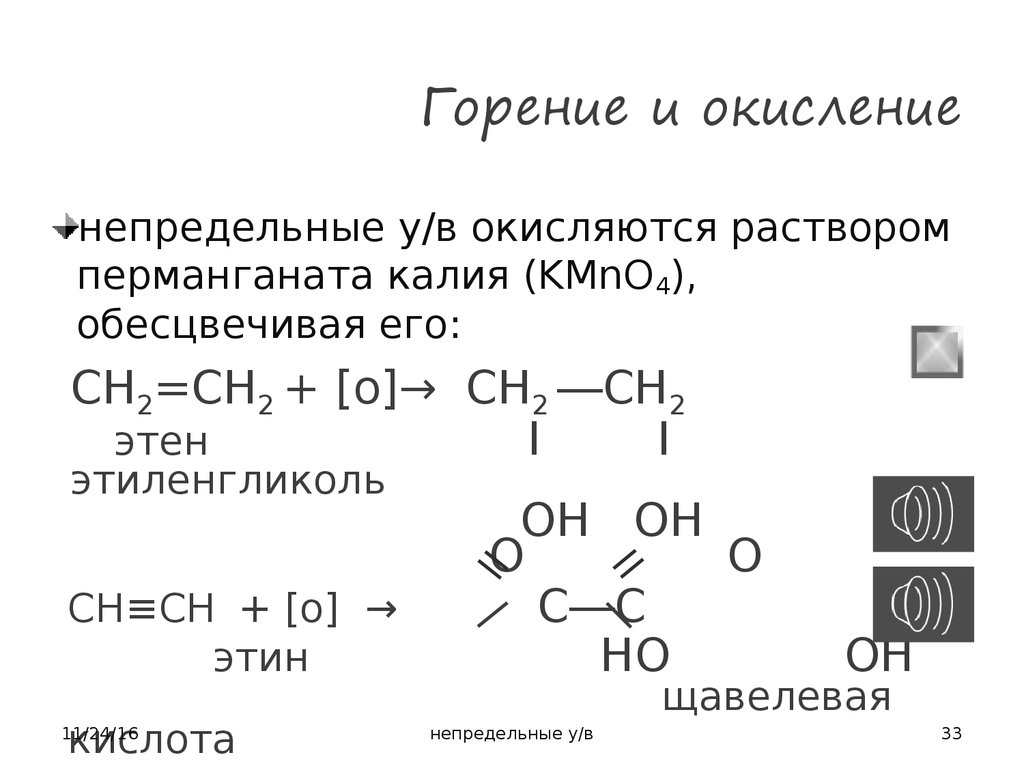
33. Горение и окисление
непредельные у/в окисляются растворомперманганата калия (KMnO4),
обесцвечивая его:
CH2=CH2 + [o]→ CH2 ―CH2
этен
I
I
CH≡CH + [o] →
этин
кислота
11/24/16
II
ОH OH
O
O
C―C
HО
II
этиленгликоль
OH
щавелевая
непредельные у/в
33
34. Реакции замещения
эта реакция позволяет отличить алкины сконцевой (≡) связью от алканов, алкенов,
алкадиенов и алкинов с (≡) в середине
цепи.
НС≡СН +Ag2O
Ag-С≡С-Ag + Н2O
ацетиленид серебра
НС≡СН+2CuCl Cu-С≡С-Cu + 2НCl
ацетиленид меди (I)
2НС≡С-CН3 +Ag2O 2AgС≡С-CН3 +Н2O
ацетиленид серебра
CH3-С≡С-CH3 + Ag2O
11/24/16
непредельные у/в
34
35. Домашнее задание
§4 (алкены);§5 (алкадиены);
§6 (алкины);
подготовиться к с/р.
Т.П.О.
11/24/16
непредельные у/в
35


















 Химия
Химия








