Похожие презентации:
Алкены. Непредельные углеводороды
1. Алкены
АЛКЕНЫУчитель МБОУСОШ №4
Казанцева А.Г.
2. Непредельные углеводороды
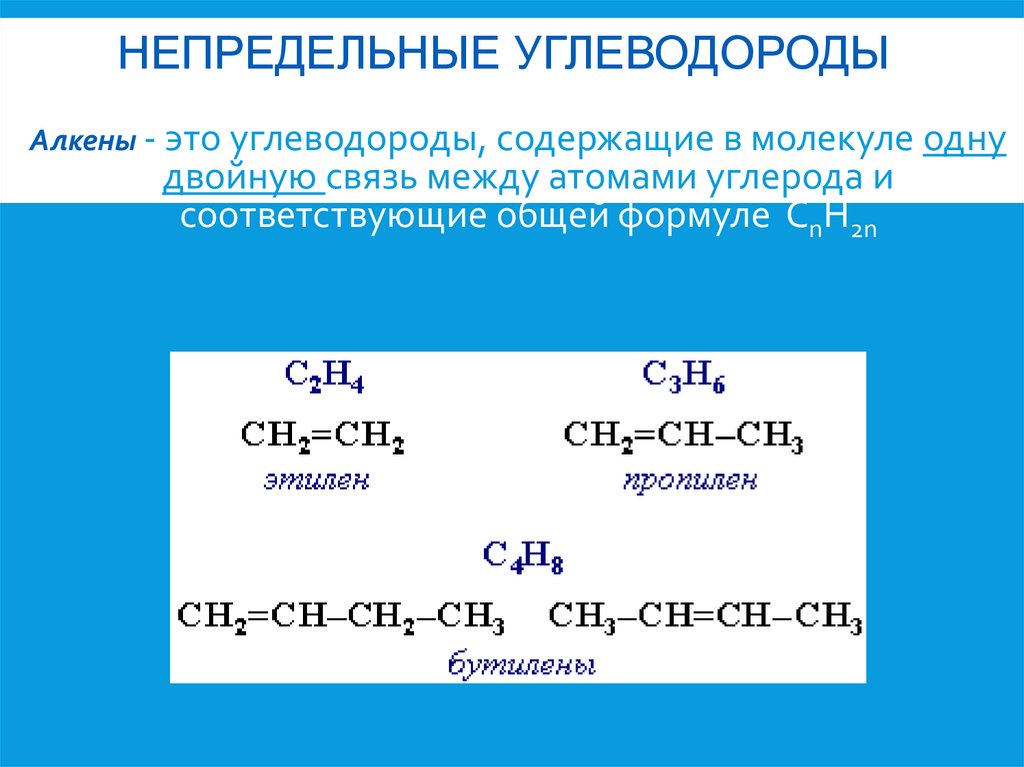
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫАлкены - это углеводороды, содержащие в молекуле одну
двойную связь между атомами углерода и
соответствующие общей формуле CnH2n
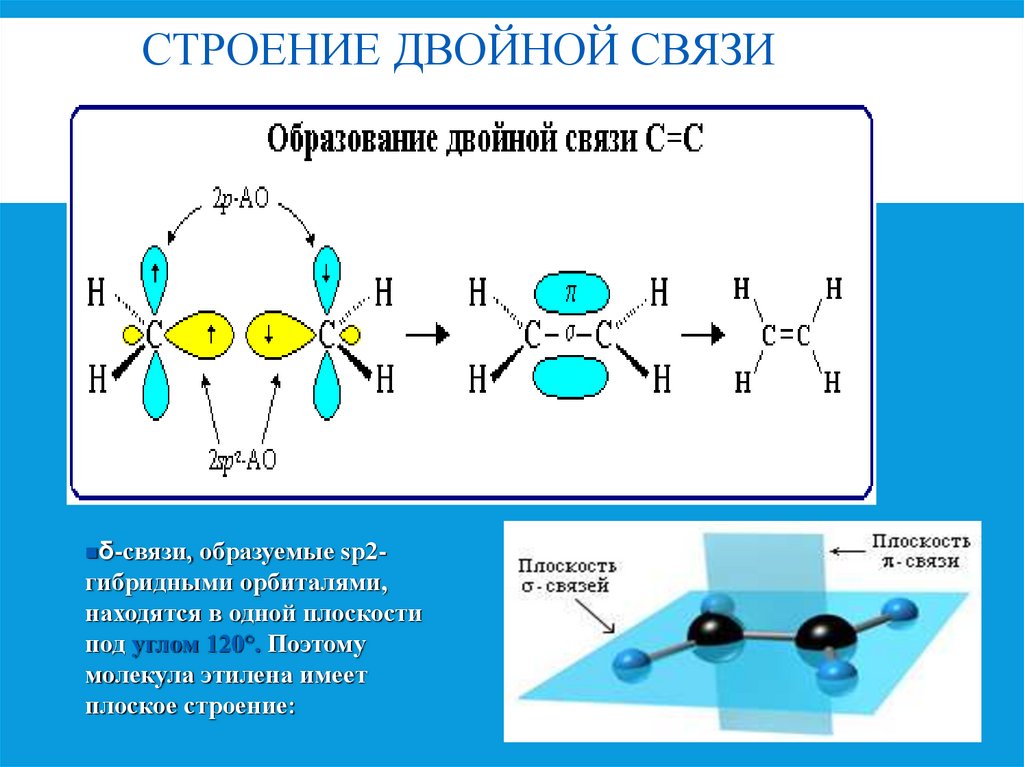
3. СТРОЕНИЕ ДВОЙНОЙ СВЯЗИ
В отличие от предельных углеводородов, алкены содержатдвойную связь С=С, которая осуществляется 4-мя общими
электронами:
δ-связь возникает при осевом перекрывании sp2-гибридных
орбиталей, а π-связь – при боковом перекрывании рорбиталей соседних sp2-гибридизованных атомов углерода
По своей природе π-связь резко отличается от δ-связи: πсвязь менее прочная вследствие меньшей эффективности
перекрывания р-орбиталей
Модели молекулы
этилена:
4. СТРОЕНИЕ ДВОЙНОЙ СВЯЗИ
δ-связи,образуемые sp2гибридными орбиталями,
находятся в одной плоскости
под углом 120°. Поэтому
молекула этилена имеет
плоское строение:
5. Номенклатура алкенов
НОМЕНКЛАТУРА АЛКЕНОВ• По систематической номенклатуре названия алкенов производят от названий
соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса
–ан на –ен:
С2Н4-_этен;
С3Н6 -пропен и т.д.
• Главная цепь выбирается таким образом, чтобы она обязательно включала в себя
двойную связь (т.е. она может быть не самой длинной).
• Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
Цифра, обозначающая положение двойной связи, ставится обычно после суффикса –
ен.
Например
Для простейших алкенов применяются также исторически сложившиеся названия:
этилен (этен), пропилен (пропен), бутилен (бутен-1), изобутилен
• В номенклатуре различных классов органических соединений наиболее часто
используются следующие одновалентные радикалы алкенов:
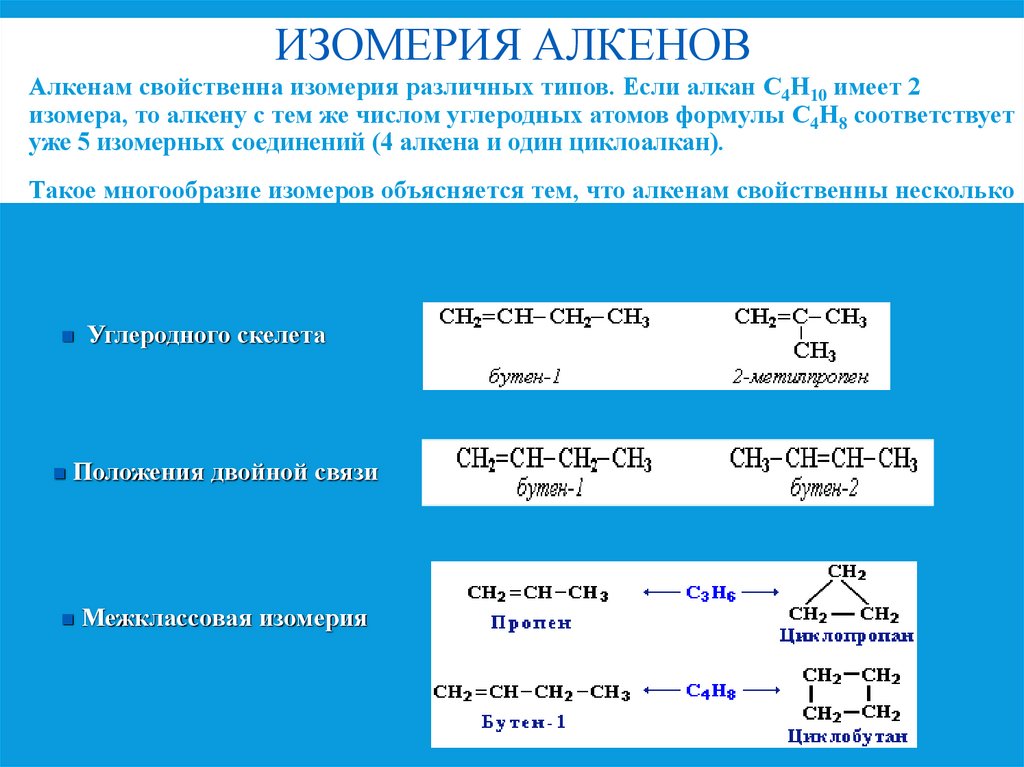
6. Изомерия алкенов
ИЗОМЕРИЯ АЛКЕНОВАлкенам свойственна изомерия различных типов. Если алкан С4Н10 имеет 2
изомера, то алкену с тем же числом углеродных атомов формулы С4Н8 соответствует
уже 5 изомерных соединений (4 алкена и один циклоалкан).
Такое многообразие изомеров объясняется тем, что алкенам свойственны несколько
видов изомерии:
Углеродного скелета
Положения двойной связи
Межклассовая изомерия
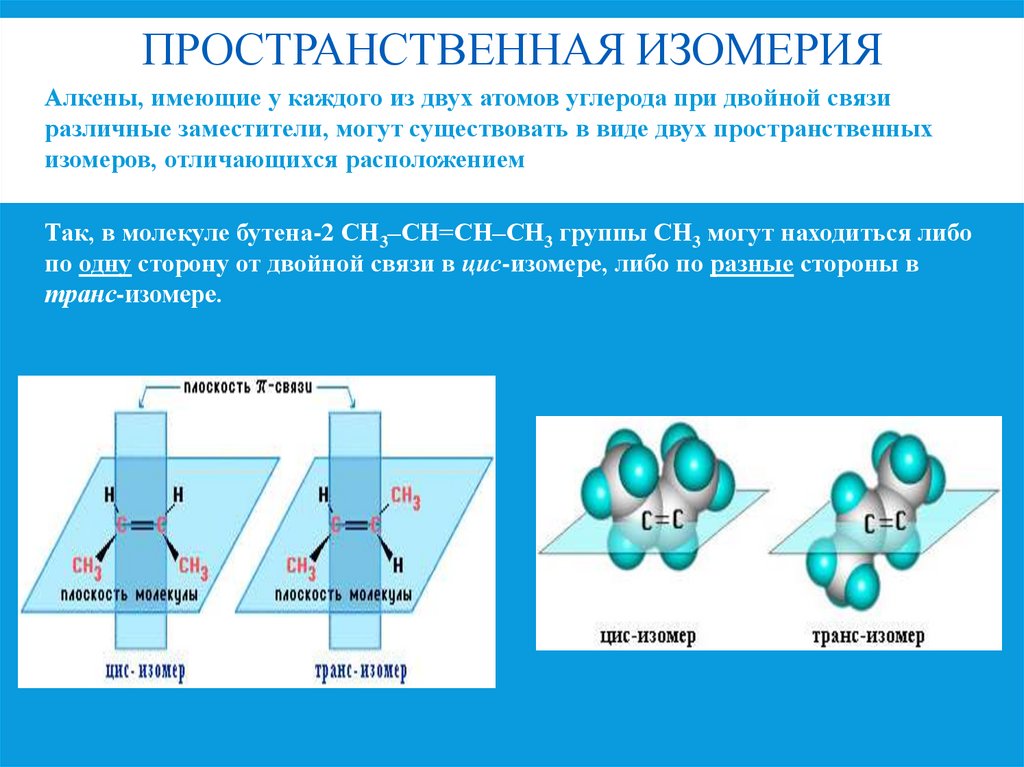
7. Пространственная изомерия
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯАлкены, имеющие у каждого из двух атомов углерода при двойной связи
различные заместители, могут существовать в виде двух пространственных
изомеров, отличающихся расположением заместителей относительно
плоскости π-связи.
Так, в молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо
по одну сторону от двойной связи в цис-изомере, либо по разные стороны в
транс-изомере.
8. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
По физическим свойствам этиленовые углеводородыблизки к алканам:
Закономерно изменяются в гомологическом ряду:
от С2Н4 до С4Н8 – газы
начиная с С5Н10 – жидкости
с С18Н36 – твердые вещества
Температура их плавления и кипения, а также плотность
увеличиваются с ростом молекулярной массы
Алкены практически нерастворимы в воде, но хорошо
растворяются в органических растворителях
9. ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Алкены вступают в разнообразные реакцииприсоединения:
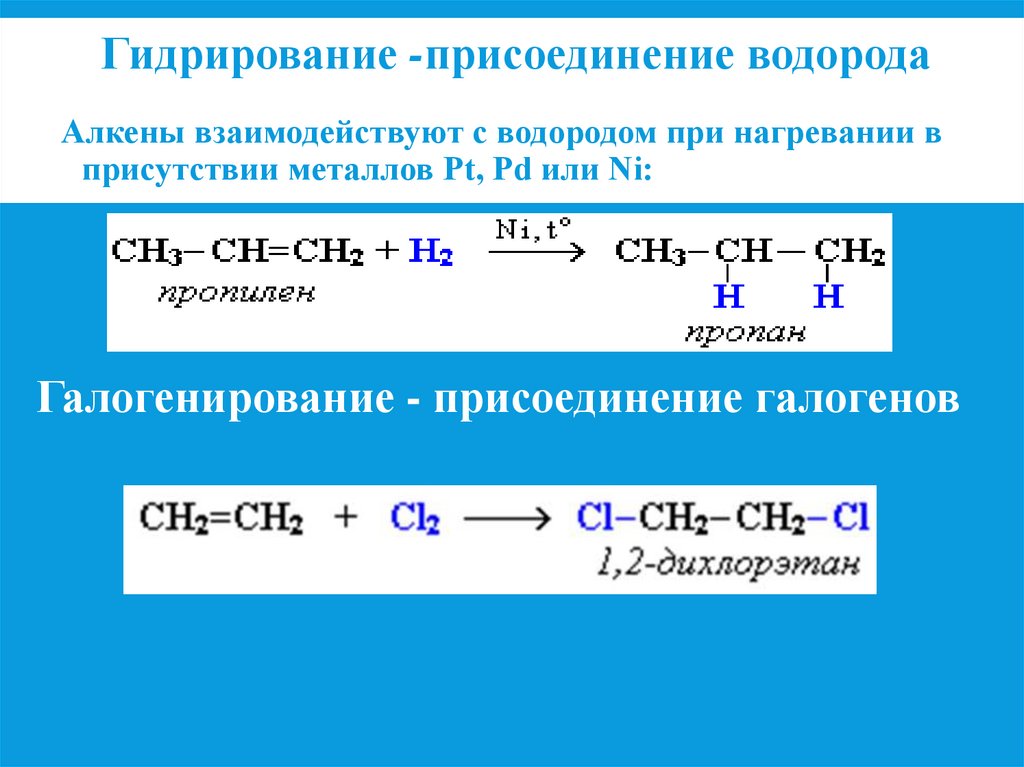
Гидрирование - реакции с водородом
образуются алканы
Галогенирование – реакции с галогенами
образуются дигалогенопроизводные алканов
Гидратации – реакции с водой
образуются спирты
Гидрогалогенирование – реакции с
галогеноводородами
образуются
моногалогенопроизводные алканов
10.
Гидрирование -присоединение водородаАлкены взаимодействуют с водородом при нагревании в
присутствии металлов Pt, Pd или Ni:
Галогенирование - присоединение галогенов
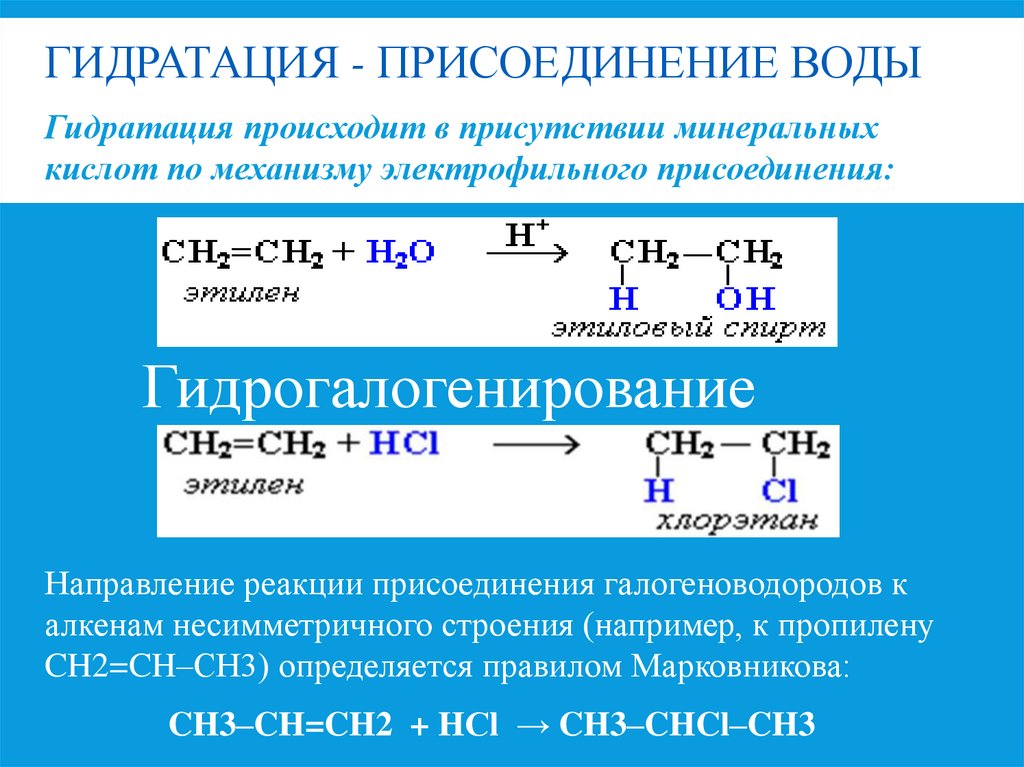
11. Гидратация - присоединение воды
ГИДРАТАЦИЯ - ПРИСОЕДИНЕНИЕ ВОДЫГидратация происходит в присутствии минеральных
кислот по механизму электрофильного присоединения:
Гидрогалогенирование
Направление реакции присоединения галогеноводородов к
алкенам несимметричного строения (например, к пропилену
CH2=CH–СН3) определяется правилом Марковникова:
CH3–CH=CH2 + HСl → CH3–CHCl–CH3
12. ОКИСЛЕНИЕ АЛКЕНОВ
Мягкое окисление алкенов водным раствором перманганатакалия приводит к образованию двухатомных спиртов
В ходе этой реакции происходит обесцвечивание фиолетовой
окраски водного раствора KMnO4. Поэтому она используется
как качественная реакция на алкены
ИЗОМЕРИЗАЦИЯ АЛКЕНОВ
13. ПОЛИМЕРИЗАЦИЯ АЛКЕНОВ
процесс образования высокомолекулярного соединения(полимера) путем соединения друг с другом молекул
исходного низкомолекулярного соединения (мономера)
nCH2=CH2→(-CH2-CH2)-n
этилен
полиэтилен
При полимеризации двойные связи в молекулах исходного
непредельного соединения "раскрываются", и за счет
образующихся свободных валентностей эти молекулы
соединяются друг с другом
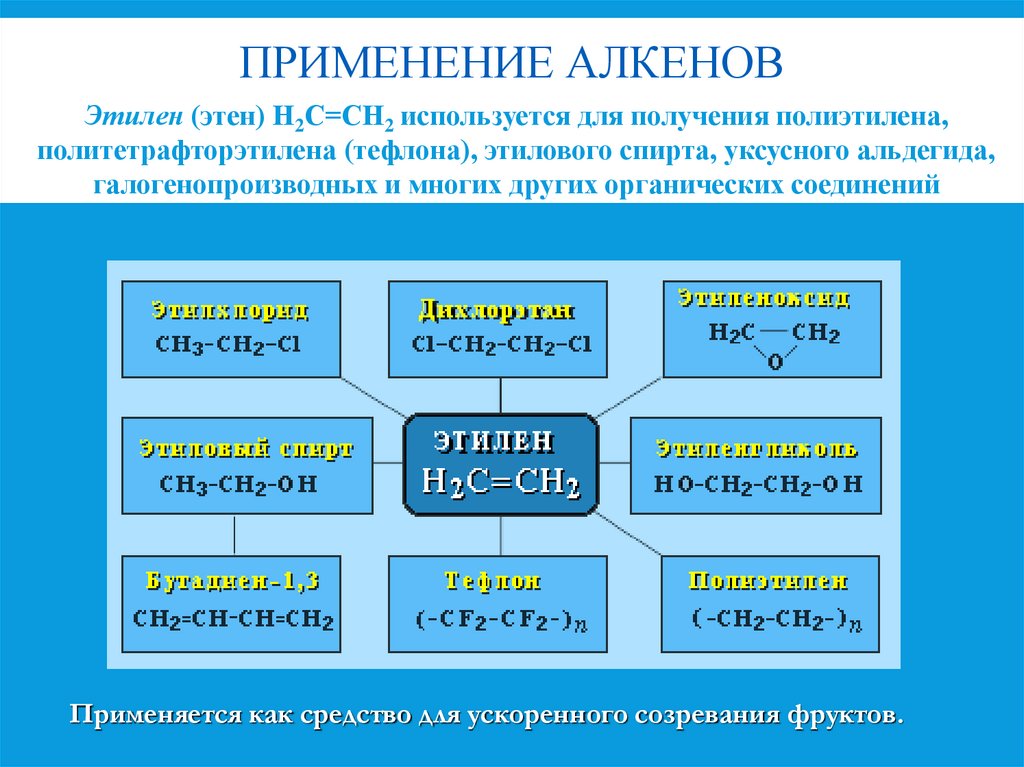
14. ПРИМЕНЕНИЕ АЛКЕНОВ
Этилен (этен) Н2С=СН2 используется для получения полиэтилена,политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида,
галогенопроизводных и многих других органических соединений
Применяется как средство для ускоренного созревания фруктов.







 Химия
Химия








