Похожие презентации:
Современные подходы к диагностике и лечению первичных опухолей головного мозга
1. Современные подходы к диагностике и лечению первичных опухолей головного мозга
Насхлеташвили Давид Романовичк.м.н., химиотерапевт-нейроонколог
отделение нейроонкологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина”
Минздрава России, г. Москва
Член RUSSCO, EANO, ESMO, ASCO
член совета экспертов
RUSSCO и АОР по практическим рекомендациям
по лечению первичных опухолей ЦНС
Руководитель совета экспертов
RUSSCO по практическим рекомендациям
по лечению метастатических опухолей головного мозга
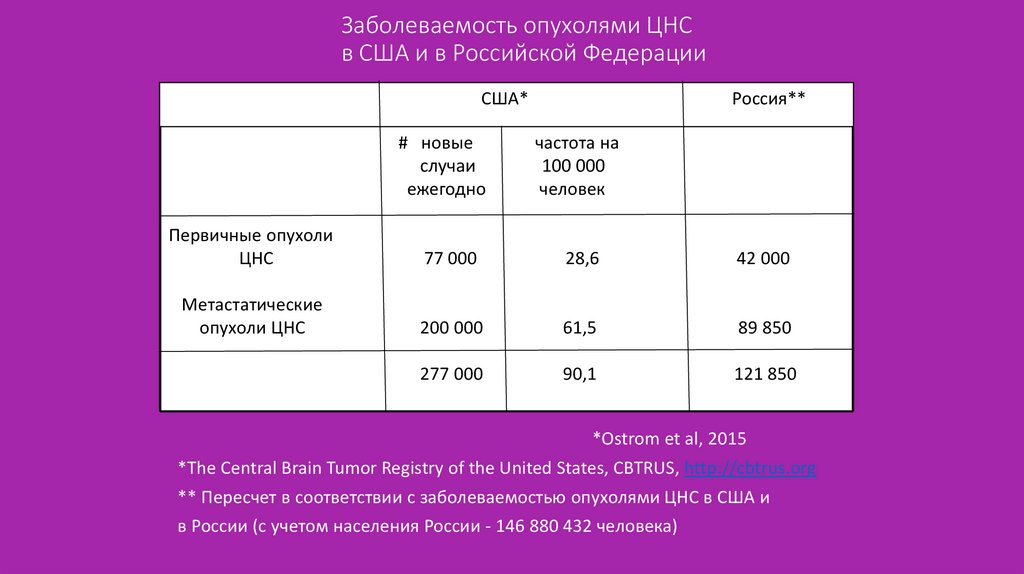
2. Заболеваемость опухолями ЦНС в США и в Российской Федерации
США*# новые
случаи
ежегодно
Россия**
частота на
100 000
человек
Первичные опухоли
ЦНС
77 000
28,6
42 000
Метастатические
опухоли ЦНС
200 000
61,5
89 850
277 000
90,1
121 850
*Ostrom et al, 2015
*The Central Brain Tumor Registry of the United States, CBTRUS, http://cbtrus.org
** Пересчет в соответствии с заболеваемостью опухолями ЦНС в США и
в России (с учетом населения России - 146 880 432 человека)
3.
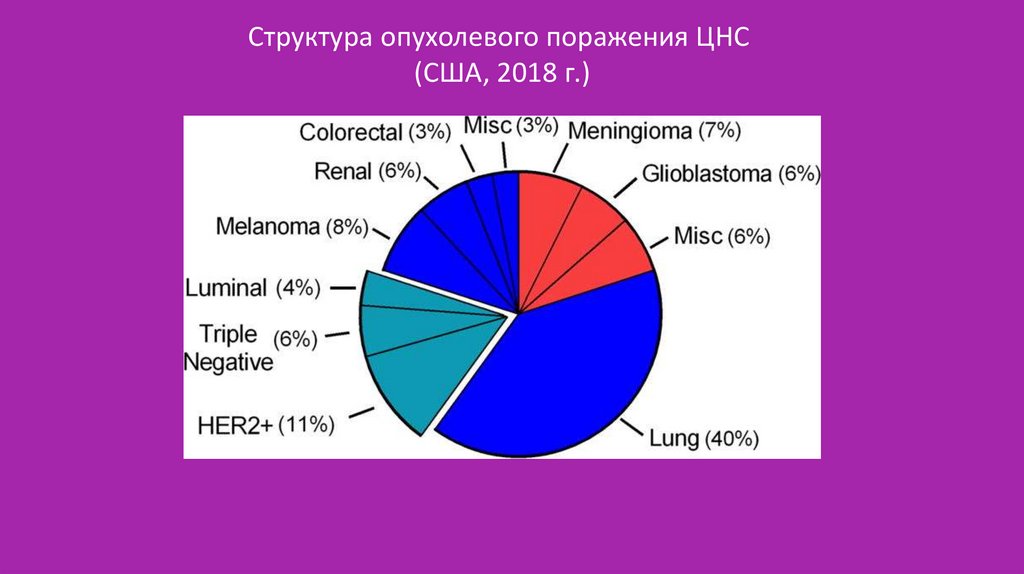
Структура опухолевого поражения ЦНС(США, 2018 г.)
4.
Эпидемиология• Опухоли головного мозга находятся на 3-м
месте по темпам роста заболеваемости среди
всех онкологических новообразований (у детей
– на 2 месте).
• Опухоли головного мозга – третья наиболее
частая причина смерти от онкологических
заболеваний у мужчин и четвёртая по частоте у
женщин в возрасте между 15 и 35 годами.
American Cancer Society.: Cancer Facts and Figures 2005
5. Распределение опухолей головного мозга в зависимости от морфологической структуры
Глиомы составляют:42% всех опухолей ГМ
Другие
13,5%
Лимфомы
3,3%
Из оболочек нервов
7,9%
Глиобластома
21,0%
Астроцитомы
10,3%
Краниофарингиомы
0,7%
Гипофизарные
5,9%
Эпендимомы
2,3%
Менингиомы
29,3%
Олигодендроглиомы
3,9%
Эмбриональные,
включая
медуллобластомы
1,8%
PRIMARY BRAIN TUMORS IN THE UNITED STATES STATISTICAL REPORT 1997-2001 (N=58907)
(The Central Brain Tumor Registry of the United States (CBTRUS 2005))
6.
Slide 5Астроцитома G IV (2021 г.)
Presented By Sandro Santagata at 2018 ASCO Annual Meeting
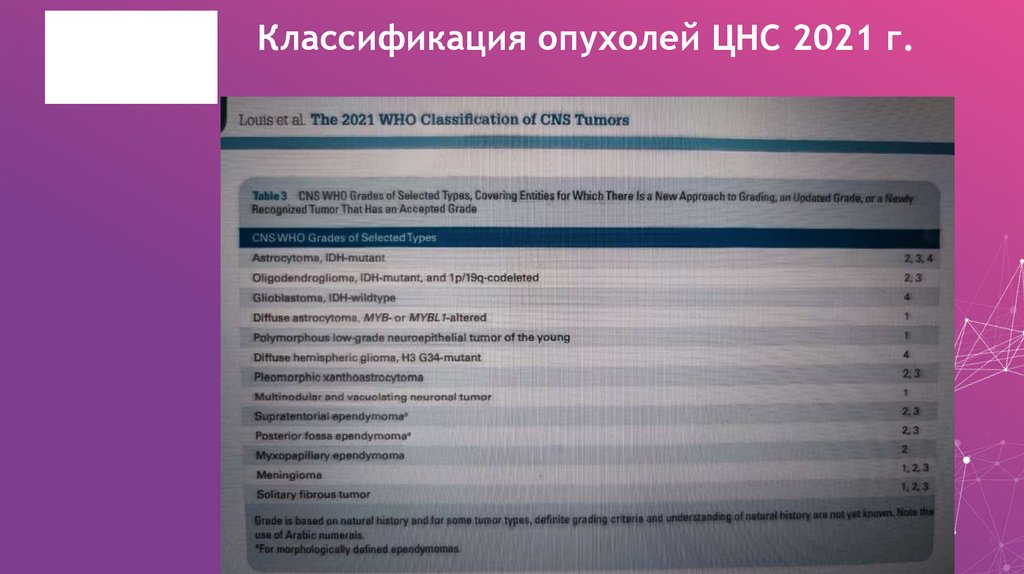
7. Классификация опухолей ЦНС 2021 г.
8. Классификация опухолей ЦНС 2021 г.
9. Первые симптомы при глиомах головного мозга
Головная боль – 1/ 3Судорожные припадки – 1/ 5
Парезы конечностей – 5%
Афатические нарушения
Вынужденное положение головы
Зрительные нарушения
10. Диагностика
МРТ головного мозга с контрастным усилением –“золотой стандарт” в диагностике опухолей
головного мозга
ПЭТ/КТ головного мозга с аминокислотами
(метионин или тирозин)
- в случае неоперабельных опухолей
-с целью дифференциальной диагностики между
постлучевыми изменениями и продолженным ростом
опухоли
-с целью оценки эффекта противоопухолевой
лекарственной терапии
11. Комплексная терапия больных глиальными опухолями
•Хирургия – цель: максимальное удалениеопухоли, компенсация состояния больного,
точный гистологический диагноз.
•Химиотерапия – темозоломид, ломустин,
мюстофоран, препараты платины, бевацизумаб
•Лучевая терапия – (режим обычного
фракционирования) доза 54 – 60 Грей в
сочетании с темозоломидом при глиобластомах
12. Астроцитомы (медиана выживаемости пациентов)
КлассификацияМедиана выживаемости
Глиобластома
1,0-1,5 года
Анапластическая
астроцитома
2-3 года
Глиомы низкой степени
злокачественности (GII)
6-8 лет
13. Современные подходы к терапии глиом
• Тактика неодинакова для различныхморфологических форм опухолей:
-
Глиомы низкой степени злокачественности
Анапластическая астроцитома
Глиобластома
Олигодендроглиальные опухоли
14. Задачи хирургического этапа лечения
Установление гистологического диагнозаДекомпрессия
Уменьшение неврологического дефицита
Улучшение когнитивных функций
Уменьшение массы опухоли или ее полное удаление
• ПОДГОТОВКА к этапу химио–лучевой терапии
• МАКСИМАЛЬНОЕ УДАЛЕНИЕ ОПУХОЛЕВОЙ ТКАНИ БЕЗ СОЗДАНИЯ
НОВОГО НЕВРОЛОГИЧЕСКОГО ДЕФИЦИТА
15.
RTOG 9802: III фаза клинического исследования по изучению лучевойтерапии с или без химиотерапии по схеме PCV (прокарбазин + CCNU
(ломустин) + винкристин) у больных глиомами низкой степени
злокачественности (GII).
ASCO 2014
Slide 2
Presented By Michael Prados at 2014 ASCO Annual Meeting
16. R9802 SCHEMA
Группа низкогориска:
возраст<40 лет и
Наблюдение
полное удаление
R9802 SCHEMA
опухоли
Группа высокого
риска:
Возраст>40лет,
и/или
неполное
удаление
опухоли
Presented By Michael Prados at 2014 ASCO Annual Meeting
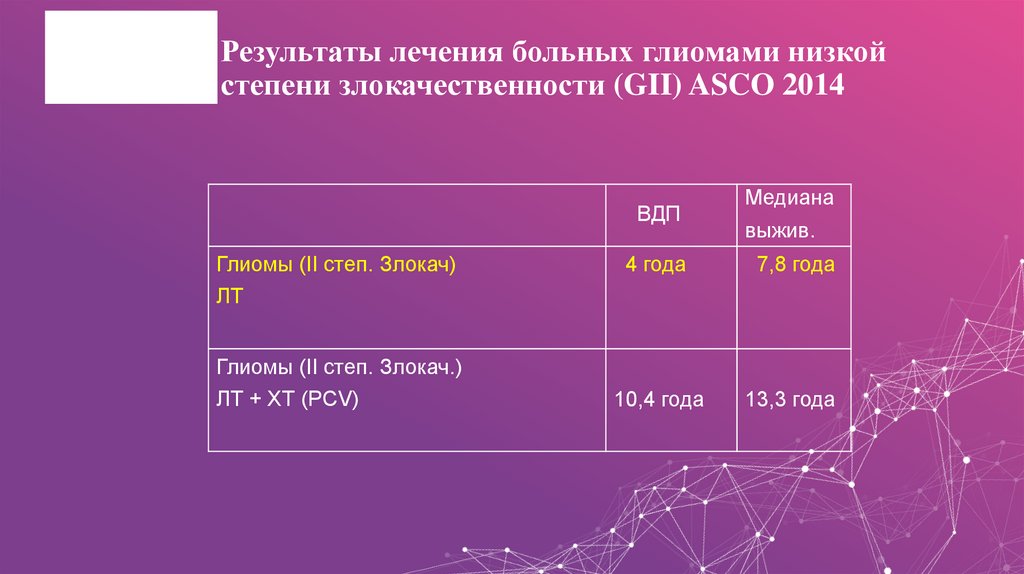
17. Результаты лечения больных глиомами низкой степени злокачественности (GII) ASCO 2014
ВДПГлиомы (II степ. Злокач)
ЛТ
Глиомы (II степ. Злокач.)
ЛТ + ХТ (PCV)
Медиана
выжив.
4 года
7,8 года
10,4 года
13,3 года
18. ASCO 2014: Overall Survival
Presented By Michael Prados at 2014 ASCO Annual Meeting19. Выводы
1) Добавление химиотерапии (6 курсов PCV) к лучевой терапии
статистически значимо увеличивает выживаемость без
прогрессирования (на 6,4 года) и общую выживаемость (на 5,5 лет) в
группе больных глиомами низкой степени злокачественности (GII) и
высокого риска (больные с неполной резекцией опухоли, или больные
старше 40 лет, независимо от объема операции);
5-летняя выживаемость выше на 9% (72,3% vs 63,1%)
10-летняя выживаемость выше на 20% (60,1% vs 40,1%)
2) При мультивариантном анализе прогностически благоприятными
фактороми были:
- проведение химиотерапии (по схеме PCV)
- морфологический вариант опухоли (олигодендроглиома)
- пол (женский)
3) RTOG 9802 – это первое проспективное исследование,
продемонстрировавшее увеличение общей выживаемости больных
глиомами II степени злокачественности при проведении химиотерапии
20.
Исследование III фазы поодновременной химиолучевой
терапии у больных с впервые
диагностированной мультиформной
глиобластомой
EORTC 26981-22981 and NCIC CE.3
Roger Stupp, WP Mason, MJ Van Den
Bent, M Weller, B Fisher, M Taphoorn,
AA Brandes, G Cairncross, D Lacombe,
RO Mirimanoff
New Engand .Journal Medicine 2005
21. Схема лечения
RКомбинированная
терапия TMД/ЛТ
0
6
Teмозоломид 75 мг/м2/сутки x 6 нед.
10
14
18
22
26
Tемозоломид 150-200 мг/м2 x 5 дней,
каждые 28 дней x 6 циклов
Локальная радиотерапия (30 x 2 Гр, 60 Гр)
Объем опухоли + 2–3 cm вокруг
30
Недели
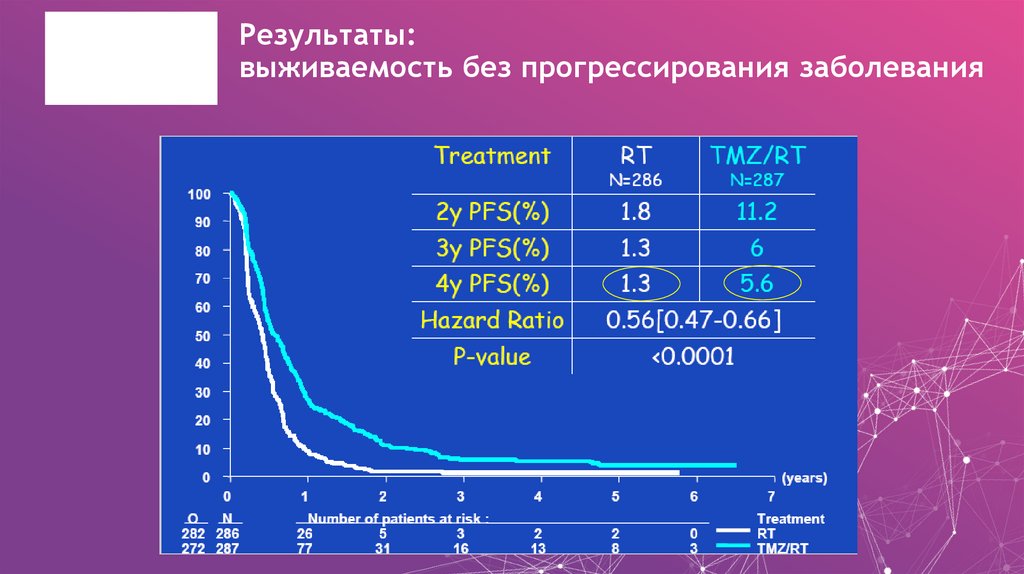
22. Результаты: выживаемость без прогрессирования заболевания
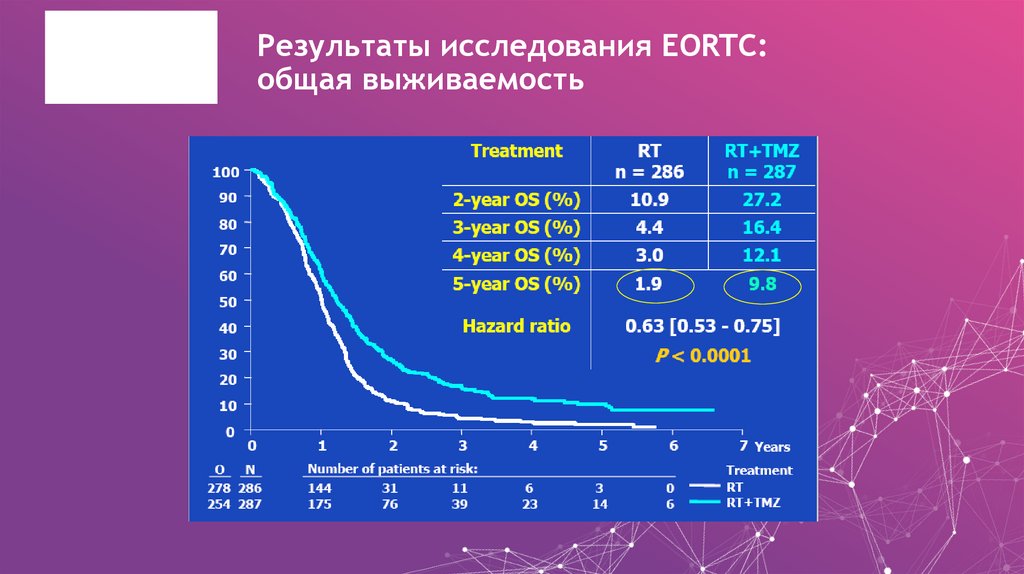
23. Результаты исследования EORTC: общая выживаемость
24. Оценка результатов терапии при учете факторов прогноза
•Объем оперативного вмешательства•Общий соматический статус (ECOG)
•Возраст
•Ген MGMT
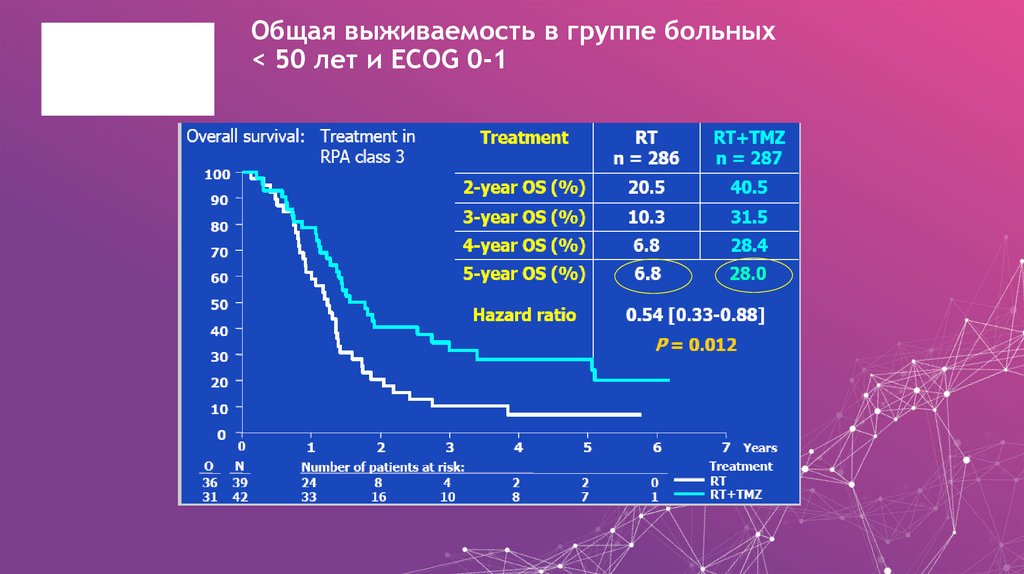
25. Общая выживаемость в группе больных < 50 лет и ECOG 0-1
Общая выживаемость в группе больных< 50 лет и ECOG 0-1
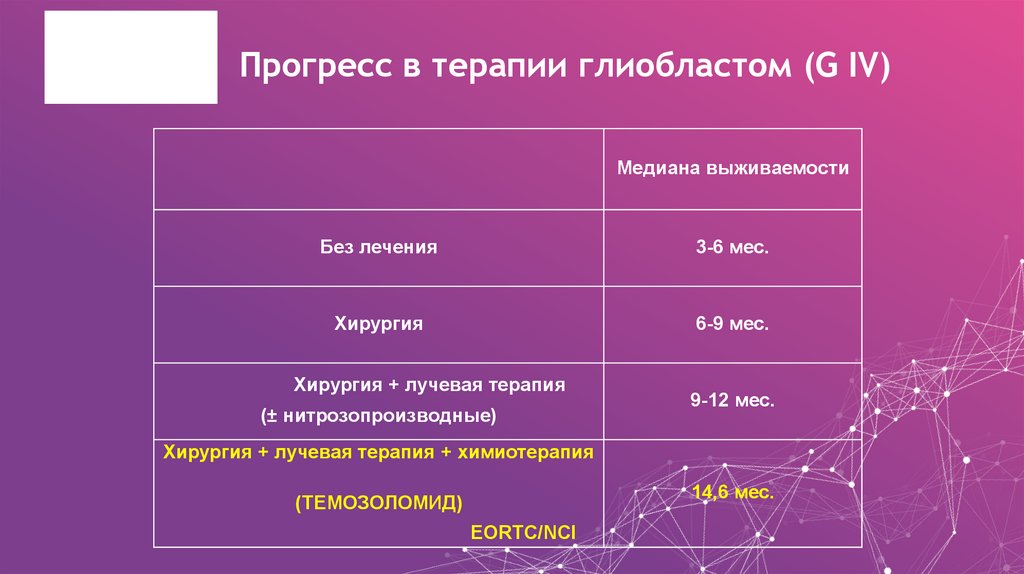
26. Прогресс в терапии глиобластом (G IV)
Медиана выживаемостиБез лечения
3-6 мес.
Хирургия
6-9 мес.
Хирургия + лучевая терапия
(± нитрозопроизводные)
9-12 мес.
Хирургия + лучевая терапия + химиотерапия
14,6 мес.
(ТЕМОЗОЛОМИД)
EORTC/NCI
27.
ГЛИОБЛАСТОМА:медиана общей выживаемости ~
14,6 мес (Stupp,2005)
медиана безрецидивной выживаемости ~
6,9 мес (Stupp,2005)
Примерно половину жизни от диагноза
пациенты проводят с рецидивом опухоли!
28. Лечение рецидива глиобластомы – ОПЦИИ ограничены
Повторнаярезекция
- возможна у ограниченного числа пациентов по показаниям
- не доказано влияние на выживаемость– медиана выживаемости после
прогрессирования 2 мес vs. 5 мес после резекции 1,2
Повторная
лучевая терапия
- возможно, целесообразна радиохирургия при локальных небольших рецидивах
- лучевой некроз, необходимость в непрерывной кортикостероидной
терапии, ухудшение качества жизни
Химиотерапия
- эффектность ограничена
иринотекан, темозоломид, производные нитрозомочевины (ломустин,
кармустин), препараты платины
Таргетная
терапия – Бевацизумаб
1. Guyotat J, Signorelli F, Frappaz D, et al. Oncol Rep 2000;7:899–904. 2. Clarke JL, Ennis MM, Yung WK, et al. Neuro Oncol 2011;13:1118–24.
3. Lamborn 2008; 4. Wong 1999; 5. Yung 2000, 4. Stupp. J Clin Oncol 2010;28:2712–8; 5. Weller. Neuro Oncol 2012;15:4–27;
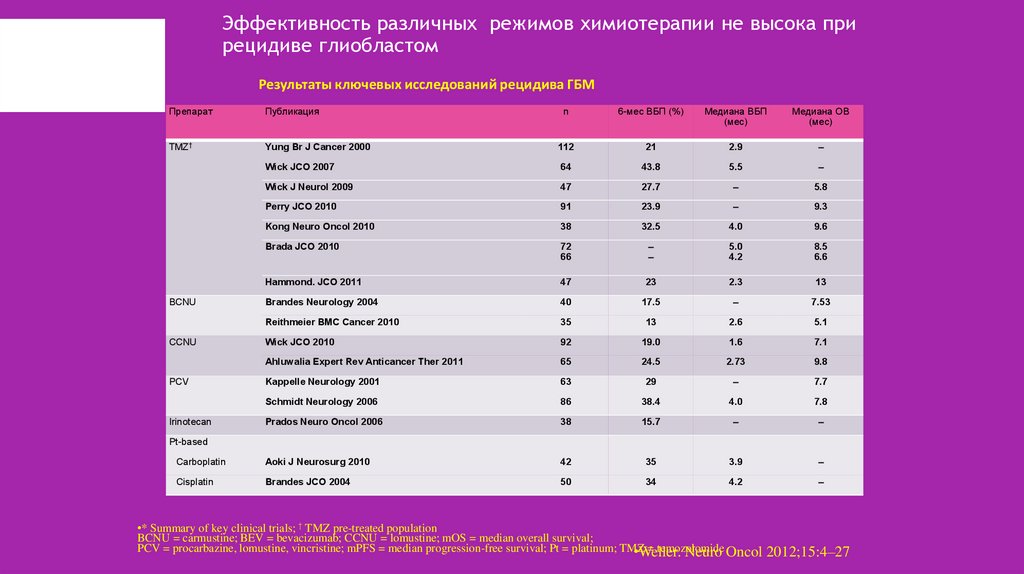
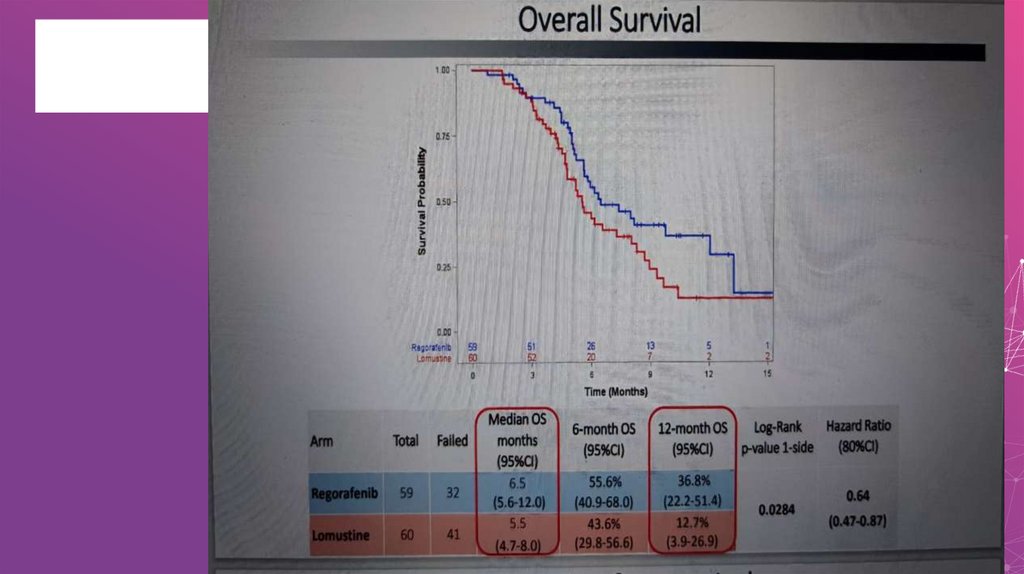
29. Эффективность различных режимов химиотерапии не высока при рецидиве глиобластом
Результаты ключевых исследований рецидива ГБМПрепарат
Публикация
n
6-мес ВБП (%)
Медиана ВБП
(мес)
Медиана ОВ
(мес)
TMZ†
Yung Br J Cancer 2000
112
21
2.9
–
Wick JCO 2007
64
43.8
5.5
–
Wick J Neurol 2009
47
27.7
–
5.8
Perry JCO 2010
91
23.9
–
9.3
Kong Neuro Oncol 2010
38
32.5
4.0
9.6
Brada JCO 2010
72
66
–
–
5.0
4.2
8.5
6.6
Hammond. JCO 2011
47
23
2.3
13
Brandes Neurology 2004
40
17.5
–
7.53
Reithmeier BMC Cancer 2010
35
13
2.6
5.1
Wick JCO 2010
92
19.0
1.6
7.1
Ahluwalia Expert Rev Anticancer Ther 2011
65
24.5
2.73
9.8
Kappelle Neurology 2001
63
29
–
7.7
Schmidt Neurology 2006
86
38.4
4.0
7.8
Prados Neuro Oncol 2006
38
15.7
–
–
Carboplatin
Aoki J Neurosurg 2010
42
35
3.9
–
Cisplatin
Brandes JCO 2004
50
34
4.2
–
BCNU
CCNU
PCV
Irinotecan
Pt-based
•* Summary of key clinical trials; † TMZ pre-treated population
BCNU = carmustine; BEV = bevacizumab; CCNU = lomustine; mOS = median overall survival;
PCV = procarbazine, lomustine, vincristine; mPFS = median progression-free survival; Pt = platinum; TMZ
= temozolomide
•Weller.
Neuro Oncol
2012;15:4–27
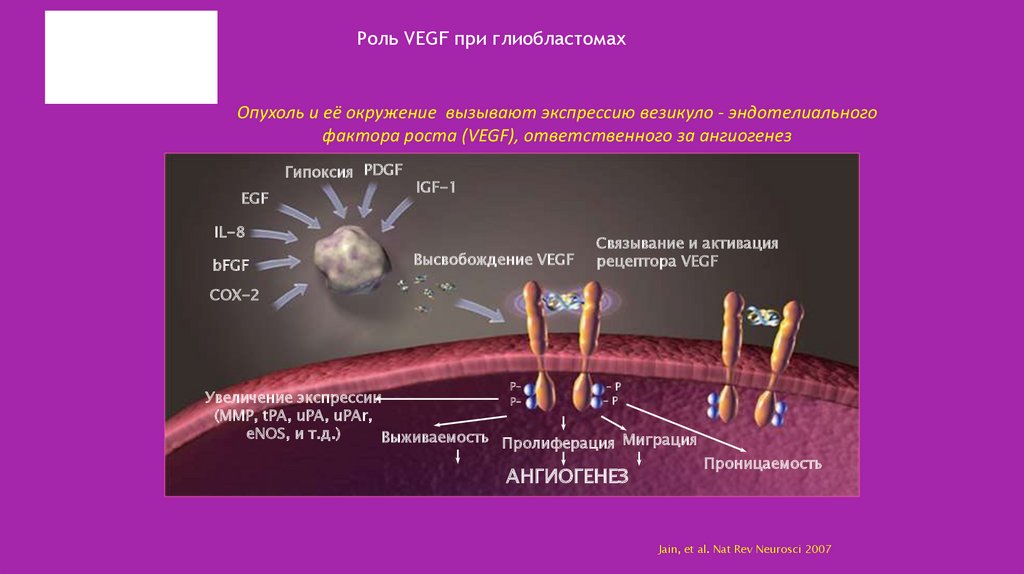
30. Роль VEGF при глиобластомах
Опухоль и её окружение вызывают экспрессию везикуло - эндотелиальногофактора роста (VEGF), ответственного за ангиогенез
Гипоксия PDGF
EGF
IGF-1
IL-8
bFGF
Высвобождение VEGF
Связывание и активация
рецептора VEGF
COX-2
P–
–P
Увеличение экспрессии
–P
P–
(MMP, tPA, uPA, uPAr,
eNOS, и т.д.)
Выживаемость Пролиферация Миграция
АНГИОГЕНЕЗ
Проницаемость
Jain, et al. Nat Rev Neurosci 2007
31.
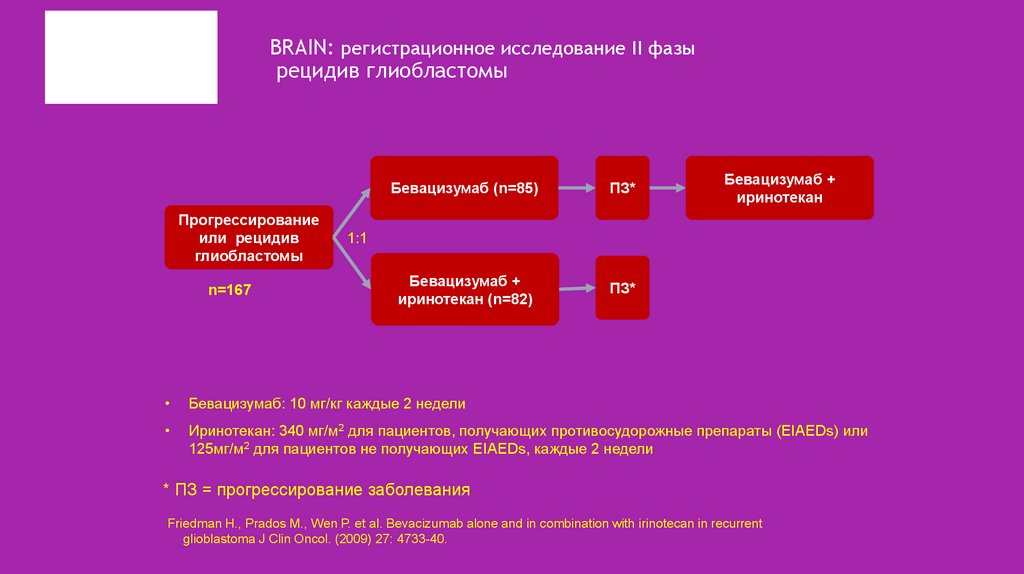
32. BRAIN: регистрационное исследование II фазы рецидив глиобластомы
Прогрессированиеили рецидив
глиобластомы
n=167
Бевацизумаб (n=85)
ПЗ*
Бевацизумаб +
иринотекан (n=82)
ПЗ*
Бевацизумаб +
иринотекан
1:1
Бевацизумаб: 10 мг/кг каждые 2 недели
Иринотекан: 340 мг/м2 для пациентов, получающих противосудорожные препараты (EIAEDs) или
125мг/м2 для пациентов не получающих EIAEDs, каждые 2 недели
* ПЗ = прогрессирование заболевания
Friedman H., Prados M., Wen P. et al. Bevacizumab alone and in combination with irinotecan in recurrent
glioblastoma J Clin Oncol. (2009) 27: 4733-40.
33.
Результаты исследования BRAINКонечная точка
Авастин
Авастин+Иринотекан
6-месячная ВБП (%)
42,6
50,3
ЧОО (%)
28,2
37,8
9,2 мес
8,7 мес
Медиана ОВ
На фоне терапии Бевацизумабом наблюдалось снижение применяемой
дозы кортикостероидов и значительное улучшение нейрокогнитивной
функции
Friedman H., Prados M., Wen P. et al. Bevacizumab alone and in combination with irinotecan in
recurrent glioblastoma J Clin Oncol. (2009) 27: 4733-40.
34. Сравнение результатов исследования BRAIN с данными других исследований
BEVBEV+
CPT11
CCNU
TMZ/
BCNU
TMZ
ПР+ЧР
28,2%
37,8%
4,3%
9,6%
5,4%
6-мес.
PFS
42,6%
50,3%
19%
24,1%
21%
12 мес.
Выжив.
38%
38%
26%
26,7%
23%
24 мес.
Выжив.
16%
17%
--
--
--
30 мес.
Выжив.
11%
16%
--
--
--
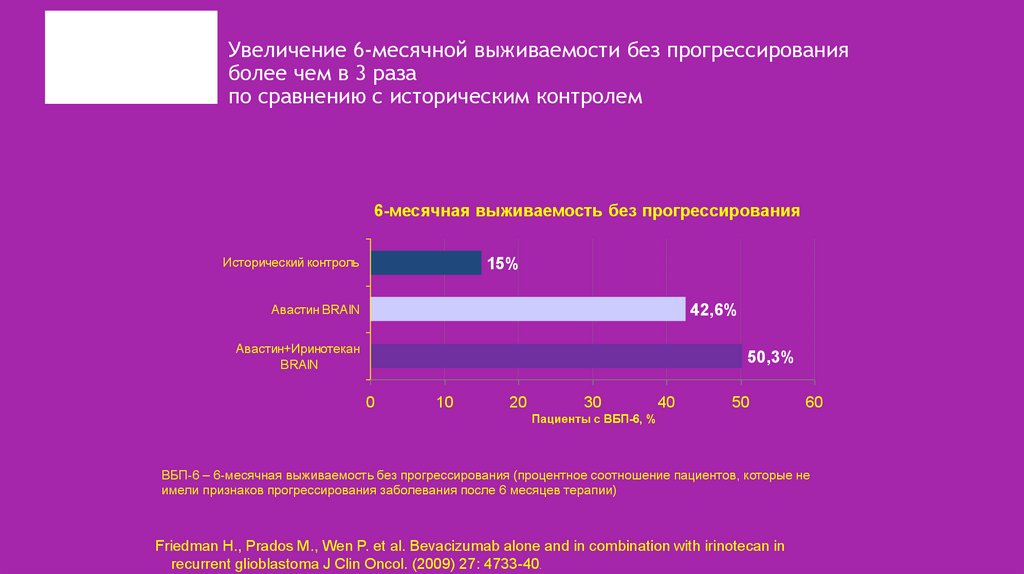
35. Увеличение 6-месячной выживаемости без прогрессирования более чем в 3 раза по сравнению с историческим контролем
6-месячная выживаемость без прогрессированияИсторический контроль
15%
Авастин BRAIN
42,6%
Авастин+Иринотекан
BRAIN
50,3%
0
10
20
30
40
50
60
Пациенты с ВБП-6, %
ВБП-6 – 6-месячная выживаемость без прогрессирования (процентное соотношение пациентов, которые не
имели признаков прогрессирования заболевания после 6 месяцев терапии)
Friedman H., Prados M., Wen P. et al. Bevacizumab alone and in combination with irinotecan in
recurrent glioblastoma J Clin Oncol. (2009) 27: 4733-40.
36. Улучшение или стабилизация нейрокогнитивной функции (по данным оценки, проведенной на 24-й неделе)*3
Монотерапия АвастиномУ 70,4% пациентов (19 из 27) с ВБП более 6
месяцев наблюдались стабилизация или
улучшение нейрокогнитивной функции на
24-й неделе
Авастин + иринотекан
У 69% пациентов (20 из 29), получавших
Авастин и иринотекан, с ВБП более 6
месяцев наблюдались стабилизация или
улучшение нейрокогнитивной функции на
24-й неделе
1. Wefel JS et al. Poster presented at ASCO 2009. Poster 2056 2. Vredenburg J et al
ECCO15|ESMO34 2009; Abstract 8707
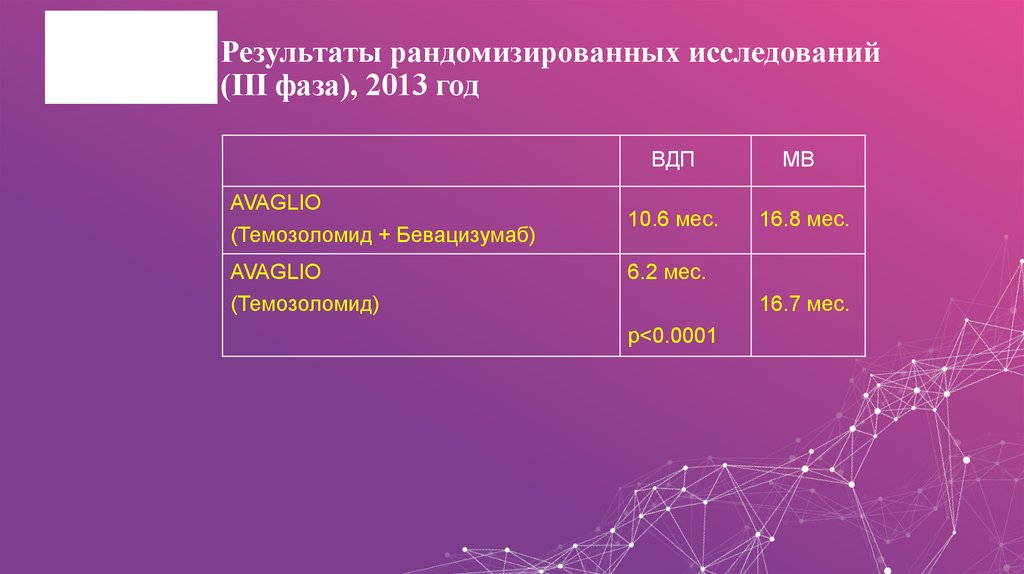
37. Результаты рандомизированных исследований (III фаза), 2013 год
AVAGLIO(Темозоломид + Бевацизумаб)
AVAGLIO
(Темозоломид)
ВДП
МВ
10.6 мес.
16.8 мес.
6.2 мес.
16.7 мес.
p<0.0001
38.
ЛЕЧЕНИЕ РЕЦИДИВА ГЛИОБЛАСТОМЫ: «Резюме»Повторная резекция: не доказано влияние на выживаемость
(возможно, целесообразно строго определять показания, удаление не
менее 98% опухоли)
Повторная лучевая терапия: (возможно, целесообразна
стереотаксическая радиотерапия/радиохирургия при локальных небольших
рецидивах + Бевацизумаб)
Химиотерапия – нет эффективных режимов
Таргетная терапия – бевацизумаб – улучшает показатели
выживаемости без прогрессирования и качества жизни больных с
рецидивом ГБМ
39. Режимы противоопухолевой лекарственной терапии при рецидивах злокачественных глиом
Бевацизумаб – 5-10 мг/кг внутривенно в 1 день, каждые 2 неделиБевацизумаб – 5-10 мг/кг внутривенно в 1 день, каждые 2 недели
+ Ломустин – по 40 мг внутрь в 1, 8, 15, 22 дни цикла, каждые 6
недель
Бевацизумаб – 5-10 мг/кг внутривенно в 1 и 15 дни, каждые 4
недели + Иринотекан – 125-200 мг/м2 внутривенно в 1 и 15 дни,
каждые 4 недели
Бевацизумаб – 5-10 мг/кг внутривенно в 1 день, каждые 2 недели
+ Паклитаксел – 80 мг/м2 + Карбоплатин – по AUC=2 внутривенно
в 1, 8, 15 дни, каждые 4 недели
Бевацизумаб – 7,5 мг/кг внутривенно в 1 день, каждые 3 недели +
Карбоплатин – по AUC=5 внутривенно в 1 день, каждые 3 недели
40. Режимы противоопухолевой лекарственной терапии при неоперабельных глиомах ЦНС
Диагноз устанавливается на основании клинико-рентгенологическихданных (МРТ головного мозга с контрастным усилением, ПЭТ/КТ
головного мозга с аминокислотами (метионин или тирозин)
Исключается опухолевая патология экстракраниально (ПЭТ/КТ всего
тела с меченой глюкозой или КТ органов грудной клетки, органов
брюшной полости, органов малого таза с внутривенным
контрастированием)
Темозоломид – 150-200 мг/м2/сутки внутрь в 1-5 дни, каждые 28 дней
При масс-эффекте и выраженном перифокальном отеке
Темозоломид – 150-200 мг/м2/сутки внутрь 1-5 дни, каждые 28 дней +
Бевацизумаб – 5-10 мг/кг внутривенно в 1 день, каждые 2 недели
41. Pembrolizumab + bevacizumab in recurrent GBM
Presented By Duane Mitchell at 2018 ASCO Annual Meeting42.
Slide 3Presented By John De Groot at 2018 ASCO Annual Meeting
43.
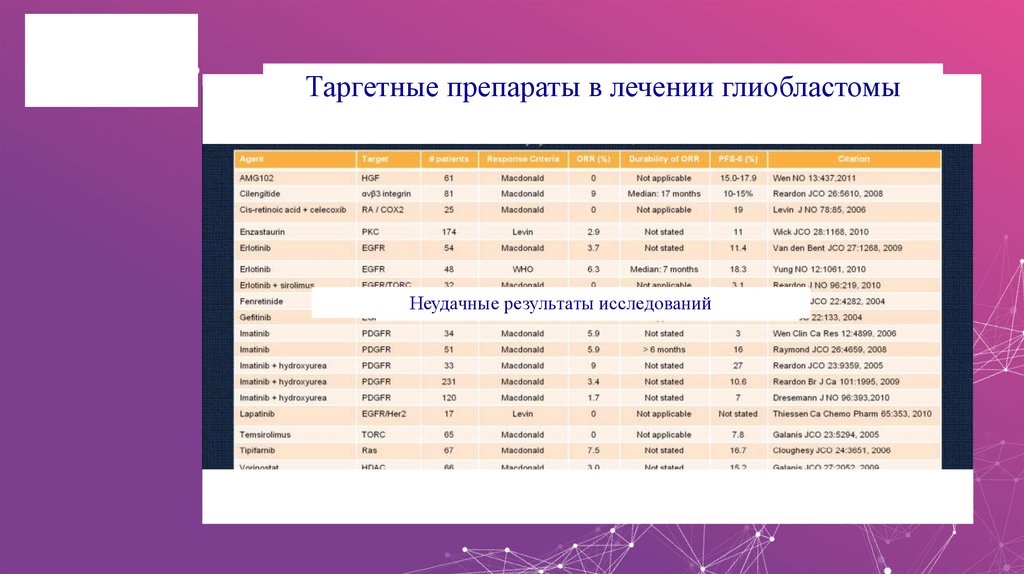
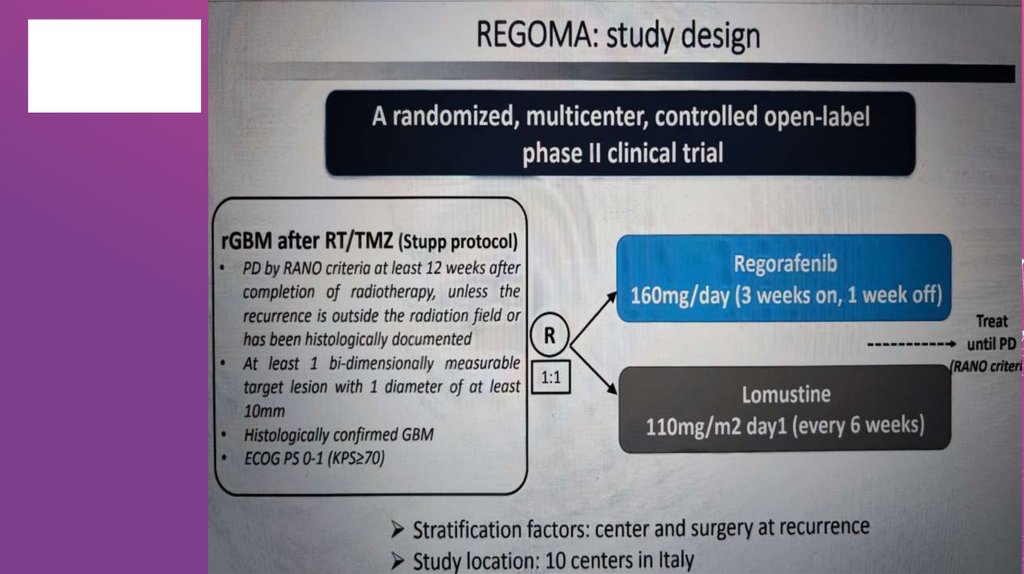
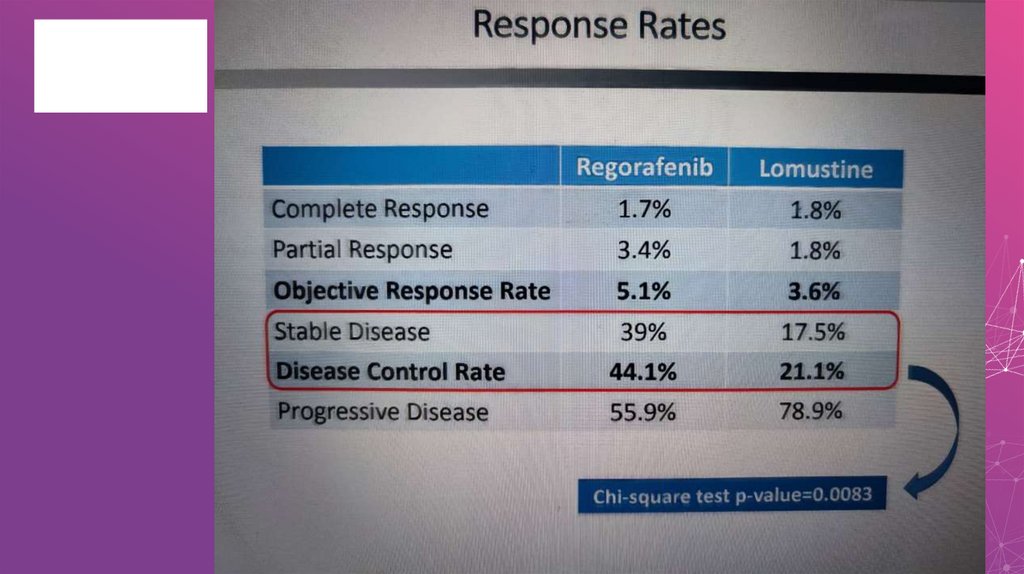
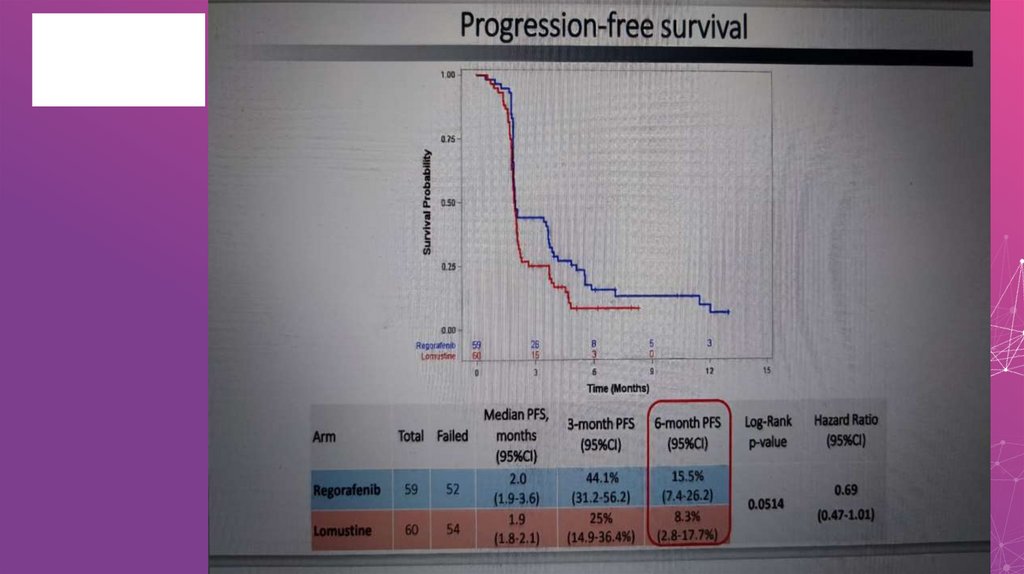
Таргетные препараты в лечении глиобластомыНеудачные результаты исследований
FSCO
44.
45.
46.
47.
48.
49.
50.
51.
52. Комплексное геномное профилирование (NGS) (опыт отделения нейроонкологии НМИЦ онкологии им. Н.Н. Блохина)
у 37 пациентов (94,8%) из 39 были выявлены потенциальные мишени для таргетнойтерапии
У 1 пациента (2,6%) выявлена микросателлитная нестабильность и высокая
мутационная нагрузка в опухоли
. У 28 пациентов (71,2%) с рецидивами злокачественных глиом выявлены мутации, на
основании которых в Европейском Союзе назначается таргетная терапия в лечении
других солидных опухолей.
9 пациентам (24,3%), в случаях, когда были исчерпаны возможности стандартного
лечения, была назначена таргетная терапия на основании исследования опухоли на
комплексное геномное профилирование.
53. Комплексное геномное профилирование (NGS) (опыт отделения нейроонкологии НМИЦ онкологии им. Н.Н. Блохина)
У 2 пациентов с мутациями V600E BRAF в опухоли (рецидив глиобластомы и рецидиванапластической плеоморфной ксантоастроцитомы) достигнута длительная полная
ремиссия (32 мес.+ и 30 мес., соответственно) при терапии ингибиторами BRAF.
У 1 пациента с рецидивом глиобластомы с наличием транслокации ROS1 в опухоли
достигнута длительная стабилизация (24 мес.) при терапии препаратом кризотиниб.
У 1 пациента с рецидивом глиобластомы с наличием мутации T467fs*3, rearrangement
intron 57, ассоциированной с NF1 (нейрофиброматоз I типа) достигнута стабилизация
(10 мес.+) при терапии препаратом траметиниб.
У 2 пациентов с рецидивами глиобластом таргетная терапия была неэффективна (в
первом случае – при назначении кабозантиниба у пациента с амплификацией MET в
опухоли, во втором случае – при назначении палбоциклиба у пациента с делецией
CDKN2A в опухоли).
Таким образом, в 4 случаях из 6 удалось достичь длительного контроля опухолевого
процесса при использовании индивидуального подхода к лечению на основе
комплексного геномного профилирования.
54. Клинический случай 1
• Пациентка И., жен., 27 лет• В марте 2014 года появились жалобы на головные боли. При обследовании,
по данным МРТ головного мозга с контрастным усилением, выявлена
опухоль левой лобной доли головного мозга. 24.04.2014 г. в НМИЦ
онкологии им. Н.Н. Блохина выполнено удаление опухоли головного мозга.
• При морфологическом исследовании установлен диагноз: глиобластома (G
IV)
• Выявлено метилирование гена MGMT в опухоли
• Не выявлено мутаций IDH1 и IDH2 в опухоли
• Состояние после химиолучевой терапии (Темозоломид – 75 мг/м2/сутки
внутрь, в период проведения лучевой терапии + лучевая терапия на
область первичной опухоли головного мозга, РОД=2 Гр, СОД=60 Гр),
химиотерапии (6 курсов по схеме: Темозоломид, до декабря 2014 г.).
• Наблюдалась до июля 2019 года без признаков рецидива заболевания
55. Общая выживаемость в группе больных < 50 лет и ECOG 0-1
Общая выживаемость в группе больных< 50 лет и ECOG 0-1
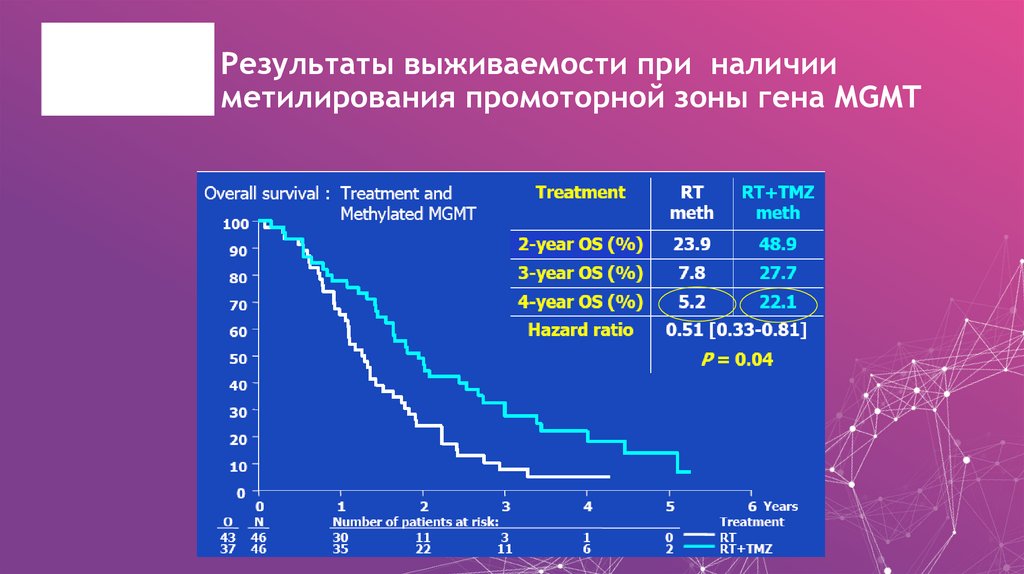
56. Результаты выживаемости при наличии метилирования промоторной зоны гена МGMT
57. Клинический случай 1
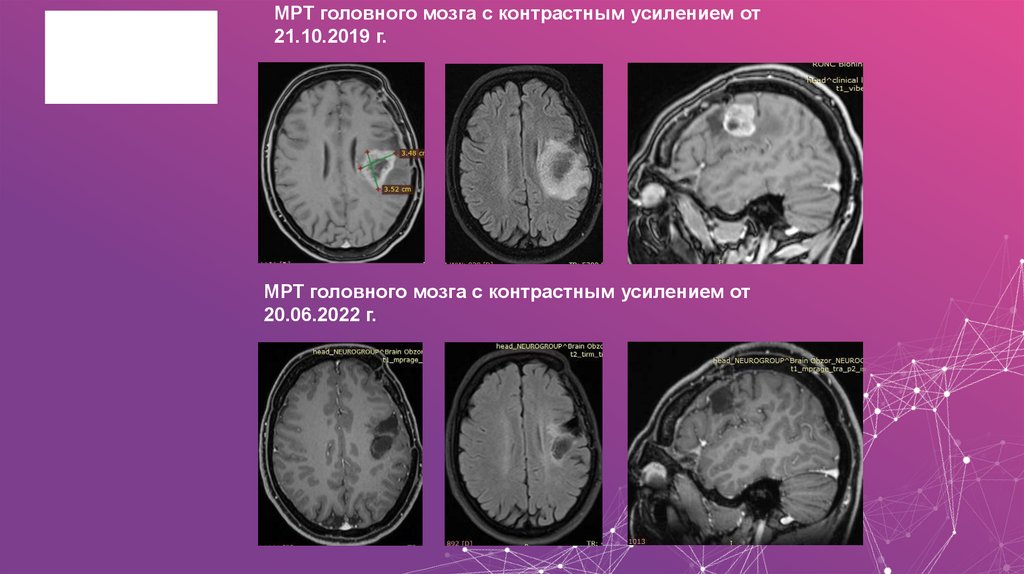
• Прогрессирование болезни в июле 2019 года. Продолженный рост опухолиголовного мозга (по данным МРТ головного мозга с контрастным усилением
от 29.07.2019 г.).
• Состояние после химиотерапии (2 курса по схеме: Темозоломид +
Карбоплатин, август – октябрь 2019 г.).
• Прогрессирование болезни в октябре 2019 года. Продолженный рост
опухоли головного мозга (по данным МРТ головного мозга с контрастным
усилением от 21.10.2019 г.).
• Клинически – ухудшение (головные боли, слабость в правой руке
(парез до 4 баллов)
• Выполнено исследование опухоли на комплексное геномное
профилирование.
• Выявлена мутация V600E BRAF в опухоли.
• (мутации V600E BRAF выявляются у 1% больных глиобластомой)
58. BRAF mutations: an actionable target
Presented By Martin Van Den Bent at 2018 ASCO Annual Meeting59. МРТ головного мозга с контрастным усилением от 21.10.2019 г.
По данным ПЭТ/КТ головного мозга с метионином от23.10.2019 г. выявлена повышенная метаболическая
активность в опухоли (ИН макс.=3,34, метаболические
размеры – 36х34 мм)
60. Клинический случай 1
• Состояние в процессе таргетной терапии (Дабрафениб + Траметиниб, с25.11.2019 г. по настоящее время).
• Частичный эффект (по данным МРТ головного мозга с контрастным
усилением от 27.01.2020 г.)
• Клинически – улучшение (исчезли головные боли, регрессировал парез
в правой руке).
• По данным МРТ головного мозга с контрастным усилением от 24.07.2020
г., от 27.10.2020 г., от 13.09.2021 г. – полная регрессия.
• По данным ПЭТ/КТ головного мозга с метионином от 28.10.2020 г. и от
16.09.2021 г. – без признаков метаболически активной опухоли в
головном мозге (полный метаболический эффект).
61. МРТ головного мозга с контрастным усилением от 20.06.2022 г.
МРТ головного мозга с контрастным усилением от21.10.2019 г.
МРТ головного мозга с контрастным усилением от
20.06.2022 г.
62. Благодарю за внимание!
Насхлеташвили Давид Романовичк.м.н., химиотерапевт-нейроонколог
отделение нейроонкологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина”
Минздрава России, г. Москва
Член RUSSCO, EANO, ESMO, ASCO
Член совета экспертов
RUSSCO и АОР по практическим рекомендациям
по лечению первичных опухолей ЦНС
Руководитель совета экспертов
RUSSCO по практическим рекомендациям
по лечению метастатических опухолей головного мозга










































 Медицина
Медицина








