Похожие презентации:
Аліфатичні галогенопохідні
1.
Органічна хімія (6) – галогенопохідніТема 6. Аліфатичні галогенопохідні
1. Класифікація і номенклатура аліфатичних галогенопохідних.
Будова молекул, оптична ізомерія
2. Методи добування аліфатичних галогенопохідних
3. Реакційна здатність аліфатичних галогенопохідних. Механізми
реакцій нуклеофільного заміщення в аліфатичному ряду: SN1, SN2.
Реакції елімінування: E1, E2, E1CB.
4. Дихлорокарбен, карбен.
5. Металоорганічні сполуки – будова молекул, добування, реакційна
здатність.
1
2.
Органічна хімія (6) – галогенопохідніАліфатичні галогенопохідні – продукт заміщення одного або декількох
атомів Н в молекулах вуглеводнів на галоген(и) (F, Cl, Br, I)
Класифікація аліфатичних галогенопохідних:
За природою галогену (фтор-, хлор-, бром-, йод- похідні)
H 3C
H3C Cl
F
H3C Br
H 3C
I
За числом атомів галогену (моно-, ді-, три-, полігалогенопохідні)
H
H
H
H
Cl
Cl
Cl
H
Cl
H
Cl
Cl
Cl
Cl
Cl
Cl
За положенням атомів галогену (первинні, вторинні, третинні, гемінальні,
віцинальні …)
Cl
Cl
Cl
Cl
первинні
вторинні
третинні
Cl
Cl
Cl
віцинальні
гемінальні
За ступенем ненасиченості (галогеналкани, галогеналкени, галогеналкіни)
Cl
хлоретан
Cl
хлоретилен,
вінілхлорид
Cl
хлорацетилен,
етинілхлорид
2
3.
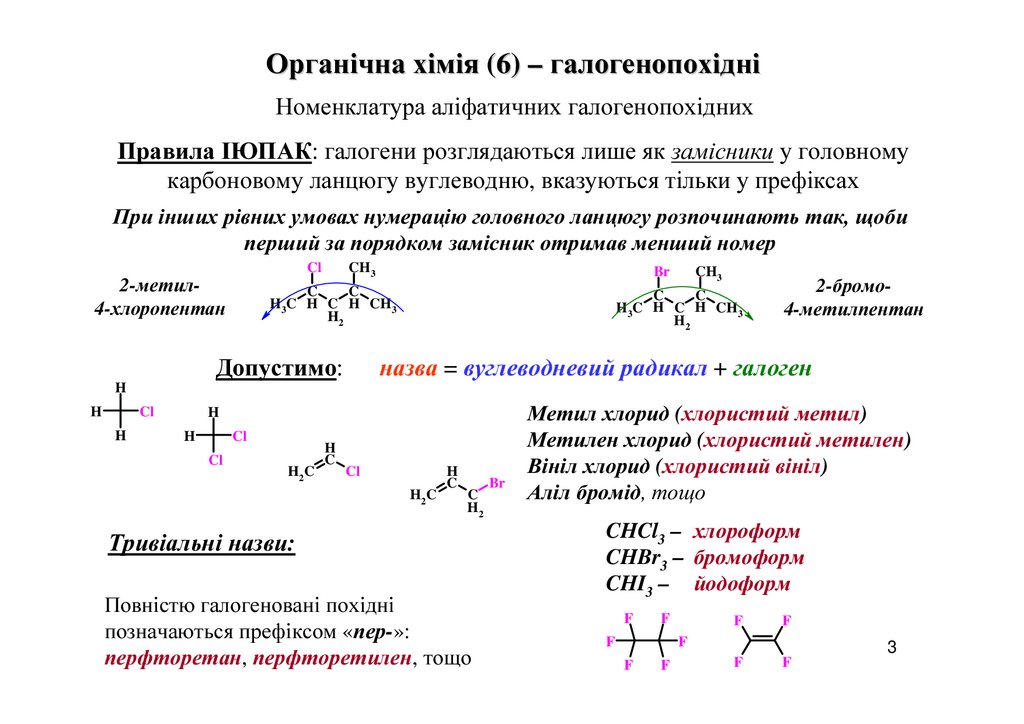
Органічна хімія (6) – галогенопохідніНоменклатура аліфатичних галогенопохідних
Правила ІЮПАК: галогени розглядаються лише як замісники у головному
карбоновому ланцюгу вуглеводню, вказуються тільки у префіксах
При інших рівних умовах нумерацію головного ланцюгу розпочинають так, щоби
перший за порядком замісник отримав менший номер
Cl
2-метил4-хлоропентан
CH3
Br
C
C
H3C H C H CH3
H2
CH3
C
C
H3C H C H CH3
H2
2-бромо4-метилпентан
назва = вуглеводневий радикал + галоген
Допустимо:
H
H
Cl
H
H
H
Cl
Cl
H2C
H
C
Cl
H 2C
H
C
C
H2
Тривіальні назви:
Повністю галогеновані похідні
позначаються префіксом «пер-»:
перфторетан, перфторетилен, тощо
Br
Метил хлорид (хлористий метил)
Метилен хлорид (хлористий метилен)
Вініл хлорид (хлористий вініл)
Аліл бромід, тощо
CHCl3 – хлороформ
CHBr3 – бромоформ
CHI3 – йодоформ
F
F
F
F
F
F
F
F
F
F
3
4.
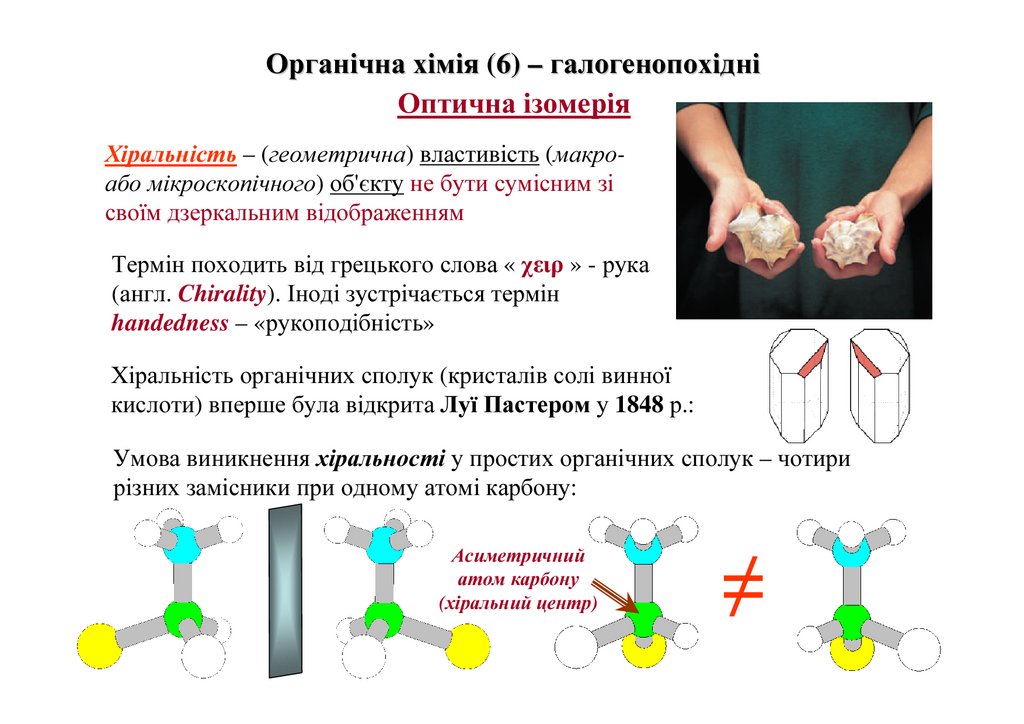
Органічна хімія (6) – галогенопохідніОптична ізомерія
Хіральність – (геометрична) властивість (макроабо мікроскопічного) об'єкту не бути сумісним зі
своїм дзеркальним відображенням
Термін походить від грецького слова « χειρ » - рука
(англ. Chirality). Іноді зустрічається термін
handedness – «рукоподібність»
Хіральність органічних сполук (кристалів солі винної
кислоти) вперше була відкрита Луї Пастером у 1848 р.:
Умова виникнення хіральності у простих органічних сполук – чотири
різних замісники при одному атомі карбону:
Асиметричний
атом карбону
(хіральний центр)
≠
4
5.
Органічна хімія (6) – галогенопохідніОптична ізомерія
Оптичні ізомери, ЕНАНТІОМЕРИ – ізомерні структури, які є
просторово несумісними дзеркальними відображеннями одна одної
Всі основні фізичні і хімічні параметри енантіомерів є абсолютно
тотожними, за виключенням двох:
1. Обертання площини поляризованого світла
Електромагнітне
випромінювання:
Два поляризатори з
суміщеними (║)
Спеціальні прилади – ПОЛЯРИЗАТОРИ – дозволяють
осями пропускають
виділити світло, в якому коливання електричного поля
світло, а з
здійснюються вздовж визначеного напряму у просторі
перехрещеними
(┼) осями - ні
ЕНАНТІОМЕРИ проявляють
ОПТИЧНУ АКТИВНІСТЬ:
При проходженні поляризованого
світла через розчин одного з
ЕНАНТІОМЕРІВ площина поляризації
повертається на певний кут, який
5
визначає будова його молекули.
6.
Органічна хімія (6) – галогенопохідніОптична ізомерія
ЕНАНТІОМЕРИ (оптичні
антиподи) повертають площину
поляризованого світла на один і той
же кут, але в різних напрямках:
Ліворуч,
проти годинникової
стрілки,
L – levorotatory,
знак «–» (мінус)
Праворуч,
за годинниковою
стрілкою,
D – dextrarotatory,
знак «+» (плюс)
-θ +θ
L
D
-
+
Еквімолярна суміш енантіомерів – РАЦЕМІЧНА СУМІШ (рацемат),
ОПТИЧНО НЕ АКТИВНА!
2. ЕНАНТІОМЕРИ демонструють різну реакційну здатність в реакціях з
іншими оптично активними сполуками, якщо реакційні центри знаходяться
близько або співпадають з їх центрами хіральності
Швидкості
L+L
хімічних
D+L
6
D+D
реакцій:
≠
7.
Органічна хімія (6) – галогенопохідніОптична ізомерія
Способи зображення трьохвимірної будови ЕНАНТІОМЕРІВ
на площині
CH3
В площині
H
Br
Cl
За площиною
Перед
площиною
1-бром-1-хлоретан
Проекції Фішера
CH3
Cl
Br
H
CH3
Cl
Br
H
Усі дії з проекціями Фішера відбуваються виключно у площині рисунку,
можливі повороти тільки на кути 180°/360° !!!
7
8.
Органічна хімія (6) – галогенопохідніОптична ізомерія
Проекции Фишера
Обертання навколо одного зі зв'язків у хірального центру
еквівалентно циклічній зміні положення трьох замісників в
проекції Фішера
Br
CH3
Cl
Br
H
H3C
Cl
Br
H
Cl
Cl
H
CH3
Br
CH3
H
Зміна положення будь-яких двох замісників заборонена, оскільки
це змінює конфігурацію хірального центру,
центру дві послідовні
перестановки - дозволені
8
9.
Органічна хімія (6) – галогенопохідніОптична ізомерія
Стереохімічна номенклатура Інгольда – Кана – Прелога:
Заснована на порядку розташування в просторі замісників при
асиметричному атомі карбону згідно їх старшинства
CH3
Cl
Розвертаємо молекулу так, щоби
сховати від спостерігача молодший
замісник (Н в даному прикладі)
Br
H
Визначаємо порядок зменшення старшинства трьох замісників, що залишилися:
за годинниковою стрілкою – R-ізомер, проти годинникової стрілки – S-ізомер
Latin:
Rectus (прямий)
Sinister (лівий)
H
Cl
Br
CH3
H
D
R
Мнемонічне правило, яке
допоможе це запам'ятати
R-1-бром-1-хлоретан
S
Br
L
CH3
Cl
9
10.
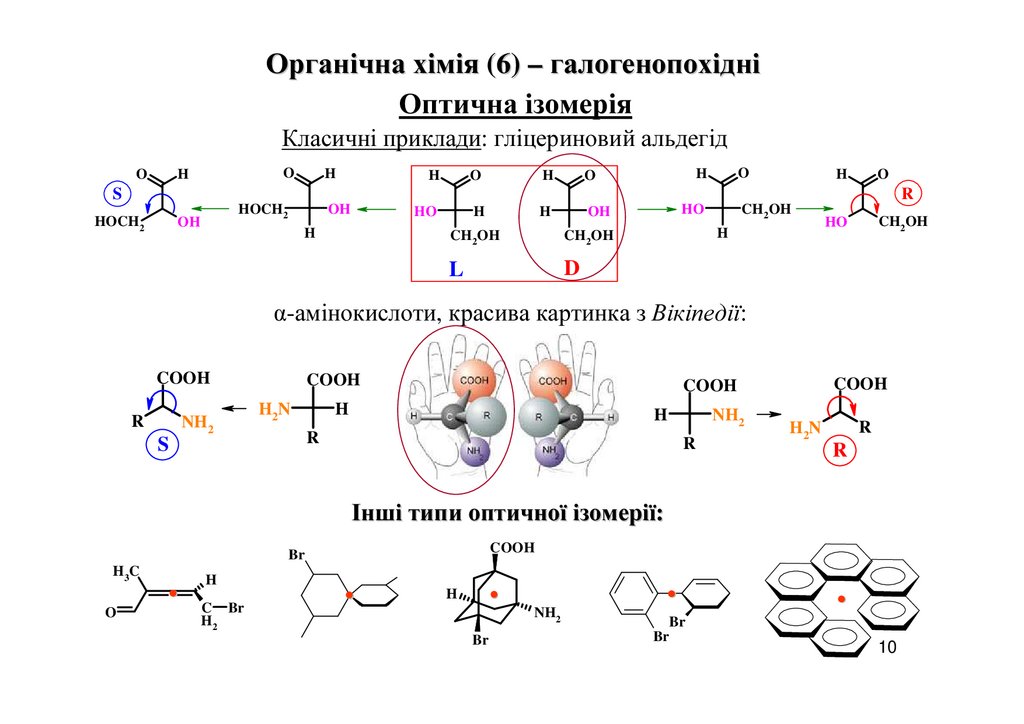
Органічна хімія (6) – галогенопохідніОптична ізомерія
Класичні приклади: гліцериновий альдегід
O
O
H
H
O
H
H
O
H
OH
HO
O
O
H
S
R
HOCH2
HOCH2
OH
OH
HO
H
H
H
CH2OH
CH2OH
L
D
CH2OH
H
CH2OH
HO
α-амінокислоти, красива картинка з Вікіпедії:
COOH
R
NH2
COOH
H2N
H
H
NH2
R
S
COOH
COOH
R
R
H2N
R
Інші типи оптичної ізомерії:
COOH
Br
H3C
O
H
C Br
H2
H
Br
NH2
Br
Br
10
11.
Органічна хімія (6) – галогенопохідніОптична ізомерія
Молекули з (n) хіральними центрами мают 2n оптичних ізомерів
діастереомери
Бромяблучна
кислота:
COOH
H
HO
COOH
COOH
R Br
RH
Br
H
COOH
SH
S OH
H
H
R Br
S OH
COOH
Br
HO
COOH
COOH
енантіомери
SH
RH
COOH
енантіомери
Діастереомери –
оптичні ізомери,
які не є
дзеркальними
відображеннями
один одного
Співвідношення 2n може не дотримуватися для симетричних молекул:
COOH
Винна
кислота:
COOH
COOH
COOH
H
OH
HO
H
H
OH
HO
H
HO
H
H
OH
H
OH
HO
H
COOH
L-винна
COOH
COOH
Оптично
неактивна
COOH
Мезо-винна кислота
D-винна
11
Луї Пастер, 1847, розділення енантіомерів винної кислоти (Na/NH4-солі)
12.
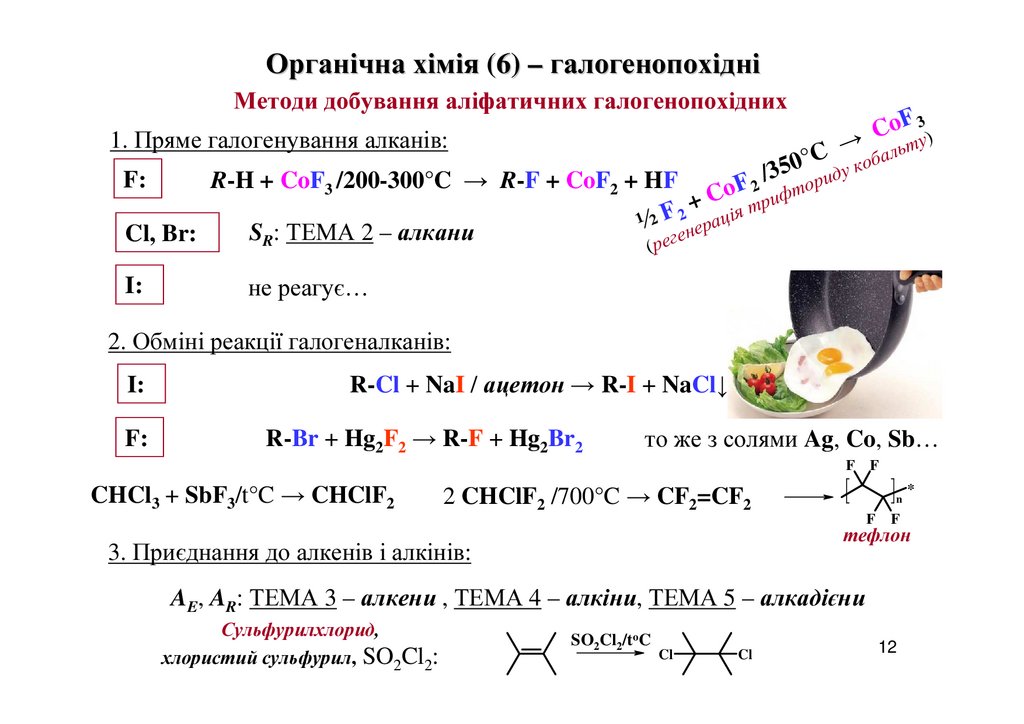
Органічна хімія (6) – галогенопохідніМетоди добування аліфатичних галогенопохідних
1. Пряме галогенування алканів:
CoF 3у )
C →к о ба л ьт
°
0
д у
/35
F:
R-H + CoF3 /200-300°C → R-F + CoF2 + HF
о р и
F
2
o
т
C т риф
+
F2 р а ц і я
½
н е
SR: ТЕМА 2 – алкани
Cl, Br:
р е ге
(
I:
не реагує…
2. Обміні реакції галогеналканів:
I:
F:
R-Cl + NaI / ацетон → R-I + NaCl↓
R-Br + Hg2F2 → R-F + Hg2Br2
то же з солями Ag, Co, Sb…
F
CHCl3 + SbF3/t°C → CHClF2
F
2 CHClF2 /700°C → CF2=CF2
n
F
F
тефлон
3. Приєднання до алкенів і алкінів:
AE, AR: ТЕМА 3 – алкени , ТЕМА 4 – алкіни, ТЕМА 5 – алкадієни
Сульфурилхлорид,
хлористий сульфурил, SO2Cl2:
*
SO2Cl2/toC
Cl
Cl
12
13.
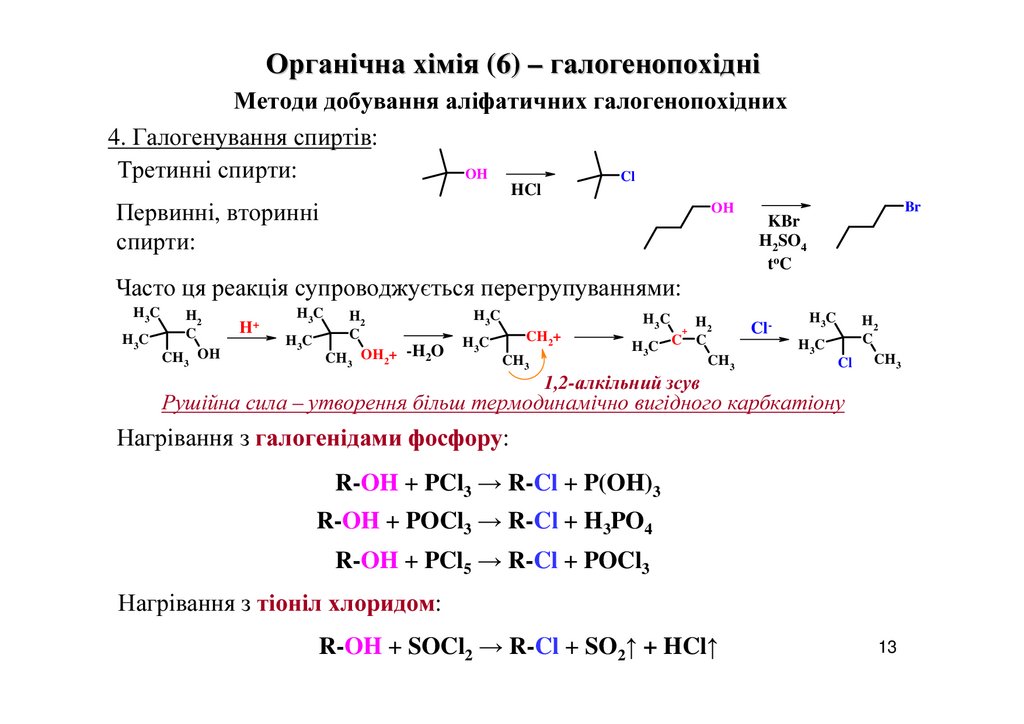
Органічна хімія (6) – галогенопохідніМетоди добування аліфатичних галогенопохідних
4. Галогенування спиртів:
Третинні спирти:
OH
Cl
HCl
OH
Первинні, вторинні
спирти:
Br
KBr
H2SO4
to C
Часто ця реакція супроводжується перегрупуваннями:
H 3C
H2
C
H3 C
CH OH
3
H+
H 3C
H2
C
H3 C
CH OH2+ -H2O
3
H3C
H 3C
CH2+
H3C
CH3
H2
C
C
H3 C
CH3
+
Cl-
H3C
H2
C
H 3C
Cl CH3
1,2-алкільний зсув
Рушійна сила – утворення більш термодинамічно вигідного карбкатіону
Нагрівання з галогенідами фосфору:
R-OH + PCl3 → R-Cl + P(OH)3
R-OH + POCl3 → R-Cl + H3PO4
R-OH + PCl5 → R-Cl + POCl3
Нагрівання з тіоніл хлоридом:
R-OH + SOCl2 → R-Cl + SO2↑ + HCl↑
13
14.
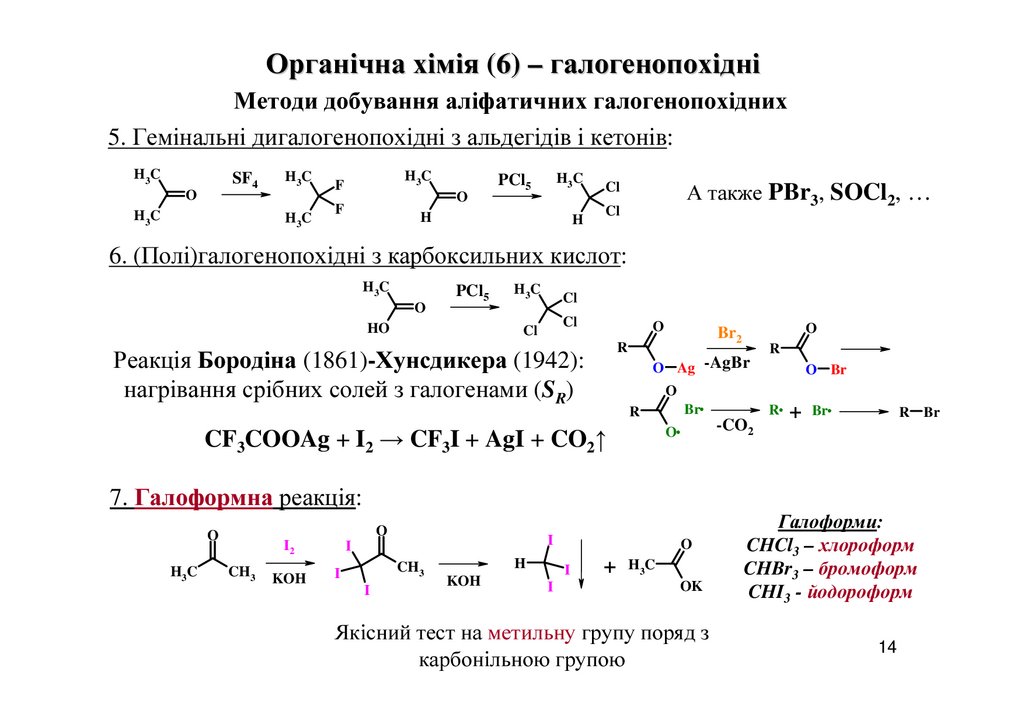
Органічна хімія (6) – галогенопохідніМетоди добування аліфатичних галогенопохідних
5. Гемінальні дигалогенопохідні з альдегідів і кетонів:
H3C
SF4
O
H3 C
H3C
H3C
H3C
F
O
F
H3 C
PCl5
H
H
Cl
А также PBr3, SOCl2, …
Cl
6. (Полі)галогенопохідні з карбоксильних кислот:
H3C
O
PCl5
HO
H3 C
Cl
Cl
Cl
O
R
Реакція Бородіна (1861)-Хунсдикера (1942):
нагрівання срібних солей з галогенами (SR)
O
Br2
O Ag -AgBr
R
O Br
O
Br
R
CF3COOAg + I2 → CF3I + AgI + CO2↑
-CO2
O
R + Br
R Br
7. Галоформна реакція:
O
O
H3C
I2
CH3
KOH
I
I
CH3
I
I
H
KOH
O
I
I
+ H3C
OK
Якісний тест на метильну групу поряд з
карбонільною групою
Галоформи:
CHCl3 – хлороформ
CHBr3 – бромоформ
CHI3 - йодороформ
14
15.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
δ+ δ-
Атом карбону, до якого приєднано галоген,
здобуває частковий позитивний заряд і стає
центром нуклеофільної атаки
C Hal
Nu:
Галогенопохідним властиві реакції нуклеофільного заміщення (SN1 і SN2)
та елімінування (E1, E2 і E1CB)
Механізми реакції нуклеофільного заміщення
R C Hal
+
:Nu(-)
R C Nu
+
Hal-
Приклади:
OH-
SN2
H3C Br
CH3
SN1
H3C C Cl
CH3
H2O
H2O
O
O
H3C OH
+
Br-
V = k· [CH3Br]·[OH-]
другий кінетичний
порядок реакції
CH3
H3C C OH
CH3
+ HCl
V = k· [(CH3)3C-Cl]
перший кінетичний
порядок реакції
15
16.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
Реакція нуклеофільного заміщення 1 порядку передбачає
наявність двох стадій:
CH3
1 стадія:
CH3
H3C C Cl
H3C
CH3
C
E
H 3C
C
+
CH3
CH3
+
Cl-
повільно
H 3C
CH3
2 стадія:
+
+
OH-
швидко
H3C C OH
CH3
стадія, що визначає
швидкість реакції
Полярні розчинники
полегшують дисоціацію
Енергетичний профіль реакції:
H3C
Проміжний карбкатіон є плоским,
оскільки карбкатіонний центр =
атом карбону в sp2 гібридному стані
+
C CH3
H3C
∆E(2)act
CH3
CH3
H3C
+
∆E(1)act
Cl
CH3
CH3
H3C
OH
CH3
H3C
C
CH3
Вірогідність нуклеофільної атаки з
кожного боку площини є однаковою
В результаті реакції SN1 оптично активні вихідні сполуки
перетворюються в оптично неактивну рацемічну суміш
16
17.
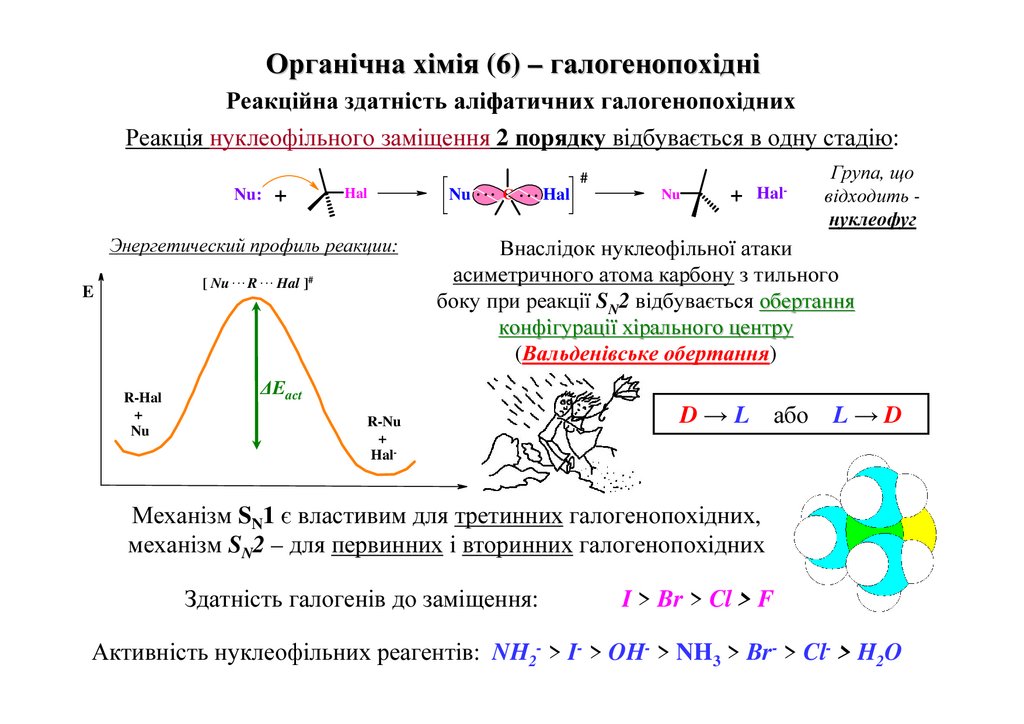
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
Реакція нуклеофільного заміщення 2 порядку відбувається в одну стадію:
Nu:
+
Hal
Энергетический профиль реакции:
[ Nu . . . R . . . Hal ]#
E
R-Hal
+
Nu
Nu . . . C . . . Hal
#
Nu
+
Hal-
Група, що
відходить нуклеофуг
Внаслідок нуклеофільної атаки
асиметричного атома карбону з тильного
боку при реакції SN2 відбувається обертання
конфігурації хірального центру
(Вальденівське обертання)
∆Eact
R-Nu
+
Hal-
D → L або L → D
Механізм SN1 є властивим для третинних галогенопохідних,
механізм SN2 – для первинних і вторинних галогенопохідних
Здатність галогенів до заміщення:
I > Br > Cl > F
Активність нуклеофільних реагентів: NH2- > I- > OH- > NH3 > Br- > Cl- > H217
O
18.
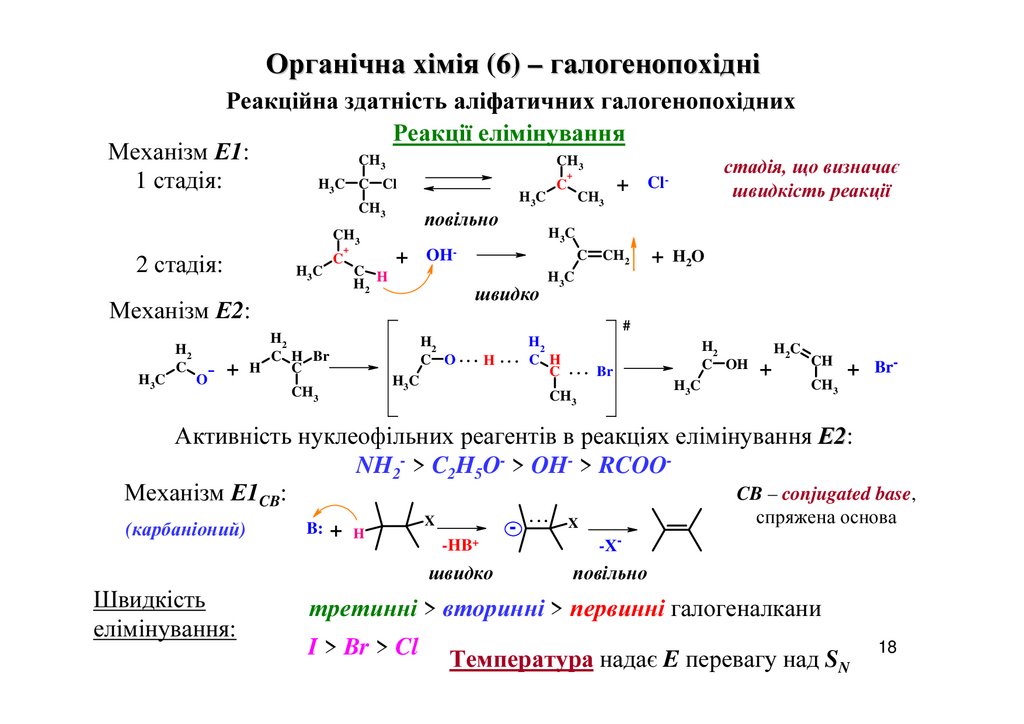
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
Реакції елімінування
Механізм Е1:
CH
CH
стадія, що визначає
1 стадія:
Cl
H C C Cl
C
+
швидкість реакції
3
3
+
3
повільно
CH3
+
2 стадія:
H3 C
C
C
H2 H
+
H3C
H2
C
O
+
CH3
H3C
OH-
C
швидко
Механізм Е2:
H2
C H Br
H
C
CH3
H3C
CH3
CH2
+ H2O
H3 C
#
H3 C
H2
H2
C O... H ... C H
C . . . Br
H2
C OH
H 3C
CH3
H2C
+
CH
CH3
+ Br-
Активність нуклеофільних реагентів в реакціях елімінування Е2:
NH2- > C2H5O- > OH- > RCOOCB – conjugated base,
Механізм Е1CB:
(карбаніоний)
Швидкість
елімінування:
B: + H
X
-
...
спряжена основа
X
-HB+
-X-
швидко
повільно
третинні > вторинні > первинні галогеналкани
I > Br > Cl
Температура надає E перевагу над SN
18
19.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
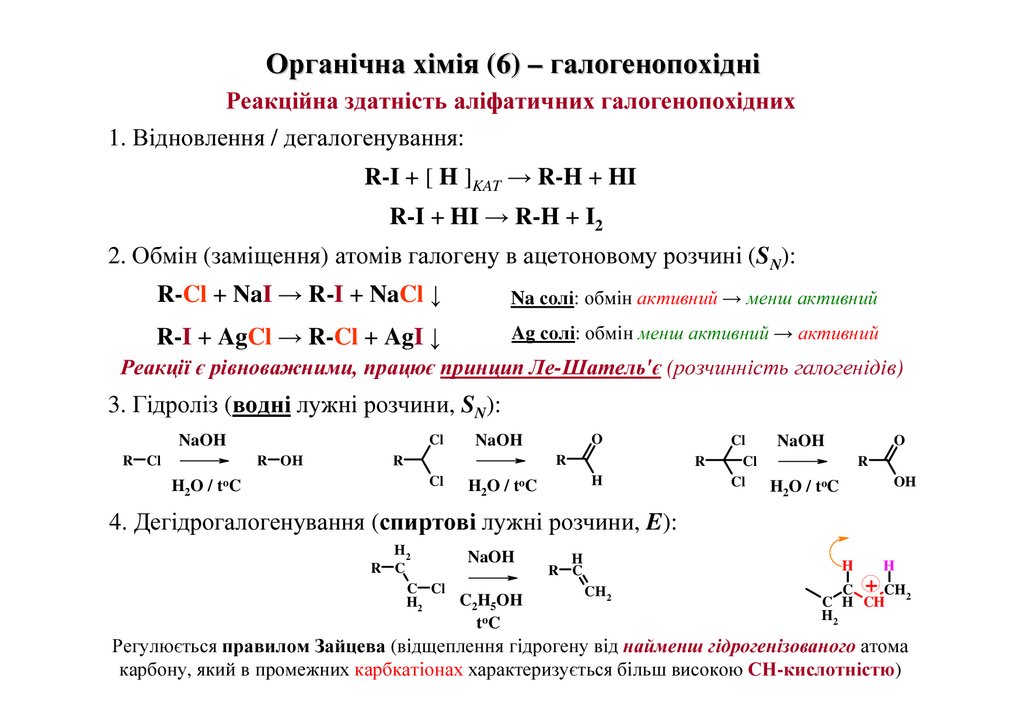
1. Відновлення / дегалогенування:
R-I + [ H ]KAT → R-H + HI
R-I + HI → R-H + I2
2. Обмін (заміщення) атомів галогену в ацетоновому розчині (SN):
R-Cl + NaI → R-I + NaCl ↓
Na солі: обмін активний → менш активний
R-I + AgCl → R-Cl + AgI ↓
Ag солі: обмін менш активний → активний
Реакції є рівноважними, працює принцип Ле-Шатель'є (розчинність галогенідів)
3. Гідроліз (водні лужні розчини, SN):
NaOH
R Cl
Cl
R OH
H 2 O / to C
NaOH
O
R
R
Cl
R
H
H 2 O / to C
Cl
NaOH
Cl
Cl
H2O / toC
O
R
OH
4. Дегідрогалогенування (спиртові лужні розчини, E):
H2
NaOH
R C
C Cl
C2H5OH
H2
t oC
H
R C
H
CH2
H
C + CH
C H CH 2
H2
Регулюється правилом Зайцева (відщеплення гідрогену від найменш гідрогенізованого атома
19
карбону, який в промежних карбкатіонах характеризується більш високою СН-кислотністю)
20.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
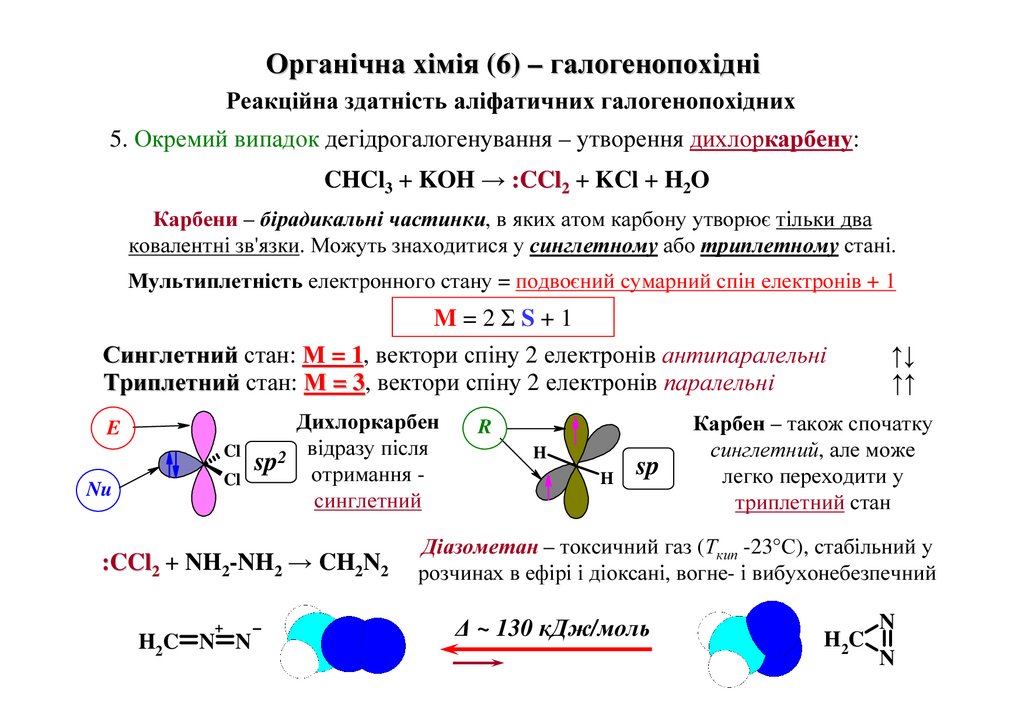
5. Окремий випадок дегідрогалогенування – утворення дихлоркарбену:
CHCl3 + KOH → :CCl2 + KCl + H2O
Карбени – бірадикальні частинки, в яких атом карбону утворює тільки два
ковалентні зв'язки. Можуть знаходитися у синглетному або триплетному стані.
Мультиплетність електронного стану = подвоєний сумарний спін електронів + 1
M=2ΣS+1
Синглетний стан: М = 1,
1 вектори спіну 2 електронів антипаралельні
Триплетний стан: М = 3,
3 вектори спіну 2 електронів паралельні
Дихлоркарбен
відразу після
Cl
sp2 отримання Cl
синглетний
E
Nu
:CCl2 + NH2-NH2 → CH2N2
+
H2C N N
R
H
H
sp
↑↓
↑↑
Карбен – також спочатку
синглетний, але може
легко переходити у
триплетний стан
Діазометан – токсичний газ (Ткип -23°С), стабільний у
розчинах в ефірі і діоксані, вогне- і вибухонебезпечний
∆ ~ 130 кДж/моль
N
H2C 20
N
21.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
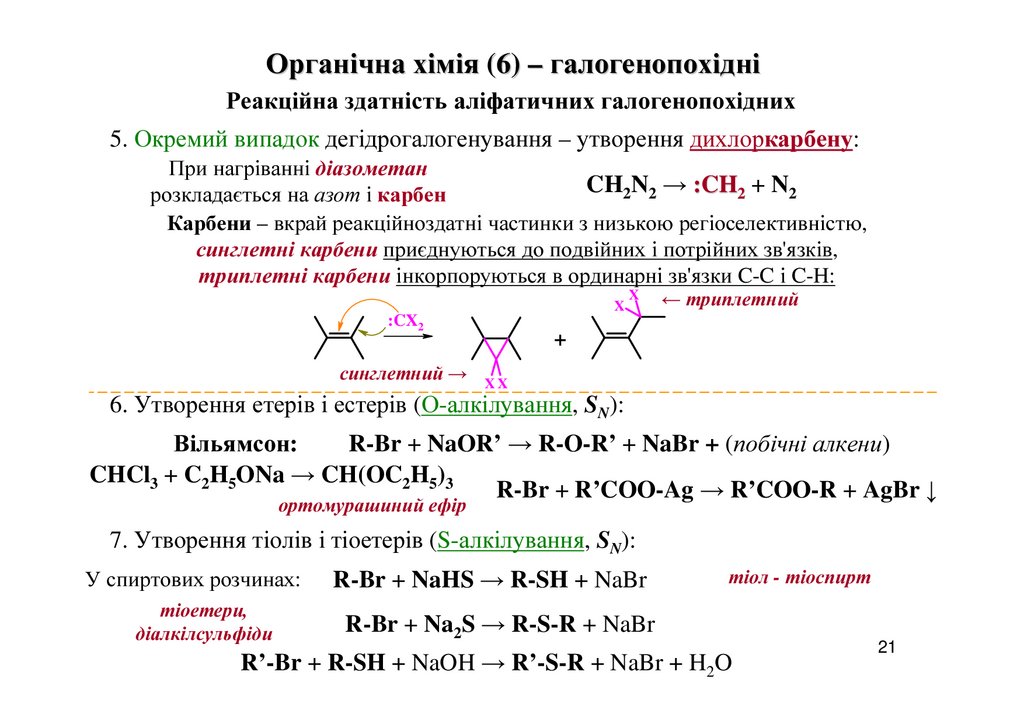
5. Окремий випадок дегідрогалогенування – утворення дихлоркарбену:
При нагріванні діазометан
CH2N2 → :CH2 + N2
розкладається на азот і карбен
Карбени – вкрай реакційноздатні частинки з низькою регіоселективністю,
синглетні карбени приєднуються до подвійних і потрійних зв'язків,
триплетні карбени інкорпоруються в ординарні зв'язки C-C і C-H:
X
:CX2
синглетний →
X
← триплетний
+
XX
6. Утворення етерів і естерів (О-алкілування, SN):
Вільямсон:
R-Br + NaOR’ → R-O-R’ + NaBr + (побічні алкени)
CHCl3 + C2H5ONa → CH(OC2H5)3
R-Br + R’COO-Ag → R’COO-R + AgBr ↓
ортомурашиний ефір
7. Утворення тіолів і тіоетерів (S-алкілування, SN):
У спиртових розчинах:
R-Br + NaHS → R-SH + NaBr
тіоетери,
діалкілсульфіди
R-Br + Na2S → R-S-R + NaBr
тіол - тіоспирт
R’-Br + R-SH + NaOH → R’-S-R + NaBr + H2O
21
22.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
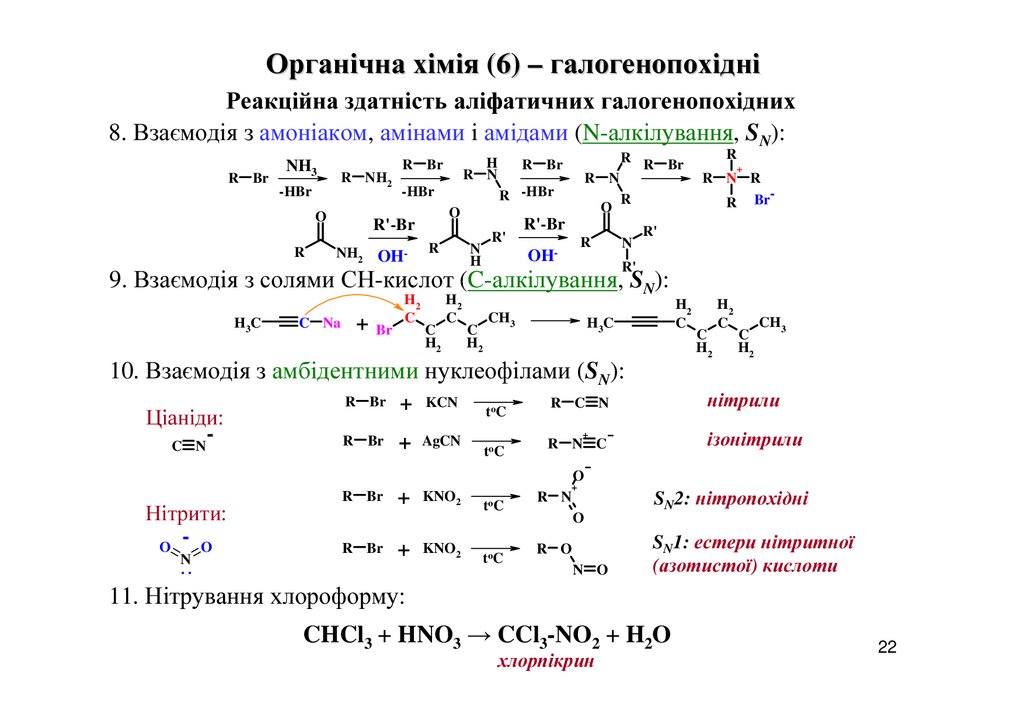
8. Взаємодія з амоніаком, амінами і амідами (N-алкілування, SN):
R Br
NH3
R NH2
-HBr
O
R
-HBr
OH-
R N
R -HBr
R
N
H
R'
R
R R Br
R Br
O
R'-Br
NH2
H
R N
R Br
O
R
R'-Br
R
OH-
N
+
R N R
R Br
R'
R'
9. Взаємодія з солями СН-кислот (C-алкілування, SN):
H3C
C Na
+ Br
H2
C
C
H2
H2
C
C
H2
CH3
H2
C
H3 C
C
H2
H2
C
C
H2
CH3
10. Взаємодія з амбідентними нуклеофілами (SN):
Ціаніди:
C N
R Br
+ KCN
toC
R Br
+ AgCN
toC
нітрили
R C N
+
ізонітрили
R N C
O
R Br
Нітрити:
- O
O
N
..
R Br
+ KNO2
+ KNO2
+
toC
toC
R N
SN2: нітропохідні
O
R O
N O
SN1: естери нітритної
(азотистої) кислоти
11. Нітрування хлороформу:
CHCl3 + HNO3 → CCl3-NO2 + H2O
хлорпікрин
22
23.
Victor GrignardОрганічна хімія (6) – галогенопохідні
Реакційна здатність аліфатичних галогенопохідних
12. Металоорганічні сполуки:
R-Br + 2Li → R-Li + LiBr
В сухих ефірі, діоксані
або тетрагідрофурані:
R-Br + Mg → R-MgBr
Реактив Гриньяру
Металоорганічні сполуки за визначенням повинні мати в
молекулі зв'язок атома карбону з атомом металу
Середній ступінь іонності зв'язків C-Met:
Na, K ~ 50%
Al, Zn ~ 20%
Li, Mg ~ 35-40%
Hg ~ 10%
i = 1− e
Для порівняння:
NaCl, CsI ~ 65%
Металоорганіка з помірним ступенем іонності зв'язку C-Met розчиняється
у інертних органічних розчинниках середньої полярності (їх структурні ф-ли →),
з високим ступенем іонності – випадає з них у осад
Нуклеофільний
центр
H H
C δ+ Br
H3C δ- Mg
−0.25( χ A − χ B )2
O O
O
Металоорганічні сполуки приєднуються до
електрофільних реакційних центрів різних молекул
Як правило, на наступній стадії продукт приєднання
піддають гідролізу
23
O
24.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
12. Металоорганічні сполуки (реакційна здатність):
а) Розщеплення ординарних зв'язків:
R-MgI + HA → R-H ↑ + A-MgI
HA = H2O, спирты, кислоти, аміди, аміни, алкіни…
алкіни
Кількісний волюметричний метод визначення активного (рухомого) гідрогену в молекулах
органічних сполук по Чугаєву / аналіз вологості / (R=CH3, точність 3-5%)
Взаємодія з
алкілгалогенідами:
Обмін Mg/Li на менш
активний метал:
Приєднання до
O
C CH2 +
епоксидів:
H3 C H
R-MgBr + R’-Br → R-R’ + MgBr2
R-MgBr + Met-Brn → R-Met(Br) + MgBr2
Br
Mg
C
H2
H2
C
H2 H2
C C
CH3
C C
H 3C H H 2
MgBr
O
CH3
H2 H2
C C
CH3
HC C
H
2
H3 C
HO
H2O
Правило Красуського: нуклеофільна атака відбувається по найбільш стерично доступному
атому карбону епоксидного циклу (сформульовано для приєднання амінів)
Реакція з елементами
VI-VII групи
Періодичної системи
(O, S, Se, Te, I…):
R-MgBr + O2 → R-OMgBr → R-OH
R-MgBr + I2 → R-I
24
25.
Органічна хімія (6) – галогенопохідніРеакційна здатність аліфатичних галогенопохідних
12. Металоорганічні сполуки (реакційна здатність):
б) Приєднання до подвійних зв'язків:
R-MgBr + CO2 → R-COOMgBr → R-COOH
Формальдегід →
первинні спирти:
Альдегіди →
вторинні спирти:
Кетони →
третинні спирти:
H
R MgBr
+
O
R C
H2
H
H
R MgBr
R MgBr
+
+
CH3
CH3
O MgBr
O
O
R
H3C
CH3
Естери →
третинні спирти:
2 R MgBr
Ортоформіати →
альдегіди:
OC2H5
R MgBr + HC OC2H5
OC2H5 -C2H5OMgBr
OH
R CH
CH3
OH
H2O
CH3
R C
H2
R
H3C
R
OC2H5
R
H2O
CH3
CH3
OH
O MgBr
O
в) Приєднання до потрійних зв'язків:
Нітрили →
R MgBr + R' C N
кетони:
H2O
O MgBr
R CH
H2 O
CH3
CH3
+
OH
O MgBr
OC2H5
R CH
OC2H5 H2O
R
R
CH3
O
R
H
ацеталь
R
R'
N
MgBr
H2 O
R'
R
25
O
26.
Органічна хімія (6) – галогенопохідніНаступна тема – спирти і етери
26














 Химия
Химия








