Похожие презентации:
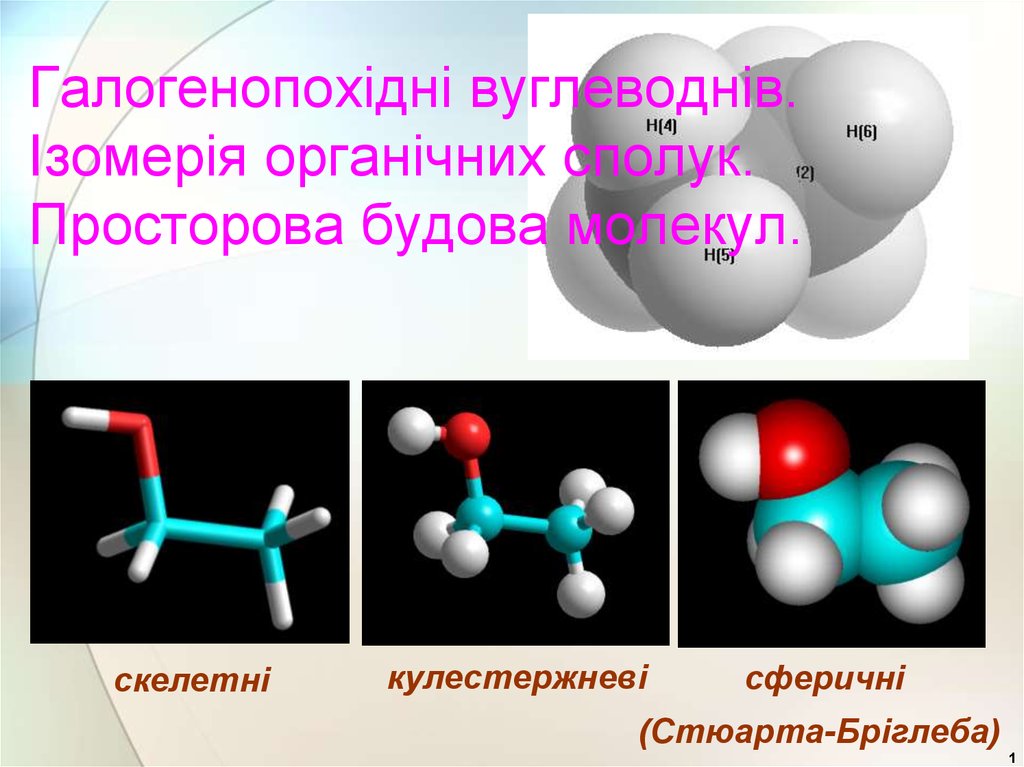
Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул
1. Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул.
скелетнікулестержневі
сферичні
(Стюарта-Бріглеба)
1
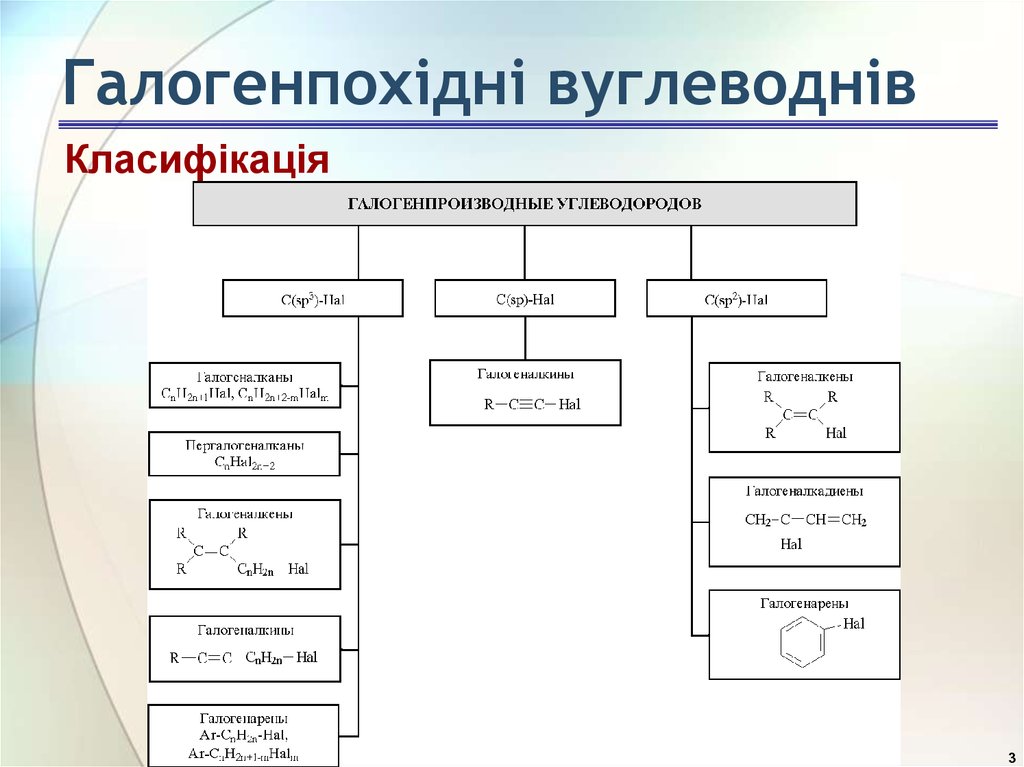
2. Галогенпохідні вуглеводнів
Галогенпохідними називаютьсяпохідні вуглеводнів, в яких один або
декілька атомів Гідрогену заміщені
атомами галогену.
2
3. Галогенпохідні вуглеводнів
Класифікація3
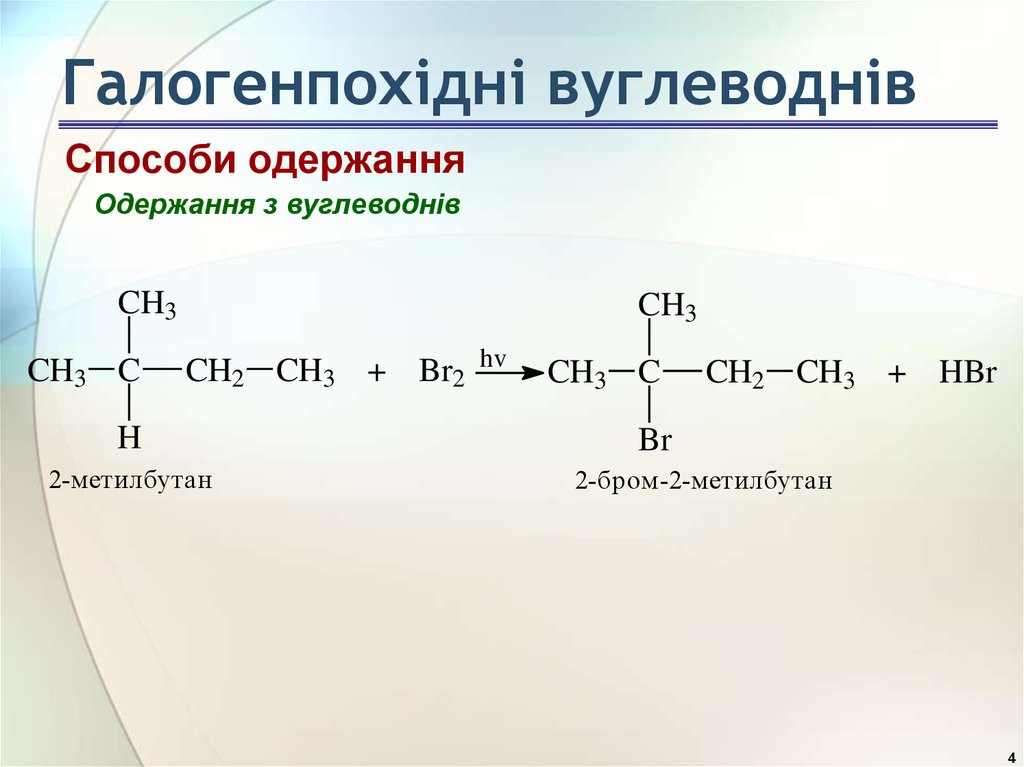
4. Галогенпохідні вуглеводнів
Способи одержанняОдержання з вуглеводнів
CH3
CH3 C
CH3
CH2 CH3 + Br2
H
2-метилбутан
hv
CH3 C
CH2 CH3 + HBr
Br
2-бром-2-метилбутан
4
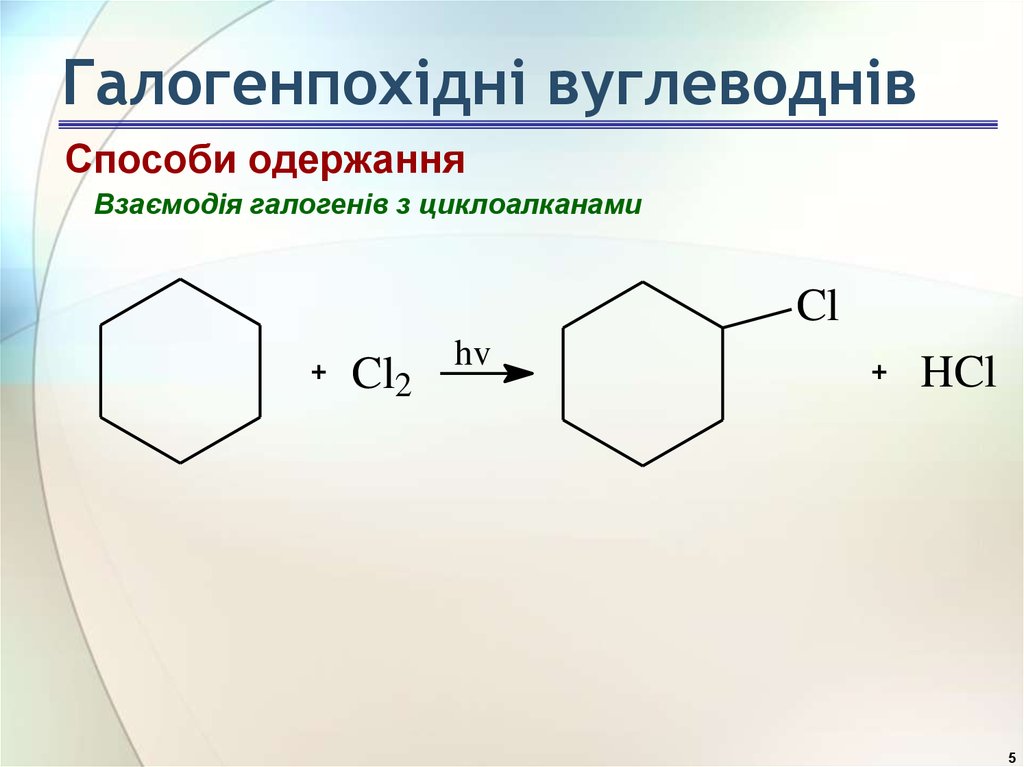
5. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія галогенів з циклоалканами
Cl
Cl2
hv
HCl
5
6. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія галогенів з алкенами і алкінами
CH3CH
CH2 + Br2
CH3CH
Br
CH2
Br
6
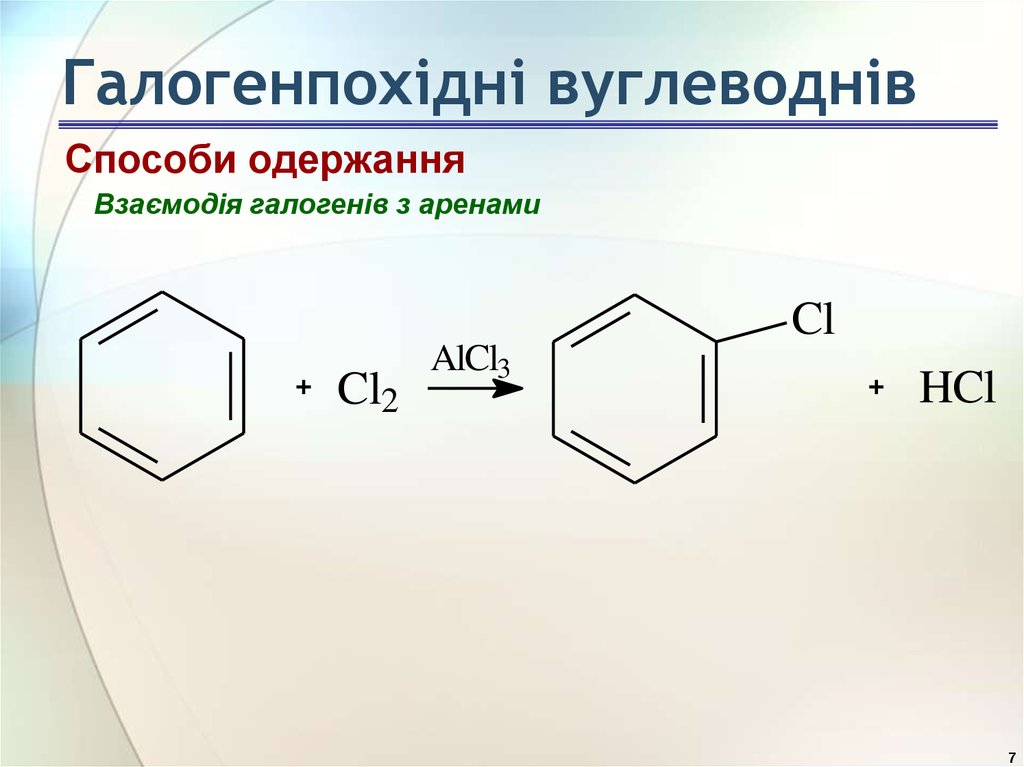
7. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія галогенів з аренами
Cl
Cl2
AlCl3
HCl
7
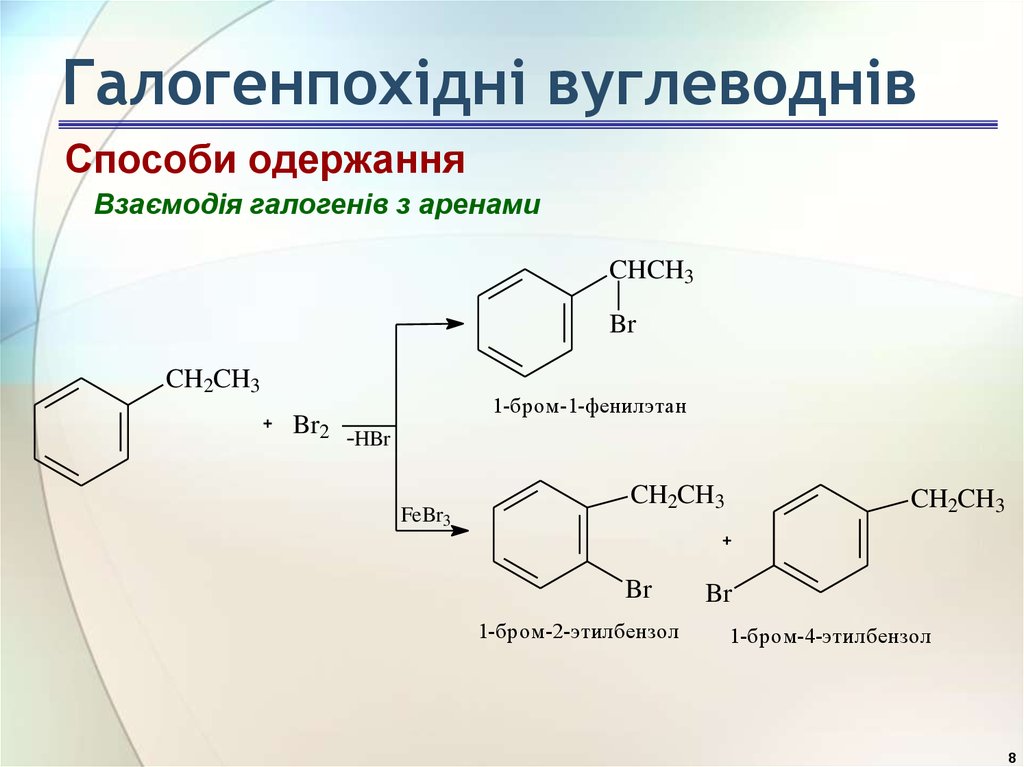
8. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія галогенів з аренами
CHCH3
Br
CH2CH3
1-бром-1-фенилэтан
Br2 -HBr
FeBr3
CH2CH3
Br
1-бром-2-этилбензол
CH2CH3
Br
1-бром-4-этилбензол
8
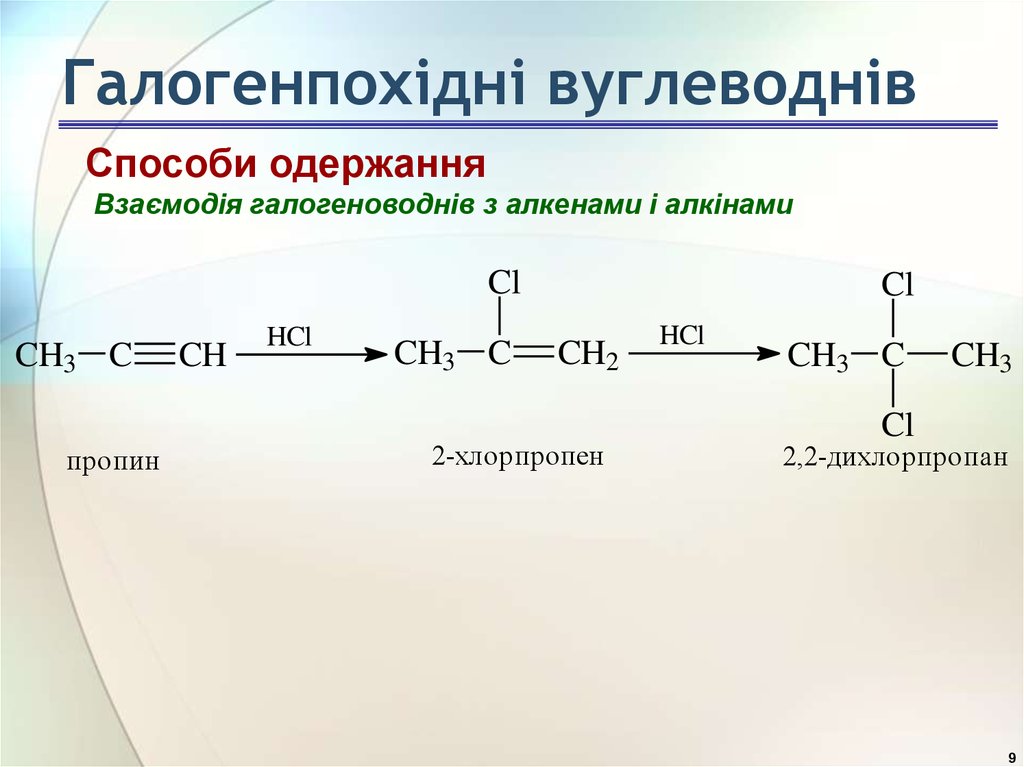
9. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія галогеноводнів з алкенами і алкінами
Cl
CH3 C
пропин
CH
HCl
CH3 C
Cl
CH2
2-хлорпропен
HCl
CH3 C
CH3
Cl
2,2-дихлорпропан
9
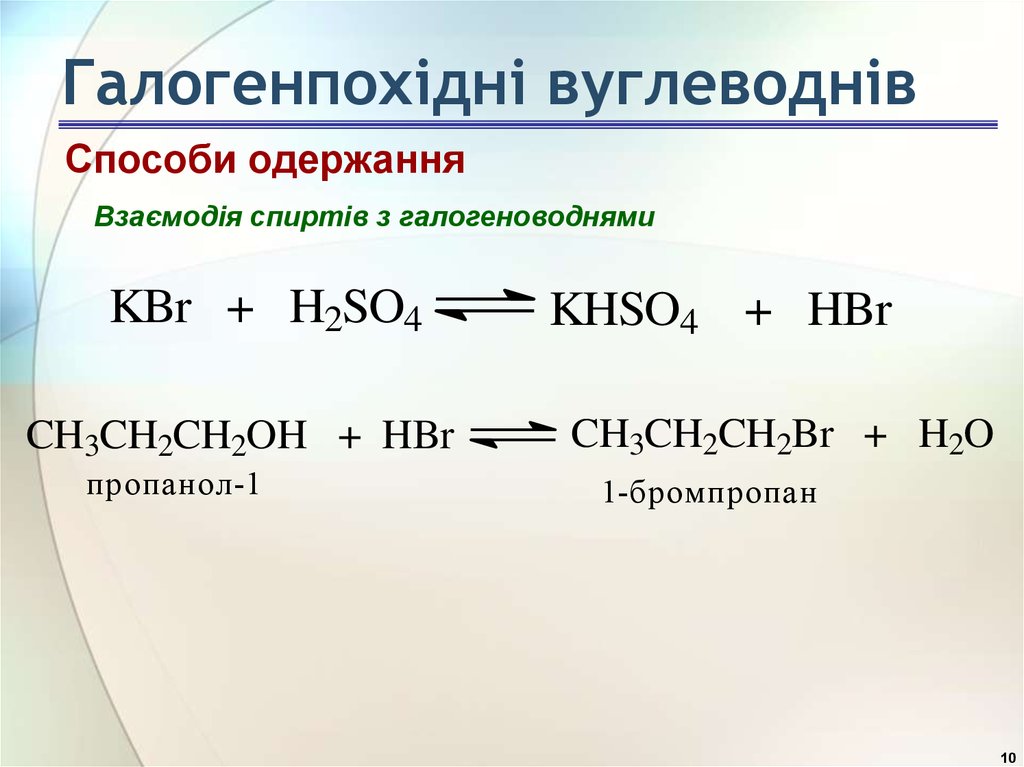
10. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія спиртів з галогеноводнями
KBr + H2SO4
CH3CH2CH2OH + HBr
пропанол-1
KHSO4 + HBr
CH3CH2CH2Br + H2O
1-бромпропан
10
11. Галогенпохідні вуглеводнів
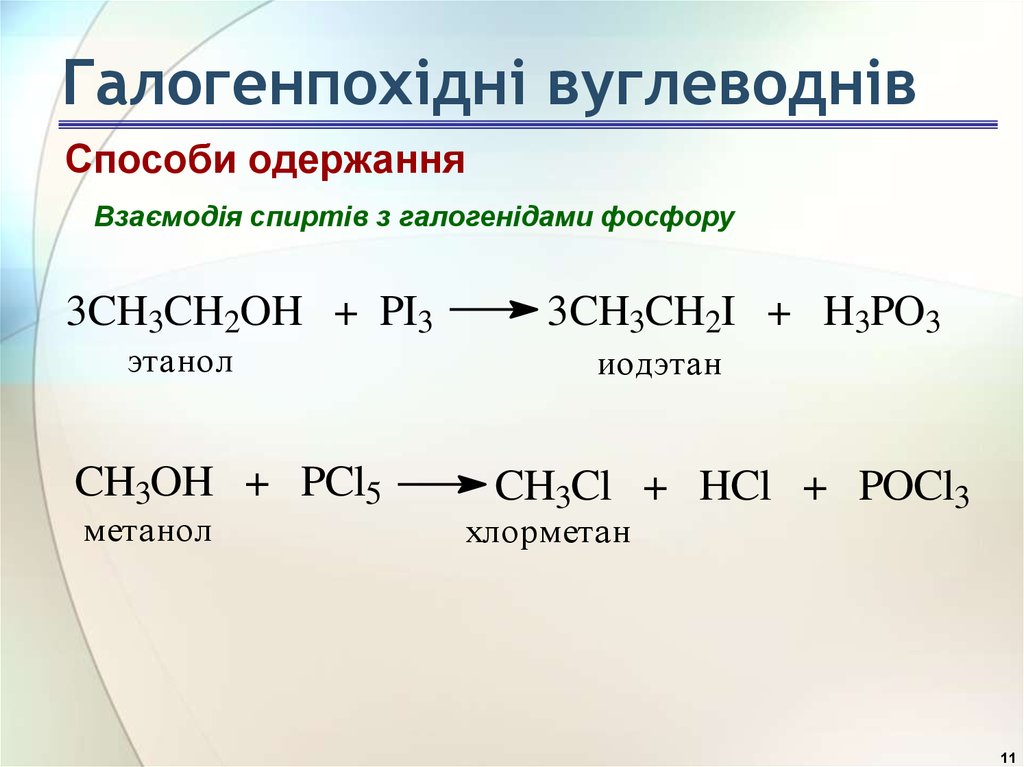
Способи одержанняВзаємодія спиртів з галогенідами фосфору
3CH3CH2OH + PI3
этанол
CH3OH + PCl5
метанол
3CH3CH2I + H3PO3
иодэтан
CH3Cl + HCl + POCl3
хлорметан
11
12. Галогенпохідні вуглеводнів
Способи одержанняВзаємодія спиртів з тіонілхлоридом
CH3CH2CH2OH + SOCl2
пропанол-1
тионилхлорид
CH3CH2CH2Cl + HCl + SO2
1-хлорпропан
12
13. Галогенпохідні вуглеводнів
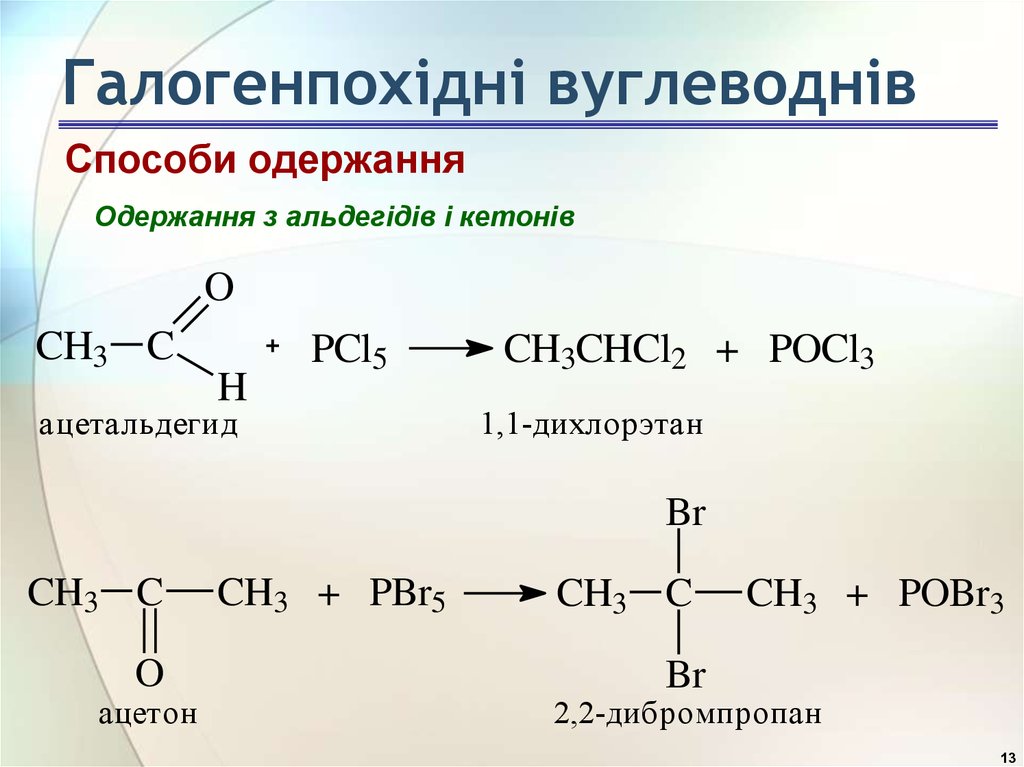
Способи одержанняОдержання з альдегідів і кетонів
O
CH3 C
H
PCl5
ацетальдегид
CH3CHCl2 + POCl3
1,1-дихлорэтан
Br
CH3 C
O
ацетон
CH3 + PBr5
CH3 C
CH3 + POBr3
Br
2,2-дибромпропан
13
14. Галогенпохідні вуглеводнів
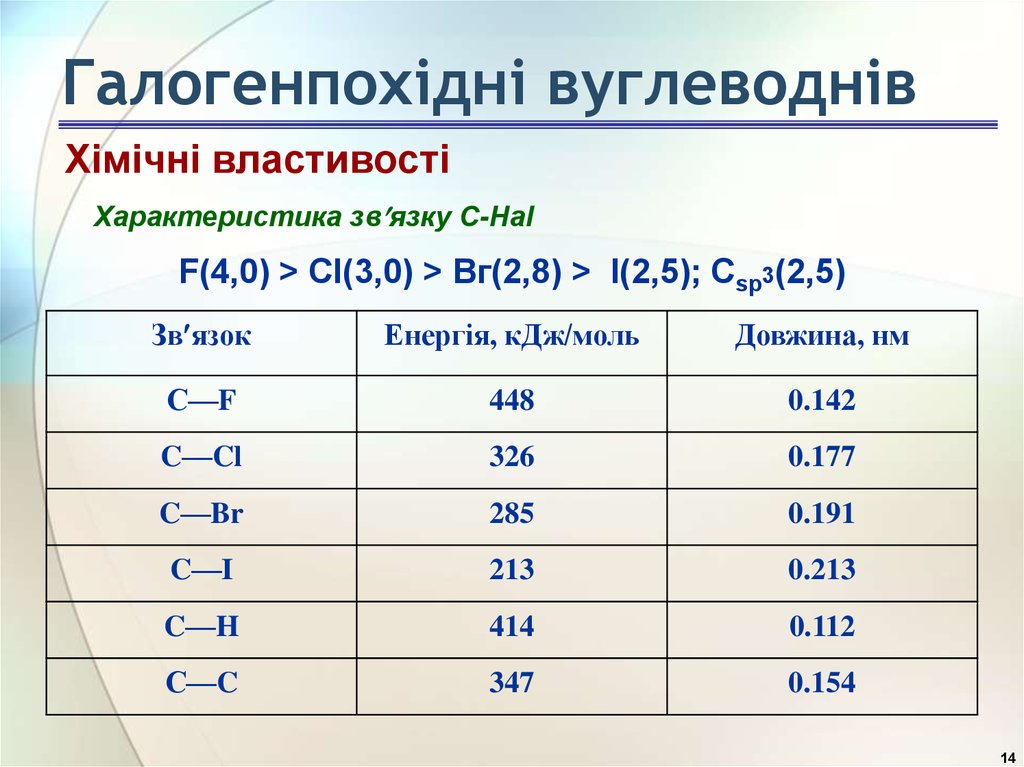
Хімічні властивостіХарактеристика зв язку C-Hal
F(4,0) > Сl(3,0) > Вг(2,8) > I(2,5); Сsp3(2,5)
Зв язок
Енергія, кДж/моль
Довжина, нм
С—F
448
0.142
C—Cl
326
0.177
C—Br
285
0.191
C—I
213
0.213
C—H
414
0.112
С—C
347
0.154
14
15. Галогенпохідні вуглеводнів
Хімічні властивостіХарактеристика зв язку C-Hal
С—I > С—Вr > C—CI > C—F
''+
3
'+
2
+
1
-
CH3 CH2 CH2 Cl
''+ < '+ < +
15
16. Галогенпохідні вуглеводнів
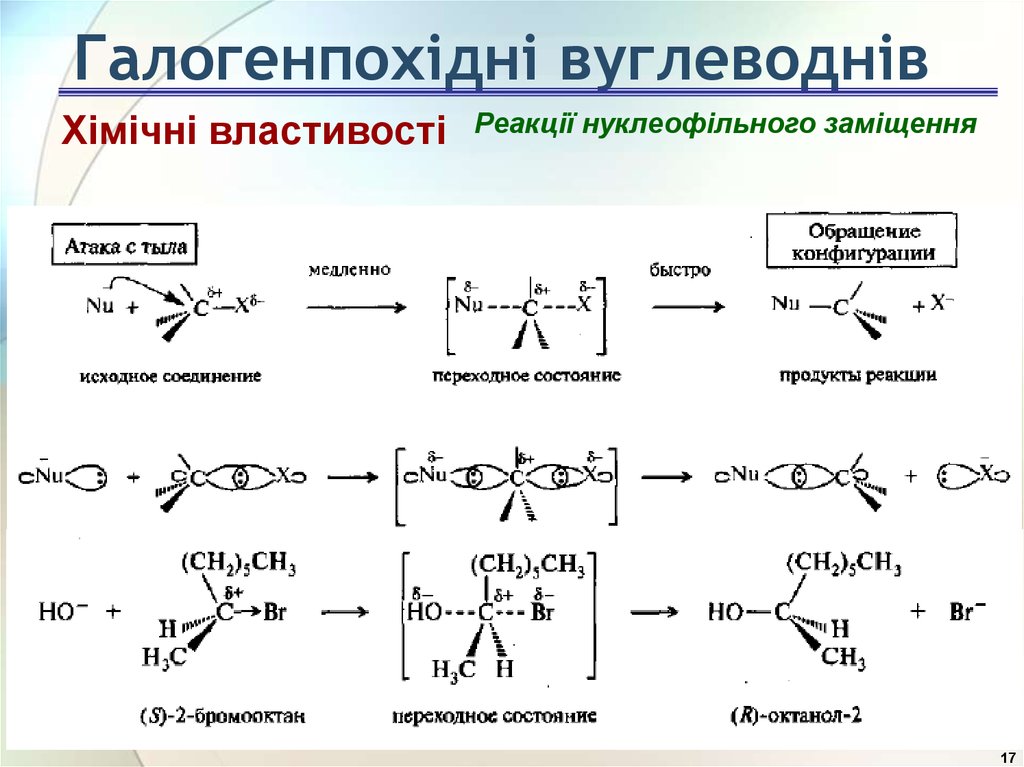
Хімічні властивостіРеакції нуклеофільного заміщення
Реакції, в результаті яких в молекулі вихідної
сполуки відбувається заміщення атома або групи
атомів на інший нуклеофіл, называють реакціями
нуклеофільного заміщення. Ці реакції позначають SN.
(від англ. substitution nucleophilic).
16
17.
Галогенпохідні вуглеводнівХімічні властивості
Реакції нуклеофільного заміщення
17
18. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції нуклеофільного заміщення
Взаємодія галогеналканів з водними
розчинами лугів
CH3CH2Br + KOH
бромэтан
CH3CH2OH + KBr
этанол
18
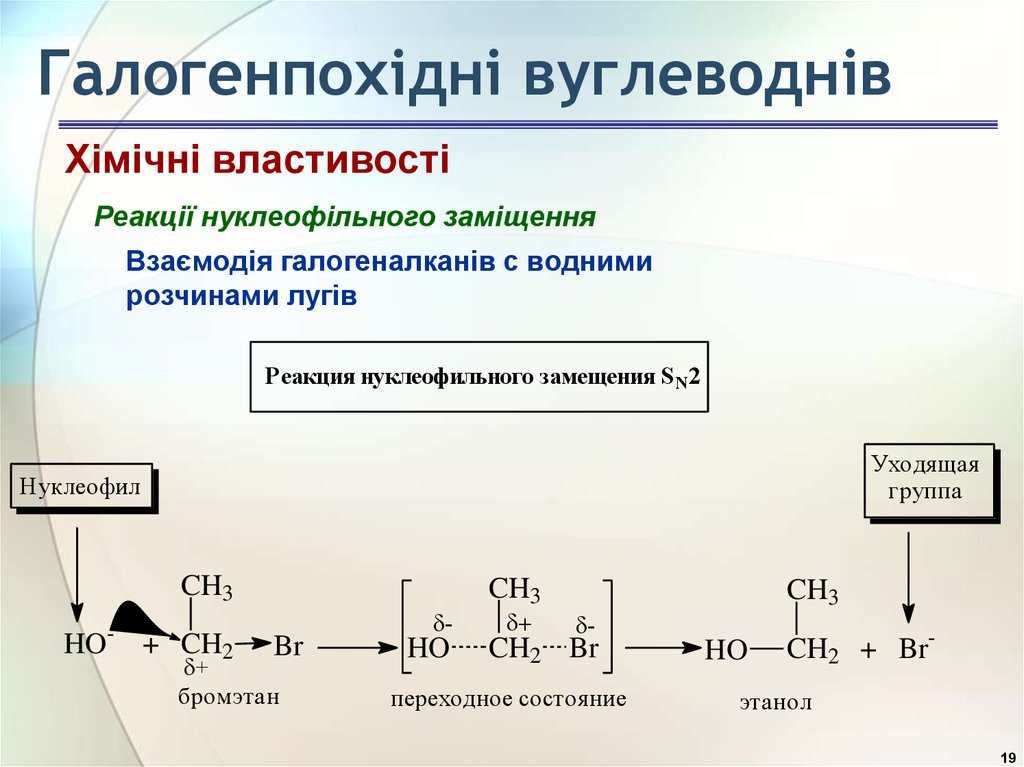
19. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції нуклеофільного заміщення
Взаємодія галогеналканів с водними
розчинами лугів
Реакция нуклеофильного замещения S N 2
Уходящая
группа
Н уклеофил
CH3
-
HO
+ CH2
Br
+
бромэтан
-
HO
CH3
CH3
-
CH2 Br
переходное состояние
HO
CH2 + Br-
этанол
19
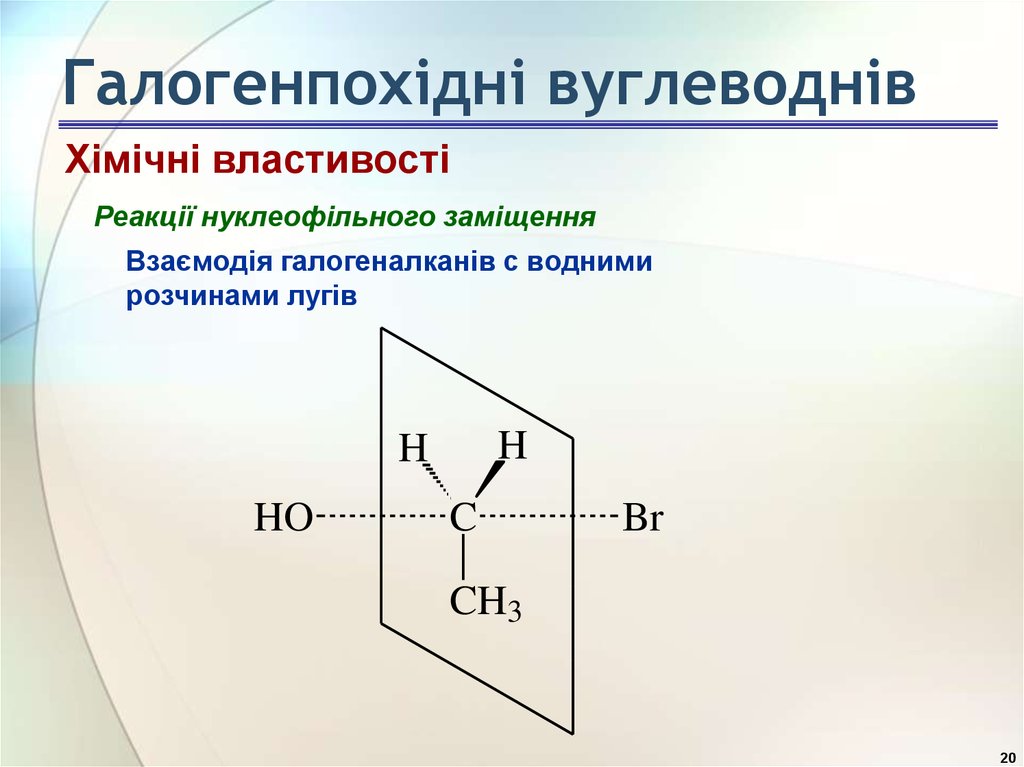
20. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції нуклеофільного заміщення
Взаємодія галогеналканів с водними
розчинами лугів
H
H
HO
C
Br
CH3
20
21. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції нуклеофільного заміщення
Швидкість реакції нуклеофільного заміщення залежить від
таких факторів:
- нуклеофільної реакційної здатності реагента;
- основності нуклеофільного реагента;
- концентрації реагента;
- величини позитивного заряду на атакованому атомі
Карбону в субстраті;
- енергії зв язку і характері відхідної групи;
- будови радикалів, що зв язані з атакованим атомом
Карбону;
- природи розчинника
21
22. Галогенпохідні вуглеводнів
Хімічні властивостіНуклеофільна реакційна здатність реагента
Під нуклеофільною реакційною здатністю
(нуклеофільною силою) прийнято розуміти
здатність реагента (аніона або нейтральної
молекули) утворювати за рахунок неподільної
пари p-електронів одного з атомів, що входить до
його складу ковалентний зв язок з атомом
Карбону в органічній молекулі (субстраті), що має
дефіцит електронної густини
22
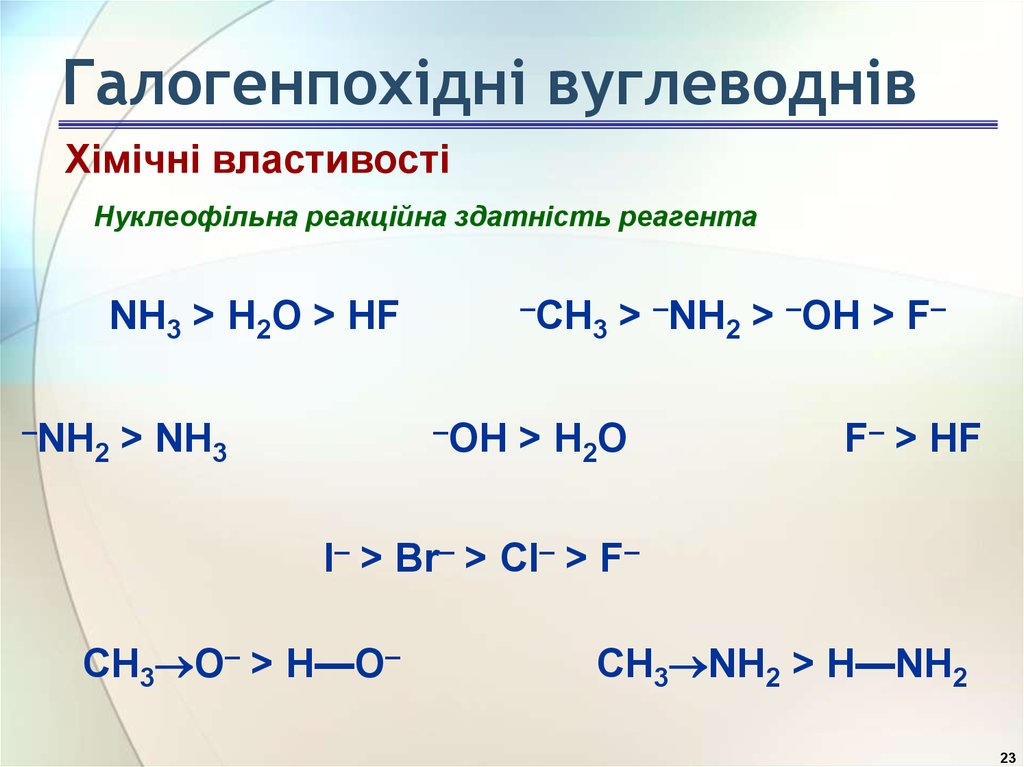
23. Галогенпохідні вуглеводнів
Хімічні властивостіНуклеофільна реакційна здатність реагента
–CH
3
NH3 > H2O > HF
–NH
2
–OH
> NH3
> –NH2 > –OH > F–
> H2O
F– > HF
I– > Br– > Cl– > F–
CH3 O– > H—O–
CH3 NH2 > H—NH2
23
24. Галогенпохідні вуглеводнів
Хімічні властивостіОсновність нуклеофільних реагентів
I– < Br– < Cl– < F–
24
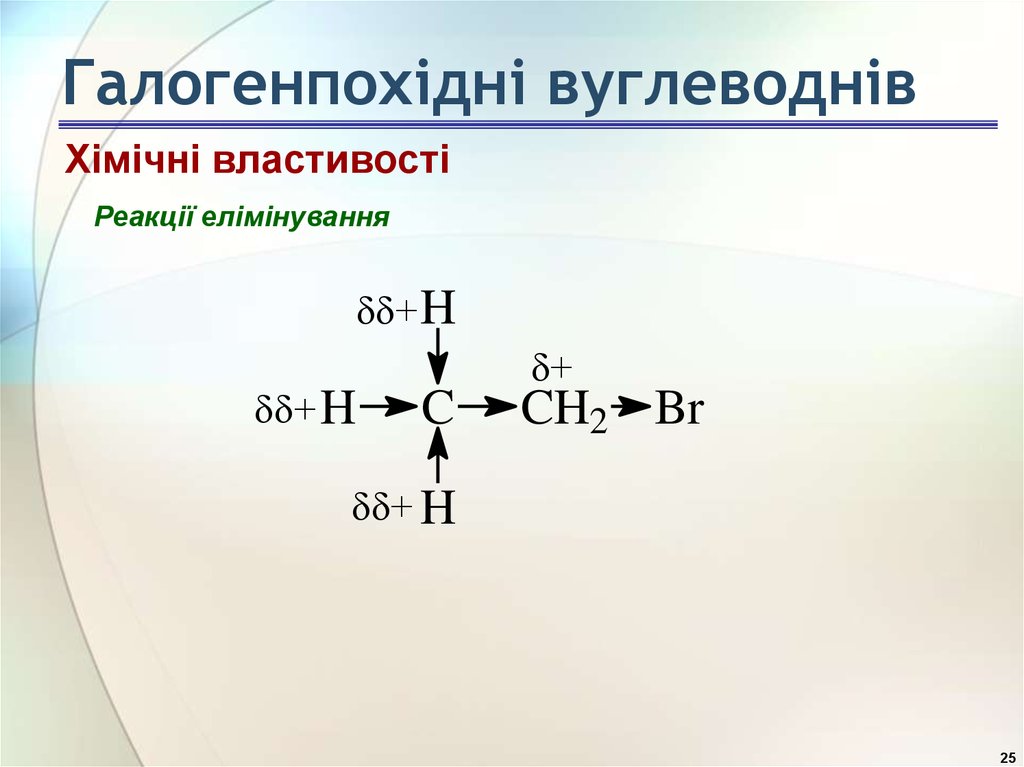
25. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції елімінування
+ H
+ H
+
C
CH2 Br
+ H
25
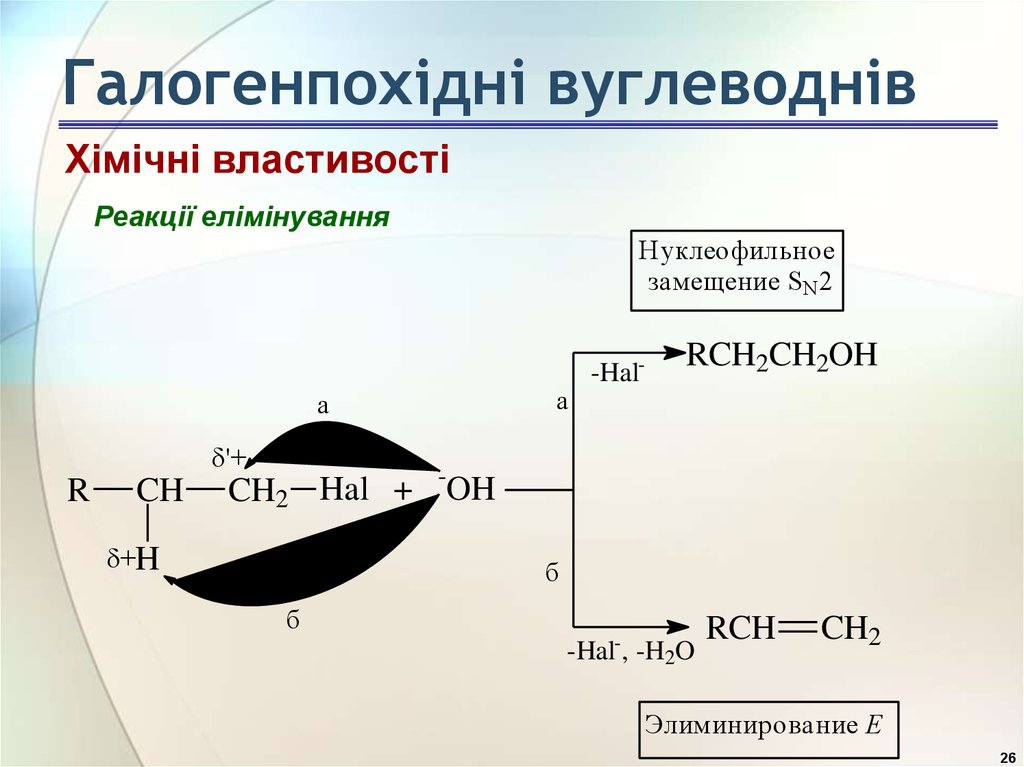
26. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції елімінування
Н уклеофильное
замещение SN 2
а
а
-Hal-
RCH2CH2OH
'+
R
CH
CH2 Hal + -OH
+H
б
б
-Hal-, -H2O
RCH
CH2
Элиминирование Е
26
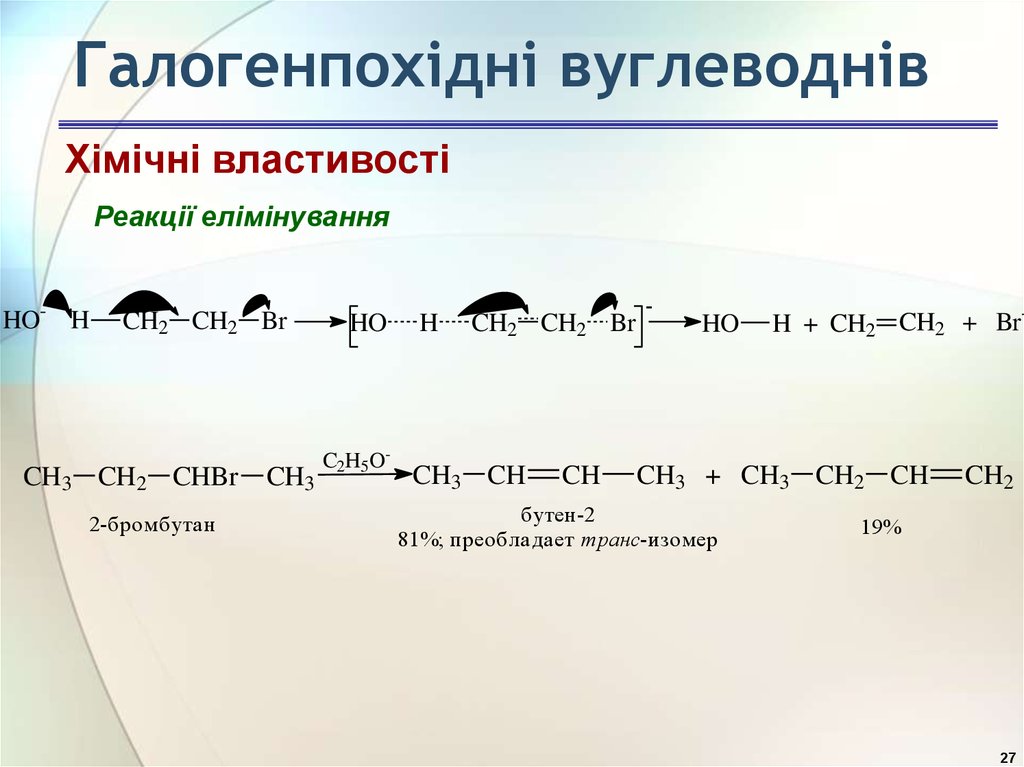
27. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції елімінування
HO- H
CH2 CH2 Br
CH3 CH2 CHBr
2-бромбутан
CH3
HO
C2H5O-
H
CH2 CH2 Br
CH3 CH
CH
-
HO
H + CH2 CH2 + Br-
CH3 + CH3 CH2 CH
бутен-2
81%; преобладает транс-изомер
CH2
19%
27
28.
Галогенпохідні вуглеводнівХімічні властивості
Реакції елімінування
28
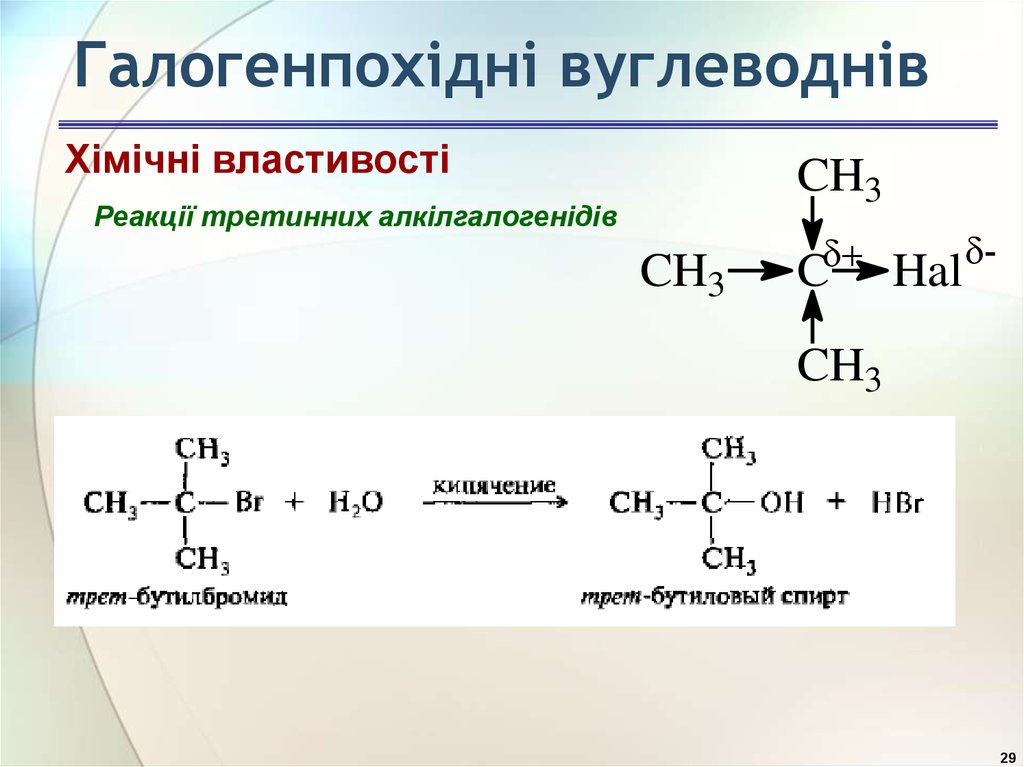
29. Галогенпохідні вуглеводнів
Хімічні властивостіCH3
Реакції третинних алкілгалогенідів
CH3
C
Hal
-
CH3
29
30.
Галогенпохідні вуглеводнівХімічні властивості
Реакції третинних алкілгалогенідів
30
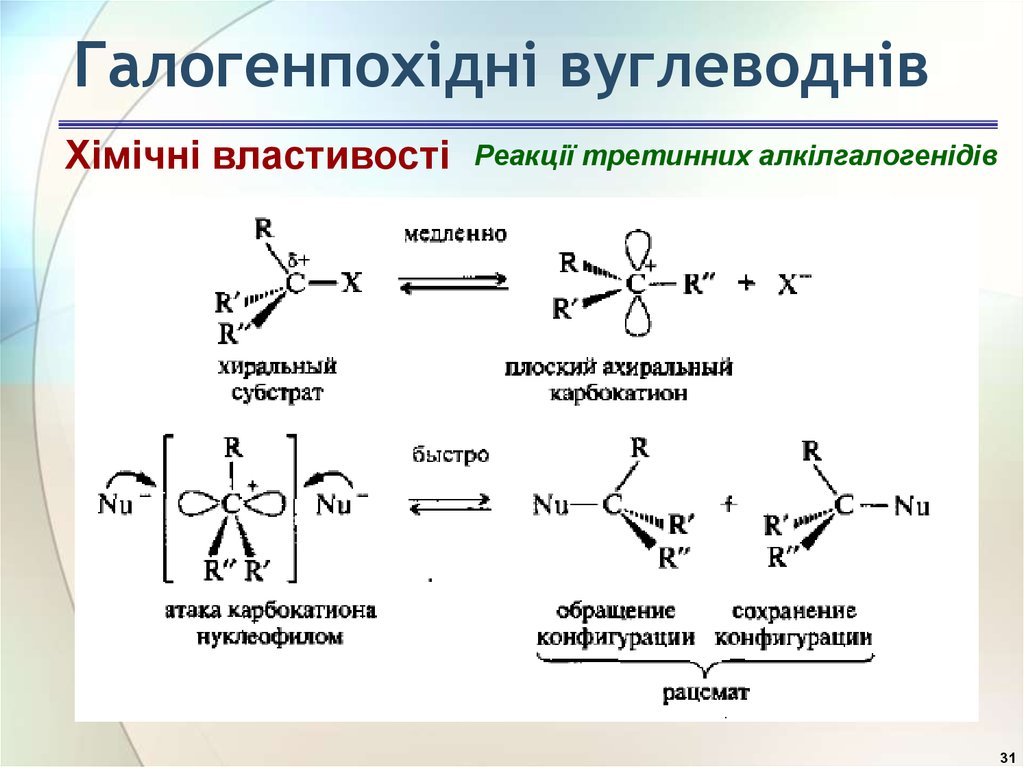
31.
Галогенпохідні вуглеводнівХімічні властивості
Реакції третинних алкілгалогенідів
31
32.
Галогенпохідні вуглеводнівХімічні властивості
Реакції третинних алкілгалогенідів
32
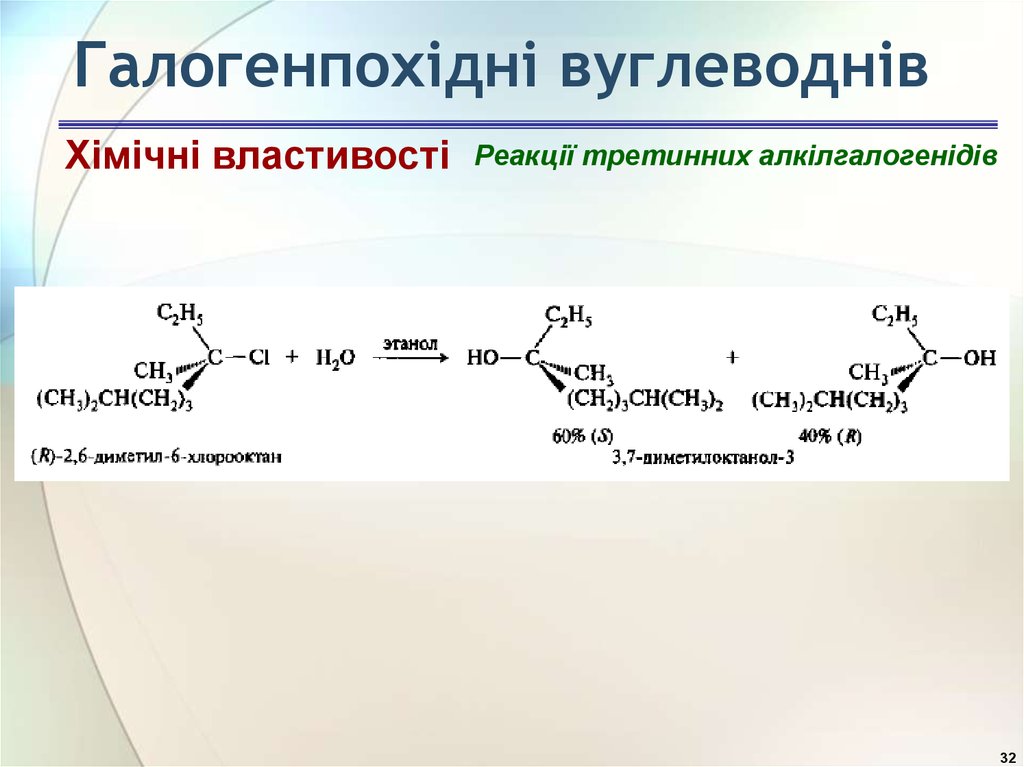
33. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції третинних алкілгалогенідів
CH3+ < CH3CH2+ < CH3CHCH3 < (CH3)3C+ < CH2 CHCH2+ <
< C6H5CH2+ < (C6H5)3C+
33
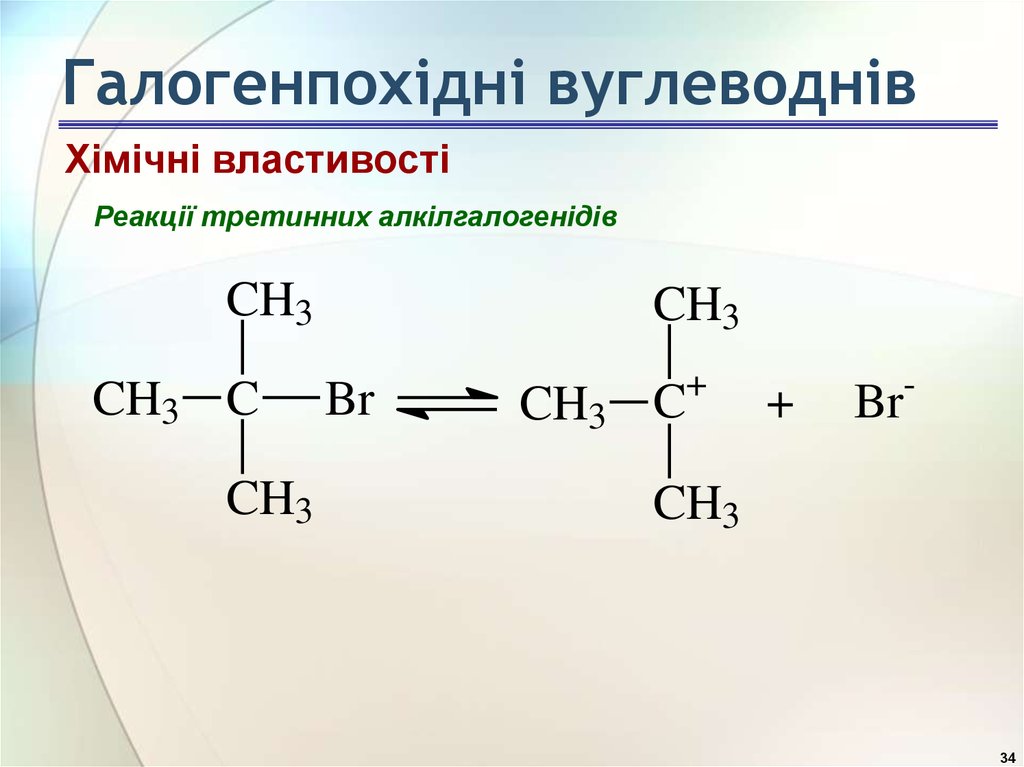
34. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції третинних алкілгалогенідів
CH3
CH3 C
CH3
CH3
Br
+
CH3 C
+
-
Br
CH3
34
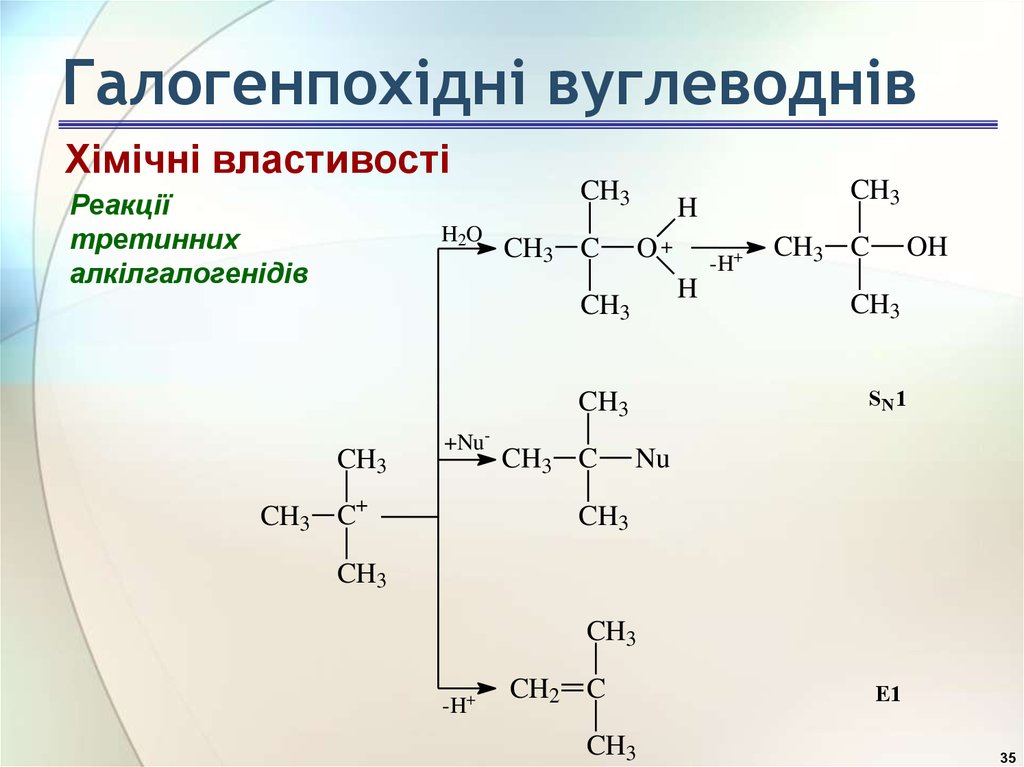
35. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції
третинних
алкілгалогенідів
H2O
CH3
CH3 C
O+
CH3 C+
CH3 C
CH3 C
OH
CH3
S N1
CH3
CH3
-H+
H
CH3
+Nu-
CH3
H
Nu
CH3
CH3
CH3
-H+
CH2 C
CH3
E1
35
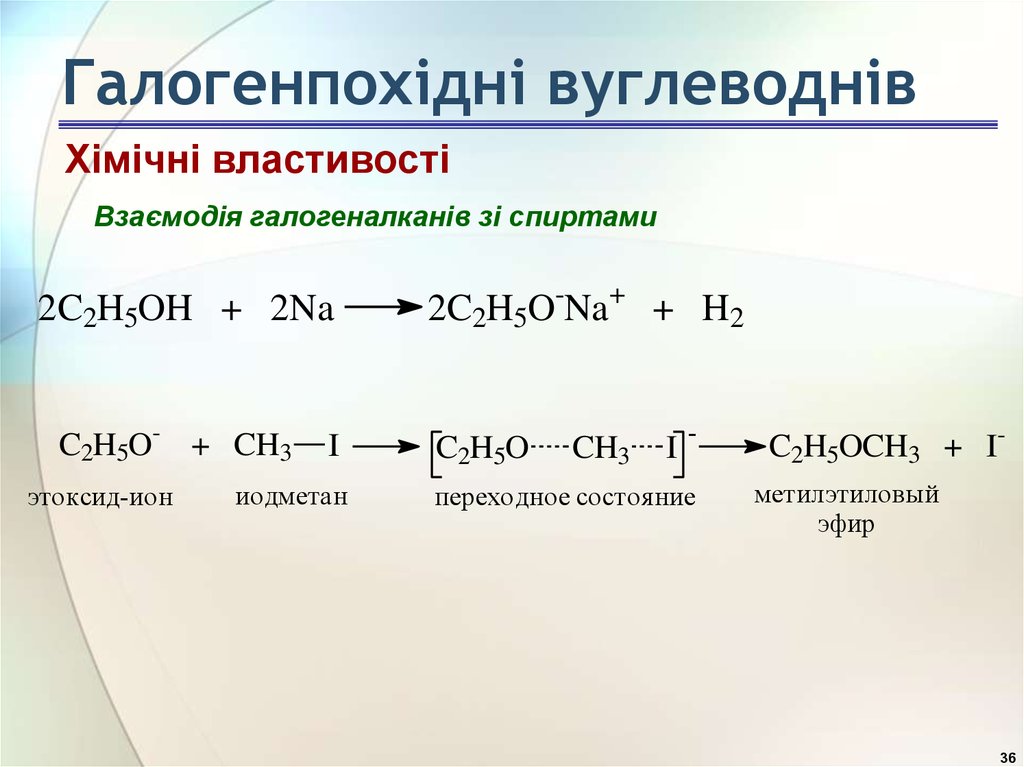
36. Галогенпохідні вуглеводнів
Хімічні властивостіВзаємодія галогеналканів зі спиртами
2C2H5OH + 2Na
C2H5O- + CH3
этоксид-ион
I
иодметан
2C2H5O-Na+ + H2
C2H5O
CH3
I
-
переходное состояние
C2H5OCH3 + Iметилэтиловый
эфир
36
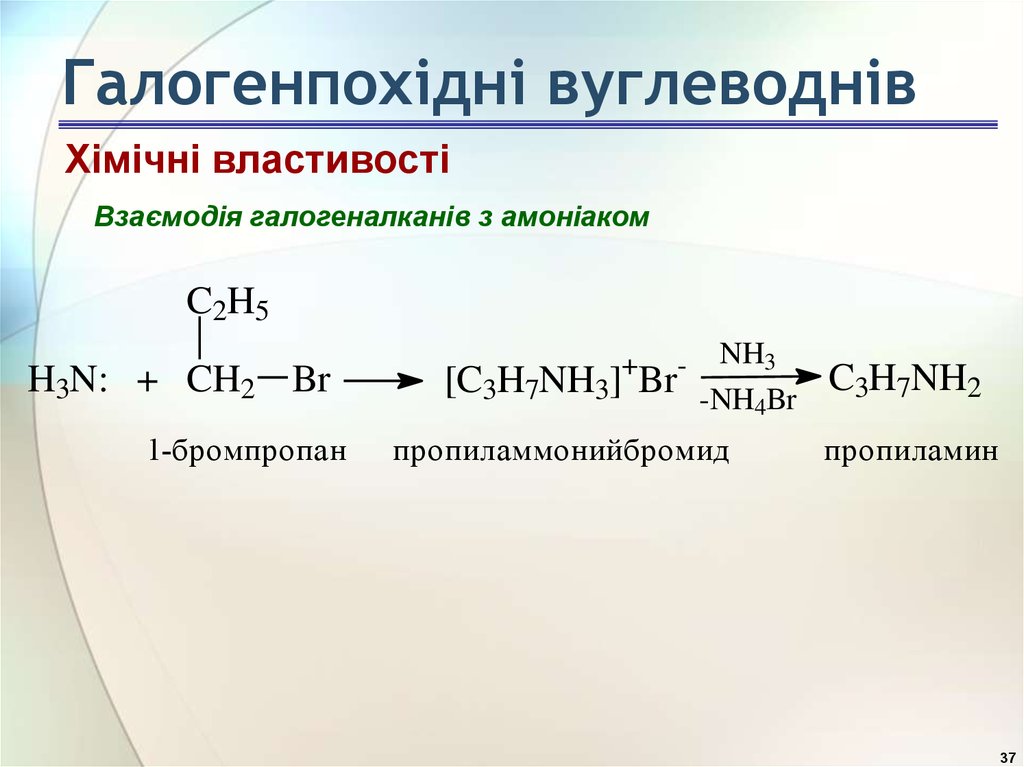
37. Галогенпохідні вуглеводнів
Хімічні властивостіВзаємодія галогеналканів з амоніаком
C2H5
H3N: + CH2 Br
1-бромпропан
+
-
[C3H7NH3] Br
NH3
-NH4Br
пропиламмонийбромид
C3H7NH2
пропиламин
37
38. Галогенпохідні вуглеводнів
Хімічні властивостіВзаємодія галогеналканів з ціанідами
CH3CH2Br + KCN
бромэтан
цианид
калия
-KBr
2H2O
CH3CH2CN -NH CH3CH2COOH
3
пропанонитрил
пропановая кислота
38
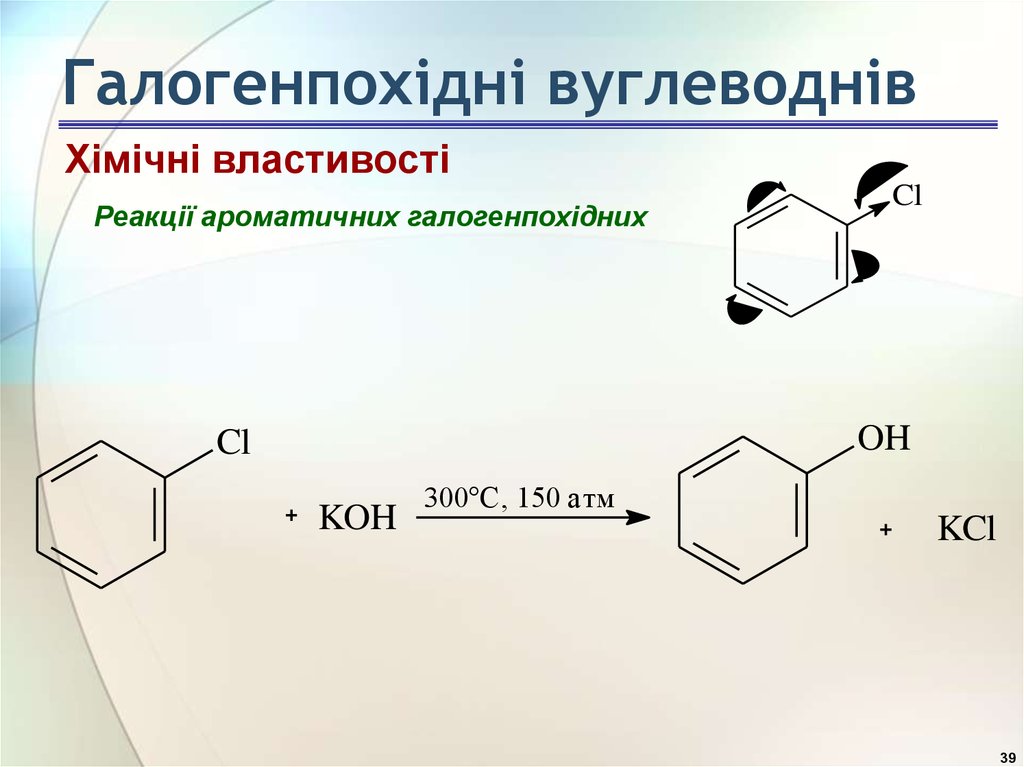
39. Галогенпохідні вуглеводнів
Хімічні властивостіРеакції ароматичних галогенпохідних
Cl
OH
Cl
KOH
300°C, 150 атм
KCl
39
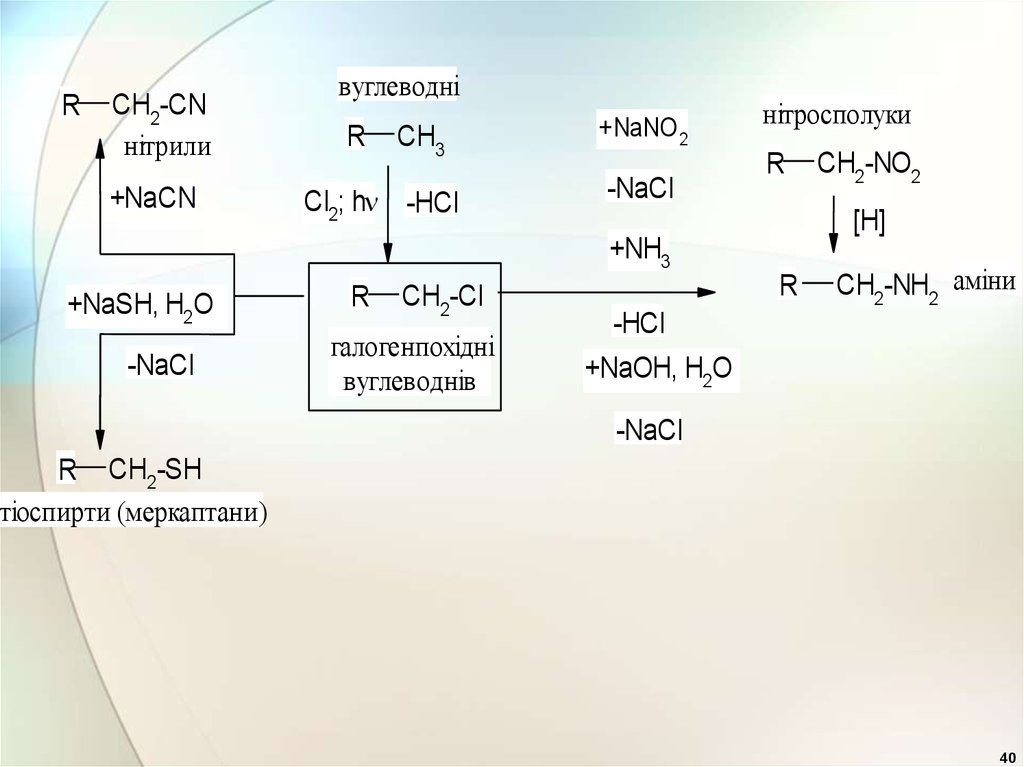
40.
RCH2-CN
нітрили
+NaCN
вуглеводні
R
CH3
Cl2; h -HCl
+NaNO 2
-NaCl
нітросполуки
R
[H]
+NH3
+NaSH, H2O
-NaCl
R
CH2-Cl
галогенпохідні
вуглеводнів
CH2-NO2
R
CH2-NH2 аміни
-HCl
+NaOH, H2O
-NaCl
R CH2-SH
тіоспирти (меркаптани)
40
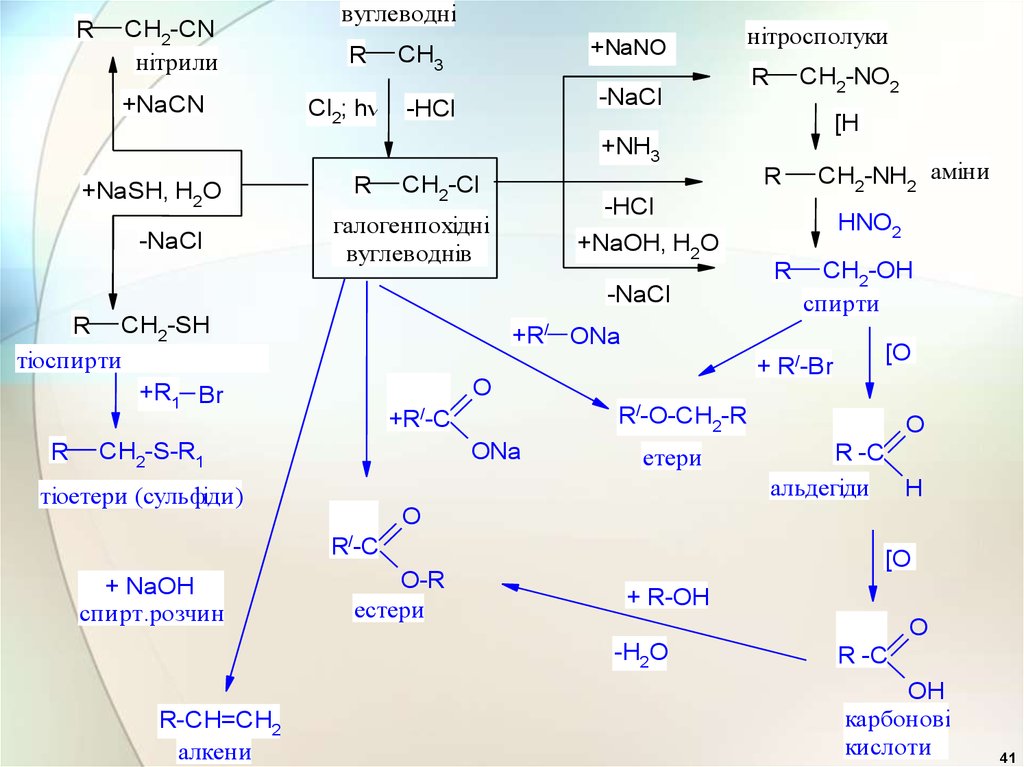
41.
RCH2-CN
нітрили
+NaCN
вуглеводні
R
Cl2; h
+NaNO
CH3
нітросполуки
2
-NaCl
-HCl
CH2-NO2
R
[H
+NH3
+NaSH, H2O
-NaCl
R
R
CH2-Cl
-HCl
галогенпохідні
вуглеводнів
R
R
+ R/-Br
O
[O
R/-O-CH2-R
+R/-C
ONa
тіоетери (сульфіди)
етери
O
R -C
альдегіди H
O
R/-C
O-R
естери
[O
+ R-OH
O
-H2O
R-CH=CH2
алкени
CH2-OH
спирти
+R/ ONa
CH2-S-R1
+ NaOH
спирт.розчин
HNO2
+NaOH, H2O
-NaCl
R CH2-SH
тіоспирти
+R1 Br
CH2-NH2 аміни
R -C
OH
карбонові
кислоти
41
42.
O + NaOHR -CH2-C
O
R -CH2-C
ONa
+ NaOH
сплавлення
OH
+2H2O
R
CH2-CN
нітрили
+NaCN
вуглеводні
R
Cl2; h
+NaNO 2
CH3
нітросполуки
-NaCl
-HCl
CH2-NO2
R
[H]
+NH3
+NaSH, H2O
-NaCl
R
R
CH2-Cl
-HCl
галогенпохідні
вуглеводнів
R
R
+R/
+ R/-Br
етери
O-R
естери
R -C
альдегіди
H
[O]
+ R-OH
O
-H2O
R-CH=CH2
алкени
O
O
R/-C
+ NaOH
спирт.розчин
[O]
R/-O-CH2-R
ONa
тіоетери (сульфіди)
CH2-OH
спирти
ONa
O
+R/-C
CH2-S-R1
HNO2
+NaOH, H2O
-NaCl
R CH2-SH
тіоспирти (меркаптани)
+R1 Br
CH2-NH2 аміни
R -C
OH
карбонові
кислоти
42
43.
Просторова будовабіологічно активних сполук.
44.
СтереоізомеріяСтереоізомери – це сполуки з однаковою
будовою, тобто одним і тим же порядком
сполучення
атомів,
але
відрізняються
розміщенням тих атомів в просторі.
З позиції їх відносної стійкості стереоізомери
поділяють на конфігураційні і конформаційні.
45.
СтереоізомеріяКонфігураційні стереоізомери характеризуються
тим, що можуть існувати у вигляді індивідуальних
форм, тобто їх можна виділити самостійно існуючої
речовини, що має набір певних фізичних і хімічних
властивостей, відмінних від властивостей іншого
стереоізомера.
Конформаційні стереоізомери, або просто
конформації, частіше всього виникають внаслідок
обертання окремих фрагментів молекули навколо
простих -зв’язків. Конформери можуть існувати
тільки разом у вигляді множини геометричних форм
молекули з різним взаємним розміщенням в просторі
окремих атомів і атомних груп.
46.
СтереоізомеріяКонформація – просторове розташування
атомів в молекулі, яке може змінитися при
обертанні і згині зв'язків.
Конфігурація – просторове розташування
атомів в молекулі, яке не може змінитися
при обертанні і згині зв'язків.
47.
Конформації – деякі конформації більшстабільні за інші
48.
Різна конфігурація49.
СтереоізомеріяГеометрична ізомерія
HOOC
HOOC
COOH
C C
C C
H
H
H
малеїнова кислота
(цис-1,2-етандикарбонова кислота)
H
COOH
фумарова кислота
(транс-1,2-етандикарбонова кислота)
CH3
CH3
CH3
CH3
цис-1,2-диметилциклопентан
транс-1,2-диметилциклопентан
50.
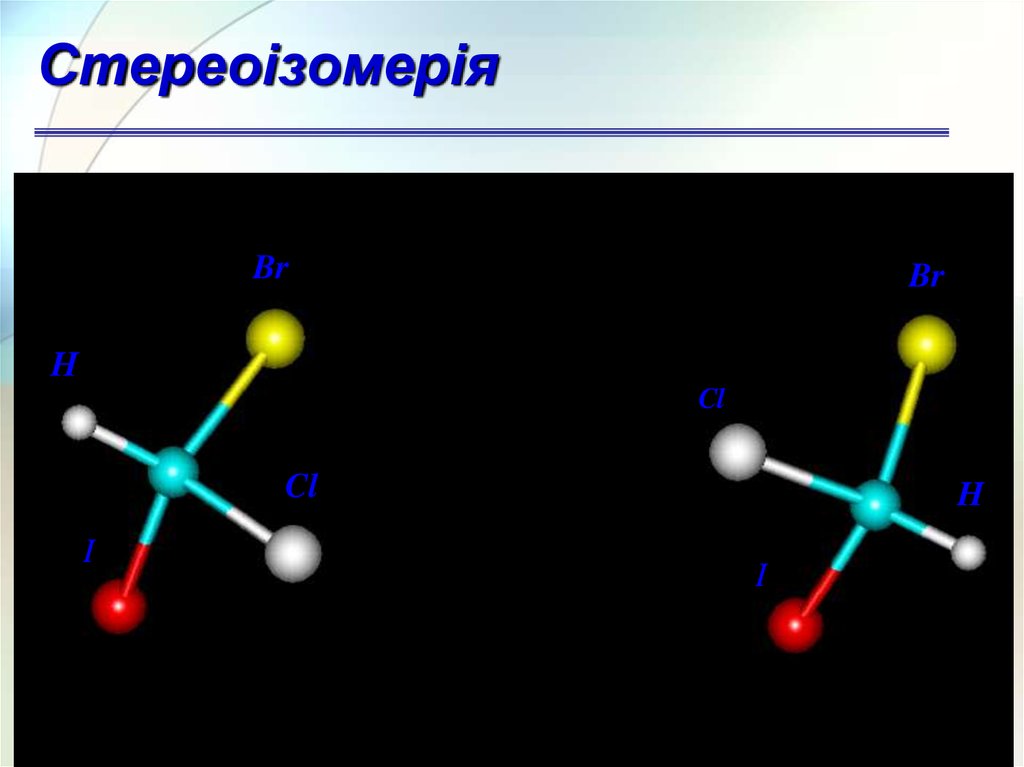
СтереоізомеріяЕнантіомери – це структури, що є дзеркальним
відображенням один одного
Хіральність – це несумісність молекули з її
дзеркальним відображенням
51.
СтереоізомеріяBr
Br
Н
Cl
Cl
I
H
I
52.
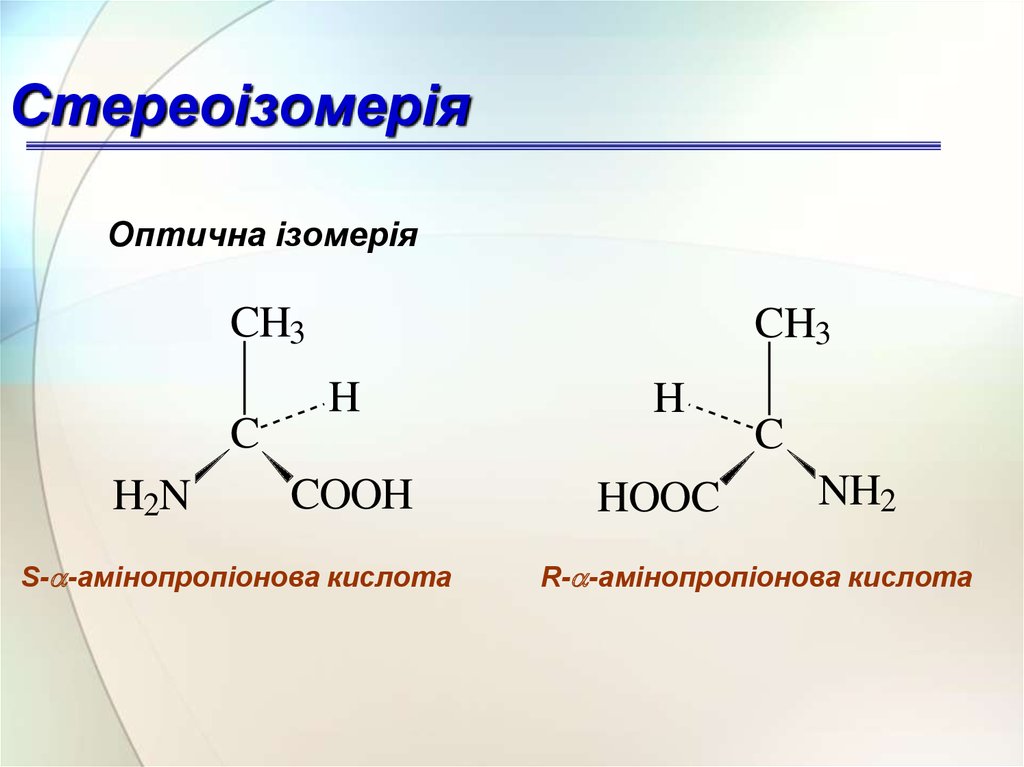
СтереоізомеріяОптична ізомерія
CH3
C
H2N
CH3
H
H
COOH
HOOC
S-a-амінопропіонова кислота
C
NH2
R-a-амінопропіонова кислота
53.
СтереоізомеріяОптична ізомерія
S-a-амінопропіонова кислота
R-a-амінопропіонова кислота
Ізомерія — одне з найбільш особливих проявів
специфіки і особливостей органічної хімії
54.
СтереоізомеріяВ площині
Стереохімічні формули:
За площиною
Перед площиною
бутандіол-1,3
HO
H
CH2OH
H
H3C
H
55.
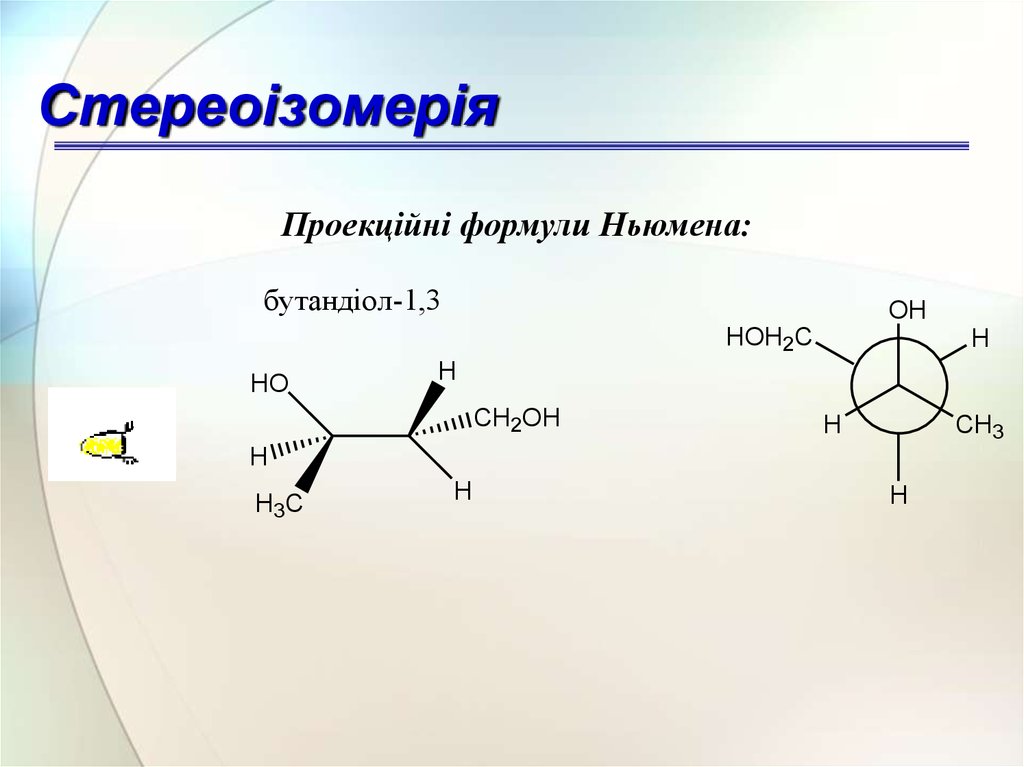
СтереоізомеріяПроекційні формули Ньюмена:
бутандіол-1,3
OH
HOH2C
HO
H
H
CH2OH
H
CH3
H
H3C
H
H
56.
СтереоізомеріяПроекційні формули Фішера:
COOH
COOH
H
COOH
H
HO
CH3
OH
CH3
H
OH
CH3
57.
Стереоізомерія*
Бутанол-2
СН3-СН(ОН)-СН2-СН3
H
*
C
H3C
C2H5
OH
CH3
C
H
CH3
*
C
C 2H 5
*
H
C2H5
OH
OH
Дзеркало
CH3
CH3
H
OH
C2H5
D-ряд
R-бутанол-2
HO
H
C2H5
L-ряд
S-бутанол-2
58.
СтереоізомеріяCH3
H3C
H
CH3
H
HO
C2H5
OH
C2H5
H
OH
C2H5
59.
СтереоізомеріяПросторова будова молекул і їх біологічна активність
В процесі еволюції живої природи виникли оптично активні
сполуки, з яких будувались більш складні біомолекули –
полісахариди, пептиди і білки, нуклеїнові кислоти, ліпіди і т.д. Для
побудови складних молекул природа використовувала один з двох
або декількох стереоізомерів. Наприклад, всі білки побудовані з
амінокислот L-ряду; в склад вуглеводвмісних біомолекул містяться
залишки тільки D-глюкози; в природних об’єктах зустрічається
фумарова кислота, але не зустрічається її -діастереомер –
малеїнова кислота.
Стереоспецифічність ферментативних реакцій.
Відомо, що в процесі гліколізу вуглеводів під дією
ферменту лактатдегідрогенази з двох енантіомерів молочної
кислоти окисненню піддається тільки S-енантіомер –
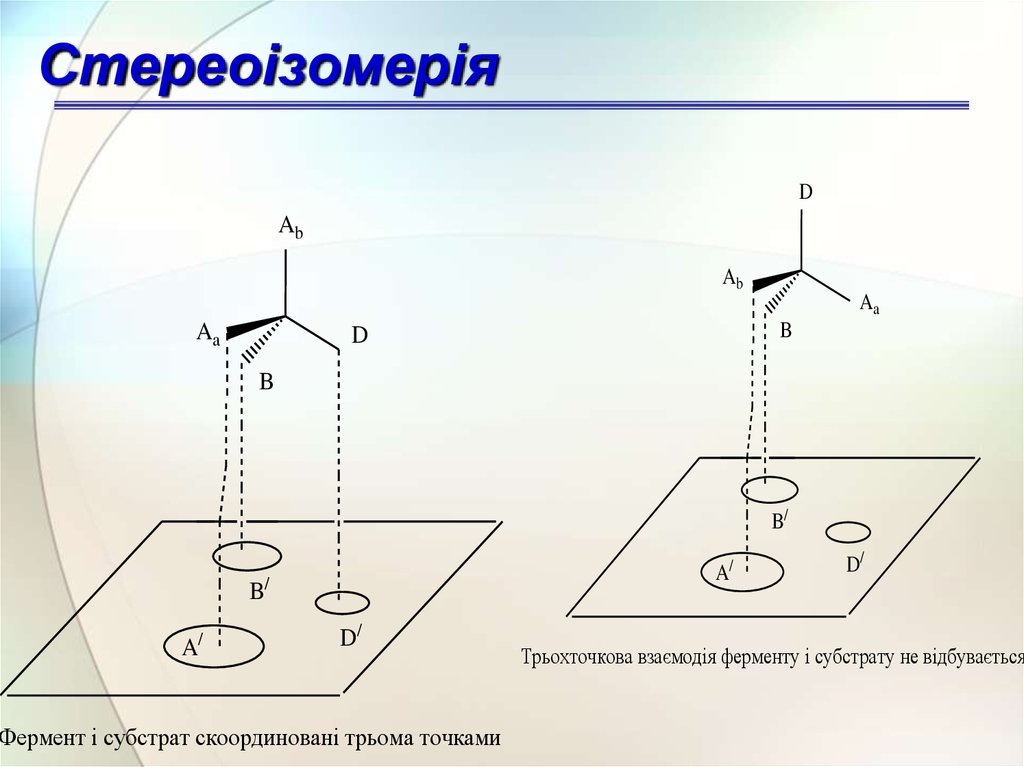
принцип трьох точкової взаємодії.
60.
СтереоізомеріяD
Ab
Ab
Aa
Aa
B
D
B
B/
A/
B/
/
A
D/
Фермент і субстрат скоординовані трьома точками
D/
Трьохточкова взаємодія ферменту і субстрату не відбувається
61.
Стереоізомерія1. Стереоспецифічність біологічно активних речовин.
Всі білки побудовані з амінокислот L-ряду; в склад вуглеводвмісних
біомолекул містяться залишки тільки D-глюкози; в природних
об’єктах зустрічається фумарова кислота, але не зустрічається
її -діастереомер – малеїнова кислота.
2. Стереоспецифічність лікарських засобів.
Фармакологічна дія ліків здійснюється частіше всього в
результаті взаємодії лікарського засобу з клітинним рецептором
– принцип трьох точкової взаємодії.
А) В одних випадках більш активним є R-форма (R-форма
діуретика мефрусиду більш як в два рази активніша за S-ізомер), в
інших – навпаки (S-енантіомер -адреноблокатора пропранолола
(використовують при срцевій недостачі) є більш активним, ніж
R-форма).
62.
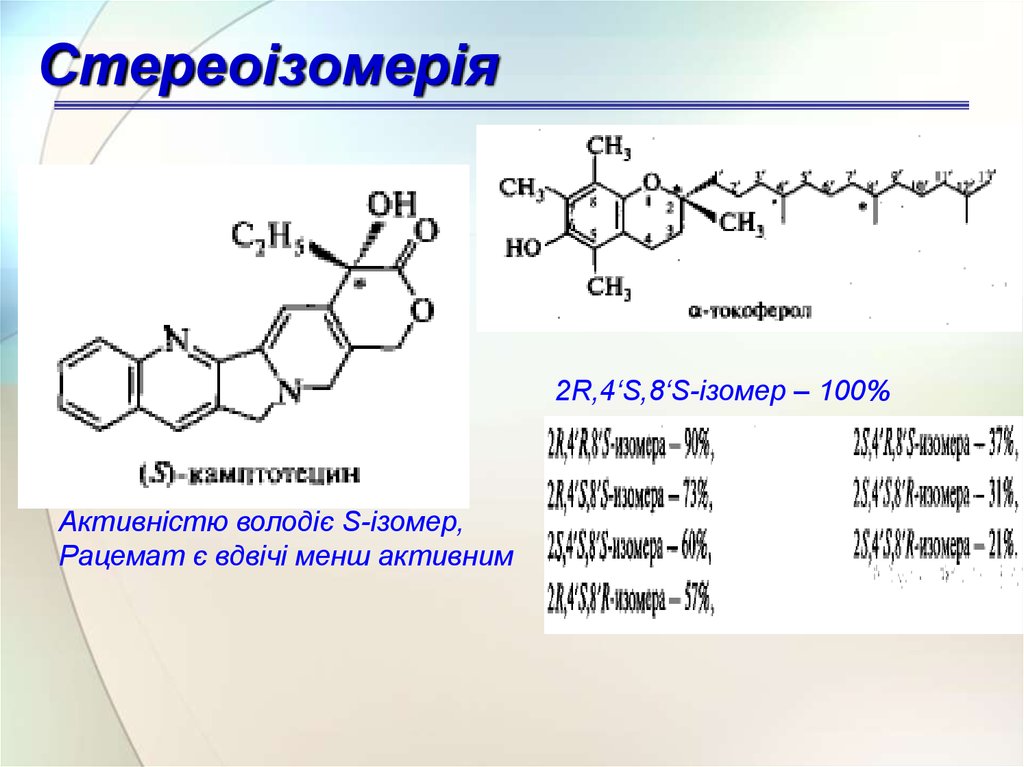
Стереоізомерія2R,4‘S,8‘S-ізомер – 100%
Активністю володіє S-ізомер,
Рацемат є вдвічі менш активним
63.
СтереоізомеріяДомішка лише 1,1% Z-ізомера в статевому феромоні метелика
Rhyacionia buoliana — (Е)-додецен-9-ілацетаті — робить його
практично неактивним. І навпаки, феромон фруктової молі
Grapholitha
molesta (Z)-додецен-8-ілацетат активний лише в присутності
Е-ізомера
64.
СтереоізомеріяБ) Іноді в дослідах in vitro більш активною є Sізомери, тоді як in vivo активність проявляє і R-ізомер
внаслідок обертання конфігурації в процесі метаболізму
(наприклад, протизапальний засіб кліданак).
В) Трагічні випадки з не врахуванням фармакологічної
активності стереоізомерів – препарат талідомід
(Західна Німеччина) окрім снотворної дії, викликав
сильну
тератогенну
і
ембріотокисчну
дію:
ненормальний розвиток плоду у вагітних жінок, у
новонароджених були недорозвинуті кінцівки – таку дію
проявляв тільки S-ізомер.
65.
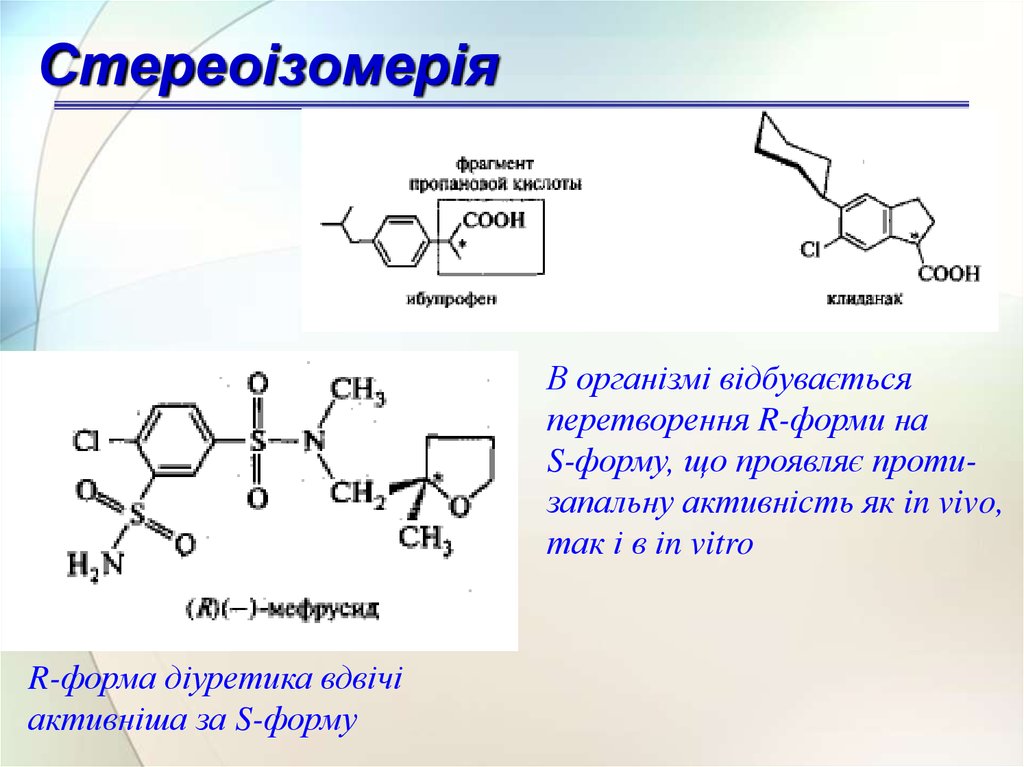
СтереоізомеріяВ організмі відбувається
перетворення R-форми на
S-форму, що проявляє протизапальну активність як in vivo,
так і в іn vitro
R-форма діуретика вдвічі
активніша за S-форму
66.
СтереоізомеріяH
N
O
O O
N
O
(-) Òàë³äî ì ³ä - òåðàòî ãåí
(+) Òàë³äî ì ³ä - òðàí êâ³ë³çàòî ð
67.
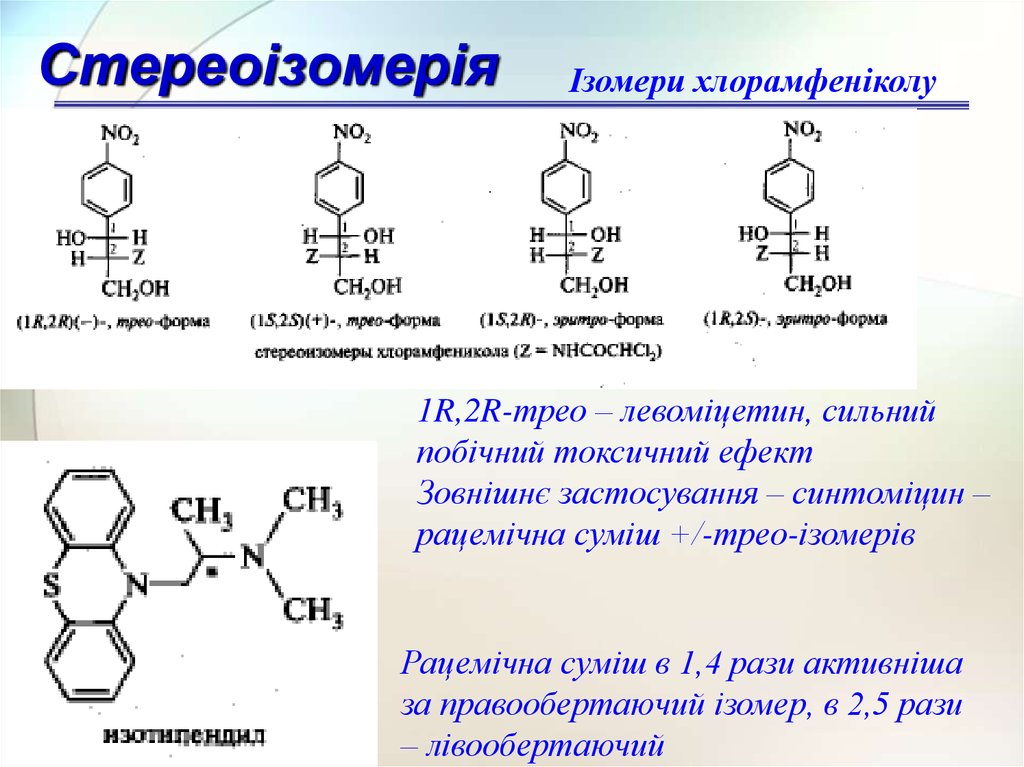
СтереоізомеріяІзомери хлорамфеніколу
1R,2R-трео – левоміцетин, сильний
побічний токсичний ефект
Зовнішнє застосування – синтоміцин –
рацемічна суміш +/-трео-ізомерів
Рацемічна суміш в 1,4 рази активніша
за правообертаючий ізомер, в 2,5 рази
– лівообертаючий

































 Химия
Химия








