Похожие презентации:
Гиалурон қышқылы
1.
2.
Гиалурон қышқылы:СООH
H
O
O
H
H
OH
D-глюкурон қышқыл
қалдығы
O
CH2OH
H
O
OH
O
H
H
NHCOCH3
N-ацетилглюкозамин
қалдығы
3.
Хондроитин- 6-сульфат:СООH
H
O
O
H
H
OH
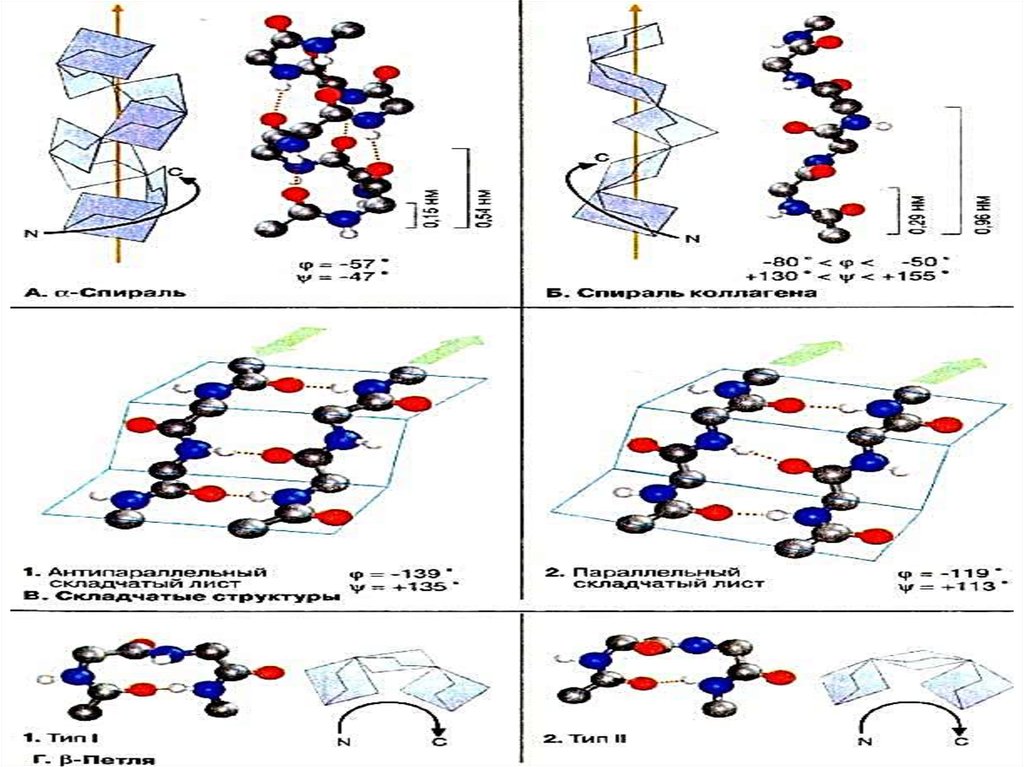
D-глюкурон қышқыл
қалдығы
O
HO3SOCH2
HО
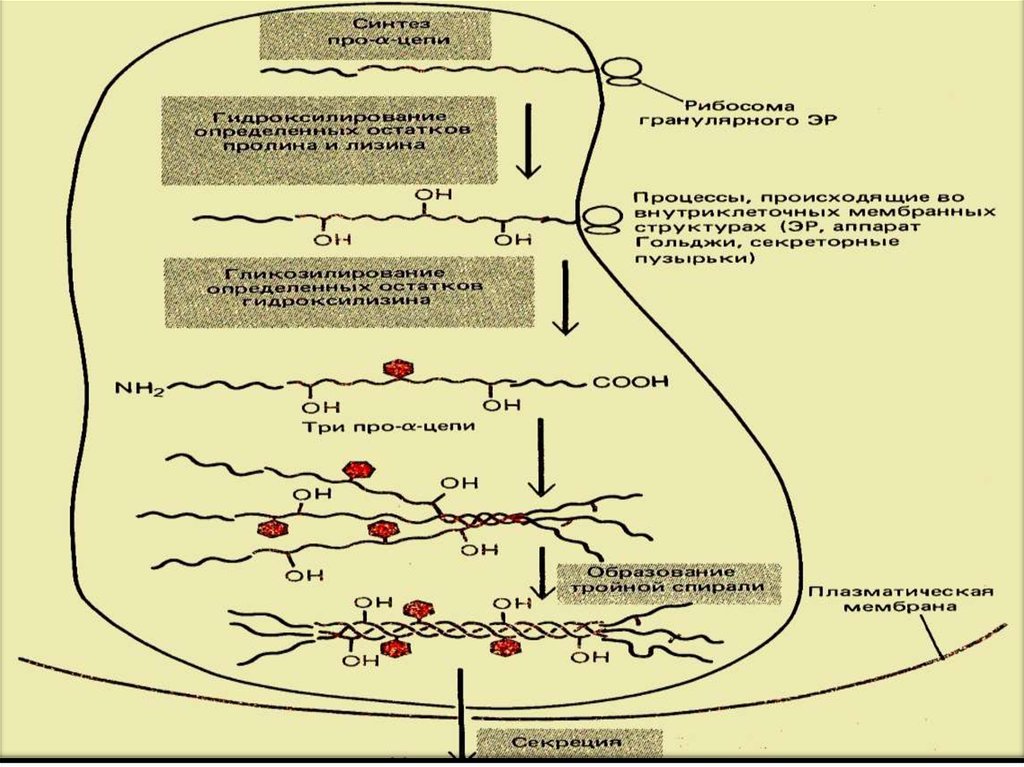
O
H
O
H
H
NHCOCH3
N-ацетилгалактозамин-6- сульфат қалдығы
4.
Дәнекер тініңбиохимиясы.
Мақсатты: Дәнекер
тіннің биохимиясы
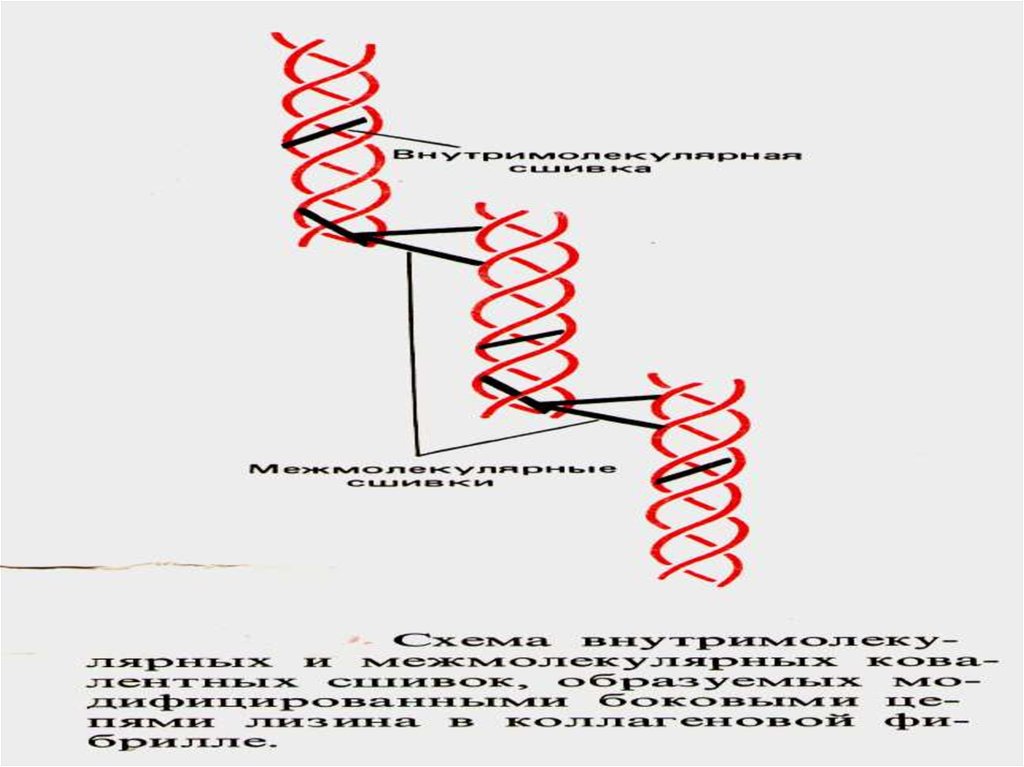
туралы түсінік
қалыптастыру.
5. Жөспар
• Дәнекер тіннің жалпы сипатамасы• Коллаген,
құрамы,құрылысы,міндеттері
• Эластин,
құрамы,құрылысы,міндеттері
• Фибронектин,міндетті
• Коллагеноздар
6.
Дәнекер тіні – ағзаның басты тірек тіні. Ол әртүрлі мү
шелерді сыртанан көмке
ріп тұрады да, оларды бірбірінен бөледі, қан тамыр
ларын,жүйке талшықтарын
қоршап,әртүрлі тіндерді
өзара байланыстырады
7. Дәнекер тіні адам салма ғының 50 % жуығын алады . Ол –шеміршек, сіңір, сүйек, дентин, тері, қан тамырлары, паренхималы мүшелер дің стромалары,
Дәнекертіні адам салма
ғының
50 % жуығын
алады . Ол –шеміршек,
сіңір, сүйек, дентин, тері,
қан тамырлары,
паренхималы мүшелер
дің стромалары, және т.б.
құрамында болады.
8.
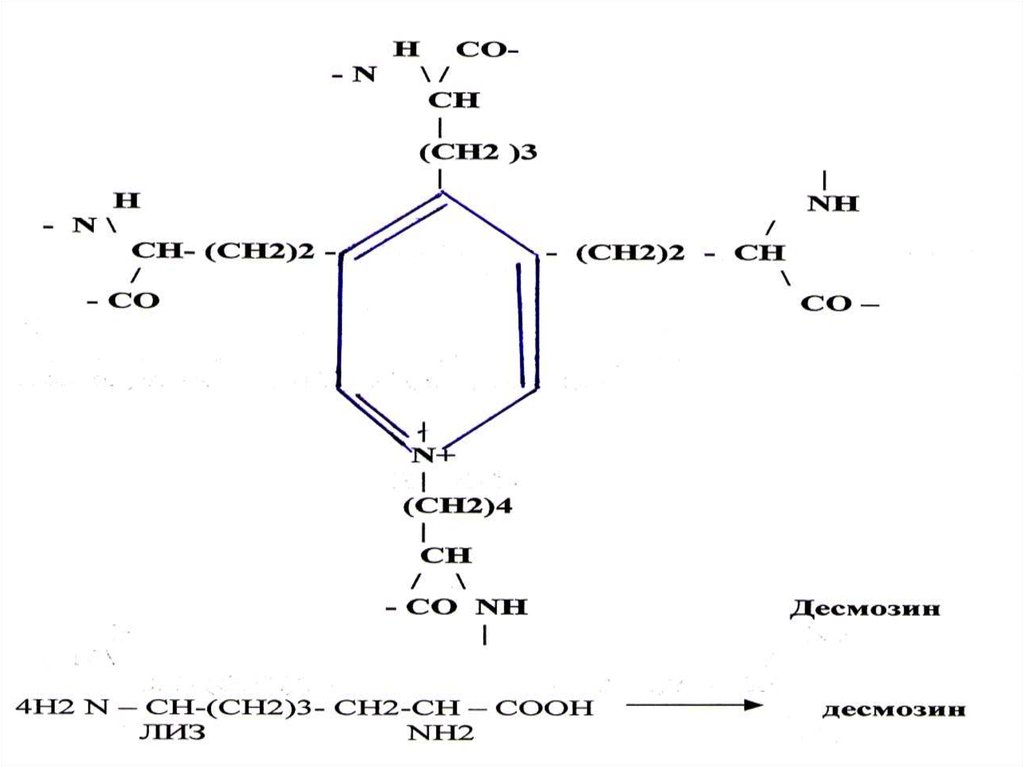
Дәнекер тіннің мөлшері әр мүшелер
де әртүрлі. Теріде,
сүйекте жоғары,
бас мийында,
жұлында өтте аз.
9.
Дәнекер тіннің міндеттері.-
тіректік \
жасушалармен
тіндерді
байланыстырды \
10.
• Трофикалық \ ағзаның ішкіортасын қалыптастыра отыра
тіндердің трофикасын және
метоболиттер элюминациясын
қамтамасыз етеді /
- қорғаныс / токсиндер мен
бактериялық ферменттердің
әсерін тежейді, механикалық
және иммунологиялық
қорғанысты қамтамасыз етеді \
11.
- қор жинақтаушы- липидтерді,минералды тұздарды, суды, био
логиялық белсенді заттарды және
т. б. жинақтайды
- құрылым түзуші- бұл қызметі
коллаген мен
гликозамингликандардын
жасушалардың өсуі мен дамуына
реттеуш әсер етуімен
байланысты
12.
-репаративті- дәнекер тінге жоғары
регенерациондық
қаблетілік тән ,сондықтан
ол әртүрлі факторлардың
әсерінен дамыған
тіндердің бұзылыстары
ның жоилуына қатысады.
13.
Дәнекер тінді жасушааралықматрикс, фибриллярлы жіпше
лер , жасушалар (фиброблас
тар, олардың туындылары
(остеобластар, хондроблас
тар, кератобластар және т.б.),
ретикулоциттер,мезенхималь
ды, толық жасушалар түзеді.
14.
Жасушааралық матрикстың ұйымдасуың
гликозамингликандар,
протеогликандар және
коллагенды талшық
тардың комплекстері
қамтамасыз етеді.
15.
Жасушааралық матрикстыңұйымдасуымен мөлшерлі
құрамы әртүрлі. Сондықтаң
сүйекте, тіcте, тас сияқты
кұрылымдар, көздің
(қарашығында ) кристалдық
ретеулік, сінірде, ( созылуда
мықты), қанат тәpiздi
коллагенді талшықтар пайда
болады. .
16.
Дәнекер тінде жасушааралық матрикстың мөлшері
жоғары, жасушалармен са
лыстырғанда. Сондықтан,
негізінең дәнекер тіннің қа
сиеттерін жасушааралық
матрикстың қасиеттері
анықтайды.
17.
18.
-Базальды мембрана
лар жасушааралық
матрикстің бөлігі. Олар
дан ағзаның бәрі жасу
шалары «өседі» \ тек
дәнекер тіннің , қанның
жасушалары жатпайды\ .
19.
Базалды мембраналардәнекер тінді басқа
тіндерден бөледі.
Дәнекер тінің жасуша
лары базалді
мембрана мен
байланыспайды.
20.
Дәнекер тіндежасушааралық матрикстың
мөлшері жоғары, жасуша
лармен салыстырғанда.
Сондықтан, негізінең
дәнекер тіннің қасиеттерін
жасушааралық
матрикстың қасиеттері
анықтайды.
21.
Жасушааралық заттыңміндеттері:
• пролиферацияға қатысу
• жасушалардың дифферен
цировкасына қатысу
• мұшелер пішінің қалыпта
суымен сақтануына қатысу
• және т.б.
22.
Жасушааралық матрикстыңұйымдасуымен мөлшерлі
құрамы әртүрлі. Сондықтаң
сүйекте, тіcті, тас сияқты
кұрылымдар, көздің (
роговицасында ) кристалдық
ретеулік, сінірде, ( созылуда
мықты), қанат тәpiздi
коллагенді талшықтар пайда
болады.
23.
24.
Жасушааралық матрикстыңкомпоненттері бірі-бipiмен
байланысып тініннің бipiкен
жүйесін түзеді. Ал
гликозамингликандар
және протеогликандар
жасушааралық матрикстың
гидратталған гелін (негізгі
затты) түзеді.
25.
Полисахаридты гельдің су фазасы қанмен
жасушалардың арасын
да нәрлі заттардың ,
мeтaбoлиттepдiң ,гор
мондардың диффузия
сын қамтамасыз етеді.
26.
Негізгі затта коллагенталшықтары орнала
сады. Олар матриксты
бекітеді және реттейді.
Матрикста орналасқан
эластин оған созыл
ғыштықты енгізеді.
27.
28.
Негізгі затта коллаген талшықтары орналасады. Олар
матриксты бекітеді және
реттейді. Матрикста
орналасқан эластин оған
созылғыштық енгізеді. Ал
матрикстің компоненттерінің
біріктіруінде фибронектиннің
маңызы өте зор.
29.
Коллаген. . Коллагеназа.Коллаген, коллаген талшықтар
ының негізгі фибриллярлы
белогы ( гликопротеин ). Тіндерді
байланыстырады.
Қасиеттері. Құрамында:
1. әрбір үшінші аминқышқылы
глицин ( 33 % ).
30.
2. басқа белоктарда кездеспейтін оксипролин,
оксилизин бар.
3.пролин,оксипролинның
мөлшері жоғары
23 %
оксилизин
10 %.
4. три ,мет мөлшері аз.
31.
Коллаген \гликопротеин\• Коллагенның полипептидті
тізбектерінде үшпептидтер
(Gly- Х- Y)
қайталанады.
Оларда бір аминқышқыл
глицин (Gly), ал екеуі
( Х немесе Y ) пролин
немесе
оксипролин
32.
Коллаген 3 а –полипептидтерден
тұрады. Олардың
ерекше аминқышқыл
дық құрамы кeлeci
мүмкіндіктерді
қамтамасыз етеді :
33.
а - спиральданбасқа ерекше
түрлі ғажайып
үштік
спиральдiң
түзілуін
1.
34.
35.
Коллагеннің түрлерігенетикалық әртүрлі 7 а тізбектермен
анықталады. Олардың
бірігуіне байланысты,
коллагенның генетикалық
әртүрлі 10 артық
түрлерін ажыратады.
.
36.
Ағзада жиі кездесетінколлагенның I түрі
( 90 %). IY түрі
базальды
мембраналарда және
тағы басқаларда .
37.
Коллагенның биосинтезі /негізінен фибробластар
да /. Ең алдымен рибосо
мада про-а–тізбектер
синтезделеді. Оларда С
және N шеттерінде
қосымша пептидтер
болады.
38.
Арығарай про-а- тізбектер посттрансляцион
дық өзгерістерге ұшы
райды: про мен лиз
кейбір қалдықтары
гидроксильденеді.
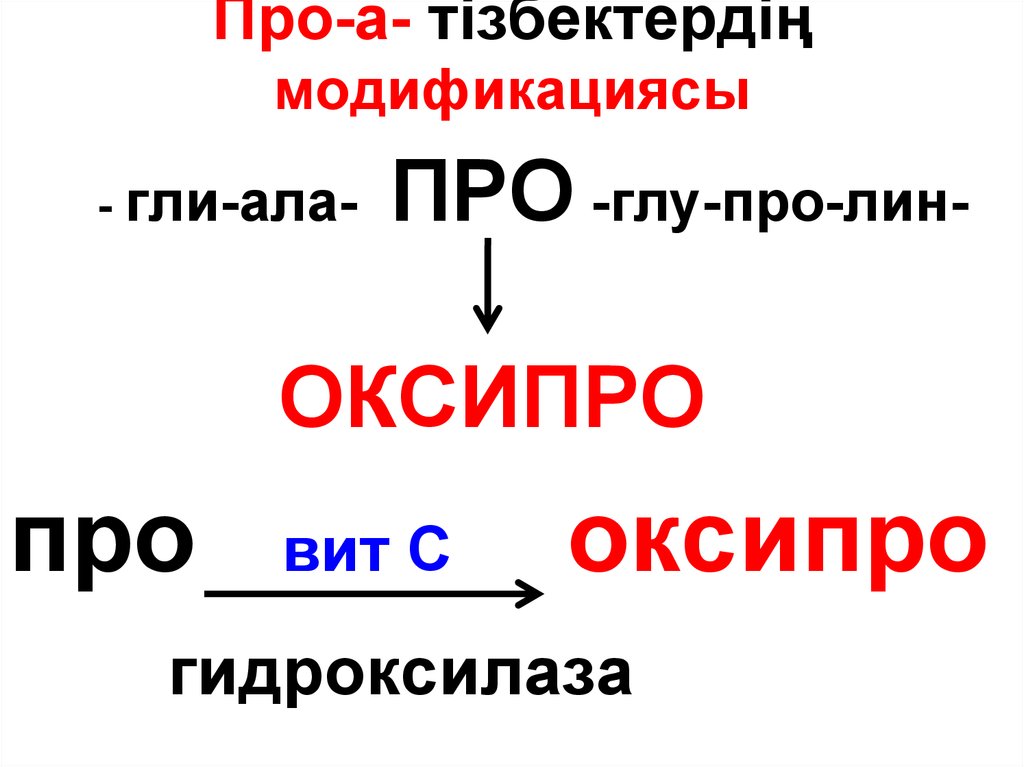
39. Про-а- тізбектердің модификациясы
- гли-ала-ПРО -глу-про-лин-
ОКСИПРО
про
вит С
оксипро
гидроксилаза
40.
ОКСИПРОгидроксильді топтары
сутекты байланыстар
ды түзіп, үштік
спиральдің тұрақты
лығың қамтамасыз
етеді.
41.
Про- а - тізбектерделизинның кейбір
қалдықтарының
гидроксильденуі
42.
-NH - С=О-NH - С=О
|
|
СН-NH
СН-NH
|
|
(СН2)2
(СН2)2
|
вит С [ O ]
|
СН2
СН- ОН
|
гидроксилаза
|
СН2
( Fe++)
СН2
|
|
NH - CОNH - CО-( лизин )- ( оксилизин )-
43.
Гидроксилиз окситоптарыпроколлаген молекуласы
ның гликолизденуіне
\гидроксилиз окситопта
рына қысқа олигосаха
ридтер қосылады / және
коллагенді фибрилласы
түзілу үшін қажет.
44.
Вит.С /цинга\ , оттек, темір жетіспеушілігінде
проколлагенның спи
ральдері түзілмейді. Жа
сушаларда про-а-тізбек
тер ыдырайды, нәтижесін
де терінің, қан тамырлары
ның бұзылыстары байқалады
45.
Про-а -тізбектерсутекті байланыс
арқылы қосылып
3 - спиральді
проколлаген
түзеді.
46.
47.
Жасушадан тыс кеңістікте I, II,III типті проколлагеннен,
проколлагенпептидазаның
әсерімен, қосымша пептидтер
бөлініп коллаген ( немесе
тропоколлаген )
түзіледі. IV және V түрлі
проколлагендер
ыдырамаған күйінде қалады.
48.
Тропоколлагенның түзілуі оның молекуласын
дағы лизин және оксилиз
аминтоптарының
альдегидті топтарға
тотуғуымен
белсендіріленеді.
дейин
49.
50.
Аальдегидті топтарарқылы
тропоколлагенның
жеке молекулалары,
ковалентты
байланыстар
арқылы өзара
байланысады
51.
52.
53.
Коллагенның \тропоколлагеннің \ молекулалары
қосылып коллагенді
фибриллаларды түзеді.
Коллагенге (немесе
тропоколлагенге )
жартылай өзбетімен
жиналу мүмкіндік тән.
54.
Олар фибриллаларда «басы» -
«аяғы » түрі бой
ынша параллель
ді түйіндер түрін
де орналасады.
55.
56.
57.
Коллагендіфибриллалар
топтасу арқылы
коллагенді
талшықтарді
түзеді.
58.
Олардың бұзылыстары коллагенның мық
тылығың төмендеті.
Нәтижесінде тері,
сінір, қан тамырлар
дың бұзылыстары
байқалады.
59.
60.
61.
Коллаген метаболизмінің жалдамдығы жасқа,
тіннің түріне, тағамға
тәуелді. Коллагенның
ыдырауы тінді колла
геназалардың және
лизосомды ферменттер
дің әсерімен жүреді.
62.
Коллаген ыдырап оныңфрагменттері пайда
болады.
Арығарай олар экзо-және
эндопептидазалармен
бос аминқышқылдарға
дейін ыдырайды.
63.
Коллагеныдырауының
жылдамдығының
көрсеткіші –қанда бос
және пептидтермен
байланысқан оксипро
нинның мөлшері.
64.
Тіндік коллагеназалардың белсенділігі бip ка
тар ауруларда жоғар
лайды ( ревматоидты
артрит, кейбір iciк
тер , терінің ауру
лары).
65.
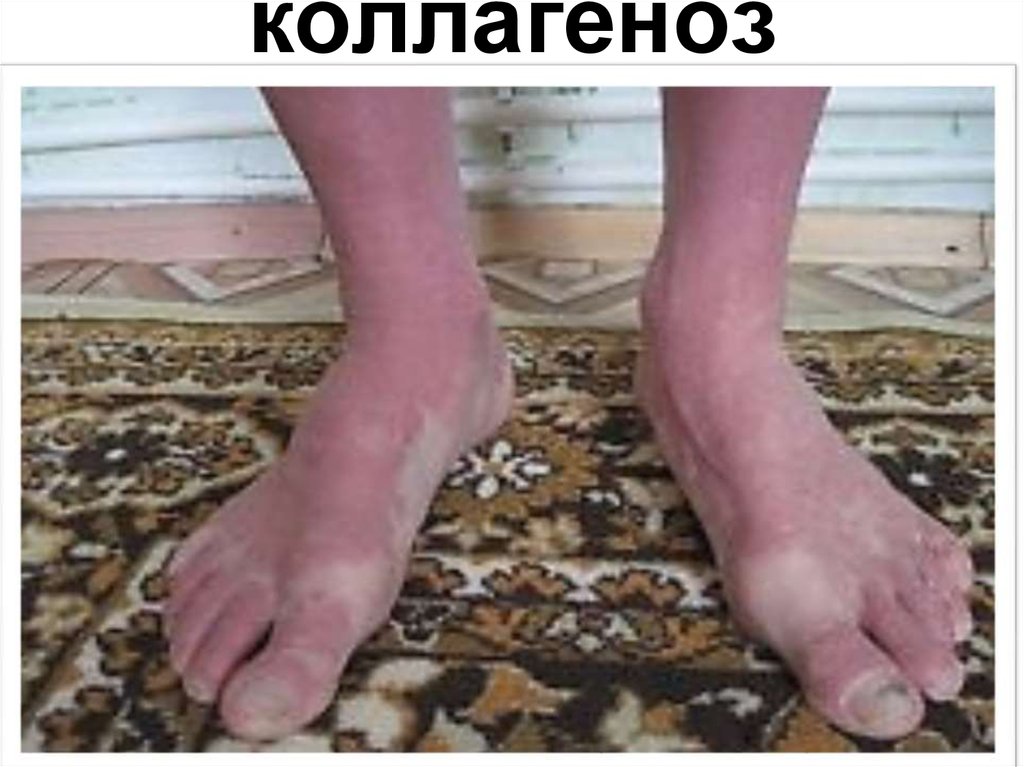
Коллагеноз – дәнекер тінніңқұрылымының өзгеруімен,
коллагеннің синтезі және
басқа да алмасу процесінің
бұзылуымен байланысты
болатын аурулар тобы
(қызыл волчанка,
ревматизм, склеродермия,
дерматомиозит, т.б.).
66. коллагеноз
67.
Ревматизм –стрептококкты
инфекциялар туғыза
тын дәнекер тіннің
иммундық қасиетінің
төмендеуінен
туатын ауру.
68.
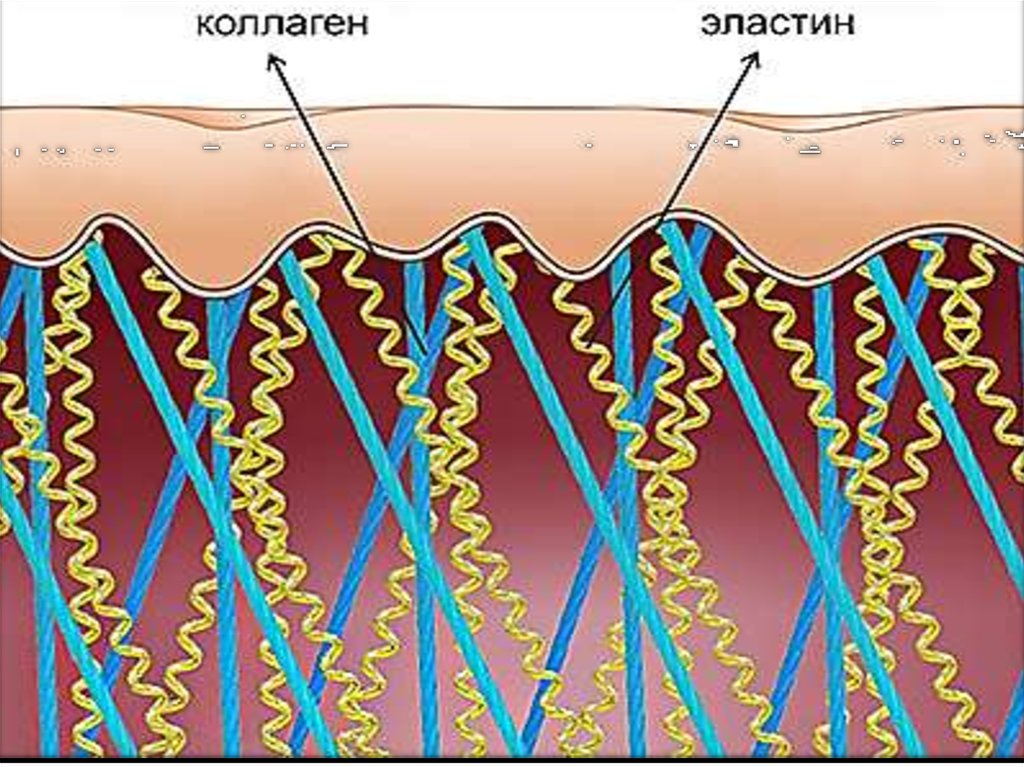
Эластин – эластикалық талшықтардың
негізгі белогі (глико
протеин).
Сары жасушаларда
синтезделеді.
69.
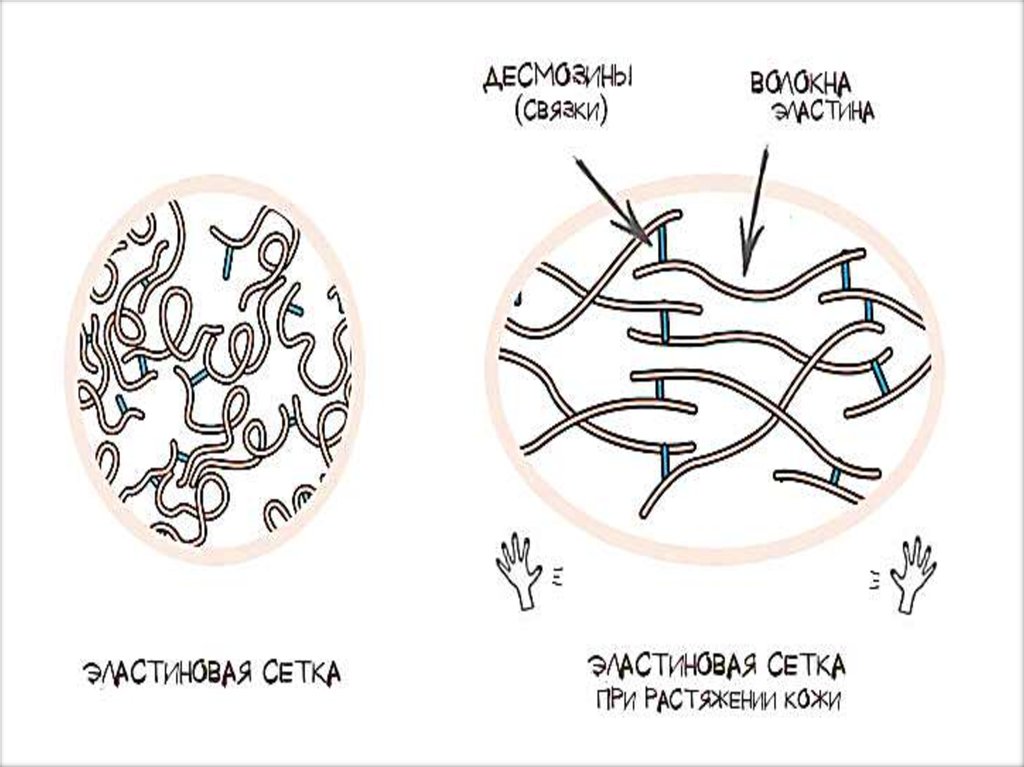
Эластинның молекулалары ковалентты
тігістер арқылы кең
тор түзіп, бip қатар
тіндepдiң
созылғыштығың
қамтамасыз етеді
70.
\ өкпе, қантамырлар, аорта,
сінірлер, ішек,
қуық, асқазан
және т.б.\ .
71.
72.
Эластинның құрамында пролин, глицин көп, гидроксипро
лин аз, гидроксилизин жоқ.
Эластинның фибрилласының
негізгі сүббірлігі- тропоэластин
Ол а - спираль мен коллагенді
спиральдан айырмашылығы
бар ерекше түрлі спираль
түзеді.
73.
Тропоэластинның молекуласы гли қалдықтары мен бай
спиральді белшек тер
ден тұрады. Олар ала және
лиз қалдықтарынан тұратын
қысқа бөлшек
термен бөлінеді
ӨТте
74.
Керу кезіндеспиральді белшектер
ұзарады, бірақ жүкті
алып тастағанда
қайтадан өзінің
қалыпты ұзындығына
келеді.
75.
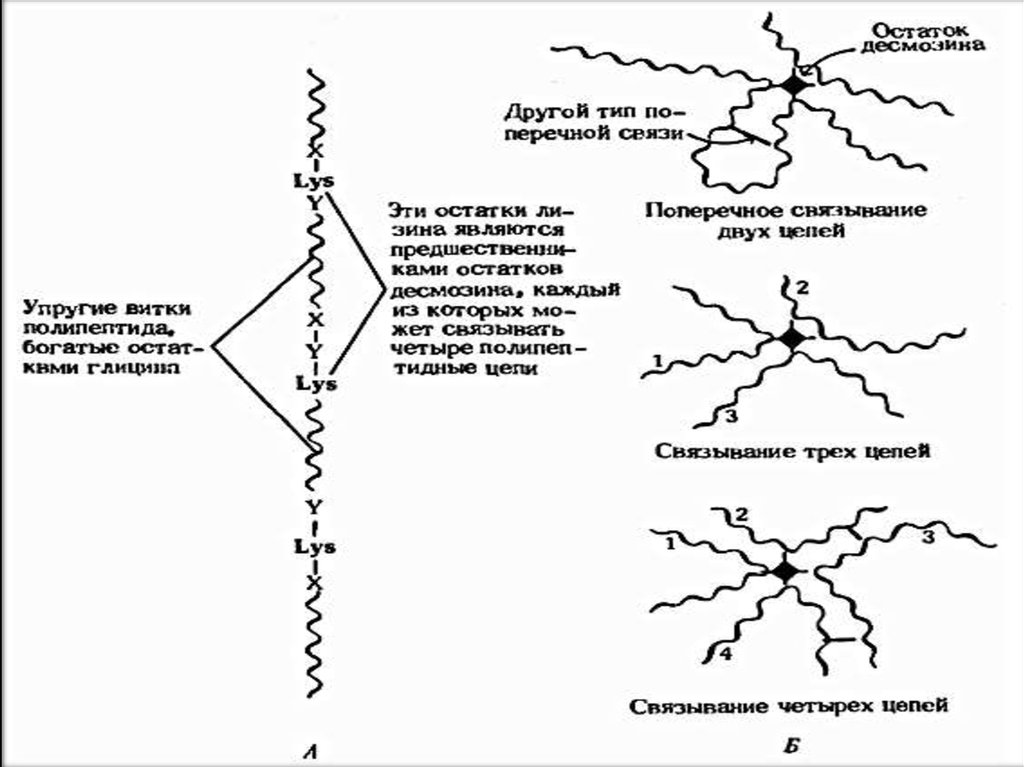
Лизин қалдығы бар бөлшeктep коваленті байлаыс
тардың түзілуіне қатнасады.
Лизинның 4 радикалды топ
тары 6ip - бірімен жақдында
сып десмозин немесе
изодесмозин ( минорлы
аминқышқыл ) түзеді.
76.
77.
Олартропоэластинның 3-4
полипептидтік тізбек
терін байланыстыра
ды. Сондықтан
эластин барлық
бағытта созылады.
78.
79.
Керу кезіндеспиральді белшектер
ұзарады, бірақ жүкті
алып тастағанда
қайтадан өзінің
қалыпты ұзындығына
келеді.
80.
81.
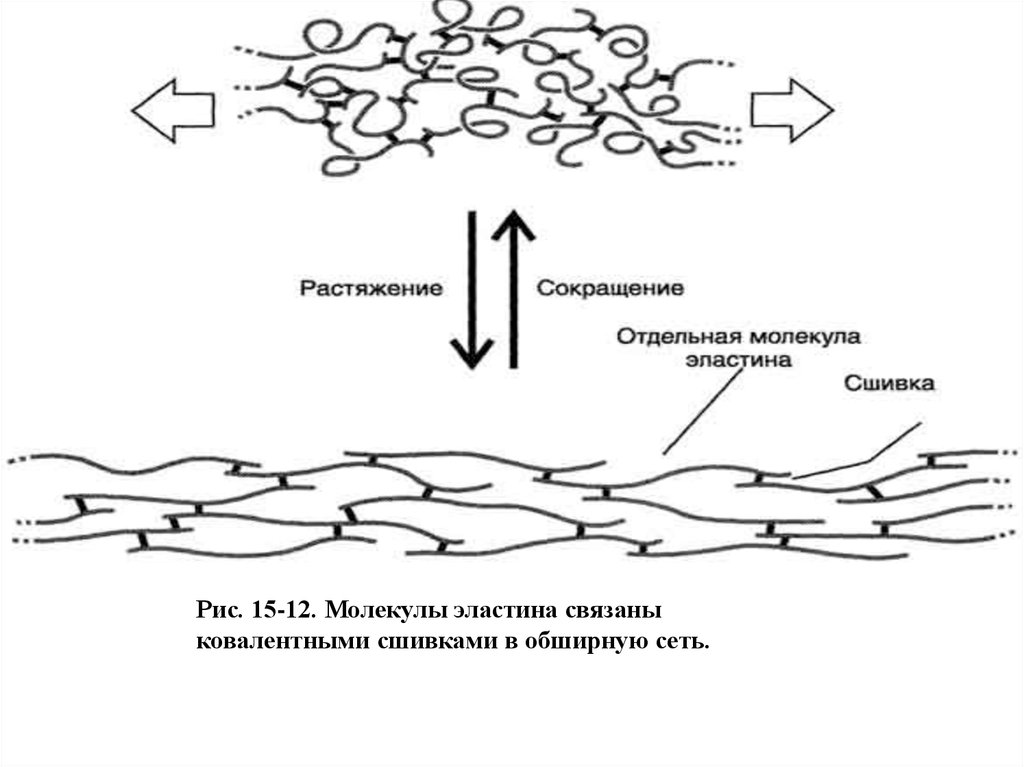
Рис. 15-12. Молекулы эластина связаныковалентными сшивками в обширную сеть.
82.
Эластикалық торлардамықты коллагенды фиб
риллалар болады. Олар
бүтін тордың созыл
ғыштығын шектеп,
тіннің
бұзылуының
алдын алады.
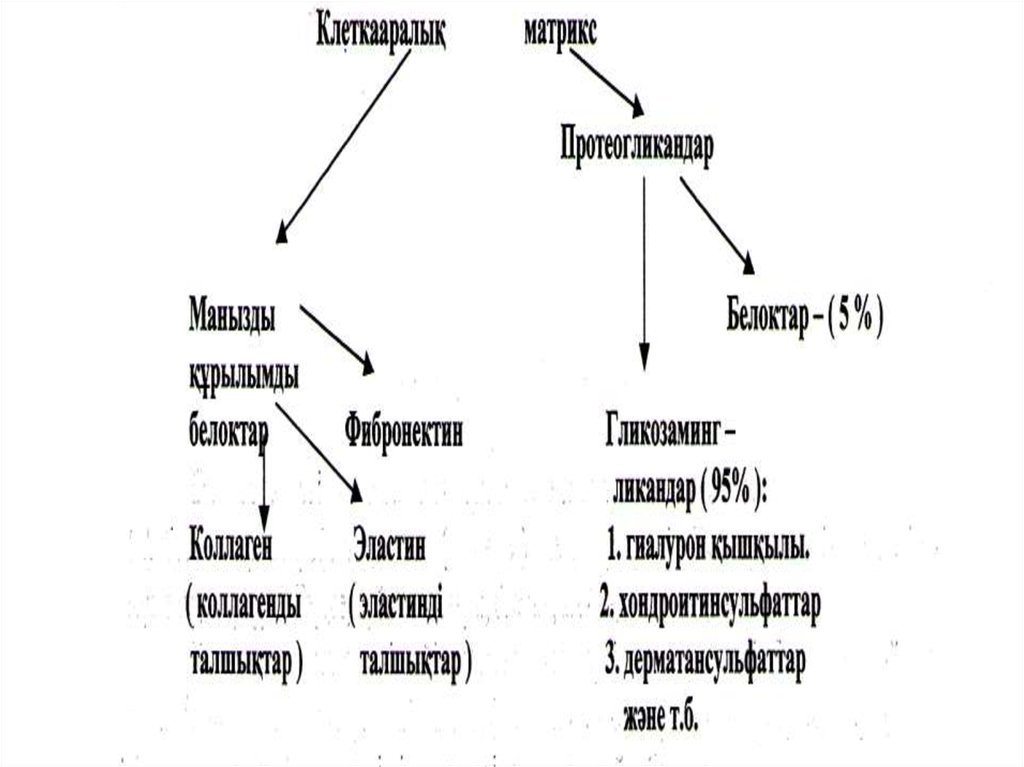
83. Дәнекер тінің гликозамингликандарымен протеогликандары
Гликозамингликандар –биополимерлер.
Протеогликандар –
дәнекер тіндердің
1/3 бөлігін құрайды. Олар белоктар
дан- 5%, 95% гликозамингликандардан
(мукополисахаридтер)- %
тұратын комплекстер.
84.
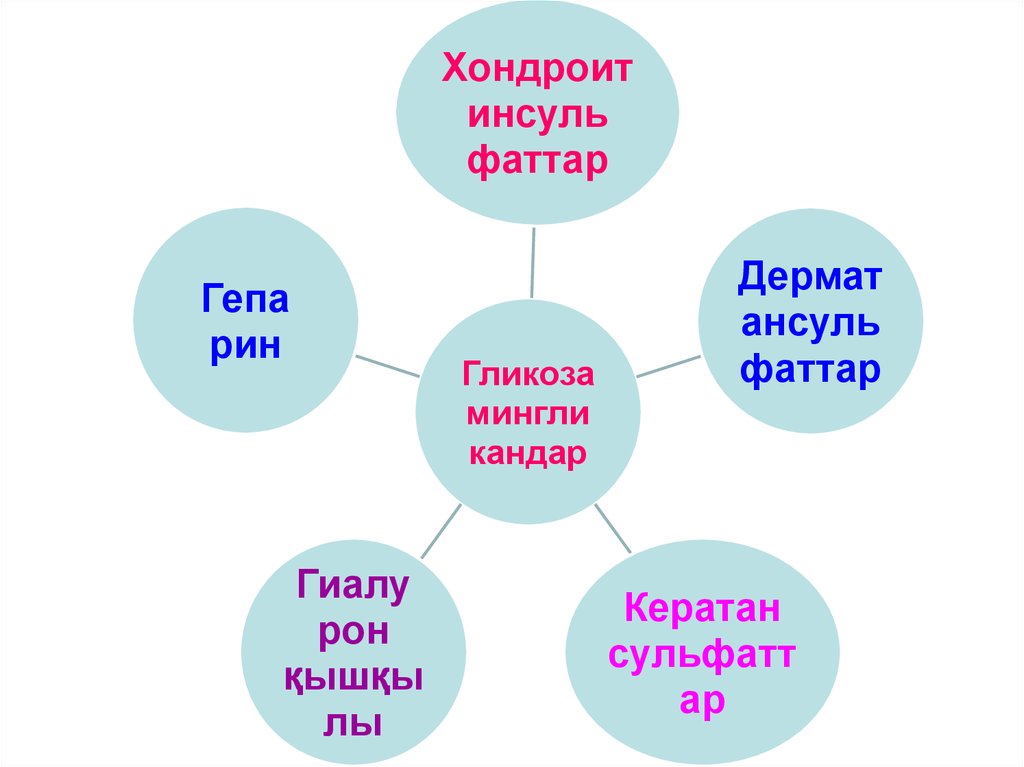
ГликозамингликандарГиалурон қышқылы
Хондроитинсульфаттар
Дерматансульфаттар
Кератансульфаттар
Гепарин
85.
Хондроитинсуль
фаттар
Гепа
рин
Гиалу
рон
қышқы
лы
Гликоза
мингли
кандар
Дермат
ансуль
фаттар
Кератан
сульфатт
ар
86.
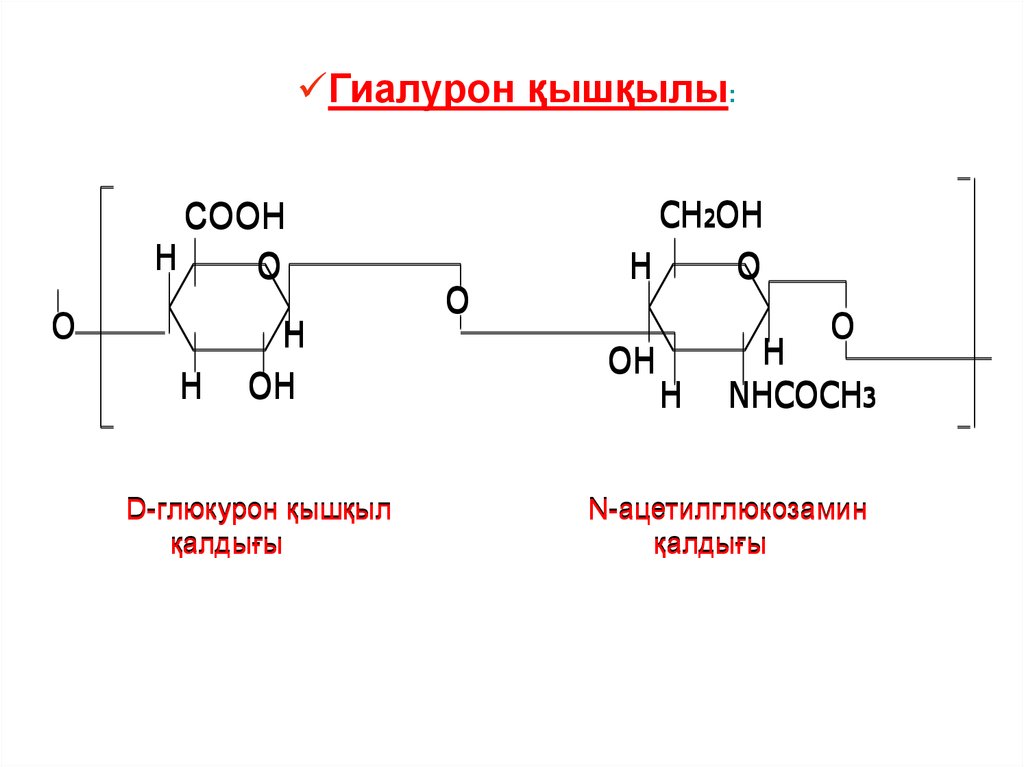
Гиалурон қышқылы:СООH
H
O
O
H
H
OH
D-глюкурон қышқыл
қалдығы
O
CH2OH
H
O
OH
O
H
H
NHCOCH3
N-ацетилглюкозамин
қалдығы
87.
Гиалурон қышқылдыгиалуронидаза
ыдыратады.
Бул ферментті белгілі
бактериялар, оның ішінде
ауруларды шақыртатың бөледі.
Нәтижесінде тіндерге
бактериялардың , оның ішінде
ауруды шақыртатың енуі
женілденеді. Салдары: ауру .
88.
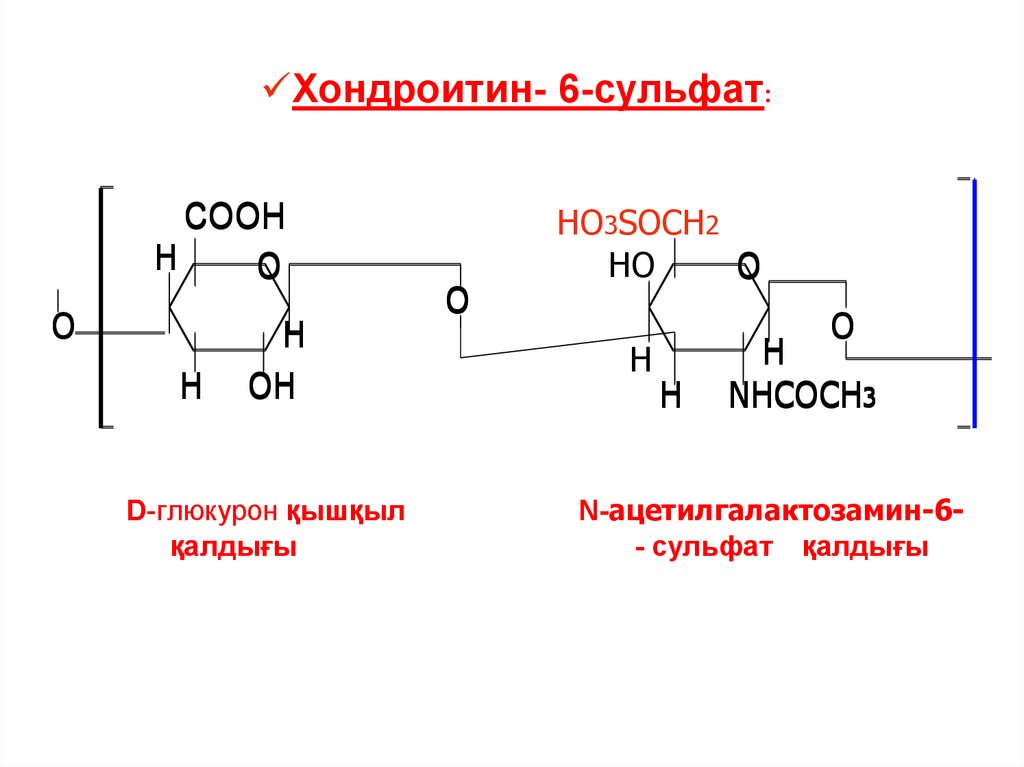
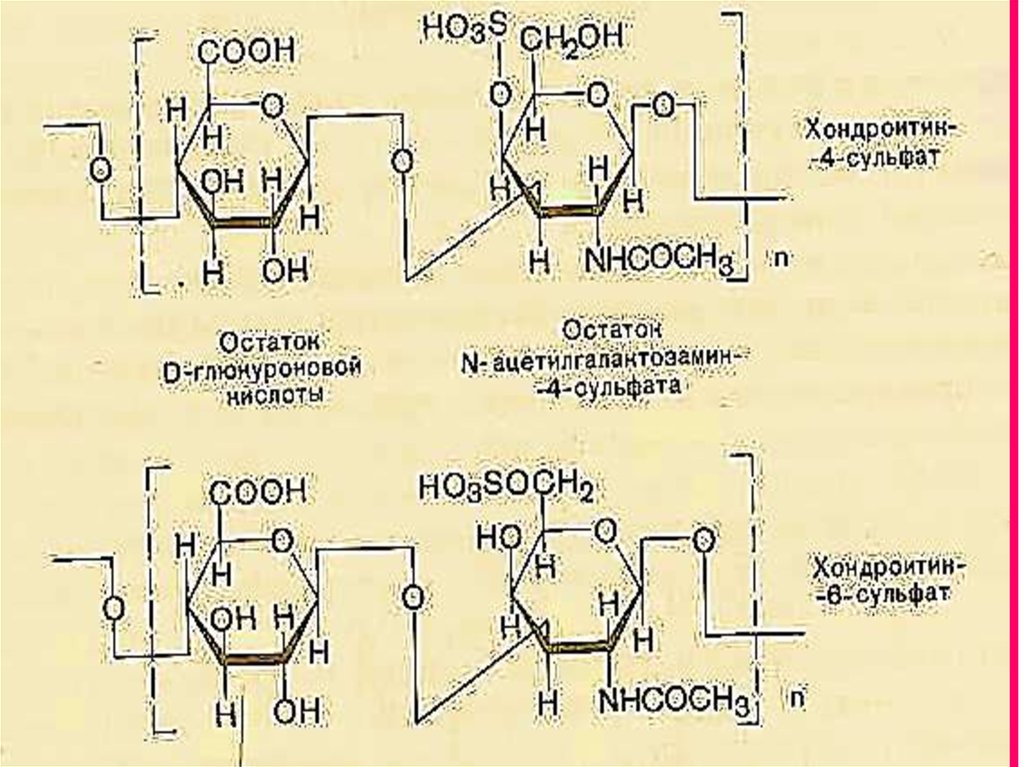
Хондроитин- 6-сульфат:СООH
H
O
O
H
H
OH
D-глюкурон қышқыл
қалдығы
O
HO3SOCH2
HО
O
H
O
H
H
NHCOCH3
N-ацетилгалактозамин-6- сульфат қалдығы
89.
90.
Дерматансульфат:H
H
O
O
H
H
OH
L-идурон қышқыл
қалдығы
O
HO3S CH2OH
О
O
H
O
H
H
NHCOCH3
N-ацетилгалактозамин-4- сульфат қалдығы
91.
Кератансульфат:C2HОH
HO
O
O
H
H
H
OH
D-галактоза
қалдығы
O
HO3SOCH2
H
O
O
H
H
NHCOCH3
N-ацетилглюкозамин-6- сульфат қалдығы
92.
Гликозамингликандардың карбоксильдіжоғары
мөлшерде теріс зарядтардың
және сульфатты топтары
болуың қамтамасыз етеді.
Осымен байланысты полисаха
ридті тізбектер коллагенның
молекуласымен электростати
калық әрекетеседі және Nа+
иондарын байланыстырады.
93.
Гликозамингликандардың бул қасиетімен
байланысты,
жасушааралық зат сутузды алмасуының
реттелуіне қатысады.
94.
95.
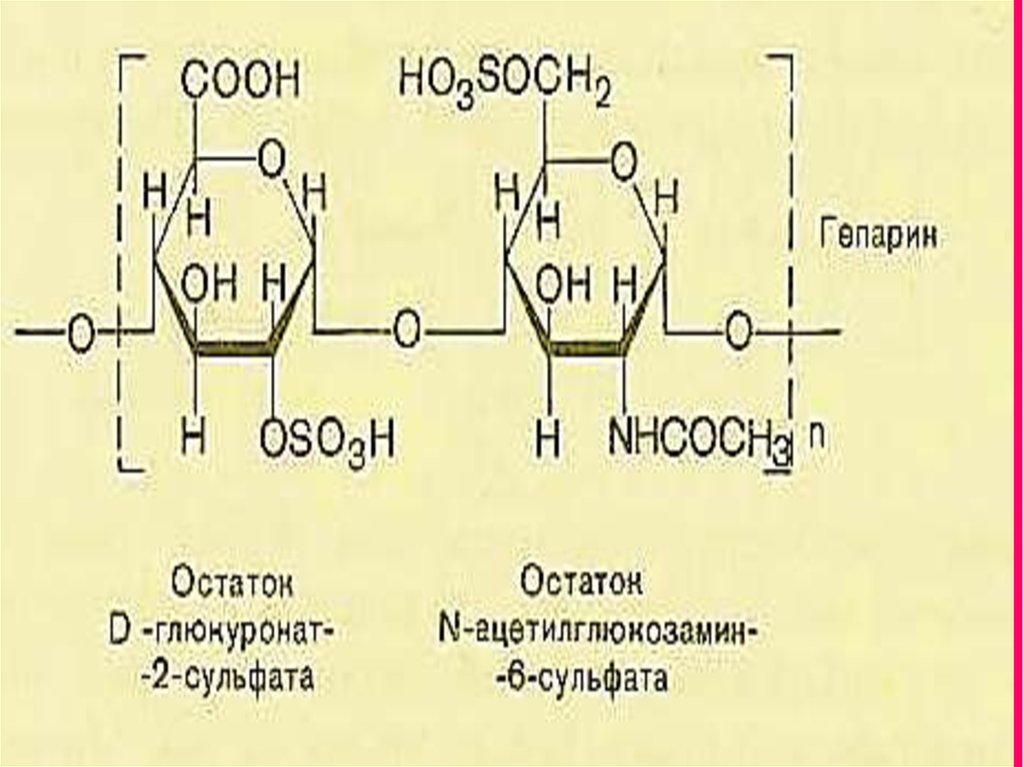
Гепарин – жасушааралықматрикстің құрылымдық
компонентіне жатпайды. Ол
дәнекер тінің жасушаларында
, қан тамырларында
синтезделеді. Қан тамырла
рында ақуыздармен
байланысады. Қанның ұйюын
тежейді \ антикоагулянт \ .
96.
Гликоамингликандаржасушааралық мат
рикстың белокта
рымен байланысып
протеогликандарды
түзеді.
97.
Протеогликандар –дәнекер тіндердің
1/3 бөлігін құрайды.
Олар белоктардан 5% , гликозамингли
кандардан - 95%
тұратын
комплекстер
98.
Протеогликандыгель тіндерге,
шеміршекке, сүйеке
түсетін жүктеу
өзгepicтepдi
женілдетеді.
99.
Жасушааралық матрикстыңкомпоненттері бip-бipiмен байла
нысып тіннің бipiкен жүйесін
түзеді. Ал гликозамингликандар
және протеогликандар
жасушааралық матрикстың
гидратталған гелін (негізгі заттің)
түзеді. Негізгі затта коллаген тал
шықтары орналасады. Олар мат
риксты бекітеді және
реттейді
100.
Жасушааралық заттың міндеттері:• жасушалардың дифферен
цировкасына қатысады
• тәндер каркасының қалып
тасуын қамтамасыз етеді
• мұшелер пішінің қалыпта
суымен сақтануына
қатысады
101.
Полисахаридты гельдің суфазасы қанмен
жасушалардың арасында
нәрлі заттар, мeтaбoлиттep,
гормондардың
диффузиясын қамтамасыз
етеді.
Матрикста орналасқан
эластин оған созылғыштық
р
102.
Жасушааралық матрикстыңұйымдасуына және базальді
мембрананың қалыптасуына
өзгешелік белоктар қаты
са ды.Мысалы: матрикс ком
поненттерінің біріктруінде
фибронектиннің
мәні зор.
103.
Фибронектин – диcyльфидтi байланыспен қо
сылған 2 полипептидті
тізбектерден тұрады.
Құрамында 4- 5 % көмір
сулар бар. Фибронектин
жасушаның үстінде
орналасады.
104.
Фибронектинмолекуласында
коллаген, гиалурон
қышқылы,
көмipcyлap, плазмати
калық мембранамен
байланысатың
орталар бар.
105.
Фибронектин.Биол мәні: 1. әртүрлі жасуша
ларды басқа жасушалар, кол
лаген және басқа субстрат
тармен байланыстырады
2. жабысқақтығын өзгерте
отырып жасушалардың
жылжуына (адгезивті процесс)
әсер керсетеді
106.
3. базальды мембраналардыңпайда болуына, жасушакалық
дифференцировкаға қатына
сады
4.коллаген талшықтарының
мөлшepiнiң реттейді
5. плазматикалык
фибронектин қан уюына,
фагозитозға қатынасады
107.
Қартайған саиндәнекер тінде
протеогликан мен
гликозамингликан
дардың мөлшері
азаяды.
108.
А-типті хондроитинсульфатВ-типті хондроитсульфатқа
аусады. Теріде коллагенді
фибриллалардың мөлшері
жоғарлайды. Қан тамырлар
ында III -типті коллаген I- типті
коллагенге аусады. Сүйекте I типті коллаген 3 -типті
коллагенге ауысады.
109.
Жараның жазылуындаденекер тіннің мәні:
- фибробластарда жасуша
аралық заттың компонент
терінің әcipece коллаген
ның синтезі күшееді. Нәти
жесінде, дәнекер тіннің
бip түрі – тыртық
пайда болады.
110.
Жараны, терінің дефектілерін,трофикалык язваны емдеу
үшін пленка, тор, губка , паста
пайда ланады. Олардың құра
мында - еритін коллаген
бар. Аталған препараттардың
антигендік белсенділігі
төмен және олар
Токсикалық
емес.
111.
Нетижесінде ол фибрингеаустырылады.Сол себебтен
қанда бос жене байланысқан
оксипролиннің мөлшері
жоғарлап,
ол зәрмен шығады
(оксипролинурия).
112.
Коллагеноздар / ревматизм,склеродермия, қызыл волчанка
және т. б.\. Негізгі белгілері:
- дәнекер тіннің ұйымдасуы
мен қан тамырлар міндетті
нің бұзылуы
- коллагеназаның әсерімен
коллаген өте тез ыдырауы
және т.б.
113.
Коллагеноздар / ревматизм,склеродермия, қызыл волчанка
және т. б.\. Негізгі белгілері:
- дәнекер тіннің
ұйымдасуымен қан
тамырлар міндеттінің
бұзылуы
- тіндік коллагеназалардың
белсенділігінің жоғарлауы
114.
Дәнекер тіндер. Гормондардың әсері:Минералокортикоидтер – дәнекер тін
нің негізгі затының биосинтезін ынта
ландырады
Тироксин – коллагенді фибриллалар
мен негізгі заттың түзілуін тежейді
Эстрогендер – гликозамингликандар
синтезін жоғарлатады
- Глюкокортикоидтар – жараныны
және коллагенозды емдеу үшін
пайдаланады
115. Дәнекер тіндер. Гормондардың әсері:
Кері байланыс.• Неге коллагенге тіректік, ал
эластинге созылғыш
міндеттер тән?
• Оксипролинурияның
себебептері.
• Атипты коллагенның
қасиеттері.
116.
РЕФЛЕКСИВТЫ ТЕСТ• Рефлексия - субъектін өз
өзіне, өз тұлғасына
• /құндылықтар,қізіушіліқтар,се
бептер,эмоциялар,
қылықтары \ ,
• өз біліміне немесе өзінін
меншікті жағдайына назар
аудару
117. РЕФЛЕКСИВТЫ ТЕСТ
Мысалы;Көп жаналықтарды білдім
Бұл маған өмірде керек
болады.
Туындаған сұрақтарға жауап
алдым. Адал ниетпен
жұмыс істеп, мақсатыма
жеттім.





































































































 Химия
Химия








