Похожие презентации:
Атомдағы электрондар қозғалысы
1.
2. Атомдағы электрондар қозғалысы
3. Сабақтың мақсаты
• атомдық орбиталь, электрондық бұлт,энергетикалық деңгей, энергетикалық деңгейше
ұғымдарын білу;
• алғашқы 36 элементтің электрондық және
графикалық формуласын құру;
• атомның сыртқы аяқталған қабаты қандай
жолмен түзілетінін анықтау;
• атомдар немесе иондардың электронды қосып
алу немесе беріп жіберу салдарын түсіну;
4. Бағалау критерийлері:
• Атомдық орбитальды және энергетикалық деңгейлерді,деңгейшелерді біледі;
• алғашқы 36 элементтің электрондық және графикалық
формуласын құрады
• Метал және бейметал арасындағы электрондарыд беріп
жіберу және қосып алу үрдісін түсінеді;
• Атомдардың ионға айналу кезінде октет ережесін қолданады
Slides.kz
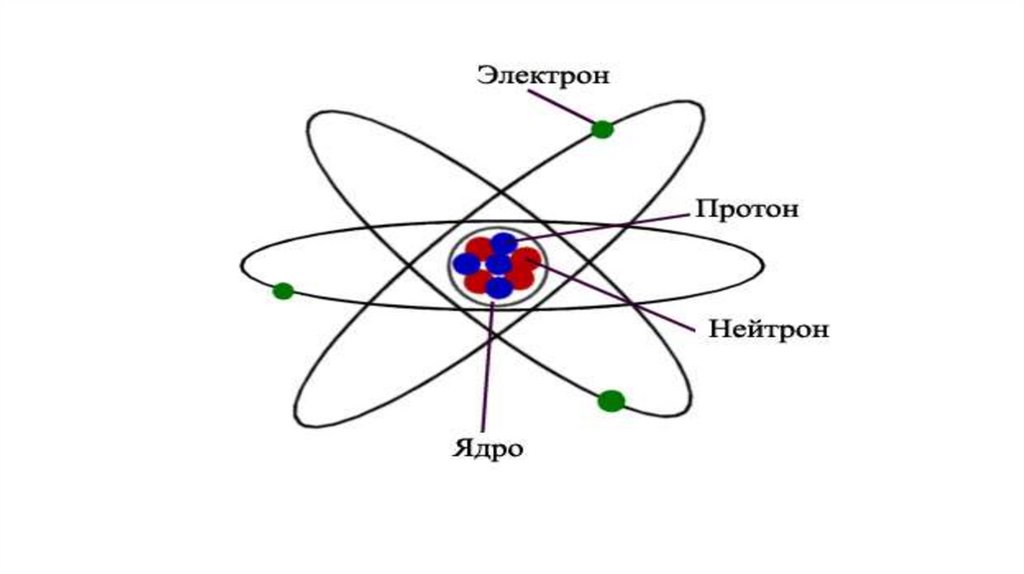
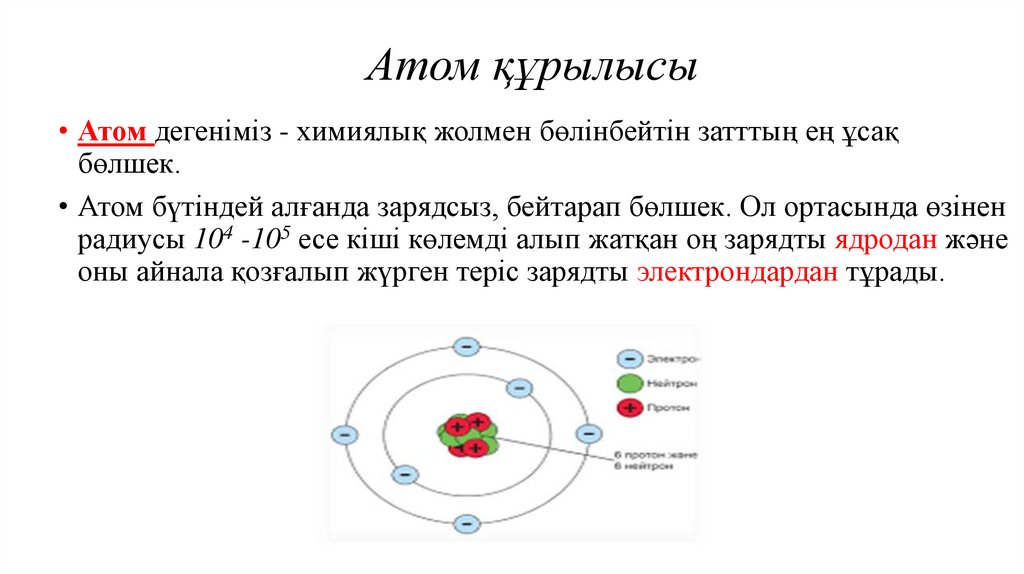
5. Атом құрылысы
• Атом дегеніміз - химиялық жолмен бөлінбейтін затттың ең ұсақбөлшек.
• Атом бүтіндей алғанда зарядсыз, бейтарап бөлшек. Ол ортасында өзінен
радиусы 104 -105 есе кіші көлемді алып жатқан оң зарядты ядродан және
оны айнала қозғалып жүрген теріс зарядты электрондардан тұрады.
6.
• Электрондар ядроның төңірегінде белгілі бір заңдылықтармен орналасады.• Атомның ядро заряды қанша болса, ондағы электрондар саны да сонша болады
дедік. Алайда, осы электрондардың барлығы ядроға бірдей күшпен тартылмайды,
олар ездерінің энергия қорының шамасына қарай ядродан әр түрлі қашықтықта
орналасады.
• Энергия қорлары шамалас электрондар ядродан бірдей қашықтықта орналасады,
осы деңгейлерді энергетикалық деңгейлер деп атайды.
• Ол N әрпімен белгіленеді, 1, 2, 3, 4, 5, 6, 7 сан мәндерін қабылдайды, N-нің мәні
элементтің орналасқан периодының нөмірімен анықталады. Әрбір
энергетикалық деңгейдегі электрондар саны N = 2n2 формуласымен анықталады.
Slides.kz
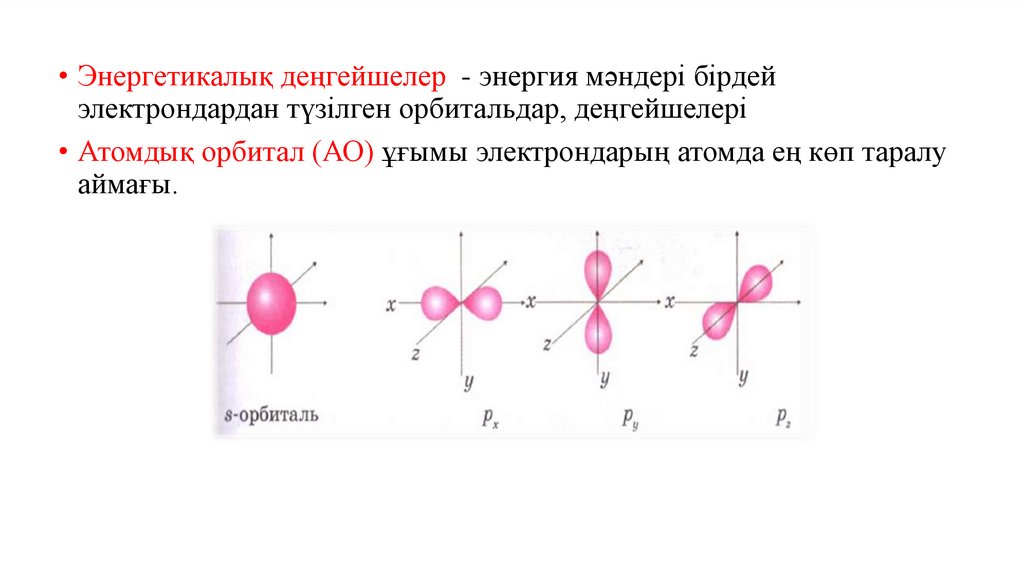
7.
• Энергетикалық деңгейшелер - энергия мәндері бірдейэлектрондардан түзілген орбитальдар, деңгейшелері
• Атомдық орбитал (АО) ұғымы электрондарың атомда ең көп таралу
аймағы.
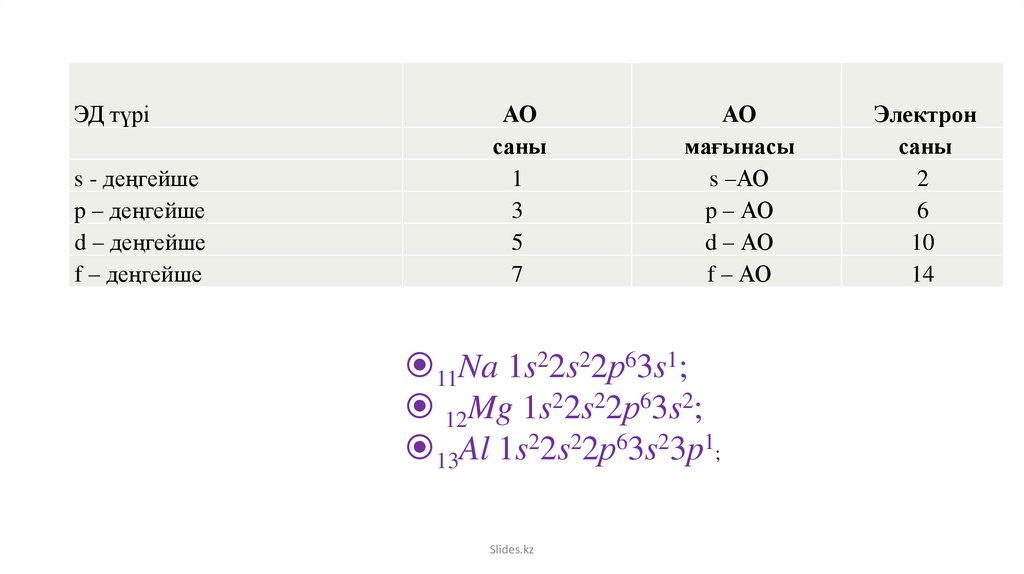
8.
ЭД түріs - деңгейше
p – деңгейше
d – деңгейше
f – деңгейше
АО
саны
1
3
5
7
АО
мағынасы
s –АО
p – АО
d – АО
f – АО
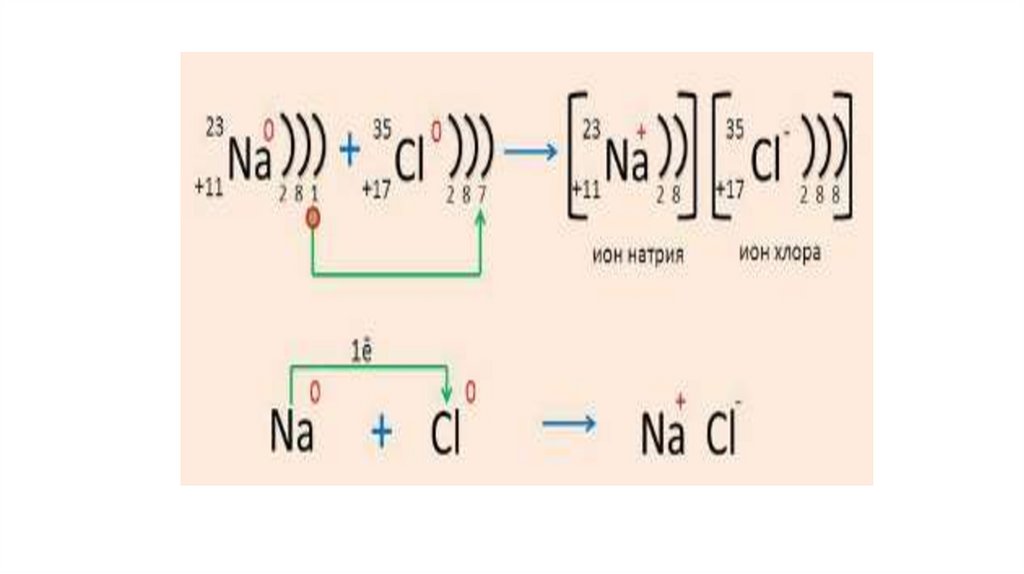
11Na 1s22s22р63s1;
12Mg 1s22s22р63s2;
13Al 1s22s22р63s23p1;
Slides.kz
Электрон
саны
2
6
10
14
9.
10.
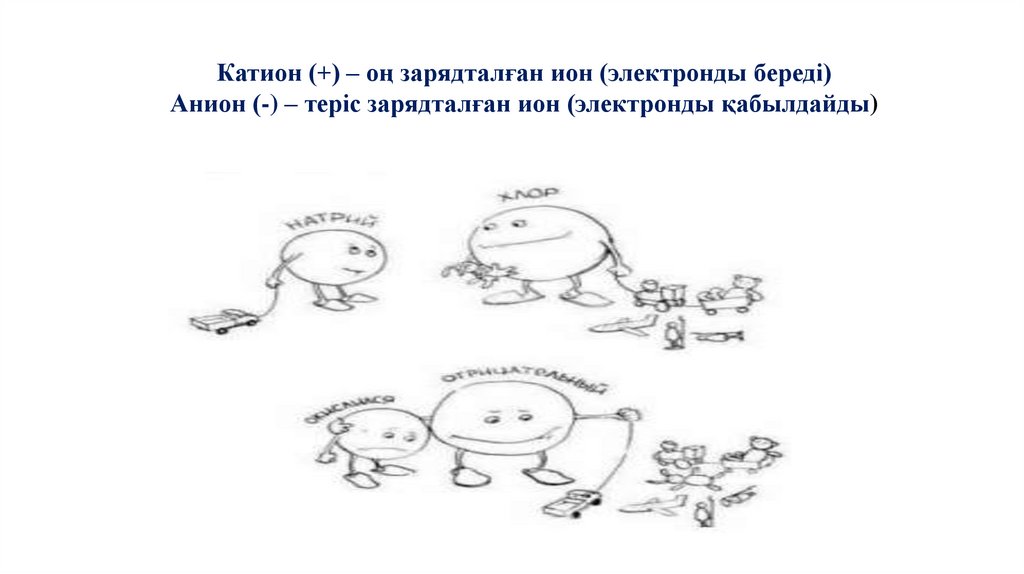
Катион (+) – оң зарядталған ион (электронды береді)Анион (-) – теріс зарядталған ион (электронды қабылдайды)
11.
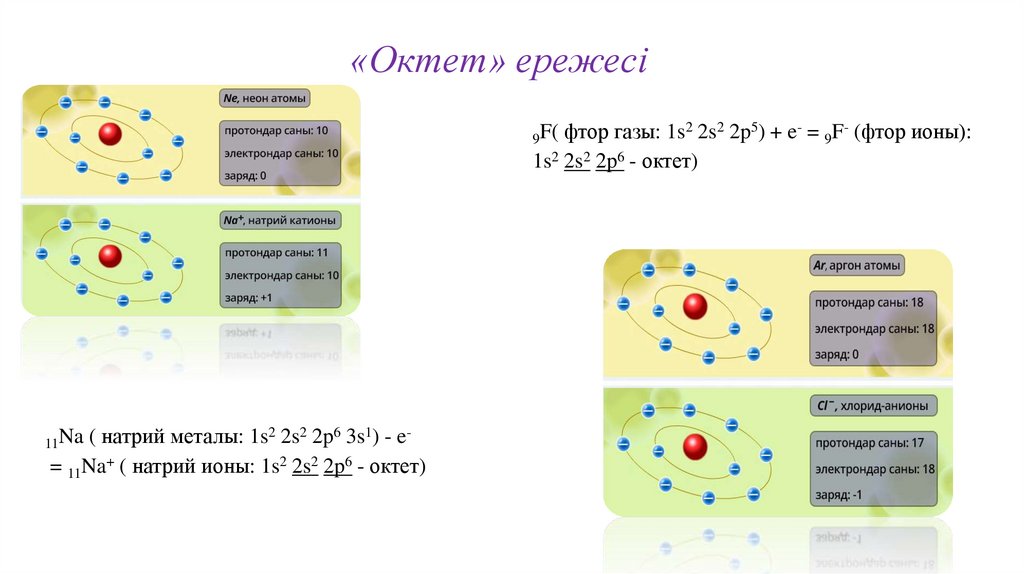
«Октет» ережесі2
2
5
9F( фтор газы: 1s 2s 2p ) + e = 9F (фтор ионы):
1s2 2s2 2p6 - октет)
2
2
6
1
11Na ( натрий металы: 1s 2s 2p 3s ) - e
= 11Na+ ( натрий ионы: 1s2 2s2 2p6 - октет)
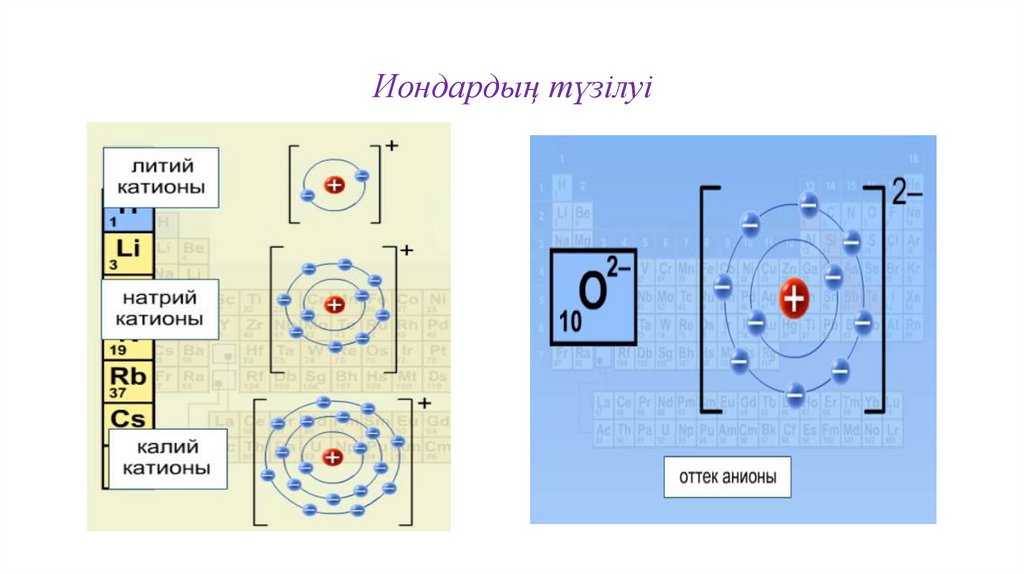
12. Иондардың түзілуі
13.
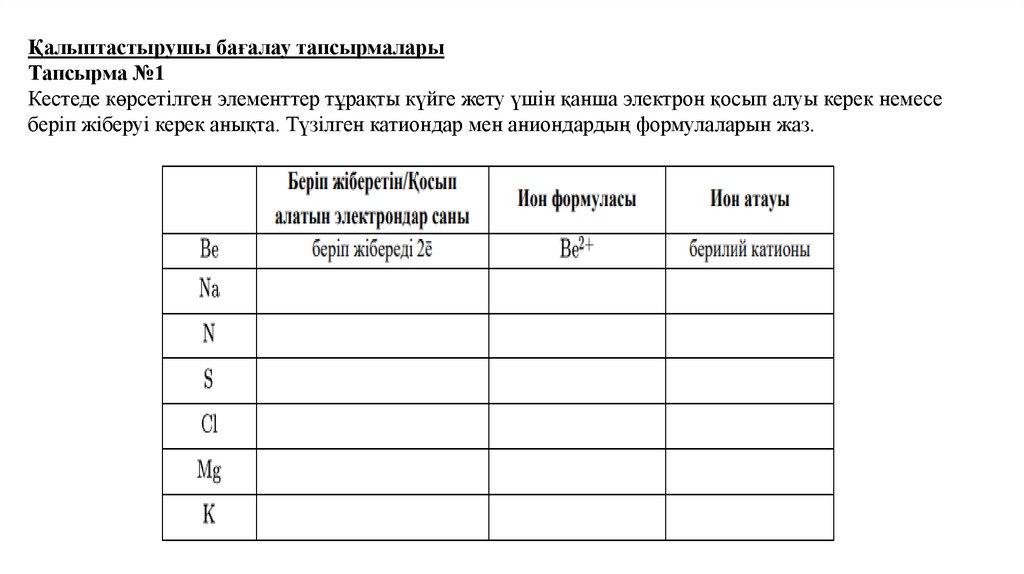
Қалыптастырушы бағалау тапсырмаларыТапсырма №1
Кестеде көрсетілген элементтер тұрақты күйге жету үшін қанша электрон қосып алуы керек немесе
беріп жіберуі керек анықта. Түзілген катиондар мен аниондардың формулаларын жаз.
14.
Дескриптор:Элементтер тұрақты күйге жету үшін қанша
электрон қосып алуы керек немесе беріп
жіберуі керек екенін анықтайды.
Иондардың түзілуін жазады
Катион немесе анионды анықтайды
15.
Тапсырма №2Төменде берілген иондар мен атомдарының электрондық
конфигурациясын жаз
Дескриптор: Берілген иондар мен атомдарының
электрондық конфигурациясын жазады
16.
Тапсырма №317.
Бағалаукритерийі
Метал және
бейметал
арасындағы
электрондарыд
беріп жіберу
және қосып алу
үрдісін түсінеді;
Атомдардың
ионға айналу
кезінде октет
ережесін
қолданады
Дескриптор
Элементтің қанша электрон қосып алуын
немесе беріп жіберуін анықтайды.
Түзілген катиондар мен аниондардың
формулаларын жазады.
Иондар мен атомдардың электрондық
конфигурациясын жазады.
Алюминий атомының электрондық
конфигурациясын анықтайды.
18. Үй тапсырмасы
• Алғашқы 36 химиялық элементтің атомдарыныңэлектрондық және графикалық формуласын құру
19.
Не білдім?Нені
үйрендім?
Түсініксіз
болған
тұстары
Нені
толықтыру
керек?









 Химия
Химия








