Похожие презентации:
Окислительно-восстановительные реакции. Урок 1. 9 класс
1.
Окислительновосстановительные реакции9 класс-урок1
2.
оврОкислительно-восстановительные реакции
– реакции, протекающие с изменением
степеней окисления атомов элементов.
3.
конспектСтепень окисления: - это заряд, который возникает на атомах в результате перехода электронов
(условного или действительного) при образовании химической связи.
Элементы с постоянной степенью окисления:
Н, кроме
+1
соединений с ме, где
-1
F
-1
O, кроме
-2
Соединения ОF2 , где
+2
элементы I гр. гл.п/г
+1
элементы II гр .гл.п/г
+2
элементы III гр. гл.п/г
+3
У остальных элементов переменная степень окисления, которая рассчитывается исходя из
правила: алгебраическая сумма степеней окисления атомов в молекуле = 0
Пример:
Правила в определении степени окисления
Атомы простого вещества имеют степень окисления = 0 ,
У мe всегда (+) степень окисления
У неме: (+) и (-) = 8 – N гр.
Элемент с (+) ст.ок. пишется на 1 месте
Элемент с (-) ст.ок пишется на последнем месте
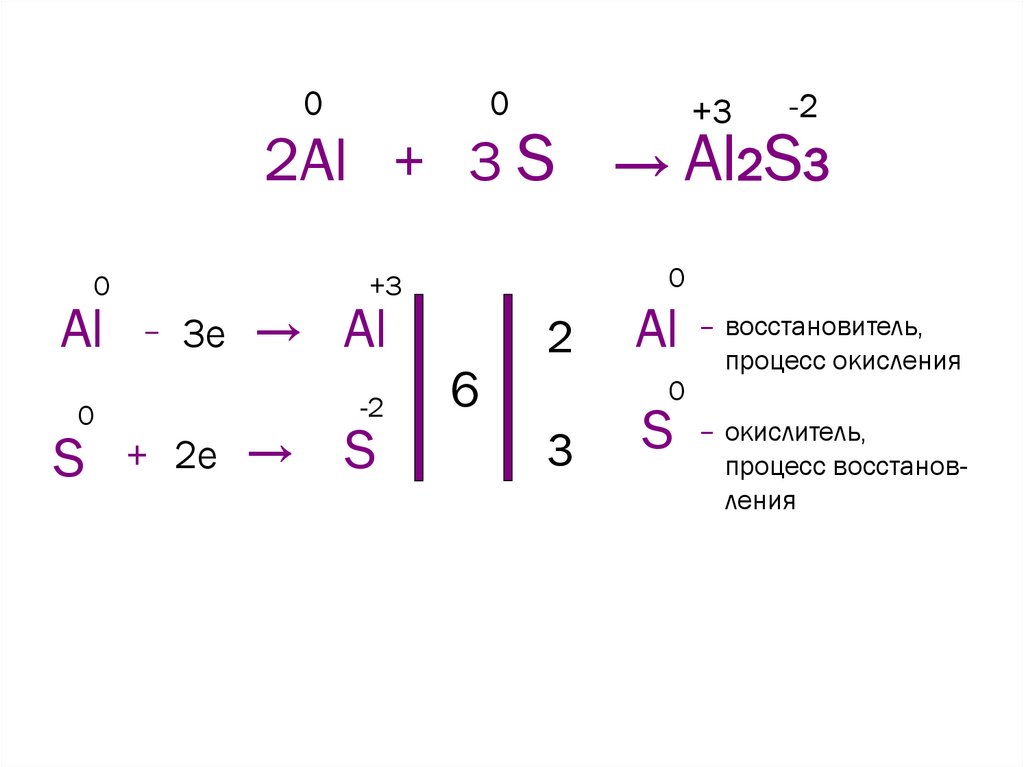
4.
00
+3
-2
2Al + 3 S → Al2S3
0
0
+3
Al – 3e → Al
0
S
-2
+ 2e →
S
6
2
Al – восстановитель,
процесс окисления
0
3
S – окислитель,
процесс восстановления
5.
Восстановитель –элемент, который
отдает электроны.
Окислитель –
элемент, который
принимает электроны.
0
+2
0
-3
S – 2e → S
P + 3e → P
6.
Процесс окисления –это процесс отдачи электронов.
0
+2
S – 2e → S
Процесс восстановления –
это процесс присоединения
электронов.
0
-3
P + 3e → P
7.
Овр с составлением уравнений Электронного баланса0
+1
-1
+2
0
-1
Zn + 2HCl = Zn Cl2 + H2
+2
0
Восстановитель
0
+1
Окислитель
Уравнения электронного баланса
8.
Д.з. расставить степень окисления над элементами во всехуравнениях и составить уравнения электронного баланса в
уравнениях №3 и №4
9.
Значениеокислительновосстановительных
реакций
10.
фотосинтезО2
О2
О2
CO2 + H2O → C6H12O6 + O2
О2
11.
Коррозия металловFe +H2O +O2 → Fe(OH)3
12.
Извержение вулкановS + O2 → SO2
13.
Взрывчатые веществаP + KClO3 → P2O5 + KCl
14.
Лесные пожарыC + O2 → CO2













 Химия
Химия








