Похожие презентации:
Окислительно-восстановительные реакции
1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕРЕАКЦИИ
2. Межмолекулярные ОВР
А) реакции, в результате которых степень окисления всех элементовостаются без изменения:
HNO3 + NaOH → NaNO3 + H2O
Б) реакции, в результате которых степень окисления некоторых
элементов изменяется:
2KBr + Cl2 → Br2 + 2KCl
3.
ОКИСЛИТЕЛИПример 1:
S0 + 2e → S2Cl20 + 2e → 2ClFe3+ +1e → Fe2+
ВОССТАНОВИТЕЛИ
Пример 2:
Fe2+ - 1e → Fe3+
Al0 - 3e → Al3+
H20 - 2e → 2H+
4.
ОКИСЛИТЕЛИ1. Неметаллы
с
высокой Cl20 + 2e → 2Cl-
электроотрицательностью.
Присоединяют электроны,
превращаясь в анионы.
2. Катионы. Присоединяют Cu2+ + 2e → Cu0
электроны,
образуя
нейтральные атомы или
молекулы.
5.
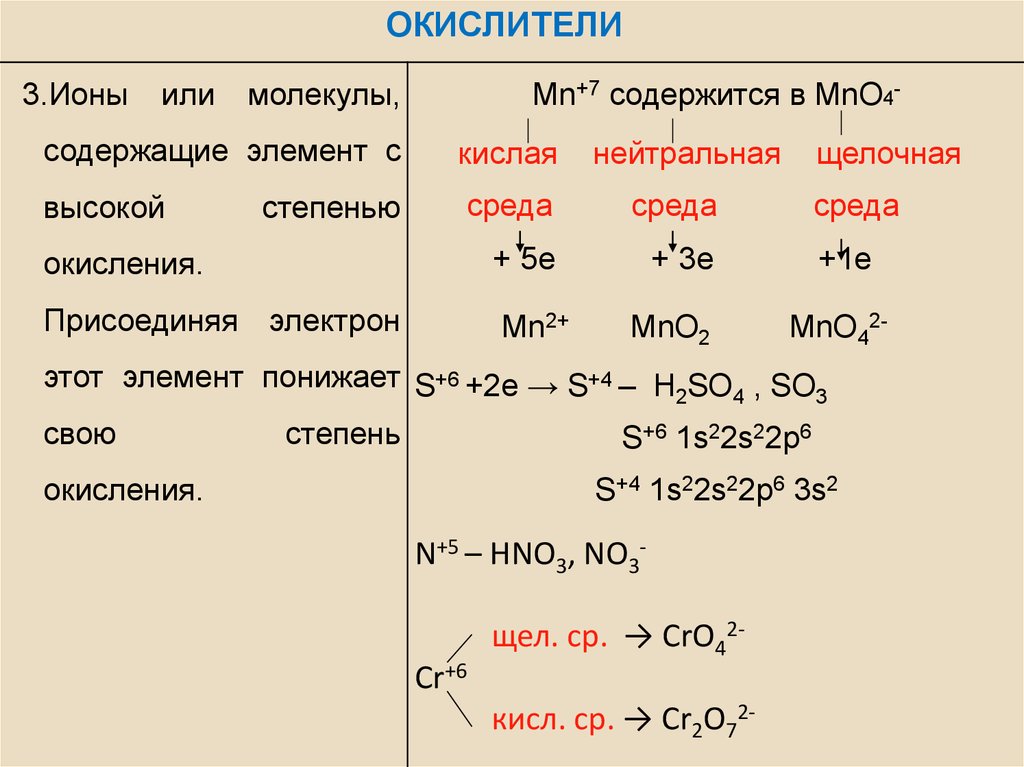
ОКИСЛИТЕЛИ3.Ионы
или
молекулы,
Mn+7 содержится в MnO4-
содержащие элемент с
кислая
высокой
среда
среда
окисления.
+ 5е
+ 3е
Присоединяя электрон
Mn2+
степенью
нейтральная
MnO2
щелочная
среда
+1е
MnO42-
этот элемент понижает S+6 +2e → S+4 – H SO , SO
2
4
3
свою
степень
S+6 1s22s22p6
окисления.
S+4 1s22s22p6 3s2
N+5 – HNO3, NO3Cr+6
щел. ср. → CrO42кисл. ср. → Cr2O72-
6.
ОКИСЛИТЕЛИ4.
Ионы
содержащие
и
молекулы, Cr+3 → Cr2O3
элемент
с O-1 →H O
2 2
нетипичной промежуточной
В нормальной и щелочной
степенью окисления.
среде:
H2O2-1 + 2e → 2OHВ кислой среде:
H2O2 + 2H+ +2e → 2H2O
7.
ВОССТАНОВИТЕЛИ1.Металлы.
Отдают
электрон, Ba0 – 2e → Ba2+
превращаясь в катионы.
2.Неметаллы
с
невысокой C0 – 4e → C+4
электроотрицательностью.
H02 - 2e → 2H+
3.Анионы неметаллов (кислотные 2Cl- - 2e → Cl20
остатки
бескислородных S-2 – 2e → S0
кислот).
4.Молекулы и ионы, содержащие S+4 (SO32-)
атом
неметалла
промежуточной
окисления.
в S+4 – 2e → S+6
степени
В кислой среде: O-1 (H2O2)
2О-1 -2е → О2
8.
Алгоритм расстановки коэффициентов в уравнении ОВР,если известны продукты взаимодействия
1. Записать схему реакции – слева исходные вещества,
справа – продукты реакции.
Каталитическое окисление аммиака:
NH 3 O2 кат
NO H 2O
2. Расставить степени окисления всех элементов во всех
веществах:
N-3H3+1 + O20 → N+2O-2 + H2+1O-2
3. Определить, какой элемент является восстановителем.
4. Записать схему окисления:
N-3 → N+2
9.
Алгоритм расстановки коэффициентов в уравнении ОВР,если известны продукты взаимодействия
5. Определить число электронов, отданных восстановителем
(на один атом):
(-3) – (+2) = -5
затем умножить на число атомов:
-5*1 = -5
Записать полную схему процесса окисления –
электронное уравнение:
N-3 – 5e = N+2 (восстановитель, окисление).
6. Определить, какой элемент является окислителем.
7. Записать схему процесса восстановления:
O20 → 2O-2
10.
Алгоритм расстановки коэффициентов в уравнении ОВР,если известны продукты взаимодействия
8. Определить число электронов, полученных окислителем
(на один атом окислителя):
0 – (-2) = +2
затем умножить на число атомов:
+2*2 = +4
Записать полную схему процесса восстановления –
электронное уравнение:
O20 + 4e = 2O-2 (окислитель, восстановление).
9. Найти наименьшее общее кратное для числа отданных и
полученных электронов.
11.
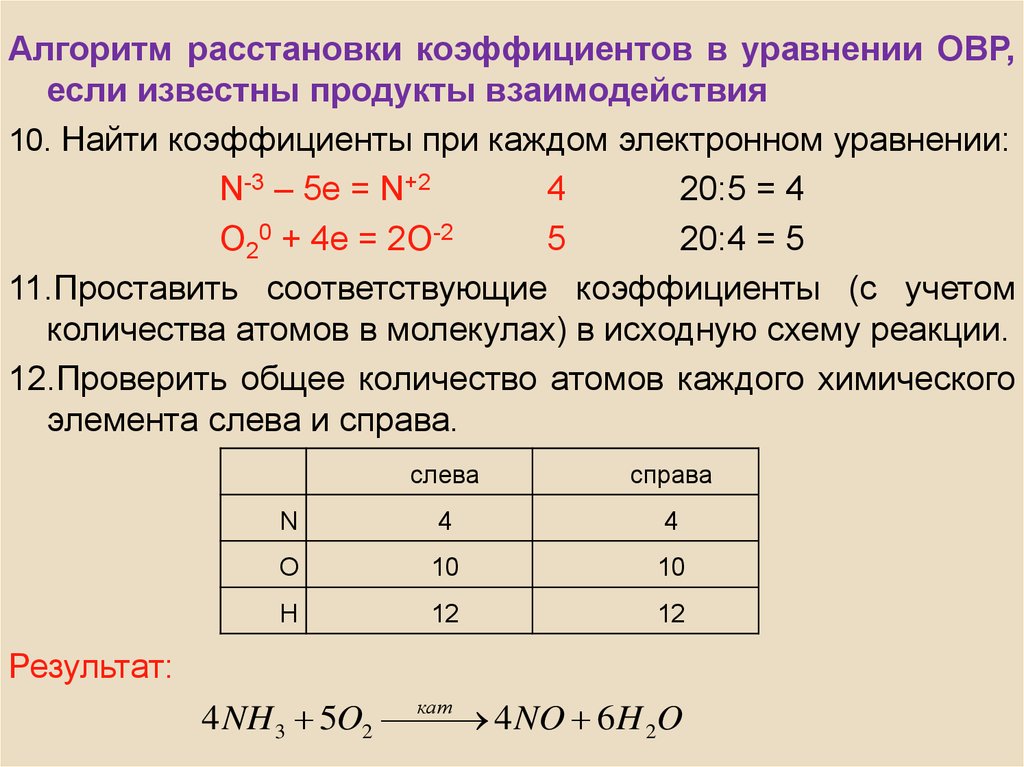
Алгоритм расстановки коэффициентов в уравнении ОВР,если известны продукты взаимодействия
10. Найти коэффициенты при каждом электронном уравнении:
N-3 – 5e = N+2
4
20:5 = 4
O20 + 4e = 2O-2
5
20:4 = 5
11.Проставить соответствующие коэффициенты (с учетом
количества атомов в молекулах) в исходную схему реакции.
12.Проверить общее количество атомов каждого химического
элемента слева и справа.
слева
справа
N
4
4
O
10
10
H
12
12
Результат:
4 NH 3 5O2 кат
4 NO 6 H 2O
12.
ПРИМЕР:Fe+2S2-1 + O20 = Fe2+3O3-2 + S+4O2-2
Fe+2 - 1e = Fe+3
S-1 – 5e = S+4
O20 +4e = 2O-2
*2
восстановитель, окисляется
восстановитель, окисляется
окислитель, восстанавливается
Fe+2 - 1e = Fe+3
10е + 1е = 11е *4
2S-1 – 10e = 2S+4
O20 +4e = 2O-2
Ответ:
4е
*11
4FeS2 + 11O2 = 2Fe2O3 +8SO2
восстановители
окислитель
13.
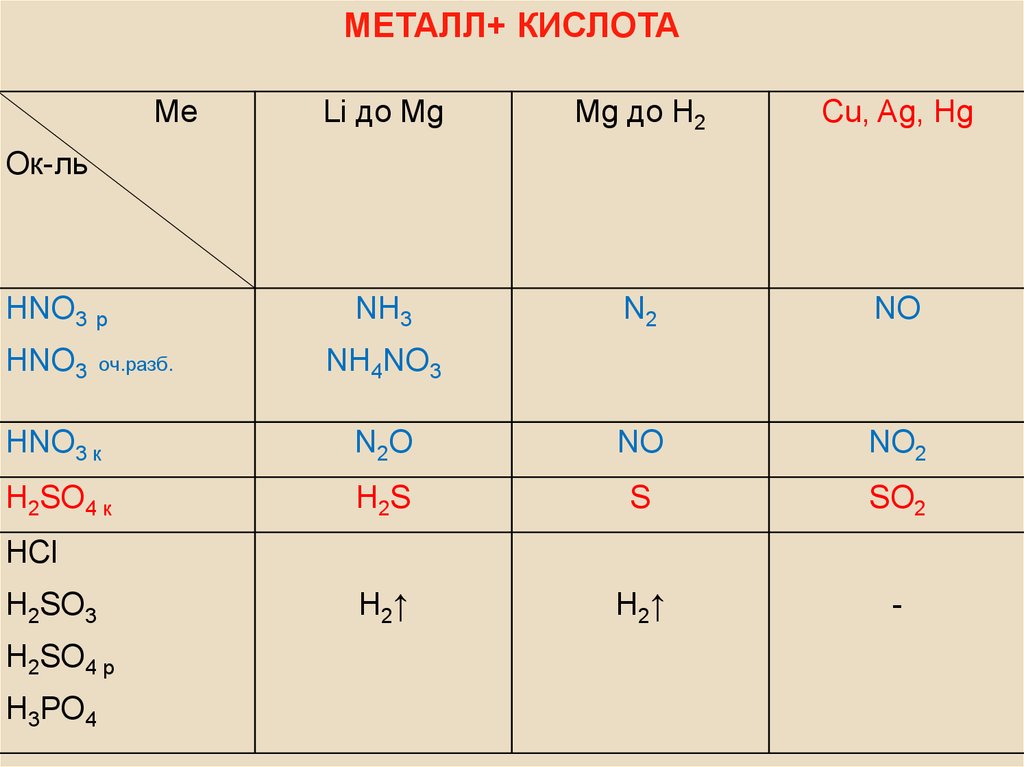
МЕТАЛЛ+ КИСЛОТАМе
Li до Mg
Mg до H2
Cu, Ag, Hg
NH3
N2
NO
Ок-ль
HNO3 р
HNO3
оч.разб.
NH4NO3
HNO3 к
N2O
NO
NO2
H2SO4 к
H2S
S
SO2
H2↑
H2↑
-
HCl
H2SO3
H2SO4 р
H3PO4
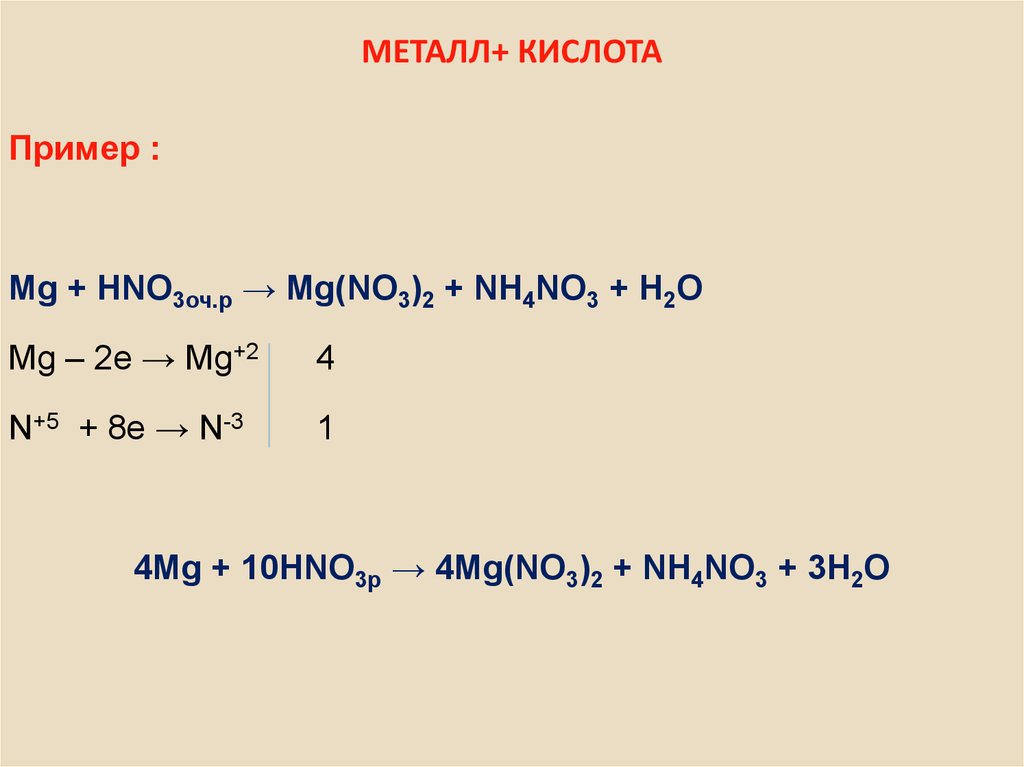
14. МЕТАЛЛ+ КИСЛОТА
Пример :Mg + HNO3оч.p → Mg(NO3)2 + NH4NO3 + H2O
Mg – 2e → Mg+2
4
N+5 + 8e → N-3
1
4Mg + 10HNO3p → 4Mg(NO3)2 + NH4NO3 + 3H2O
15.
Внутримолекулярные ОВРПример:
2 ,t
2 KClO3 MnO
2 KCl 3O2
Cl+5 +6e → Cl-1 2 - окислитель
2O-2 -4e → O2
3 - восстановитель
Реакции диспропорционирования
Пример:
t
4 KClO3
3KClO4 KCl
Cl+5 + 6e → Cl-1 1 - окислитель
Cl+5 – 2e → Cl+7 3 – восстановитель
16.
Задания для самостоятельной работы1. Какие из следующих реакций являются окислительновосстановительными:
А) KOH + CuCl2 → KCl + Cu(OH)2
Б) KBr + Cl2 → KCl + Br2
В) Fe(OH)3 → Fe2O3 + H2O
Г) Pb(NO3)2 → PbO + NO2 + O2
2. Закончите уравнения следующих процессов:
А) Al0 – 3e =
Б) S+6 + 8e =
B) N-3 – 5e =
Г) Fe+3 + 1e =
Д) Br2 + 2e =
E) Mn+2 – 5e =
Какие из этих процессов являются процессами восстановления?
17.
3. Какие из следующих веществ могут быть:А) только окислителями
Б) только восстановителями
В) и окислителями и восстановителями:
CrO3, Mg3P2, Na2CrO4, SO2, KI, KNO2, LiClO4, KH, Fe, H2O2,(NH4)2S?
Укажите тип каждой из следующих
восстановительных реакций:
А) P + KOH + H2O → PH3 + KH2PO2
Б) H2SO3 + H2S → S + H2O
В) KClO3 → KCl + KClO4
Г) NH4NO3 → N2O + H2O
Д) Cu + HNO3 → Cu(NO3)2 + NO + H2O
E) AgNO3 → Ag + NO2 + O2
Ж) Fe + Cl2 → FeCl3
4.
окислительно-
18.
5.Методом электронного баланса составьте уравнения
окислительно-восстановительных реакций, которые протекают
по схемам:
A) H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
Б) C + HNO3 → CO2 + NO + H2O
B) MnO2 + NaBiO3 + HNO3 → HMnO4 + BiONO3 + NaNO3 + H2O
Г) NaI + NaIO3 + H2SO4 → I2 + Na2SO4 + H2O
Д) Mg + HNO3 → Mg(NO3)2 + N2O + H2O
E) PbO2 + MnSO4 + HNO3 → PbSO4 + Pb(NO3)2 + HMnO4 + H2O
Ж) KMnO4 + NH3 → KNO3 + MnO2 + KOH + H2O
З) K2Cr2O7 + HClO4 + HI → Cr(ClO4)3 + KClO4 + I2 + H2O
И) H2C2O4 + KMnO4 → CO2 + K2CO3 + MnO2 + H2O
K) C6H12O6 + KMnO4 + H2SO4 → CO2 + MnSO4 + K2SO4 + H2O
19.
6. К какому типу окислительно-восстановительных реакций относитсякаждая из следующих реакций:
A) H2O2 + K2Cr2O7 + HCl → CrCl3 + KCl + O2 + H2O
Б) H2O2 → H2O + O2
B) H2O2 + KNO2 → KNO3 + H2O
Какую роль (окислителя; восстановителя; и окислителя, и
восстановителя) играет пероксид водорода в каждой из этих
реакций? Составьте уравнения реакций методом электронного
баланса.
7. Проанализируйте следующие уравнения реакций:
2 KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
2 KMnO4 + 3K2SO3 + H2O = 2MnO3 + 3K2SO4 + 2KOH
2 KMnO4 + 3K3SO4 + 2KOH = 2K2MnO4 + K2SO4 + H2O
В каком случае глубина восстановления KMnO4:
А) Наибольшая
Б) Наименьшая?
20.
ТЕСТЫВариант №1
1. Какие из следующих веществ могут являться окислителями?
А) NH3 Б) Br2 В) KClO3 Г) Fe Д) HNO3
2. Как называется следующий процесс и сколько электронов в нем
участвует: Cl02 → 2Cl+1:
А) восстановление, 1е
Б) окисление, 2е
В) восстановление, 2е
Г) окисление, 1е
3. Какие из следующих реакций являются реакциями замещения?
А) P2O5 + 6KOH = 2K3PO4 + 3H2O
Б) 2KBr + Cl2 + 2KCl + Br2
B) 2Na + 2H2O = 2NaOH + H2
Г) Cu(OH)2 = CuO + H2O
21.
Вариант №21. Какие из следующих веществ могут являться и окислителями и
восстановителями?
А) SO2 Б) Na В) H2 Г) K2Cr2O7 Д) HNO2
2. Как называется следующий процесс и сколько электронов в нем
участвует: S+6 → S-2?
А) восстановление, 2е
Б) окисление, 8е
В) восстановление, 4е
Г) окисление, 2е
3. Какие из следующих реакций являются реакциями соединения?
А) 2Al + 6HCl = 2AlCl3 + 3H2
Б) 2FeCl3 + Cl2 = 2FeCl3
В) CaCO3 = CaO + CO2
Г) 4NO2 + O2 + 2H2O = 4HNO3

















 Химия
Химия








