Похожие презентации:
Качественные реакции. Катионы
1. Качественные реакции
КАЧЕСТВЕННЫЕ РЕАКЦИИКАТИОНЫ
2.
• + NaCl+
Ag
осадок белого цвета, нерастворимый в кислотах
• +K2Cr2O7 красно-бурое окрашивание или осадок,
растворимый в кислотах
• +Na2S
черный осадок, нерастворимый в кислотах
• + NaOH
коричневый осадок, растворимый в кислотах
3.
2+Рb
• + KI
осадок желтого цвета
• + NH3 или карбонат аммония
белый осадок, нерастворимый в избытке осадителя
• +Na2HP04
белый осадок, легко растворимый в азотной
кислотеи щелочах
• + Na2S
черный осадок, нерастворимый в кислотах
4.
2+Рb
• +Na2S04
белый осадок, нерастворимый в кислотах, но
растворимый в щелочи и в ацетате аммония
• +K2Cr2O7 или K2CrO4
осадок желтого цвета нерастворимый в уксусной
кислоте, но растворимый в щелочи
• + Na2S203
белый осадок, растворимый в избытке осадителя.
При кипячении выпадает черный осадок
5.
2+Ва
• + Н2С2О4
осадок белого цвета
• +Na2СОз
осадок белого цвета
• +K2Cr2O7 или K2CrO4
осадок белого цвета нерастворимый в уксусной к
6.
2+Са
+ Н2С2О4
осадок белого цвета
+Na2СОз
осадок белого цвета
7.
Mg2+• +NaOH
бледно-розовый осадок, постепенно буреющий на воздухе
• +Na2СОз
белый осадок, пузырьки газа
• + (NН4)2СОЗ
белый осадок образуется только при кипячении или после
длительного стояния. Прибавление избытка реагента и
этанола к холодному концентрированному раствору соли
магния вызывает полное осаждение магния.
Осадок не образуется, если (NН4)2СОЗ
прибавлять к горячему разбавленному раствору магниевой
8.
2+Sn
• + NaOH
белый студенистый осадок
Sn2++2OH-=Sn(OH)2
• + NH3 или карбонат аммония белый осадок,
незначительно растворимый в избытке осадителя
Sn2++CO32-=CaCO3
9.
2+Sn
• + Na2S+ 2-3 капли HCL
S2-+ Sn2+=SnS
шоколадно-коричневый осадок, нерастворимый в кислоте
• + Zn
H2[SnCl4] + 2Zn = Zn+MgCl2+ 2HCl
выделение олова в виде губчатой массы на грануле цинка
10.
3+AI
+NаОН (недостаток) или раствор аммиака
осадок белого цвета. Осадок растворяется в избытке
раствора щелочи. При добавлении к полученному
раствору хлорида аммония вновь выпадает осадок
белого цвета.
+Na2СОз
белый осадок и газ
+(NH4)2HP04
белый осадок, нерастворимый в уксусной, но
растворимый в НС1
11.
2+Zn
+ NаОН (недостаток)
Выпадает осадок белого цвета.
Осадок растворяется в избытке раствора щелочи. При
действии на полученный раствор хлоридом аммония не
наблюдается выпадение осадка
(отличие от катиона А13+)
12.
3+Cr
• +NаОН (недостаток)
Выпадает осадок зеленого цвета.
Осадок растворяется в избытке раствора щелочи, но
нерастворим в аммиаке
Cr3+ +3OH-=Cr(OH)3
• + NaOH + Н2О2, при нагревании желтый раствор
2CrBr3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 6NaBr + 8H2O
13.
• +NaOH2+
Mn
Mn2++2OH-=Mn(OH)2
бледно-розовый осадок,
постепенно буреющий на воздухе
4Mn(OH)2 + O2 + 2H2O = 4Mn(OH)3 MnO(OH)
• +Na2СОз белый осадок
Mn2++CO32-= MnCO3
• + (NН4)2СОЗ+ Н2О2
добавить 2-3 капли 2М NaOH + 2-3 капли Н2О2 +
кристаллы (5-8 штук) (NН4)2СОЗ
Земляничнокрасное окрашивание
14.
2+Mn
• +В пробирку поместить 5-6 капель+(NH4)2S208
+ 1 -2 капли конц Н3РО4 + 1-2 капли АgNОз, нагреть на
водяной бане. Затем с помощью стеклянной палочки
внести каплю исследуемого раствора и перемешать.
Розовое окрашивание
15.
Mn2+• + K4[Fe(CN)6]
белый осадок
• + K3[Fe(CN)6]
бурый осадок, нерастворимый в аммиаке + КВгОз
• + KBrO3
фиолетовая окраска
16.
2+Co
+ НС1 конц синий раствор
+ NaOH
синий осадок, в избытке реагента становится
розовым, затем переходит в раствор
Co2++2OH-=Co(OH)2 4Co(OH)2 + O2 + 2H2O = 4Co(OH)3
+ NНз* н2о
Co(OH)2 + 6NH3 = [Co(NH3)6](OH)2
синий осадок, частично растворимый в избытке реагента
с образованием грязно-желтого раствора, постепенно
краснеющего на воздухе
17.
+Na2S черный осадокS2-+ Co2+=CoS
2+
Co
+K3[Fe(CN)6]
буровато-красный осадок
+ NH4CNS (конц. раствор) синий раствор
Co2++2CNS-=Co(CNS)2
18.
Ni2+• + NaOH
зеленый осадок
• +Na2S черный осадок
• + NH3 Н2О
зеленый осадок, переходящий в васильково-синий раствор
• + фосфат натрия
яблочно-зеленый осадок, легко растворимый в кислотах
• + K4[Fe(CN)6]
зеленоватый осадок
• + K3[Fe(CN)6]
желтовато-бурый осадок
19.
2+Fe
• + NaOH
Выпадает осадок белого цвета. Возможно образование
зеленого осадка («зеленая ржавчина»). Осадок буреет на
воздухе.
Fe2++2OH-=Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
• + K3[Fe(CN)6]
FeSO4+ K3[Fe(CN)6]= K FeFe(CN)6 + K2SO4
Выпадает осадок или образуется раствор синего цвета
20.
2+Fe
• + NH4CNS
нет изменений
+ карбонат аммония
белый осадок, буреющий на воздухе
Fe2++CO32-= FeCO3
• + Na2S
• Fe2++S2-= FeS
черный осадок, растворимый в кислотах
21.
3+Fe
• + NaOH
Fe3++3OH-=Fe(OH)3 осадок бурого цвета,
с трудом растворимый в избытке реагента
• + NH3
осадок бурого цвета, нерастворимый в избытке реагента
• + K4[Fe(CN)6]
FeCl3+ K4[Fe(CN)6]= K FeFe(CN)6 + 3KCl
+ NH4CNS
Fe3++3CNS-=Fe(CNS)3
образуется раствор темно-красного цвета.
Окраска исчезает в присутствии фторид-ионов
22.
3+Fe
+ ацетат натрия CH3COONa
темно-бурое окрашивание, при кипячении хлопья осадка
основной соли. В присутствии лимонной кислоты, глицерина
сахаров осадок не выпадает
• + ZnO (внести в раствор, перемешать, нагреть)
бурый осадок
• + Nа2Н РО4 желтовато-белый осадок
23.
3+Fe
• сульфосалициловая кислота
красно-фиолетовое окрашивание (pH 3 - 5).
При добавлении аммиака (pH 9 - 11) окраска
переходит в желтую. Контроль pH по индикаторной
бумаге!
• Na2S203 pH близок к нейтральному
красно-фиолетовая окраска, которая быстро исчезает
из-за восстановления железа (+ образуется
тетратионат!!!)
24.
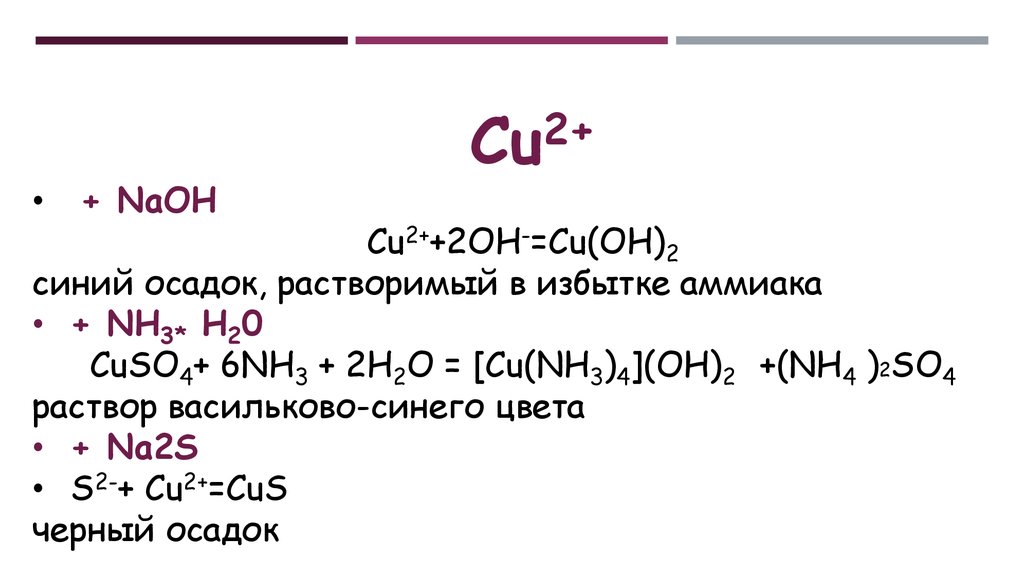
+ NaOH
2+
Cu
Cu2++2OH-=Cu(OH)2
синий осадок, растворимый в избытке аммиака
• + NH3* Н20
CuSO4+ 6NH3 + 2H2O = [Cu(NH3)4](OH)2 +(NH4 )2SO4
раствор васильково-синего цвета
• + Na2S
• S2-+ Cu2+=CuS
черный осадок
25.
+Na2СОз2+
Cu
Cu2++CO32-=CuCO3
зеленовато-голубой осадок, выделение газа
+ Na2S203 бесцветный раствор, при кипячении
красноватобурый осадок (Cu2S)
26.
2+Cu
• + KI
коричневый осадок, становящийся белым при
обработке тиосульфатом
2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
+ K4[Fe(CN)6] красно-бурый осадок
K4[Fe(CN)6] + 2CuSO4 =Си2[Fe(CN)6] +2K2SO4
+ Zn красный налет на грануле цинка
CuSO4 + Zn = Cu + I2 + ZnSO4
27.
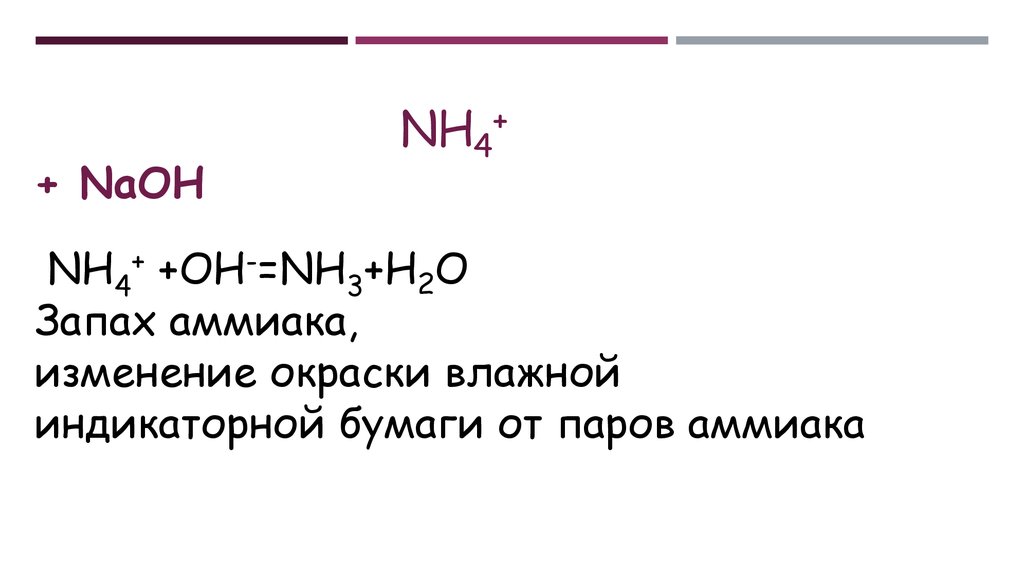
+ NaOHNH4+
NH4+ +OH-=NH3+H2O
Запах аммиака,
изменение окраски влажной
индикаторной бумаги от паров аммиака

























 Химия
Химия








