Похожие презентации:
Получение металлов
1. Здравствуйте, ребята! Мы продолжаем изучать большую главу «Металлы». А тема сегодняшнего урока …
2. Тема урока «Получение металлов».
«Металл – всех недр земных владыка»…Тема урока
«Получение металлов».
3. Теперь, давайте вспомним прошлую тему: Составьте уравнения возможных реакций:
а) Аl + Сl2 →а) Zn + Н2О →
б) Zn + AgNO3
→
б) Cа + ZnСI2 →
в) Мg + О2 →
в) Mg + HCl →
г) Сu + НСI →
г) Аg + FeSO4 →
д) Fe + CuSO4 →
д)Н2О+ Na →
4. Проблема!
Могут ли металлы находиться в природе всвободном ( самородном ) состоянии, т.е. в виде
Ме0 ?
Если могут, то какие это металлы?
Это металлы низкой химической
активности.
5. В природе металлы могут встречаться в виде простого вещества (самородки) или в виде сложного вещества:
Благородные Ме –Аu, Рt ,
встречаются в
природе только в
свободном виде.
Самородок серебра
Самородок золота
Самородок платины
6.
7. В природе металлы встречаются чаще всего в виде соединений (металлических руд). А что такое металлические руды?
В природе металлы встречаются чаще всегов виде соединений (металлических руд).
А что такое металлические руды?
Руды – содержащие
металлы природные
образования, в
которых металлы
находятся в
количествах,
пригодных в
технологическом и
экономическом
отношении для
получения металлов
в промышленности.
Из 1 тонны медной
руды можно
получить лишь 4 кг
чистой меди
Медная руда
8.
9. Активные Ме (до Sn) встречаются только в виде соединений. Менее активные металлы могут встречаются и в свободном виде и в виде
соединений (Sn, Cu, Hg, Ag)..
хлоридов :сильвинит КСl • NaCl,
каменная соль NaCl;
нитратов – чилийская селитра
NaNO3;
сульфатов – глауберова соль
Na2SO4 * 10 H2O, гипс CaSO4
2Н2О;
карбонатов – мел, мрамор,
известняк СаСО3, магнезит
MgCO3, доломит CaCO3
MgCO3;
сульфидов :серный колчедан
FeS2, киноварь HgS, цинковая
обманка ZnS;
фосфатов – фосфориты,
апатиты Ca 3(PO4)2 ;
оксидов – магнитный железняк
Fe3O4, красный железняк Fe2O3,
бурый железняк, содержащий
различные гидроксиды железа (III)
Fe2O3 • Н2О.
10. Вопрос! Как вы думаете, ребята, какой основной химический процесс лежит в основе получения металлов?
• Так как большинство металловвстречаются в природе в составе
соединений, в которых металлы
находятся в положительной степени
окисления Ме+п, значит для того чтобы
их получить в виде Ме0, необходимо
про вести процесс восстановления.
Ме+n+ne= Ме0
11.
Получениемметаллов из их
соединений
занимается
важнейшая
отрасль
промышленности,
называемая
металлургией.
12. .
Металлургия- это наука о методах и процессах
производства металлов из руд и других
металлосодержащих
продуктов,
о
получении сплавов и обработке металлов.
13. Вопрос! Как добиться доступной формы для переработки?
Это может быть обжиг руд дляперевода металла в оксид его
или растворение нерастворимых
соединений: обработка кислотами,
содой и др. Катионы металлов Ме+n в
металлургических процессах являются
окислителями.
Восстановителями выступают
следующие вещества: С (уголь), Н2,
СО, Al, Mg, активные металлы —
щелочные и щелочноземельные,
электрический ток.
14. .
Виды металлургических производствПирометаллургия
Гидрометаллургия
Микробиологический
метод получения
металлов
Электрометаллургия
15. .
Пирометаллургия- методы переработки руд, основанные на химических реакциях, происходящих при
высоких температурах.
16. Пирометаллургия.
восстановление металловиз их руд, происходящее
при высоких температурах
Обжиг в древности
Обжиг (окисление):
2PbS + ЗО2 = 2РЬО + 3SO2↑
Плавка (восстановление):
РЬО + Н2 = Pb + Н2О
WO3 + ЗН2 = W + ЗН2О
TiCl4 + 2Mg = Ti + 2MgCl2
Отраслью
пирометаллургии является
металлотермия –
восстановление Ме из
оксидов более активными
металлами, чаще
алюминием (
алюминотермия). Так
получают марганец, хром,
молибден, вольфрам.
Сr 2О3 + 2 АI → АI 2О3 + 2 Сr
17. .
Гидрометаллургия- методы получения металлов, основанные
на химических реакциях, происходящих в
растворах.
гидрометаллургический
завод
18. Гидрометаллургия
CuO + H2SO4 = CuSO4 + Н2ОМетоды
CuSO4 + Fe = FeSO4 + Сu
восстановления
металлов из
растворов их
солей другими
более активными
металлами.
Этим способом
можно получить
следующие
металлы: Ag, Au,
Zn, Zn, Mo.
19. .
Электрометаллургияметоды получения металлов, основанные на
электролизе, т.е. выделение металлов из растворов
или расплавов их соединений с помощью
постоянного электрического тока.
-
электрометаллургическая
печь
20. Электрометаллургия
получение Ме спомощью
электрического тока
(электролиз).
Так получают
активные легкие
Ме: щелочные и
щелочноземель
ные, алюминий.
Электролиз
расплава:
2 NaCI → 2Na +
CI2 ↑
2КCI →2K + CI2↑
21. Термическое разложение соединений :
так получают Ме вособо чистой
форме : титан,
цирконий, торий из галогенидов,
ванадий, ниобий,
тантал – из
оксидов.
Fe(CO)5 → Fe +
5CO
Ni(CO)4→ Ni + 4CO
22. .
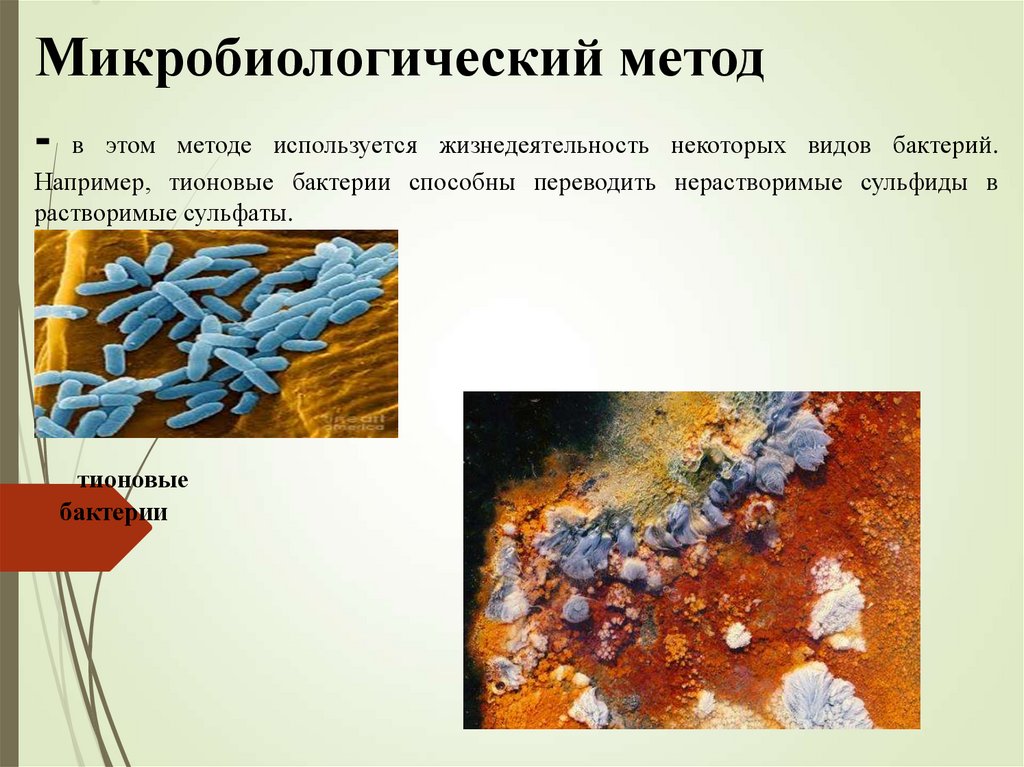
Микробиологический метод- в этом методе используется жизнедеятельность некоторых видов бактерий.
Например, тионовые бактерии способны переводить нерастворимые сульфиды в
растворимые сульфаты.
тионовые
бактерии
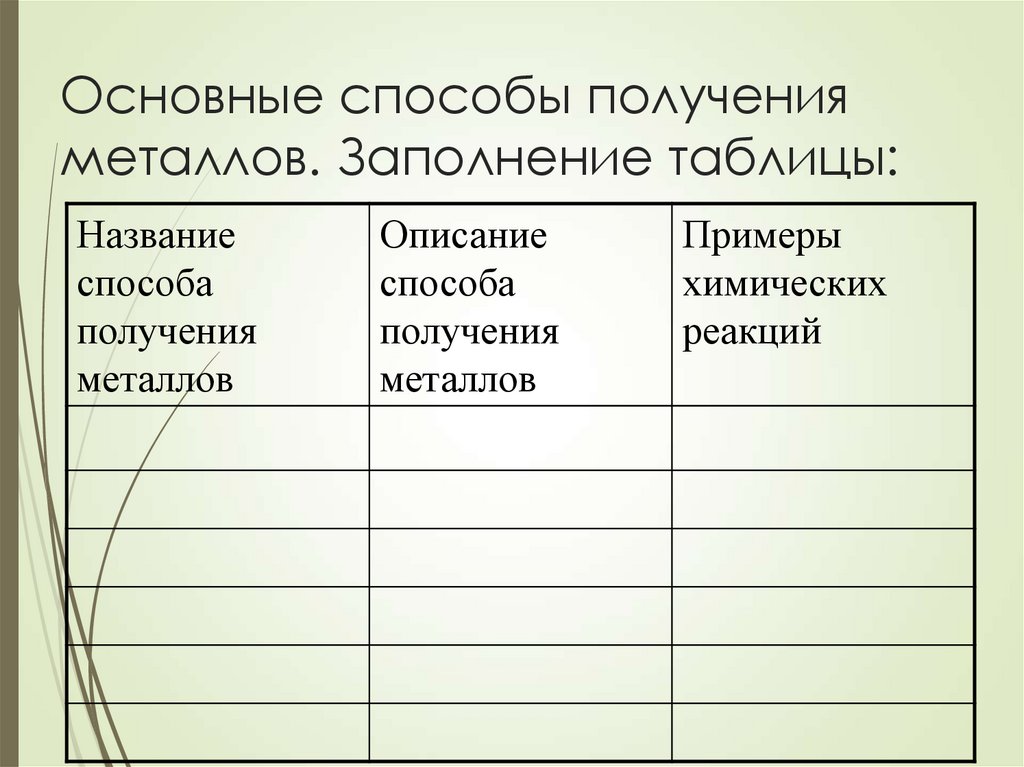
23. Основные способы получения металлов. Заполнение таблицы:
Названиеспособа
получения
металлов
Описание
способа
получения
металлов
Примеры
химических
реакций
24. Закрепление темы: Предложите цепочку производства :
Как можно получитьиз пирита FeS2
железо и серную
кислоту? Запишите
уравнения реакций.
Предложите
технологическую
цепочку
производства
свинца из
минерала
галенита PbS.
Запишите уравнения
реакций
25. Почти все справились. Молодцы!
FeS2→Fe2O3→FeFeS2→SO2→SO3→H2SO4
PbS→PbO→Pb
1)4FeS2+11O2=2 Fe2O3
+8SO2
2) Fe2O3+ 3C = 2Fe + 3CO
↑
3)2SO2+O2=2SO3
4)2SO3+H2O=H2SO4
1)2PbS+3O2=2SO2↑+2PbO
2) PbO+CO=Pb+CO2
26. Молодцы! Всем спасибо!
Домашнее задание:§12, упр. 1. Выписать
названия минералов из текста учебника.
Заполнить таблицу (слайд 23)
























 Химия
Химия Промышленность
Промышленность








