Похожие презентации:
Получение металлов (9 класс)
1. Тема урока «Получение металлов».
«Металл – всех недр земных владыка»…Тема урока
«Получение металлов».
2. Теперь, давайте вспомним прошлую тему: Составьте уравнения возможных реакций:
а) Аl + СI2 →б) Zn + AgNO3 →
в) MgO + HCl →
г) Аg + FeSO4 →
д) СuСI2 + NaOH →
а) Аg + Н2О →
б) Cu + ZnСI2 →
в) Мg + О2 →
г) Сu + НСI →
д) Fe + CuSO4 →
3. В природе металлы могут встречаться в виде простого вещества (самородки) или в виде сложного вещества:
Благородные Ме –Аu, Рt , встречаются в
природе только в
свободном виде.
Самородок серебра
Самородок золота
Самородок платины
4.
5. В природе металлы встречаются чаще всего в виде соединений (металлических руд). А что такое металлические руды?
В природе металлы встречаются чаще всего в видесоединений (металлических руд).
А что такое металлические руды?
Руды – содержащие
металлы природные
образования, в которых
металлы находятся в
количествах, пригодных в
технологическом и
экономическом
отношении для
получения металлов в
промышленности.
Из 1 тонны медной руды
можно получить лишь 4
кг чистой меди
Медная руда
6.
7. Активные Ме (до Sn) встречаются только в виде соединений. Менее активные металлы могут встречаются и в свободном виде и в виде
соединений (Sn, Cu, Hg, Ag)..
хлоридов :сильвинит КСl • NaCl,
каменная соль NaCl;
нитратов – чилийская селитра NaNO3;
сульфатов – глауберова соль Na2SO4 *
10 H2O, гипс CaSO4 • 2Н2О;
карбонатов – мел, мрамор, известняк
СаСО3, магнезит MgCO3, доломит
CaCO3 • MgCO3;
сульфидов :серный колчедан FeS2,
киноварь HgS, цинковая обманка ZnS;
фосфатов – фосфориты, апатиты
Ca 3(PO4)2 ;
оксидов – магнитный железняк Fe3O4,
красный железняк Fe2O3, бурый
железняк, содержащий различные
гидроксиды железа (III) Fe2O3 • Н2О.
8. Вопрос! Как вы думаете, ребята, какой основной химический процесс лежит в основе получения металлов?
• Так как большинство металлов встречаются в природе всоставе соединений, в которых металлы находятся в
положительной степени окисления Ме+п, значит для того
чтобы их получить в виде Ме0, необходимо про вести
процесс восстановления.
Ме+n+ne= Ме0
9.
Получением металловиз их соединений
занимается
важнейшая отрасль
промышленности,
называемая
металлургией.
10. Вопрос! Как добиться доступной формы для переработки?
Это может быть обжиг руд для перевода металлав оксид его или растворение нерастворимых
соединений: обработка кислотами, содой и др.
Катионы металлов Ме+n в металлургических
процессах являются окислителями.
Восстановителями выступают следующие
вещества: С (уголь), Н2, СО, Al, Mg, активные
металлы — щелочные и щелочноземельные,
электрический ток.
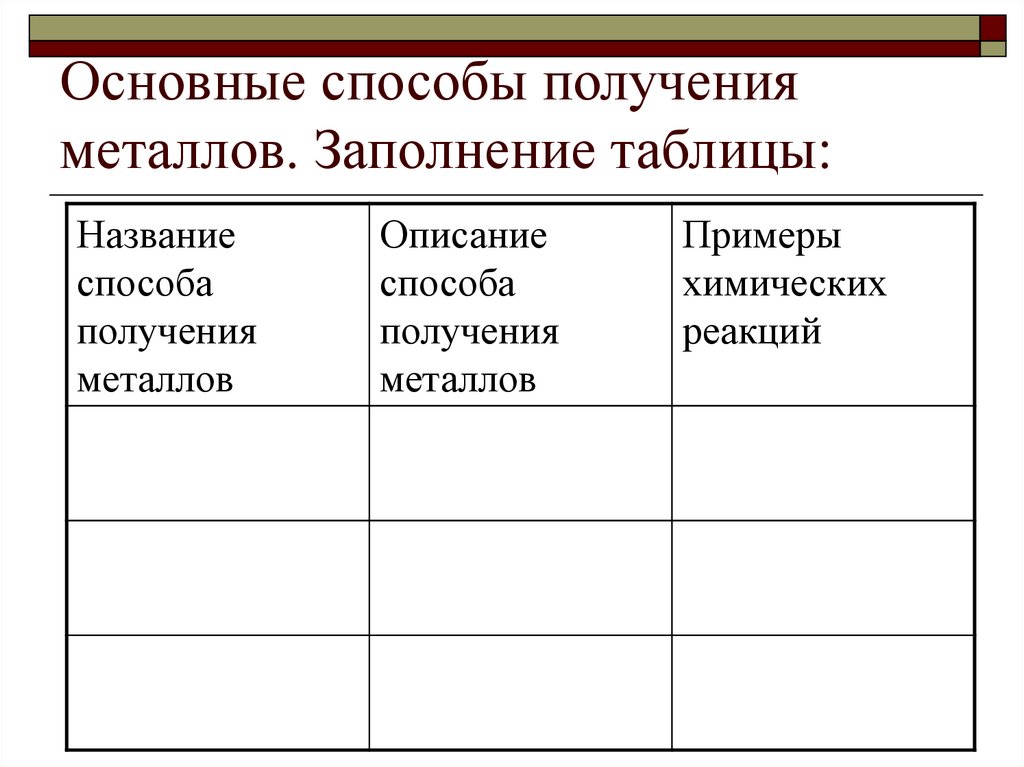
11. Основные способы получения металлов. Заполнение таблицы:
Названиеспособа
получения
металлов
Описание
способа
получения
металлов
Примеры
химических
реакций
12. Пирометаллургия.
восстановление металловиз их руд, происходящее
при высоких
температурах
Обжиг (окисление):
2PbS + ЗО2 = 2РЬО + 3SO2↑
Плавка (восстановление):
РЬО + Н2 = Pb + Н2О
WO3 + ЗН2 = W + ЗН2О
TiCl4 + 2Mg = Ti + 2MgCl2
Обжиг в древности
Отраслью пирометаллургии
является металлотермия –
восстановление Ме из оксидов
более активными металлами,
чаще алюминием (
алюминотермия). Так получают
марганец, хром, молибден,
вольфрам.
Сr 2О3 + 2 АI → АI 2О3 + 2 Сr
13. Гидрометаллургия
Методы восстановления CuO + H2SO4 = CuSO4 + Н2Ометаллов из растворов их CuSO4 + Fe = FeSO4 + Сu
солей другими более
активными металлами.
Этим способом можно
получить следующие
металлы: Ag, Au, Zn, Zn,
Mo.
14. Электрометаллургия
получение Ме спомощью
электрического тока
(электролиз).
Так получают активные
легкие Ме: щелочные и
щелочноземельные,
алюминий.
Электролиз расплава:
2 NaCI → 2Na + CI2 ↑
2КCI →2K + CI2↑
15. Термическое разложение соединений :
так получают Ме вособо чистой форме :
титан, цирконий, торий
- из галогенидов,
ванадий, ниобий,
тантал – из оксидов.
Fe(CO)5 → Fe + 5CO
Ni(CO)4→ Ni + 4CO
Микробиологический метод
тионовые бактерии
способны переводить
нерастворимые сульфиды
в растворимые сульфаты.
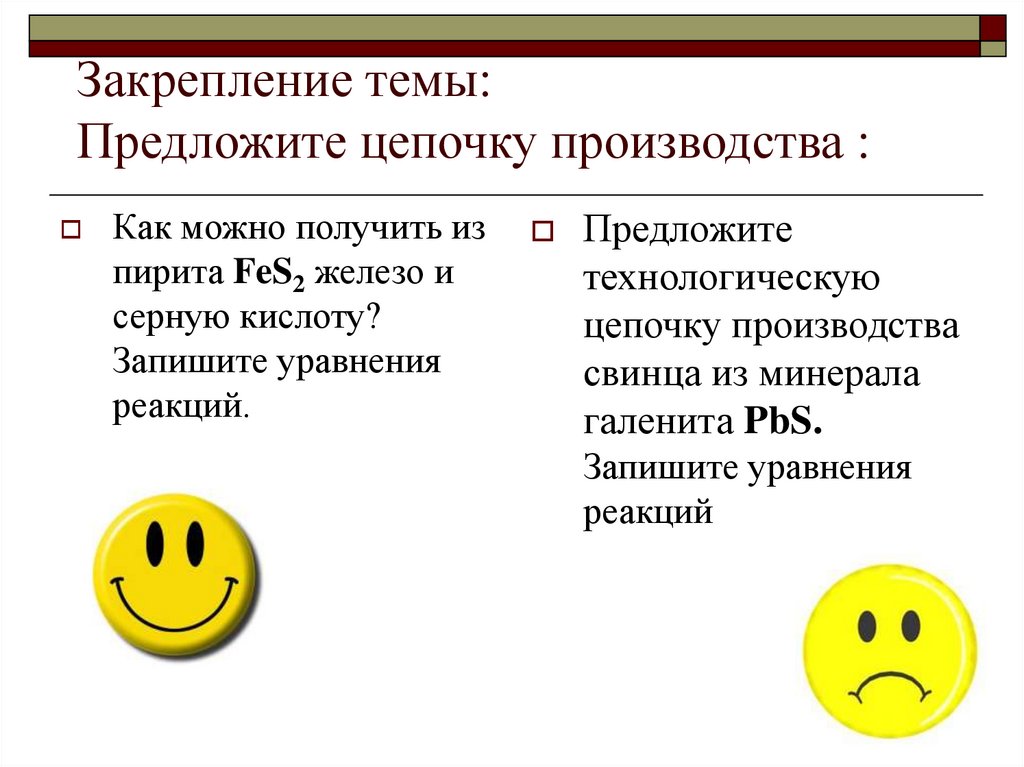
16. Закрепление темы: Предложите цепочку производства :
Как можно получить изпирита FeS2 железо и
серную кислоту?
Запишите уравнения
реакций.
Предложите
технологическую
цепочку производства
свинца из минерала
галенита PbS.
Запишите уравнения
реакций
17. Почти все справились. Молодцы!
FeS2→Fe2O3→FeFeS2→SO2→SO3→H2SO4
PbS→PbO→Pb
1)4FeS2+11O2=2 Fe2O3 +8SO2
2) Fe2O3+ 3C = 2Fe + 3CO ↑
3)2SO2+O2=2SO3
4)2SO3+H2O=H2SO4
1)2PbS+3O2=2SO2↑+2PbO
2) PbO+CO=Pb+CO2
18. Молодцы! Всем спасибо!
Домашнее задание: §12, упр. 1.Выписать названия минералов из текста
учебника.
Творческое задание: подготовить
сообщение о любом минерале и его
использовании.
















 Химия
Химия








