Похожие презентации:
Хлороводород
1.
Хлороводород2.
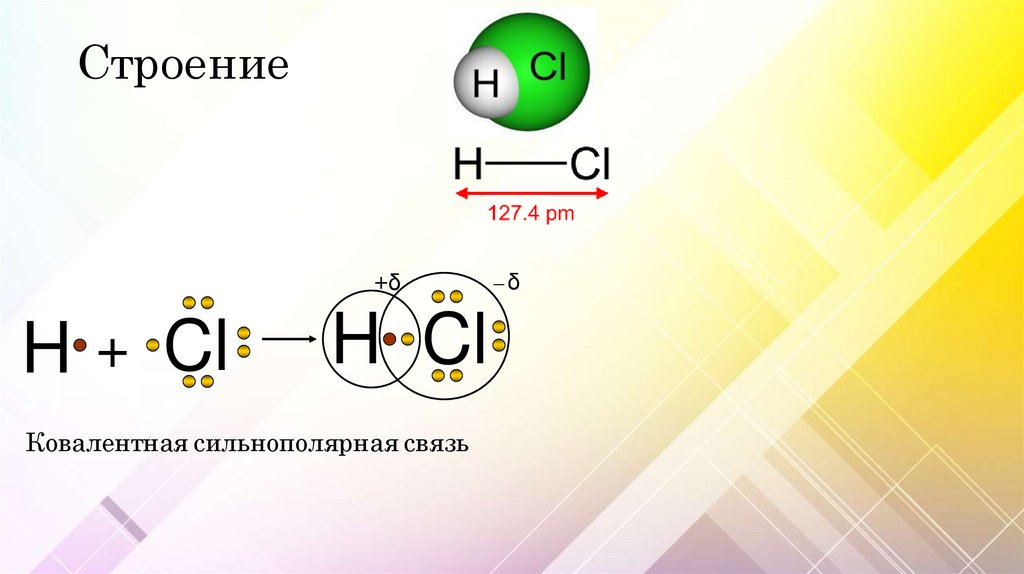
Строение+δ
H + Cl
H Cl
Ковалентная сильнополярная связь
─δ
3.
Физические свойства• Газ
• Без цвета
• С резким запахом
• Дымится на воздухе
• Ядовит
• Легко растворим в воде
• Немного тяжелее воздуха
• Термически устойчив
4.
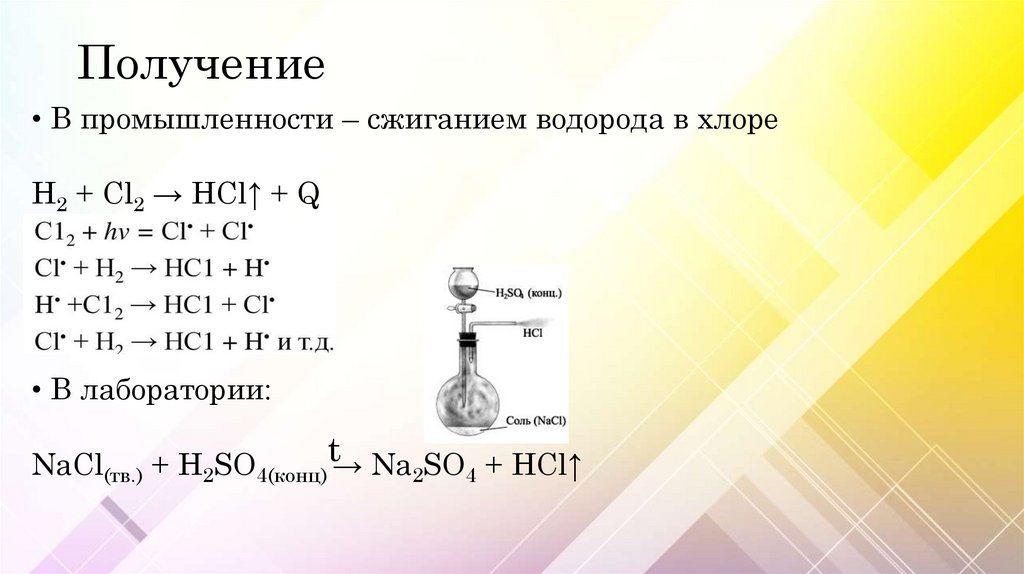
Получение• В промышленности – сжиганием водорода в хлоре
H2 + Cl2 → HCl↑ + Q
• В лаборатории:
NaCl(тв.) + H2SO4(конц)t→ Na2SO4 + HCl↑
5.
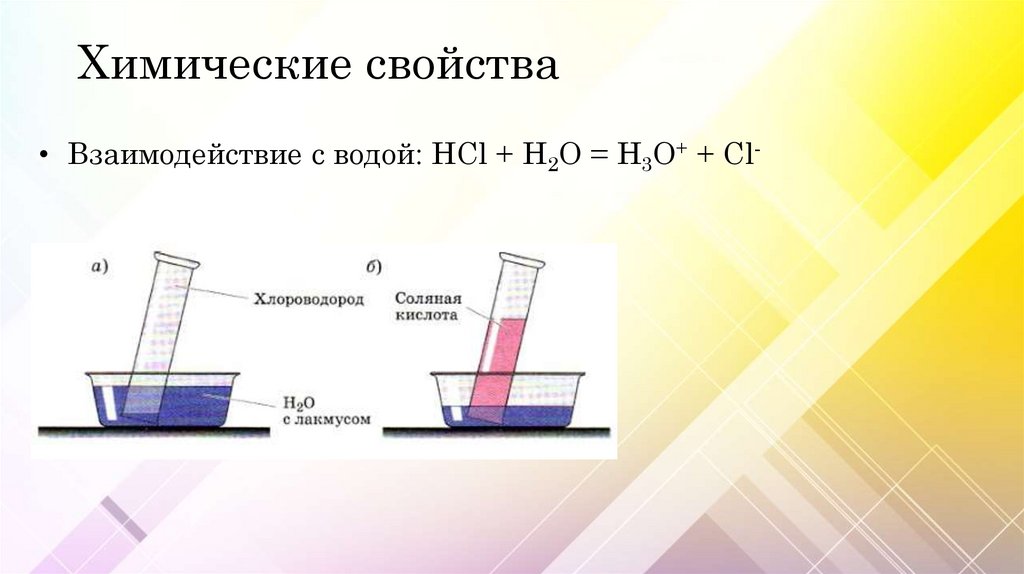
Химические свойства• Взаимодействие с водой: HCl + H2O = H3O+ + Cl-
6.
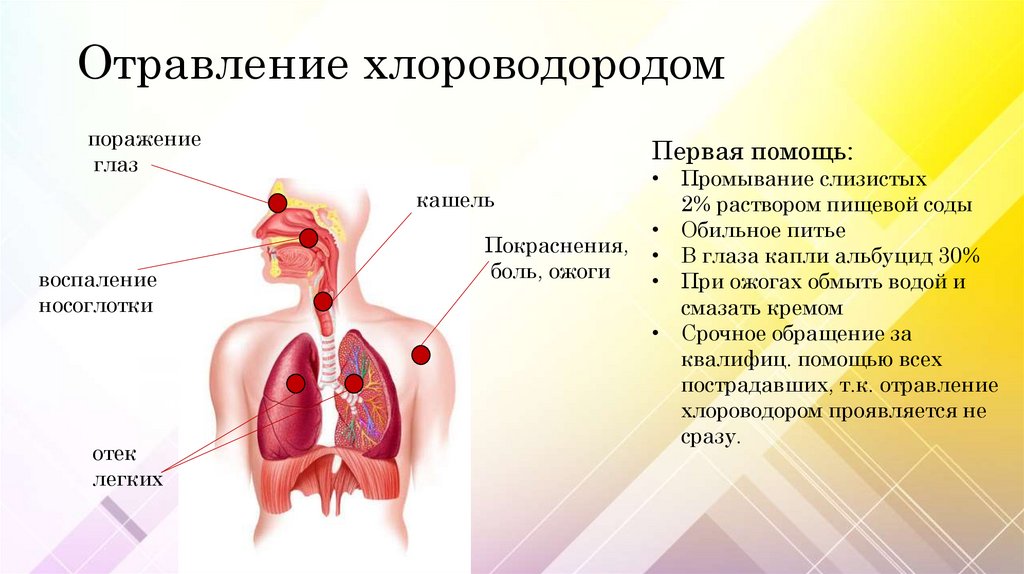
Отравление хлороводородомпоражение
глаз
Первая помощь:
кашель
воспаление
носоглотки
отек
легких
Покраснения,
боль, ожоги
• Промывание слизистых
2% раствором пищевой соды
• Обильное питье
• В глаза капли альбуцид 30%
• При ожогах обмыть водой и
смазать кремом
• Срочное обращение за
квалифиц. помощью всех
пострадавших, т.к. отравление
хлороводором проявляется не
сразу.
7.
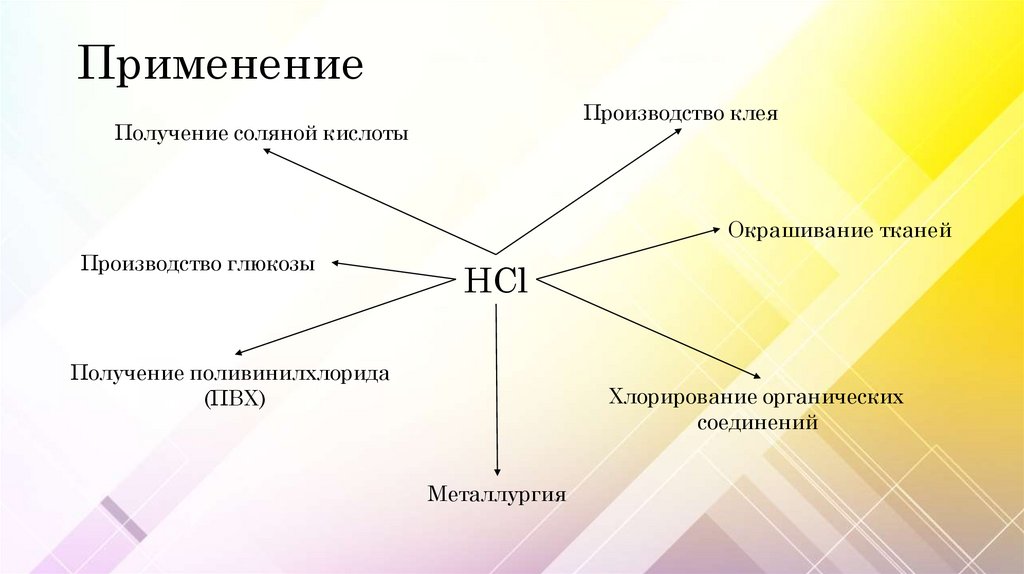
ПрименениеПроизводство клея
Получение соляной кислоты
Окрашивание тканей
Производство глюкозы
HCl
Получение поливинилхлорида
(ПВХ)
Хлорирование органических
соединений
Металлургия
8.
Хранение и маркировкаХранение хлороводорода:
• В наземных или немного заглубленных
горизонтальных емкостях
• Под давлением собственных паров
• Отдельно от горючих и активных веществ
• Помещение для хранения должно хорошо
проветриваться и быть сухим



 Химия
Химия








