Похожие презентации:
Кислород (8 класс)
1.
Кислород8 класс
2.
Содержание в природеВ земной коре ω (О) ≈ 49%
В мировом океане ω (О) ≈ 90%
3.
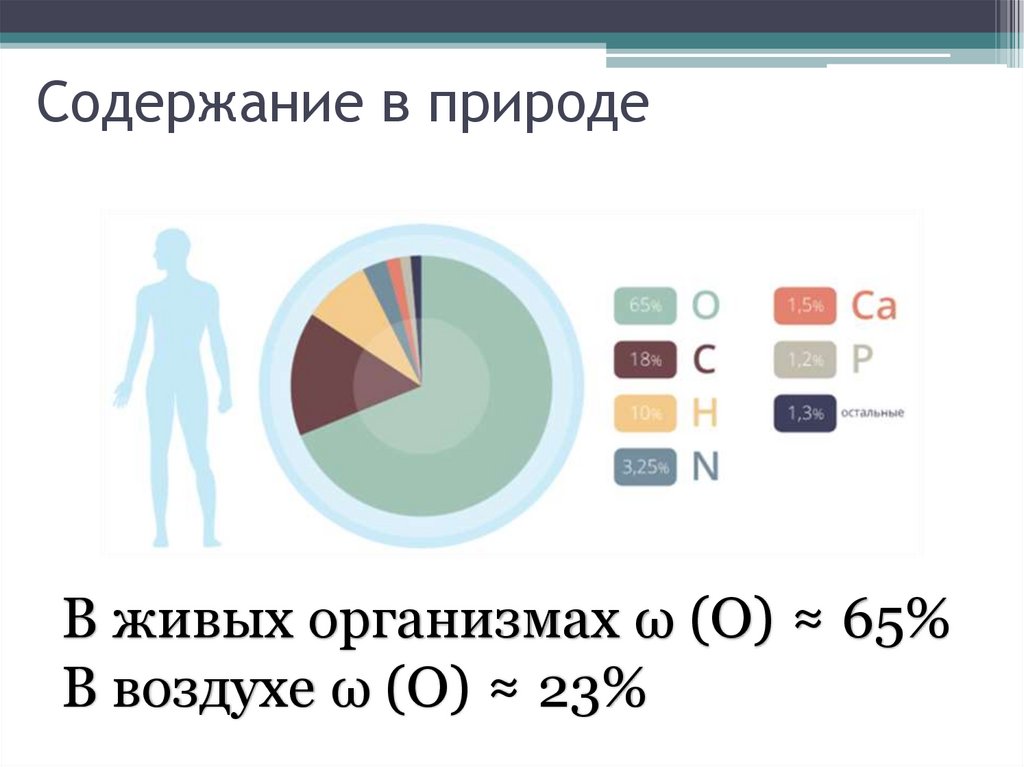
Содержание в природеВ живых организмах ω (О) ≈ 65%
В воздухе ω (О) ≈ 23%
4.
Оксид кремния (IV): песок, кварц,кремнезем
5.
Оксид алюминия: глинозем,боксит, корунд, рубин, сапфир
6.
7.
Вода H2OУглекислый газ CO2
Сернистый газ SO2
Глюкоза C6H12O6
Карбонаты (мрамор, известняк)
CaCO3
8.
Кислород – химический элементНаходится в VIA подгруппе
ПСХЭ Д.И.Менделеева
Порядковый номер 8
Ar (O) = 16
9.
Кислород – простое вещество2 аллотропные формы:
Кислород O2
Озон O3
10.
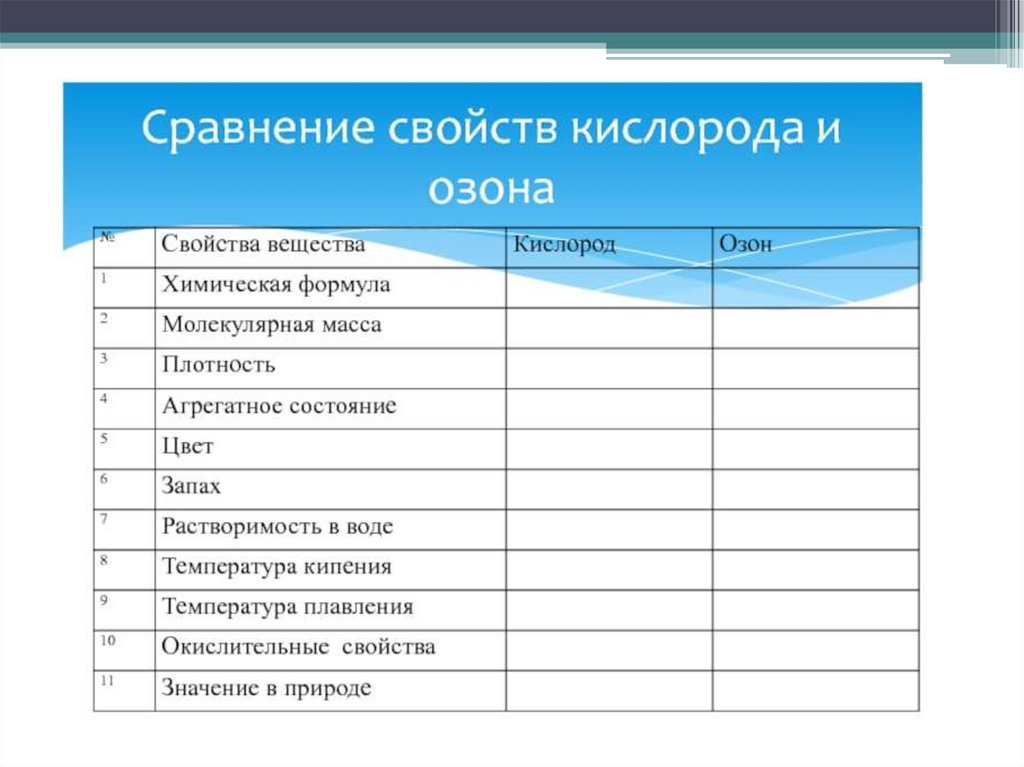
Физические свойства11.
12.
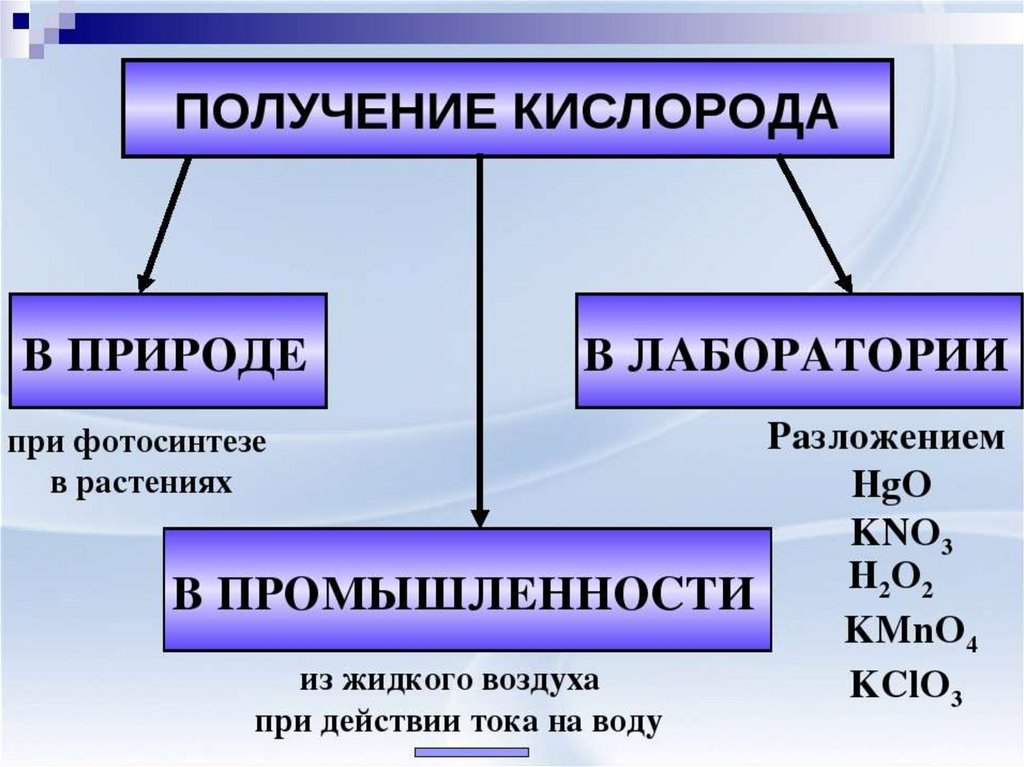
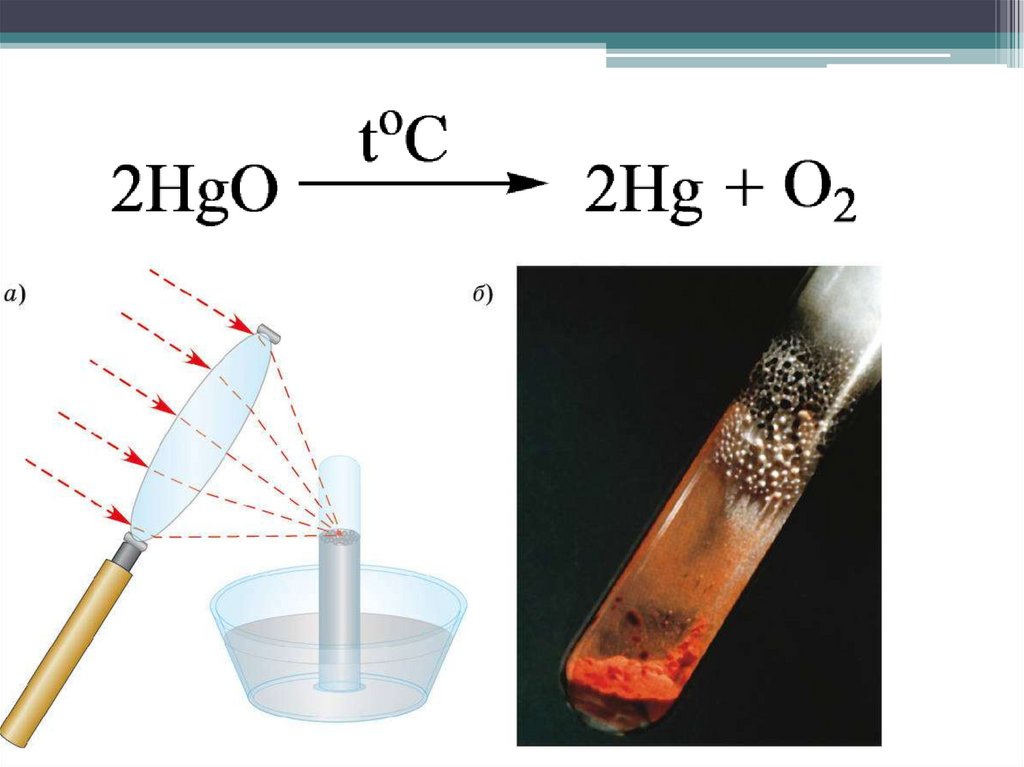
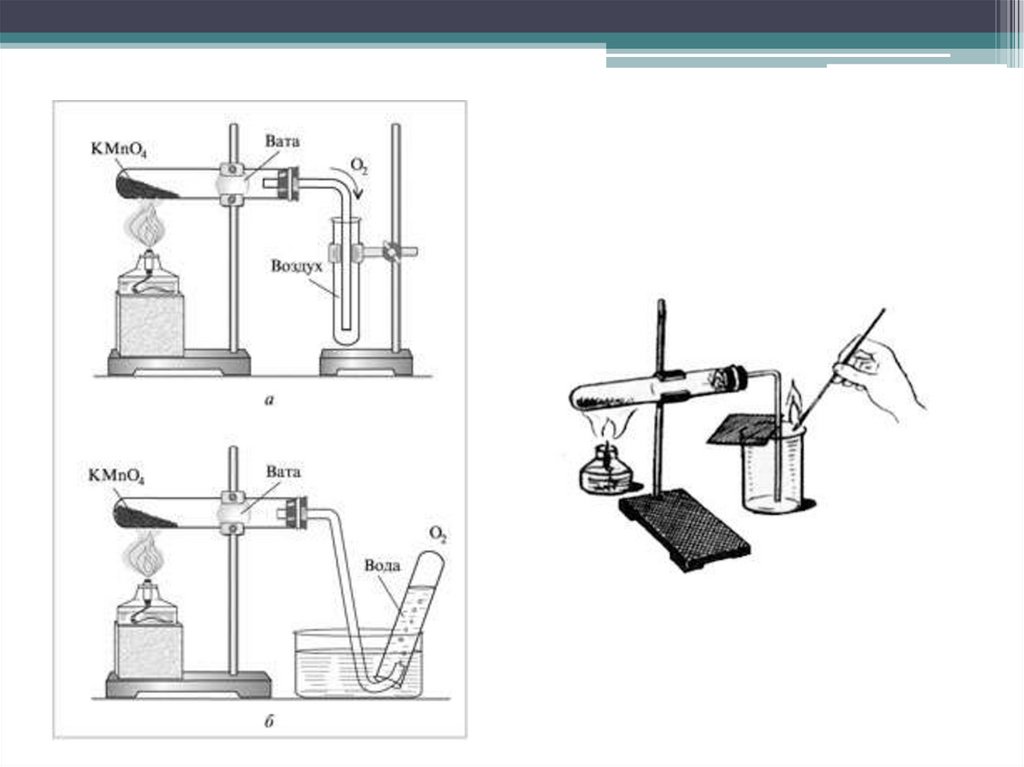
История открытия13.
14.
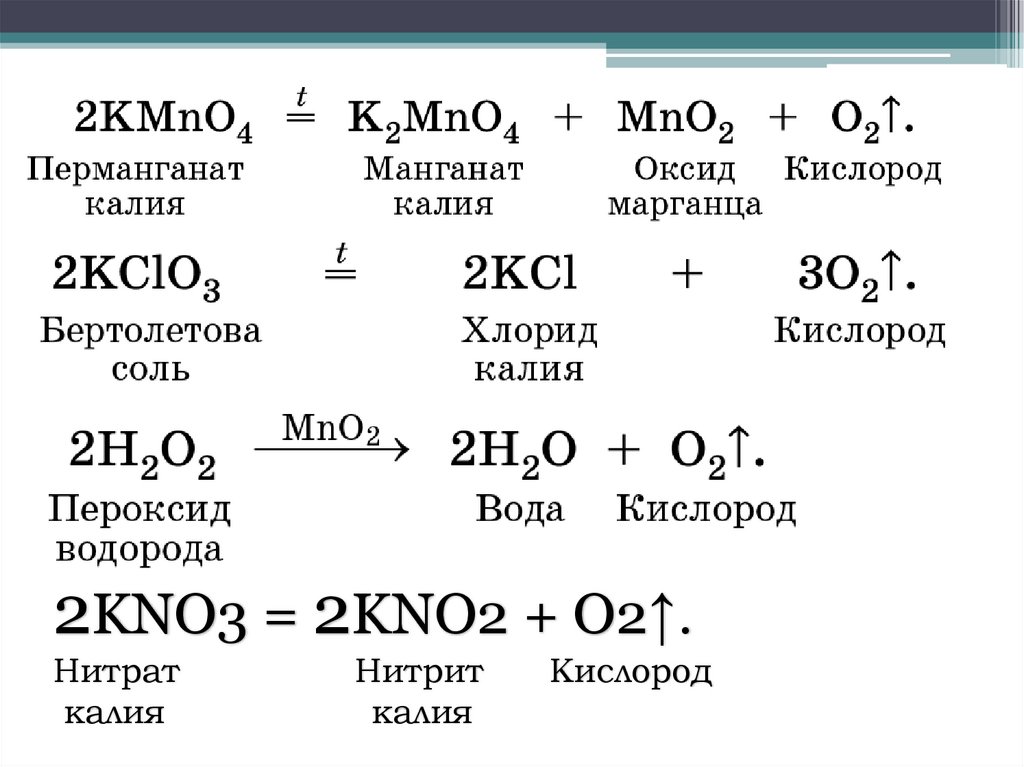
2KNO3 = 2KNO2 + O2↑.Нитрат
калия
Нитрит
калия
Кислород
15.
Катализаторы – химическиевещества, ускоряющие реакции,
но не расходующиеся в
процессе реакции.
Ферменты – биологические
катализаторы.
В реакции разложения перекиси водорода
H2O2 катализатором является диоксид
марганца MnO2, фермент каталаза.
16.
17.
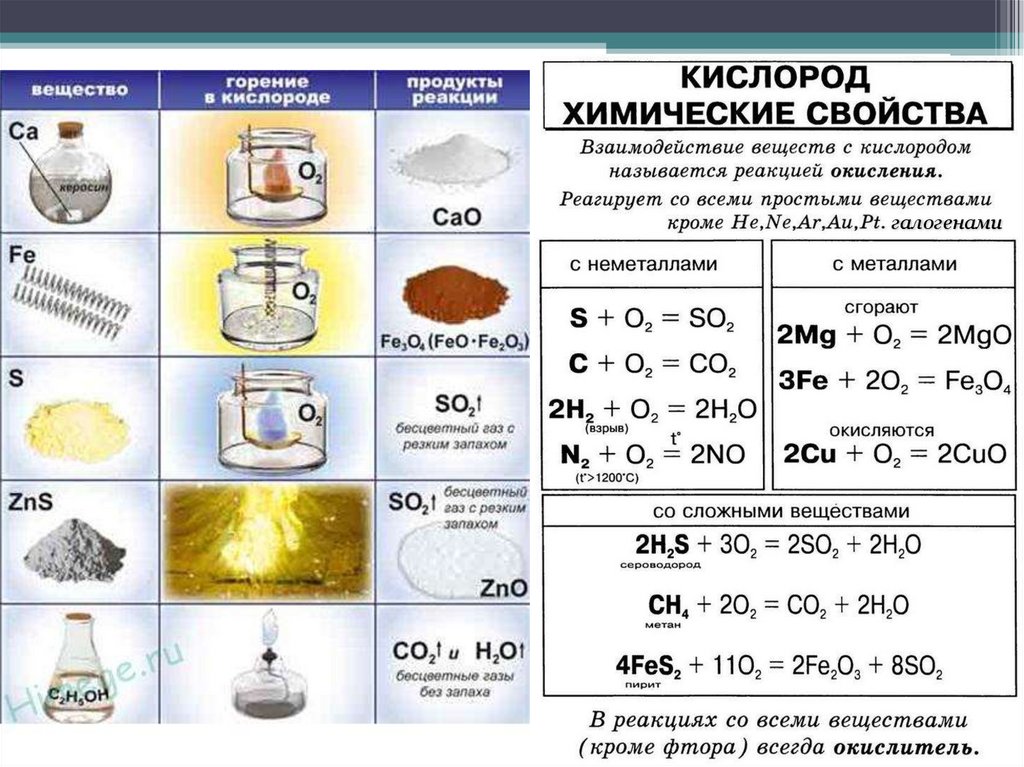
Химические свойства• Поддерживает горение.
• Окисляет многие вещества.
• При окислении простых веществ обычно
образуются оксиды.
ВАЖНО!
Не все бинарные соединения с кислородом
являются оксидами:
H2O2 – пероксид водорода (перекись водорода)
OF2 – фторид кислорода
18.
Химические свойства• Реагирует с металлами
(кроме Au, Pt).
• Реагирует с неметаллами (кроме
инертных газов, хлора, брома,
йода).
• Реагирует со многими сложными
веществами (которые можно
окислить).
19.
галогенами20.
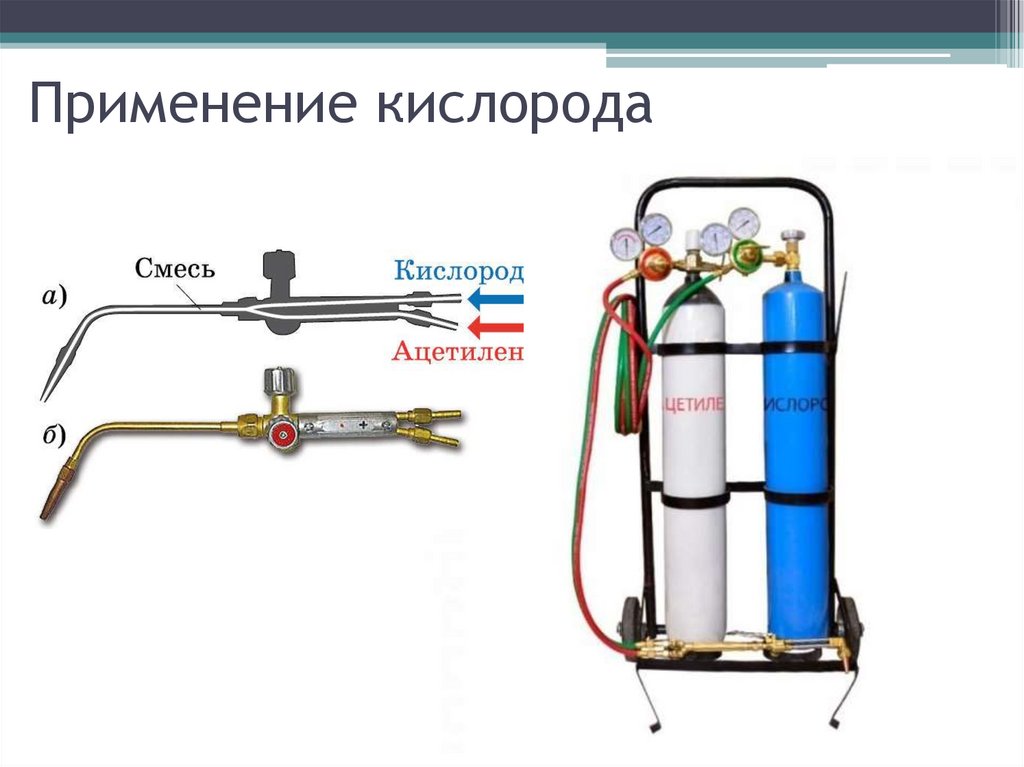
Хранение, перевозка – в стальныхбаллонах голубого цвета
21.
а — сосуд Дьюара;б — разрез лабораторного сосуда Дьюара;
в — прозрачный сосуд Дьюара с жидким
кислородом














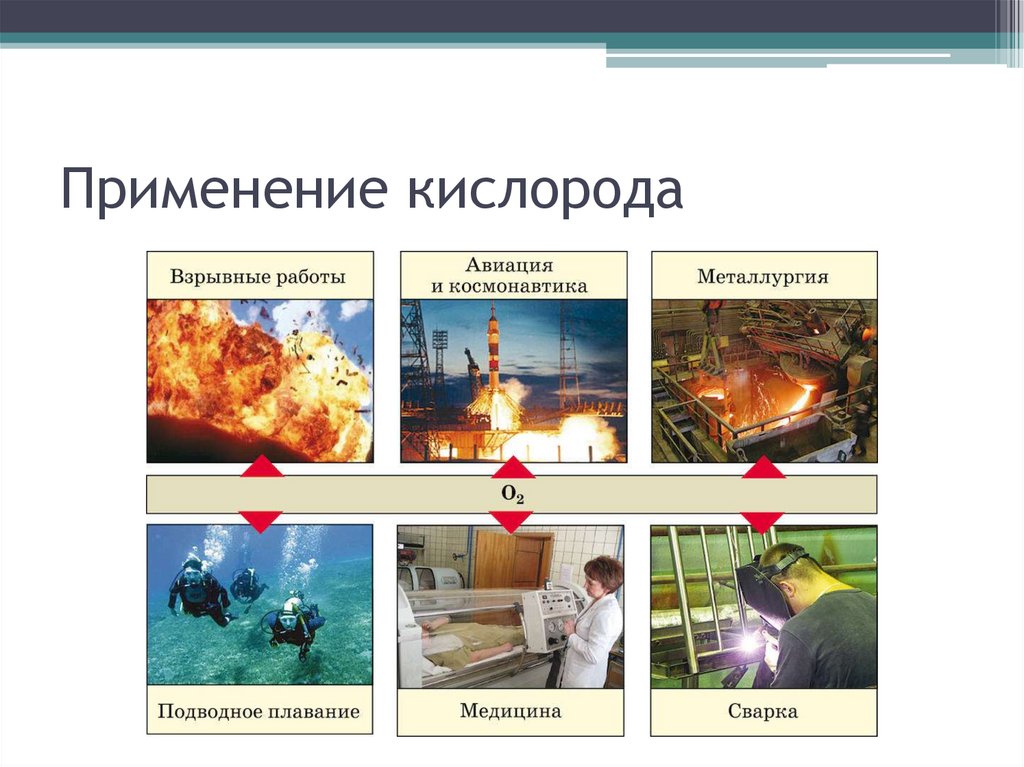
 Химия
Химия








