Похожие презентации:
Энергетический обмен и ОПК
1.
Энергетическийобмен и ОПК
2.
Взаимосвязь обмена веществ и энергииОбмен веществ включает следующие этапы:
- поступление веществ в организм;
- метаболизм, или промежуточный обмен;
- выделение конечных продуктов обмена.
Вещества поступают в организм в результате
дыхания (кислород), питания и пищеварения.
Основные вещества, поступающие с пищей –
это макромолекулы:
– полисахариды;
– жиры;
– белки;
3.
В процессе пищеварения макромолекулырасщепляются на более мелкие молекулы (глюкоза,
жирные кислоты, глицерол, аминокислоты).
В клетках организма эти вещества подвергаются
превращениям, включаясь в метаболизм (обмен
веществ).
Метаболизм – это совокупность химических
реакций, протекающих в клетках организма с
момента поступлений пищевых веществ в организм
до образования конечных продуктов обмена.
Две стороны метаболизма:
1. Катаболизм – расщепление сложных молекул
до более простых (энергия выделяется);
2. Анаболизм – синтез сложных веществ из
простых (затрата энергии в виде АТФ).
4.
Этапы катаболизмаIэтап. Происходит в кишечнике (переваривание
пищи) или в лизосомах (самообновление клеток) при
расщеплении уже ненужных или лишних молекул. При
этом освобождается около 1% энергии, заключенной в
молекуле. Она рассеивается в виде тепла.
II этап (локализация - цитозоль и митохондрии).
Вещества, образованные при внутриклеточном
гидролизе или проникающие в клетку из крови, на
втором этапе обычно превращаются в ПВК
(моносахариды в гликолизе),в ацетил-SKoA, в пируват
и другие кетокислоты (в катаболизме аминокислот), в
ацетил-SКоА (при β-окислении жирных кислот).
На этом этапе выделяется около 30% энергии,
заключенной в молекуле, и при этом запасается около
13% от всей энергии вещества (или примерно 43% от
выделенной на этом этапе энергии).
5.
6.
III этап. Все реакции идут в митохондриях.Ацетил-SКоА включается в реакции ЦТК, где
углероды веществ окисляются до СО2. Выделенные
атомы водорода соединяются с НАД и ФАД,
восстанавливают
их,
после
чего
НАДН
и
ФАДН2 переносят водород в ЦПЭ, расположенную на
внутренней мембране митохондрий. Сюда же отдают свои
атомы
водорода
молекулы
НАДН
и
ФАДН2,
образованные на втором этапе (гликолиз, окисление
жирных кислот и аминокислот).
В третьем этапе выделяется до 70% всей энергии
вещества. Из этого количества усваивается почти две
трети (66%), что составляет около 46% от общей. Таким
образом, из 100% энергии окисляемой молекулы клетка
запасает больше половины – 59%.
На внутренней мембране митохондрий в результате
"окислительного фосфорилирования" образуется вода и
главный продукт биологического окисления – АТФ.
7.
Роль АТФОдна из важнейших функций клетки – функция
обмена веществ – обеспечение клетки энергией.
Совокупность
реакций,
обеспечивающих
клетки
энергией, называется энергетическим обменом.
АТФ служит энергетической «валютой» клетки и
используется во всех реакциях обмена, требующих
затраты энергии. Богатые энергией молекулы не
перемещаются свободно из одной клетки в другую, а
образуются в том месте, где они должны быть
использованы.
АТФ играет центральную роль в энергетическом
обмене клетки. Она является непосредственным
источником
энергообеспечения
любой
клеточной
функции. Любые виды клеточной активности (движение,
биосинтез, генерация электричества, света и т.д.)
совершаются за счет энергии, освобождаемой в
результате гидролиза АТФ.
8.
Для синтеза АТФ используется 2 источникаэнергии:
1) Окислительное фосфорилирование происходит за
счет энергии переноса электронов от органических
веществ к O2 (может происходить только в аэробных
условиях).Этим способом образуется ~ 95% всего АТФ
в организме.
2) Субстратное фосфорилирование происходит за счет
энергии
макроэргических
связей
некоторых
соединений (1,3-бифосфоглицерат, фосфоенолпируват,
сукцинил-KoA, креатинфосфат и др). Может
происходить как в матриксе митохондрий, так и в
цитоплазме клеток независимо от присутствия O2.
Это вспомогательный путь синтеза АТФ в организме
(образуется ~ 5 % от всего АТФ организма).
За сутки в организме человека может
синтезироваться до 60 кг АТФ (столько же и
расходуется).
9.
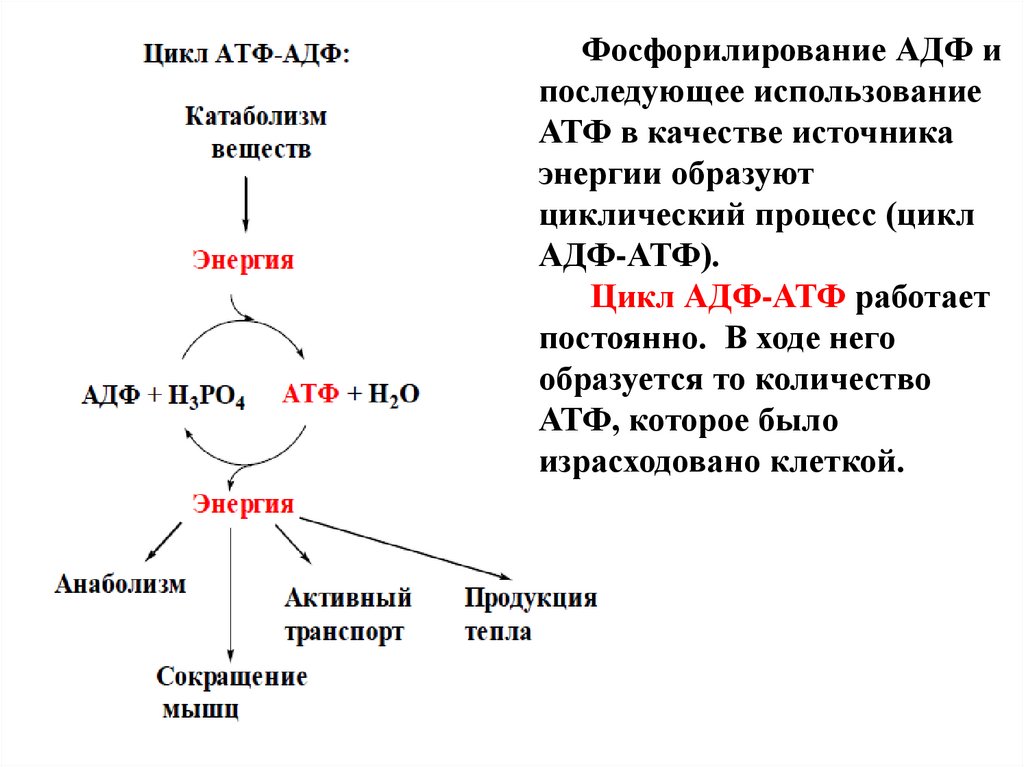
Фосфорилирование АДФ ипоследующее использование
АТФ в качестве источника
энергии образуют
циклический процесс (цикл
АДФ-АТФ).
Цикл АДФ-АТФ работает
постоянно. В ходе него
образуется то количество
АТФ, которое было
израсходовано клеткой.
10.
Окислительное декарбоксилирование ПВКПВК предварительно путем диффузии переносится
из цитозоля в митохондрии, реакция ее превращения
катализируются мультиферментным пируват-ДГкомплексом, состоящим из 3-х ферментов и 5
коферментов:
I фермент: Пируватдекарбоксилаза (E1).
Кофермент: тиаминдифосфат (ТДФ).
II фермент: Дигидролипоил-ацетилтрансфераза (E2).
Коферменты: липоевая кислота и коэнзим A (HS-KoA).
III фермент: Дигидролипоилдегидрогеназа (E3).
Коферменты: FAD и NAD+.
Коферменты ТДФ, ЛК и FAD являются
простетическими группами и прочно связаны с АЦ
соответствующих ферментов.
HS-KoA и NAD+ присоединяются к ферментам ПДК
только во время реакции.
11.
СО2Схема окислительного декарбоксилирования ПВК
12.
Превращение пирувата в ацетил-KoA происходитв 5 стадий:
I - Е1 - пируватдекарбоксилаза катализирует
декарбоксилирование пирувата и перенос С2-фрагмента на
ТДФ с образованием гидроксиэтила;
II - Е2 - дигидролипоилтрансацетилаза катализирует
окисление гидроксиэтильной группы и перенос С2фрагмента на амид липоевой кислоты;
III - ацетилированная трансацетилаза взаимодействует
с HS-КоА с образованием восстановленной формы
липоамида и ацетил-КоА;
IV - восстановленная форма трансацетилазы
дегидрируется FAD-зависимой дигидролипоил-ДГ(Е3);
V - FADH2 в составе Е3 дегидрируется при участии
NAD+.
В реакциях, катализируемых ПДК, липоевая кислота,
связанная в ферменте Е2 с остатками лизина,
функционирует как «поворотный кронштейн»,
переносящий атомы водорода и ацетильные остатки от
одного фермента к другому
13.
Рабочей частью ТДФ служит тиазоловое кольцо, ккоторому присоединяется продукт декарбоксилирования
пирувата - гидроксиэтил. В активном центре фермента
происходит прямое взаимодействие двух атомов углерода
с образованием между ними ковалентной связи.
14.
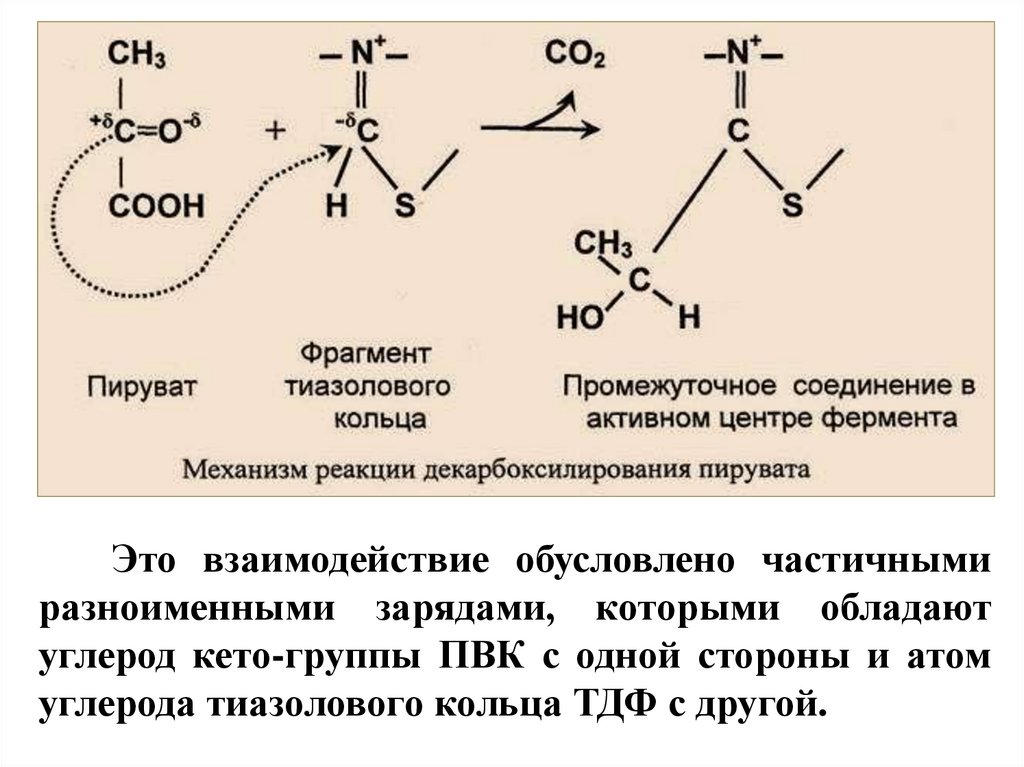
Это взаимодействие обусловлено частичнымиразноименными зарядами, которыми обладают
углерод кето-группы ПВК с одной стороны и атом
углерода тиазолового кольца ТДФ с другой.
15.
«Якорной» группой липоамида являетсядисульфидная группа, обусловливающая
окислительно-восстановительные свойства
липоевой кислоты и, естественно, липоамида.
Липоевая кислота в составе дигидролипоилтрансацетилазы
16.
Общая схема реакции:ПВК+НSКоА+НАД+ ацетил-КоА+ СО2+
НАД·Н + H+
Основной продукт реакции – Ацетил-KoA
поступает в цикл Кребса(ЦТК).
Образующийся в ходе реакции NADH + H+
вступает в ЦПЭ и способствует синтезу 3 моль
АТФ в расчете на 1 моль пирувата путём
окислительного фосфорилирования (P/O ≤ 3).
17.
Цикл Кребса(ЦТК)Процесс распада ацетил-КоА в начале ХХ в.
изучал американский биохимик Г. Кребс. Он же
доказал, что процесс имеет циклический характер. В
1953г. за исследования в этой области он был
удостоен Нобелевской премии, а процесс стал носить
его имя.
Цикл Кребса (цитратный цикл, цикл лимонной
кислоты, цикл трикарбоновых кислот) – это 8
последовательных ферментативных реакций, в ходе
которых происходит распад Ацетил-KoA до 2-х
молекул CO2 и образование доноров водорода для
ЦПЭ (НАДН + H+ и ФАДH2).
Реакции цикла Кребса происходят в матриксе
митохондрий.
18.
Ферменты:1-Цитратсинтаза; 2,3- аконитаза; 4,5 -изоцитратДГ;6 - α-кетоглутаратдегидрогеназный комплекс;
7 – сукцинаттиокиназа; 8- сукцинатДГ; 9- фумараза; 10- малатДГ.
19.
Регуляция пируватдегидрогеназного комплексаАктивность ПДК регулируется различными
способами:
- доступностью субстратов,
- ингибированием продуктами реакции,
- аллостерически и
- путём ковалентной модификации.
Ковалентная модификация ПДК осуществляется
фосфорилированием и дефосфорилированием.
Регуляторным компонентом ПДК является
фермент E1.
В состав ПДК кроме основных ферментов E1, E2 и
E3 входят 2 регуляторных субъединицы – киназа
ПДК (фосфорилирует фермент E1) и фосфатаза ПДК
(дефосфорилирует фермент E1).
При фосфорилировании ПДК инактивируется.
20.
21.
Киназа ПДК аллостерически активируется NADH,ацетил-КоА и АТФ и ингибируется пируватом, AДФ,
HS-KoA, NAD+.
В абсорбтивный период глюкоза поступает в
клетки и распадается с образованием пирувата.
Высокая концентрация пирувата влияет на
активность ПДК двумя способами:
- поддерживает ПДК в дефосфорилированной
активной форме, так как пируват наиболее сильный
ингибитор киназы ПДК;
- пируват аллостерически активирует
дефосфорилированную активную форму ПДК,
действуя согласованно с другими активаторами субстратами реакций - NAD+ и HS-KoA.
В результате создаются условия для образования
ацетил-КоА из глюкозы. В печени ацетил-КоА
используется для синтеза жирных кислот.
22.
В адипоцитах под влиянием инсулина увеличиваетсяконцентрация Са2+ в митохондриях, что активирует
фосфатазу пируватдегидрогеназного комплекса и
переводит его в активное дефосфорилированное
состояние. В результате создаются условия для
превращений: пируват - ацетил-КоА - жирные
кислоты - жиры (основная форма запасания энергии в
организме).
Регуляция ионами Са2+ особенно важна в
мышцах. Потенциал действия увеличивает
концентрацию Са2+ в митохондриях, что одновременно
ингибирует киназу и активирует фосфатазу; это
быстро переводит ПДК в активную
дефосфорилированную форму. Одновременно
Са2+ активирует регуляторные ферменты ЦТК и
ацетил-КоА быстро окисляется, обеспечивая синтез
АТФ для мышц.
23.
Регуляция цикла КребсаВ цикле Кребса 3 регуляторных фермента:
Цитратсинтаза, Изоцитратдегидрогеназа и
α-кетоглутаратдегидрогеназный комплекс.
Цитратсинтаза не является аллостерическим
ферментом. Активность фермента регулируется,
главным образом, концентрациями ОА (ЩУК) субстрата фермента и цитрата - продукта
реакции.
Когда отношение NADH/NAD+ снижается,
ускоряется превращение малата в оксалоацетат
и увеличивается скорость образования цитрата;
при повышении концентрации цитрата скорость
его синтеза соответственно снижается.
24.
Изоцитратдегидрогеназа - самый медленныйфермент ЦТК. Ферменталлостерически активируется
АДФ и Са2+. Кроме того, активность
изоцитратдегидрогеназы зависит от величины
отношения NADH/NAD+, как у всех NAD-зависимых
дегидрогеназ.
α-Кетоглутаратдегидрогеназный комплекс по
структуре и функциям сходен с ПДК. В его состав
входят 3 ферментных комплекса:
α-кетоглутаратдекарбоксилаза,
дигидролипоилтранссукцинилаза и
дигидролипоилдегидрогеназа.
Набор коферментов аналогичен таковому в ПДК.
Однако в отличие от ПДК в этом комплексе
отсутствуют регуляторные протомеры. Активность
фермента зависит от концентраций АТФ и АДФ, NAD+
и NADH, ингибируется сукцинил-КоА и
активируется Са2+.
25.
26.
27.
28.
Цепь переноса электронов (ЦПЭ)Цепь переноса электронов (дыхательная цепь) –
это сложная система переносчиков, при участии
которой происходит процесс последовательного
переноса электронов от НАДН и ФАДH2 на O2.
Дыхательной цепи предшествует отнятие
атомов водорода от окисляемых субстратов
(реакции дегидрирования).
Эти реакции относятся к окислительновосстановительным.
Их катализируют ферменты оксидоредуктазы
(подкласс: дегидрогеназы).
Бóльшая часть ОВР в клетке происходит в
матриксе митохондрий.
Реакции дегидрирования происходят в ходе
специфических и общего пути катаболизма.
29.
Структурная организация цепи переносаэлектронов (ЦПЭ)
Система ферментов и белков,
обеспечивающая взаимосвязь (сопряжение)
процессов окисления и фосфорилирования
АДФ, получила название цепи переноса
электронов или дыхательной цепи. Это
мультиферментная система, постепенно
транспортирующая протоны и электроны на
кислород с образованием воды.
В основе ее лежит работа трех важнейших
ферментных комплексов, а также двух
низкомолекулярных переносчиков.
30.
Компоненты ЦПЭ:Комплекс I – NADH-дегидрогеназа+ ФМН +FeS-белки;
Комплекс II – Сукцинатдегидрогеназа+ ФАД
+Fe-S-белки;
Комплекс III – Убихинолдегидрогеназа или
цитохром –с-редуктаза, содержит цитохромы b,
c1 и Fe-S-белки;
Комплекс IV – Цитохромоксидаза, цитохромы а
и а3, в которых содержится Сu или Fe);
Комплекс V – АТФ-синтетаза;
Низкомолекулярные переносчики:
– Убихинон (кофермент Q);
– Цитохром С
31.
Все компоненты ЦПЭ встроены во внутреннююмембрану митохондрий в порядке возрастания ОВП
(редокс-потенциалов).
Самый
низкий
редокспотенциал у НАДН (-0,32В), а самый высокий редокспотенциал у кислорода (+0,82В).
Величины
редокс-потенциалов всех редокссистем ЦПЭ находятся в области значений,
характеризующих термодинамическую устойчивость
воды (при потенциалах ниже -0,42В начинается
восстановление воды до H2, а при выше +0,82В –
окисление воды до O2).
32.
Электроны и протоны, снимаемые с белков,липидов и углеводов (реакции дегидрирования),
поступают в дыхательную цепь двумя путями:
-при дегидрировании субстратов с помощью
НАД-зависимых дегидрогеназ комплекс I переносит
электроны и протоны через ФМН и FeS-белок на
убихинон;
-при
окислении
субстратов
(сукцината)
флавинзависимыми дегидрогеназами электроны и
протоны переносятся на убихинон комплексом II,
содержащим ФАДН2-дегидрогеназу и FeS-белок.
В обоих случаях окисленная форма убихинона
(КоQ) восстанавливается до убигидрохинона (КоQН2
– коллекторная функция). Далее только электроны
от КоQН2 передаются по цепи комплексом III на
цитохром С.
33.
Убихинон (Коэнзим Q10) -жирорастворимый хинон(quinone), широко распространенный в природе
(ubiquitous - вездесущий), имеет длинный гидрофобный
“хвост”(40 углеродных атомов в 10 остатках изопрена),
дающий возможность ему легко перемещаться в
липидном бислое внутренней мембраны митохондрий.
34.
В Fe2S2 центре каждый из двух атомов железа связанкоординационными
связями
с
двумя
атомами
неорганической серы и двумя остатками цистеина в белке.
В Fe4S4 четыре атома железа связаны с четырьмя
атомами серы и четырьмя остатками цистеина в белке.
35.
Цитохромы ( гемопротеины) присутствуют вовсех типах организмов. Простетической группой и
рабочей частью всех цитохромов является гем.
Цитохромы друг от друга отличаются:
- различием боковых цепей в структуре гема;
- различием в структуре полипептидных цепей;
- различием в способе связи п/п цепей с гемом.
В зависимости от способности поглощать свет в
определённой части спектра все цитохромы делят на
группы а, b, с.
Структурные особенности разных видов
цитохромов определяют различие в их ОВП.
В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с,
с1). За исключением цитохрома С, все цитохромы
находятся во внутренней мембране митохондрий в
виде сложных белковых комплексов.
36.
Дальнейший перенос ē осуществляетсистема цитохромов, которые в цепи окисления
располагаются между убихиноном и
кислородом: b→ с1 → с → а-а3.
В ходе каталитического процесса
валентность железа цитохромов обратимо
изменяется:
Fe3+ + ē ↔ Fe2+.
Цитохромы b, с1 , с выполняют функцию
промежуточных переносчиков ē, а комплекс
цитохромов а-а3 (цитохромоксидаза) является
терминальным дыхательным ферментом,
непосредственно взаимодействующий с O2.
Работа всех комплексов (I, III, IV)
сопровождается переносом H⁺ из матрикса в
межмембранное пространство.
37.
Цитохромоксидаза, помимо гема содержиттакже ионы Cu²⁺, которые участвуют в переносе
электронов, меняя валентность:
Cu2++ ē ↔ Cu+
Электроны от цитохрома c последовательно
присоединяются сначала к ионам Fe3+
цитохромов a и а3, затем к ионам Cu2+ и,
наконец, попадают на O2. При этом также
происходит присоединение к кислороду H⁺ из
матрикса, вследствии чего образуется
метаболическая вода (~ 400 мл метаболической
воды в сутки):
½ O2 + 2ē + H⁺ → Н2O
38.
Вода в IV ферментативном комплексе образуется врезультате переноса 2℮‾на O2. При переносе одного ℮‾
образуется супероксид-радикал кислорода, что ведет
образованию Н2O2 . Два фермента- супероксиддисмутаза
и каталаза защищают компоненты клетки от активных
форм кислорода.
39.
Хемиосмотическая теория П. МитчеллаЭта теория предложена в 1961 году английским
биохимиком Питером Деннисом Митчеллом
(Нобелевская премия, 1978) и им же введено понятие
сопрягающей мембраны, т.е. мембраны, на которой
процесс транспорта ē соряжен с процессом синтеза
АТФ.
Наряду с электронами, комплексами I, III и IV за
счет энергии электронов векторно совершается
перенос протонов из матрикса митохондрий в
межмембранное пространство, где повышается
концентрация ионов Н+ и на мембране формируется
протонный градиент ∆μН+. Появляется разность
потенциалов по обе стороны мембраны:
положительный - на наружной и отрицательный - на
внутренней стороне внутренней мембраны
митохондрий.
40.
Схема дыхательной цепи41.
Протоны могут вернуться в матрикс только черезионный канал АТФ-синтазы. При накоплении в
межмембранном пространстве достаточного
количества H+ , происходит их присоединение к
ферменту → изменяется заряд и конформация
фермента → раскрывается протонный канал АТФсинтазы → H+ переносятся в матрикс по градиенту
концентрации → активируется поверхностная часть
фермента, катализирующая синтез АТФ:
АДФ + H3PO4 → АТФ + H2O
Установлено, что при переносе электронов через
поверхностную часть АТФ-синтазы происходит её
вращение по кругу и каждый поворот на 120°
приводит к синтезу 1 молекулы АТФ(полный
оборот на 360º дает три молекулы АТФ).
42.
АТФ-синтетаза – интегральный белок,состоит из множества белковых цепей,
формирующих два больших компонента:
компонент Fо (олигомицинчувствительный) – его функция
каналообразующая, через него выкачанные
наружу ионы водорода устремляются в
матрикс;
компонент F1 (fraction 1, англ. - часть 1) –
его функция каталитическая. Именно он,
используя энергию протонного градиента,
синтезирует АТФ.
43.
FоF1
44.
Пункты сопряжения дыхания и фосфорилирования45.
Если протоны поступают в межмембранноепространство через комплексы I, III и IV, и разность
потенциалов составляет [0,82-(-0,32)] V, то образуется
3 молекулы АТФ и коэффициент фосфорилирования
(отношениеP/O ) = 3;
Если протоны поступают через комплексы II, III
и IV и разность потенциалов составляет [0,82-(-0,05)]
V, то образуется 2 молекулы АТФ и коэффициент
фосфорилирования (P/O) = 2
Только на 3 или 2 участках дыхательной цепи:
- энергия выделяется порциями, и только на 2х или
3х этапах ее достаточно для фосфорилирования АТФ;
- на других участках разность потенциалов
сопряженных редокс-систем (энергия) недостаточна
для образования АТФ, в этих участках энергия
выделяется в виде тепла.
46.
Окислительное фосфорилирование – этоспособ синтеза АТФ из АДФ и неорганического
фосфата с использованием энергии протонного
электрохимического потенциала
, который
образуется за счет переноса электронов по ЦПЭ.
Количество АТФ, которое образуется в
результате сопряжения работы ЦПЭ и АТФсинтазы, оценивается с помощью коэффициента
фосфорилирования.
Коэффициент
окислительного
фосфорилирования (Р/О) показывает, какое
количество
неорганического
фосфата
затрачивается для фосфорилирования АДФ при
использовании 1 атома кислорода на образование
1 молекулы воды и численно равен количеству
моль АТФ, синтезированных в результате
окислительной реакции.










































 Биология
Биология








