Похожие презентации:
Классификация химических реакций
1. Классификация химических реакций
Учитель химии:Парпура О.Н.
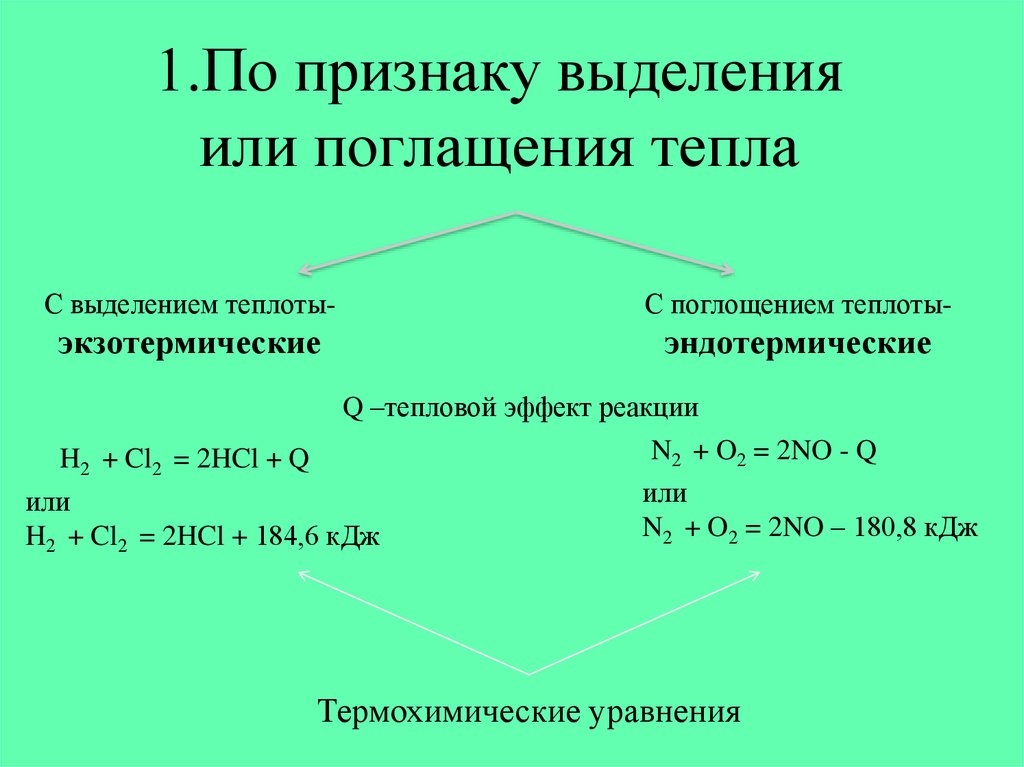
2. 1.По признаку выделения или поглащения тепла
С выделением теплоты-С поглощением теплоты-
экзотермические
эндотермические
Q –тепловой эффект реакции
H2 + Cl2 = 2HCl + 184,6 кДж
H2 + Cl2 = 2HCl + Q
N2 + O2 = 2NO - Q
N2 + O2 = 2NO – 180,8 кДж
Термохимические уравнения
3. Т.Х.У.- уравнение , в котором указан тепловой эффект и агрегатное состояние веществ
Если теплота выделяется – реакцияэкзотермическая
Если теплота поглащается – реакция
эндотермическая
4. 2.По числу и составу исходных веществ и продуктов реакции.
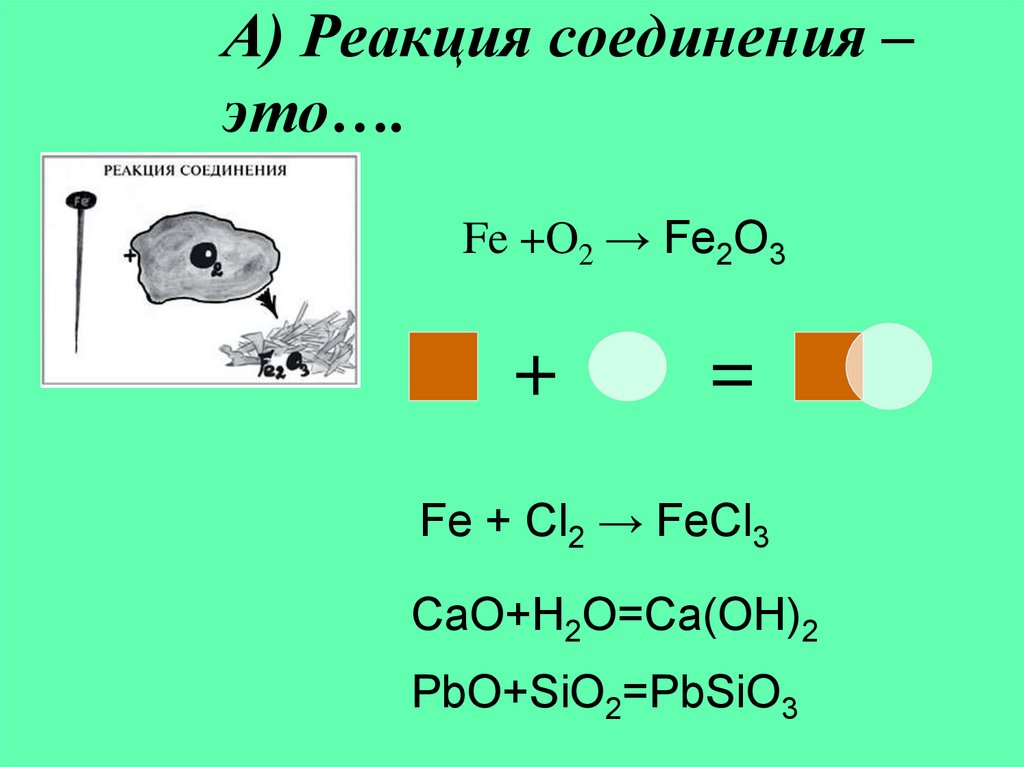
5. А) Реакция соединения – это….
Fe +O2 → Fe2O3+
=
Fe + Cl2 → FeCl3
CaO+H2O=Ca(OH)2
PbO+SiO2=PbSiO3
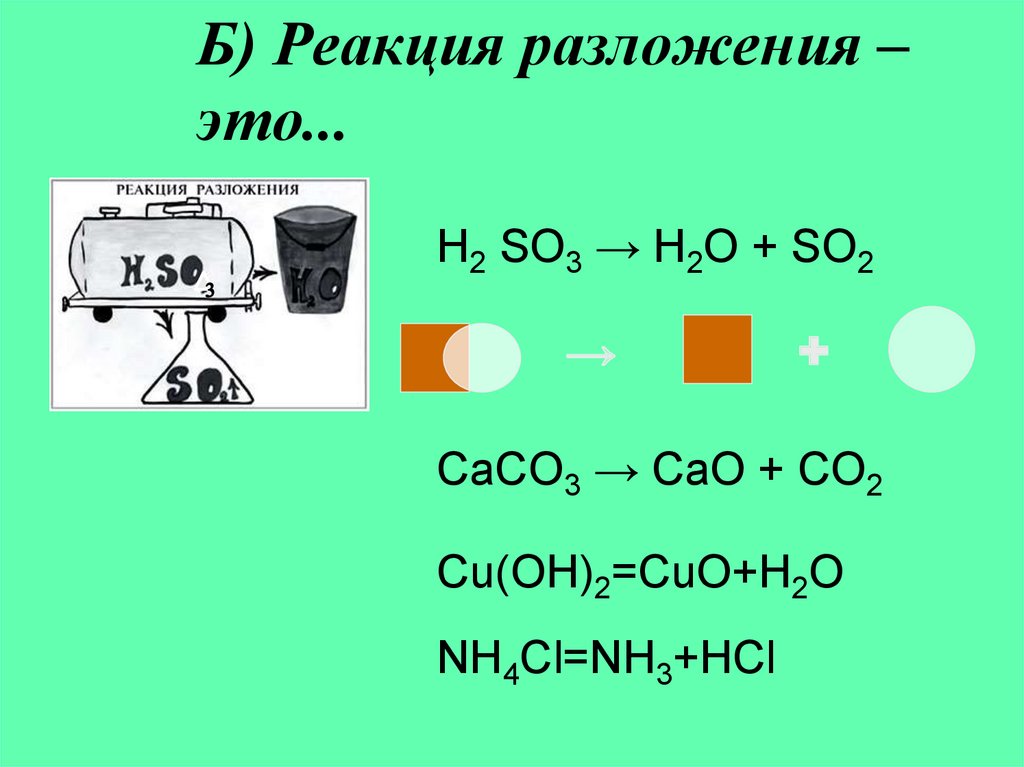
6. Б) Реакция разложения – это...
H2 SO3 → H2O + SO2→
+
CaCO3 → CaO + CO2
Cu(OH)2=CuO+H2O
NH4Cl=NH3+HCl
7. В) Реакции замещения – это…
Zn + HCl → ZnCl2 + H2+
→
+
CuSO4+Fe → FeSO4+Cu
+
2KBr+Cl2 → 2KCl+Br2
H2 + CuO → Cu + H2O
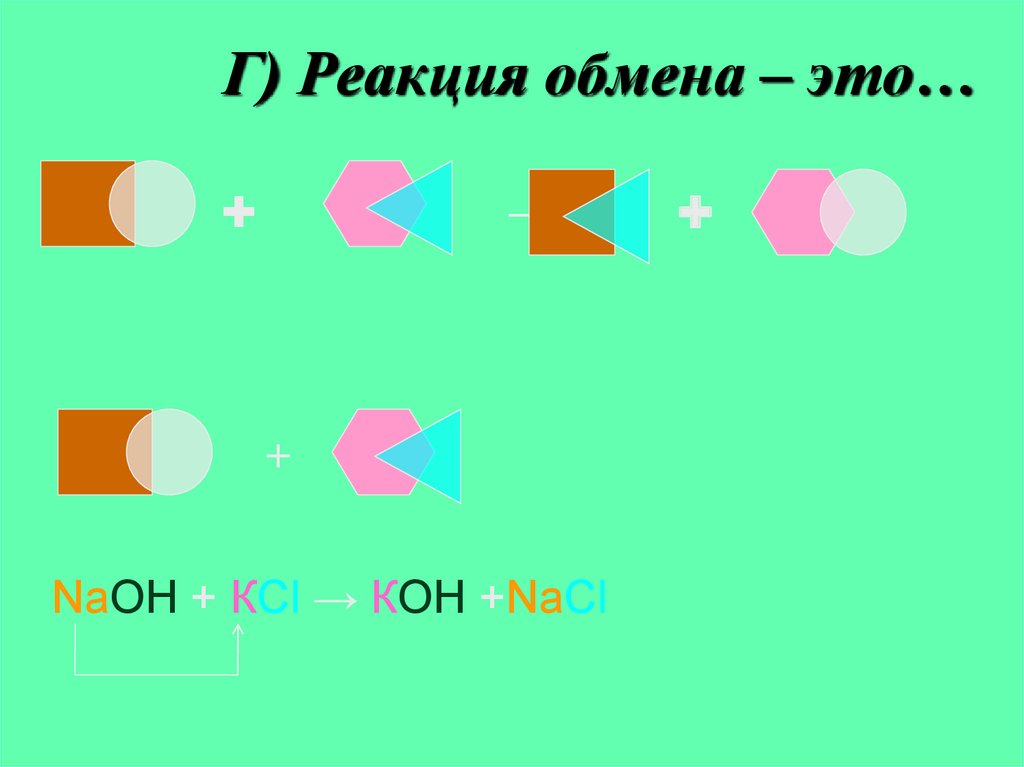
8. Г) Реакция обмена – это…
+→
+
NaOH + КCl → КOH +NaCl
+
9. 1.По признаку выделения или поглащения тепла
С выделением теплоты-С поглощением теплоты-
экзотермические
эндотермические
Q –тепловой эффект реакции
N2 + O2 = 2NO - Q
H2 + Cl2 = 2HCl + Q
или
или
N2 + O2 = 2NO – 180,8 кДж
H2 + Cl2 = 2HCl + 184,6 кДж
Термохимические уравнения
10. 2.По числу и составу исходных веществ и продуктов реакции
р. соединенияр. разложения
р. обмена
р. замещения
11. Распределите реакции по их типу, расставьте коэффициенты.
1.СuCl2 + KOH → Cu(OH)2 + KCl
2. MgO + C → Mg + CO2
3. Fe + O2 → Fe2O3
4. KNO3 → KNO2 + O2
5. KMnO4 → K2MnO4 + MnO2 + O2
6. Нитрат серебра (I) + хлорид кальция →
нитрат кальция + хлорид серебра (I)
12. Перепишите схемы уравнений реакций, расставьте в них коэффициенты, укажите, к какому типу относится каждая из них.
1. Mn O2 + Al = Al2O3 + Mn2. CuO + C = CO2 + Cu
3. Fe + O2 = Fe3O2
4. Ca + O2 =
5. NH3 = N2 + H2
6. Cr2O3 + Al =
7. SO2 + O2 = SO3
8. P2O5 + H2O = H3PO4
9. AgNO3 + Cu = Cu(NO3) + Ag







 Химия
Химия








