Похожие презентации:
Реакции металлов с растворами кислот. Урок 1-2
1.
Повторение пройденного раздела1-задание.
Как можно классифицировать ниже
приведенные металлы? Почему?
Ва,Zn,K,Hg,Ni, Al,Fe,Pt,Na,Cu,Mg
2.
2 -задание. Сделайте соответствие.Реакция взаимодействия металлов с водой:
1.Кальций
2.Цинк
3.Литий
4.Медь
5.Золото
A. идёт, образуется оксид
B. Не идёт
C. идёт, образуется гидроксид
3.
3-задание.Завершите уравнение реакции:
1. Кальций + вода=
2. Медь + вода =
3. Цинк + вода=
4. Алюминий + вода=
5. Магний+вода=
6. Калий + вода=
7. Ртуть + вода=
Дескриптор
1. Правильно называет продукты реакции
2. Правильно составляет формулу продукта реакции
3. Правильно уравнивает уравнение реакции
4.
Металлы вступают в реакцию:простые
вещества
Например: кислород
сложные
вещества
вода
5.
• Сегодня мы на уроке рассмотрим взаимодействиеметалла с еще одним из сложных веществ
- В среде этого вещества лакмус меняет свой цвет на
красный;
- Может разъесть
- Он содержится в составе цитрусовых фруктов и
лекарств
Какое это вещество?
6.
Реакции металлов с растворамикислот
7.
- Что мы знаем о кислотах?- Какой же будет цель нашего урока?
8.
Цель урока:-Исследовать реакцию
взаимодействия металлов с
растворами кислот
- Научиться записывать уравнение реакции
взаимодействия металлов с кислотами
9.
Установите слова в правильномпорядке, составив правило кислот
• https://learningapps.org/display?v=p9sorjf1j2
0
10.
• Кисло́ты — сложные вещества,которые состоят из атомов водорода, способных
замещаться на атомы металлов, и кислотных
остатков
11.
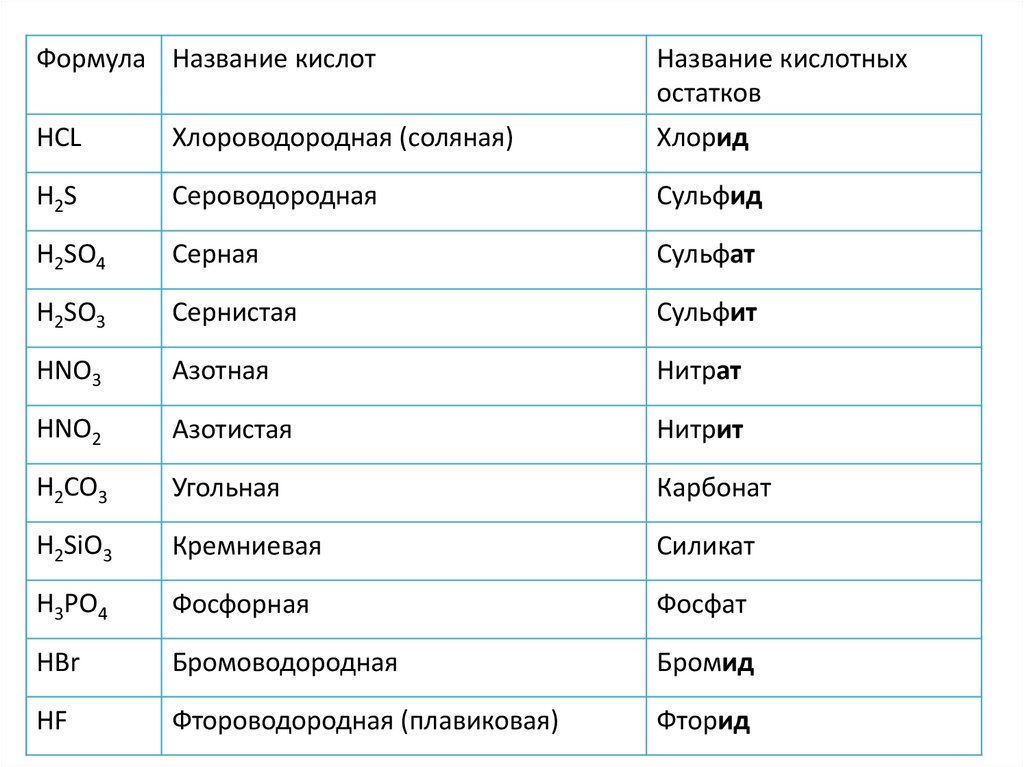
Формула Название кислотНазвание кислотных
остатков
HCL
Хлороводородная (соляная)
Хлорид
H2S
Сероводородная
Сульфид
H2SO4
Серная
Сульфат
H2SO3
Сернистая
Сульфит
HNO3
Азотная
Нитрат
HNO2
Азотистая
Нитрит
H2CO3
Угольная
Карбонат
H2SiO3
Кремниевая
Силикат
H3PO4
Фосфорная
Фосфат
HBr
Бромоводородная
Бромид
HF
Фтороводородная (плавиковая)
Фторид
12.
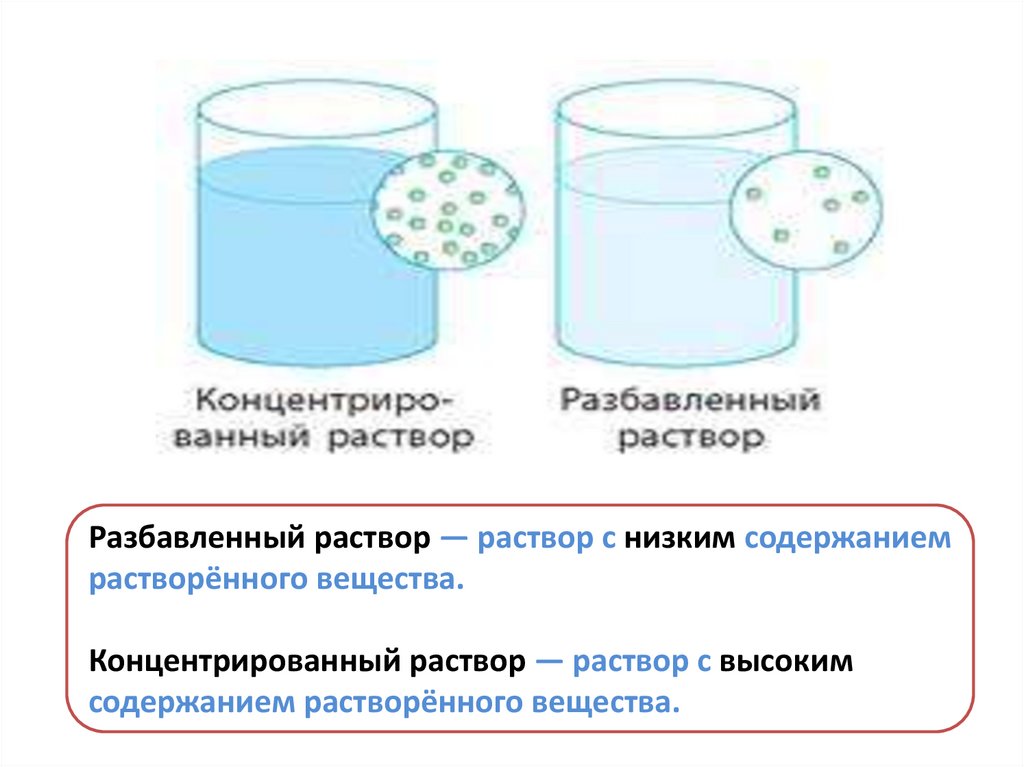
Разбавленный раствор — раствор с низким содержаниемрастворённого вещества.
Концентрированный раствор — раствор с высоким
содержанием растворённого вещества.
13.
Как вы думаете с раствором какой кислоты мыбудем с вами работать ?
14.
Соляная кислота HCl15.
Лабораторная работа №5«Взаимодействие металлов с растворами кислот»
Ход работы: Взаимодействие металлов (магний,
цинк, железо,медь) с соляной кислотой
16.
Вспомните правила техники безопасности!17.
Что можно сказать по этому рисунку?18.
Реакция замещенияОрынбасу – Замещение – Displace
Реакции замещения — это реакции, в
результате которых атомы простого вещества
замещают атомы одного из химических
элементов в сложном веществе.
19.
Вытесняют водород из раствора кислотыНе могут вытеснить
водород из раствора
кислоты
Кислота
Соль
Кроме HNO3
Металлы до
водорода
20.
Написать реакцию взаимодействияметаллов с кислотами
• Металл + кислота → соль + водород
• Мg + 2НСl = MgCl2 + H2
21.
Задание:1) Разделите нижеприведенные металлы на две колонки на
основе их взаимодействия с соляной кислотой :
алюминий, кальций, медь, никель, железо, серебро,
натрий, ртуть, калий;
2) Напишите уравнение возможных реакций;
3) Назовите продукты реакций (письменно и устно).
4) Расположите металлы по возрастанию их активности
Дескриптор
1. Правильно распределяет металлы
2. Записывает уравнение реакции
3. Правильно уравнивает реакцию
4. Правильно называет продукты реакций
5. Располагает металлы по возрастанию их активности
.
22.
Завершите словесные уравнения реакции инапишите их с помощью формул:
магний +соляная кислота → водород+ ?
Цинк + серная кислота → ? + ?
алюминий + серная кислота → сульфат ?+ ?
23.
«Подумайте"Разделите нижеприведенные металлы на две колонки:
K,Hg,Ni, Al,Fe,Pt,Na,Cu,Mg
24.
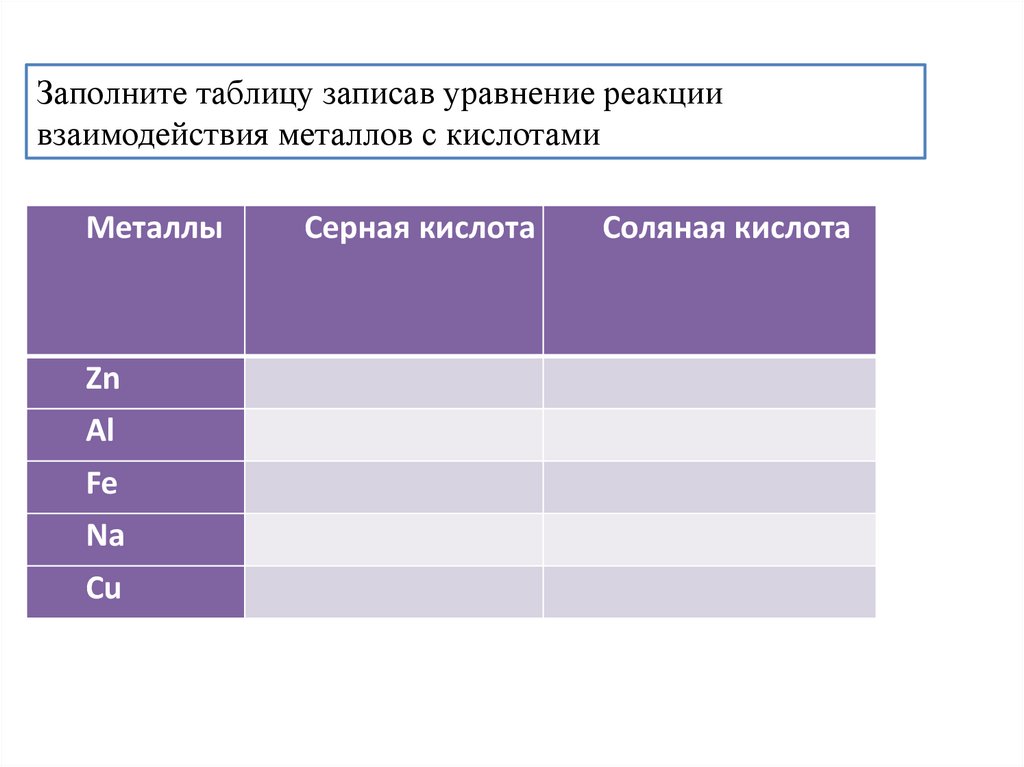
Заполните таблицу записав уравнение реакциивзаимодействия металлов с кислотами
Металлы
Zn
Al
Fe
Na
Cu
Серная кислота
Соляная кислота
25.
Рефлексия• Подставьте название металлов в приведенные ниже
словосочетания
• Натрий , цинк, медь, калий
• Реакция протекает медленне с металлом А, чем с
металлом Б
• Металл А взаимодействует быстрее , чем металл Б
• Металл А активнее/ не активнее , чем металл Б






















 Химия
Химия








