Похожие презентации:
Химические свойства металлов
1.
Химические свойства металлов2.
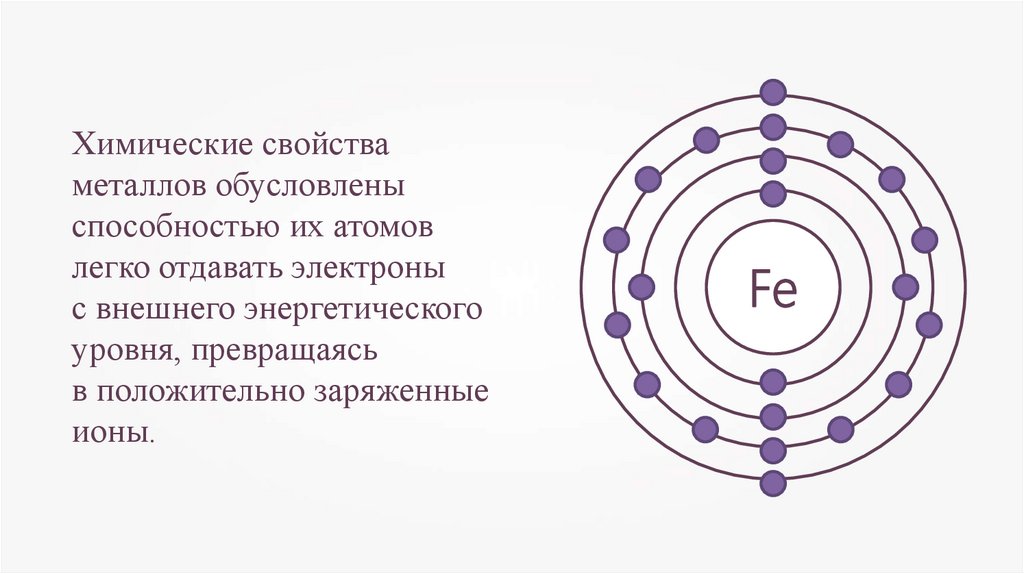
Химические свойстваметаллов обусловлены
способностью их атомов
легко отдавать электроны
с внешнего энергетического
уровня, превращаясь
в положительно заряженные
ионы.
Fe
3.
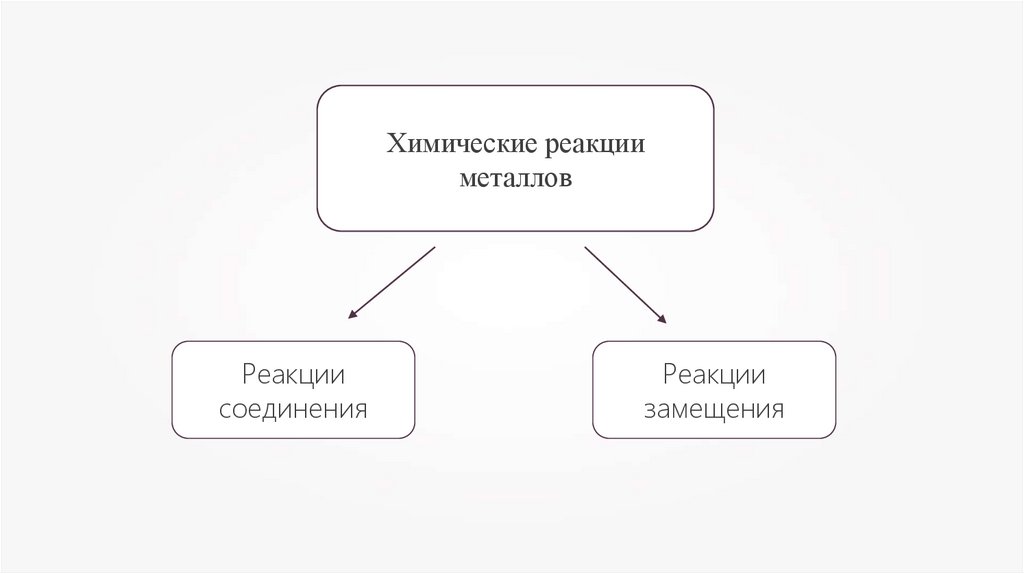
Химические реакцииметаллов
Реакции
соединения
Реакции
замещения
4.
A+BC=AC+BА
В
С
Реакции замещения — это такие реакции,
в результате которых атомы простого вещества
замещают атомы одного из химических
элементов в сложном веществе.
5.
A+B=ABА
В
Реакции соединения — это такие реакции,
в результате которых из одного или нескольких
веществ образуется одно сложное вещество.
6.
0n+
Me - ne → Me
—
В химических реакциях металлы способны
отдавать электроны, т.е. быть
восстановителями, проявлять в образовавшихся
соединениях только положительную степень
окисления.
7.
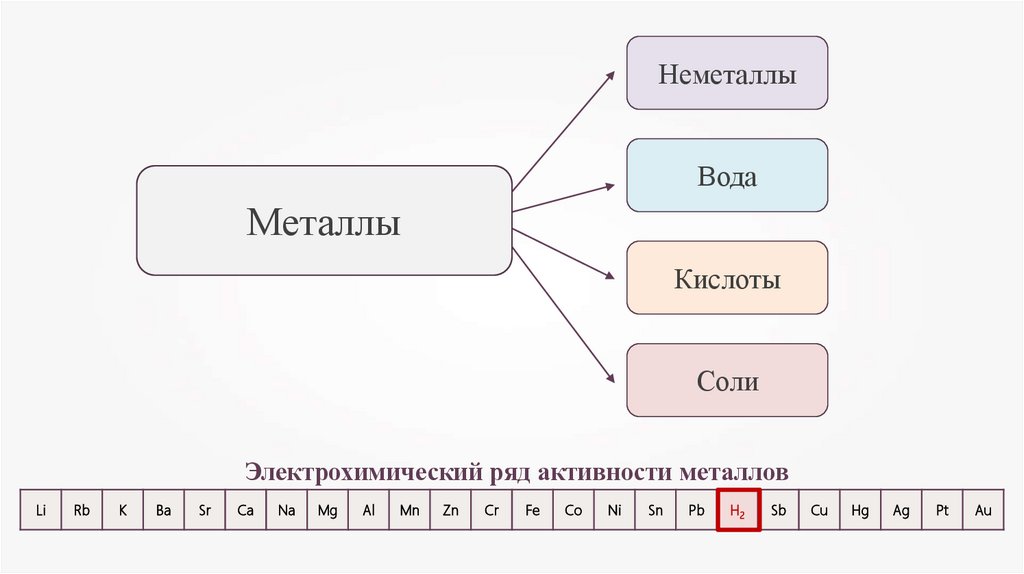
НеметаллыВода
Металлы
Кислоты
Соли
Электрохимический ряд активности металлов
Li
Rb
K
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
Hg
Ag
Pt
Au
8.
1.Взаимодействие ме с немеZn + S = ZnS
0
0
+3
-2
4Al + 3О2 = 2Al 2 О3
3Mg + N2 = Mg 3 N 2
9.
10.
Задание: напишите уравнения наблюдаемых реакцийNa+ S=
Mg + О2 =
Fe+Cl2 =
Al+I 2 =
S
11.
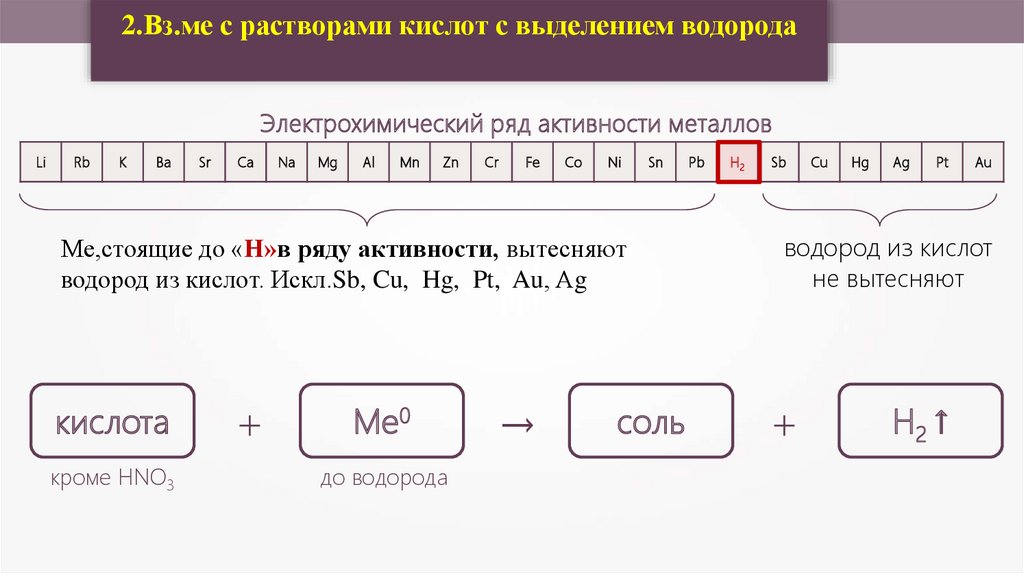
2.Вз.ме с растворами кислот с выделением водородаЭлектрохимический ряд активности металлов
Li
Rb
K
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Co
Ni
Sn
Ме,стоящие до «Н»в ряду активности, вытесняют
водород из кислот. Искл.Sb, Cu, Hg, Pt, Au, Аg
кислота
кроме HNO3
+
Ме0
до водорода
→
соль
Pb
H2
Sb
Cu
Hg
Ag
Pt
Au
водород из кислот
не вытесняют
+
H2 ↑
12.
Взаимодействие ме с кислотами0
+1
+2
0
Zn + 2HCl = ZnCl2 + H2↑
Соляная
кислота
H2SO4 + Ca = CaSO4 + H2
13.
Взаимодействие металлов с кислотамиЭлектрохимический ряд активности металлов
Li
Rb
K
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
взаимодействуют
с разбавленными кислотами
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
Hg
Ag
Au
реагируют
с концентрированными
кислотами без
выделения водорода
H2SO4 + Ca = SO2 + CaSO4 + H2O
Серная кислота
Концент.
Pt
14.
3.Вз.ме с растворами солей:Электрохимический ряд активности металлов
Li
Rb
K
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
Hg
Ag
Pt
Au
Начиная с магния, более активный ме вытесняет
менее активный ме
из р-ра соли
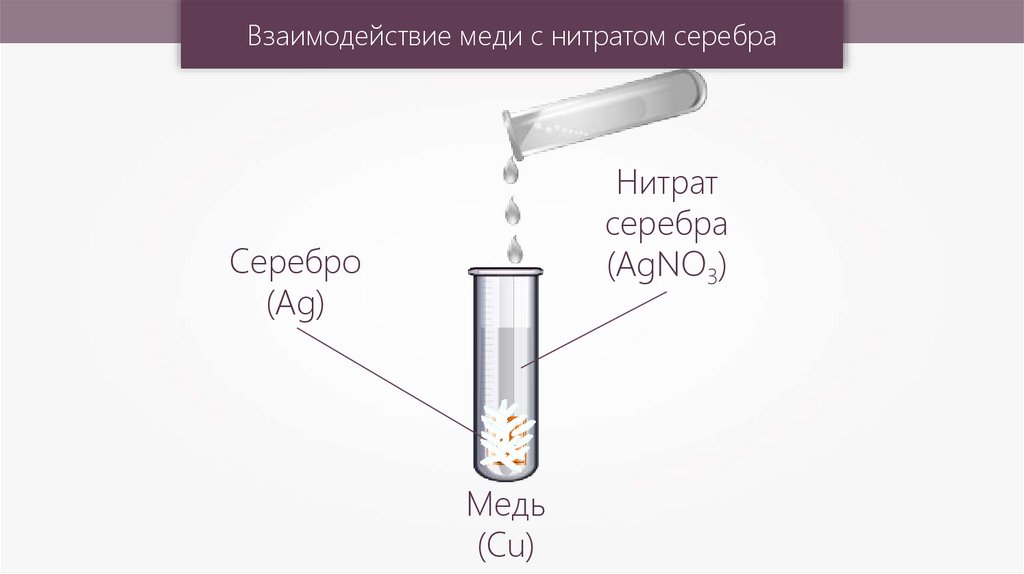
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
15.
Взаимодействие меди с нитратом серебраНитрат
серебра
(AgNO3)
Серебро
(Ag)
Медь
(Cu)
16.
4.Вз. ме с водой с выделением водорода:Электрохимический ряд активности металлов
Li
Rb
K
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Co
Ni
Sn
Pb
активные металлы
H2
Sb
Cu
Hg
Ag
Pt
не вытесняют
водород
1.С активными ме отLi по Аl образуются основания без нагревания
2Na + 2HOH= 2NaOH + H2↑
2. С ме средней активности при t°образуются оксиды
2Fe+3 H2O(пар)=Fe2O3+ 3H2 ↑
Ме,стоящие до «Н»в ряду активности,вытесняют водород из воды.
Искл.Sb, Cu, Hg, Pt, Au, Аg
Au
17.
Д.з:Li
Rb
K
2.
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
Hg
Ag
1.Какая из р-й осуществима: Cu + 2Нg(NO3 ) 2 =
Zn+Fe (NO3 ) 2 =
Ag+ НgCl2 =
Сплав меди с алюминием поместили в НСl. Какой из ме растворится
в кислоте и почему? Написать уравнение р-и .
3. Sn, Zn ,Fe ,Ва.
Какой из ме взаимодействует с водой без
нагревания? Написать уравнение р-и.
4.
Почему легкий и прочный ме кальций не применяется в авиации?
Pt
Au
18.
5.)решить задачу: 20г сплава меди и цинкарастворили в соляной кислоте, при этом
выделилось 22,4л водорода. Рассчитайте массу меди
в сплаве.
6)-доп.решить задачу: Вычислите объем водорода,
который может быть получен при взаимодействии 196
г серной кислоты с магнием.
7.)-доп..Вычислите объем водорода (н.у.), который
может выделиться при взаимодействии 13 г цинка с
серной кислотой.
Li
Rb
K
Ba
Sr
Ca
Na
Mg
Al
Mn
Zn
Cr
Fe
Co
Ni
Sn
Pb
H2
Sb
Cu
Hg
Ag
Pt
Au













 Химия
Химия








