Похожие презентации:
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
1. Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів зГідрогеном.
Нn Е, E Нn.
Особливості водних розчинів цих
сполук, їх застосування
Масштабні моделі молекул НСІ, H2S, NH3 і СН4
2.
3.
4.
5.
6.
7.
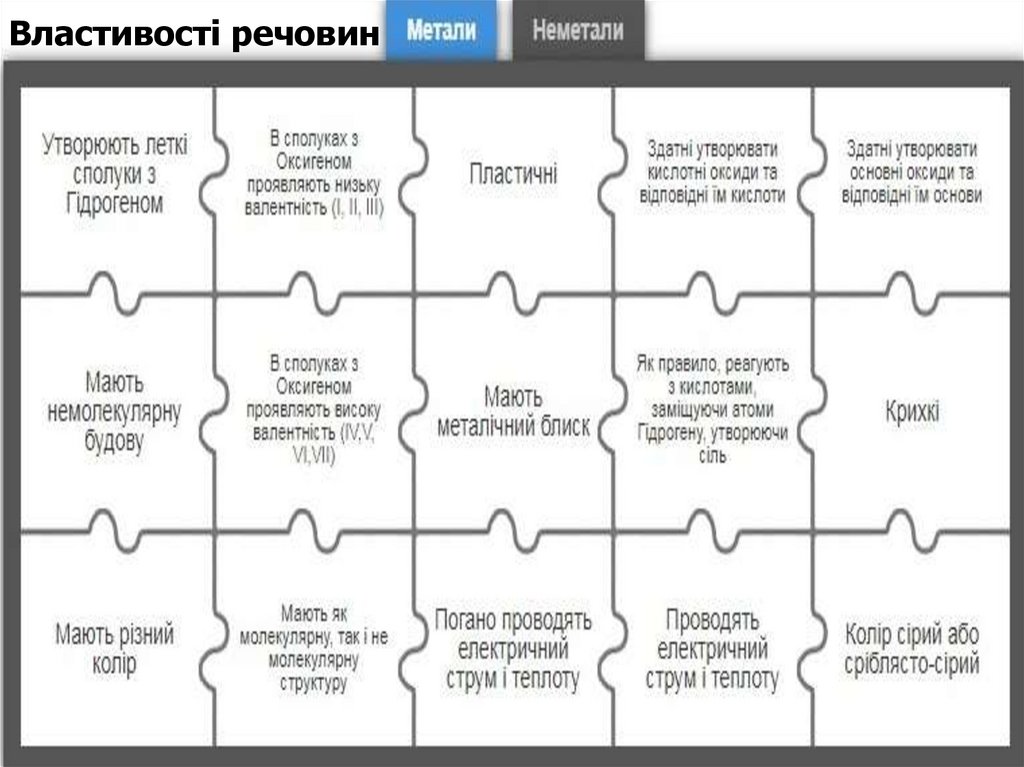
Властивості речовин8.
9.
10.
11.
Нn Е,E Нn.
Багато хімічних елементів утворюють сполуки з Гідрогеном. Але характерною особливістю
неметалічних елементів є те, що їхні сполуки з Гідрогеном леткі, тож вони мають молекулярні
кристалічні ґратки і за звичайних умов перебувають у рідкому (вода H2O та гідроген флуорид
HF)
або газуватому агрегатному стані. ( гідроген хлорид HCl, амоніак NH3, гідроген сульфід H2S).
Завдання 1. Обчисліть відносну густину гідроген хлориду за
повітрям. Як правильно зібрати цей газ у пробірку?
Завдання2.
Математичними обчисленнями доведіть,
що збирати амоніак необхідно в пробірку, розташовану догори дном.
12.
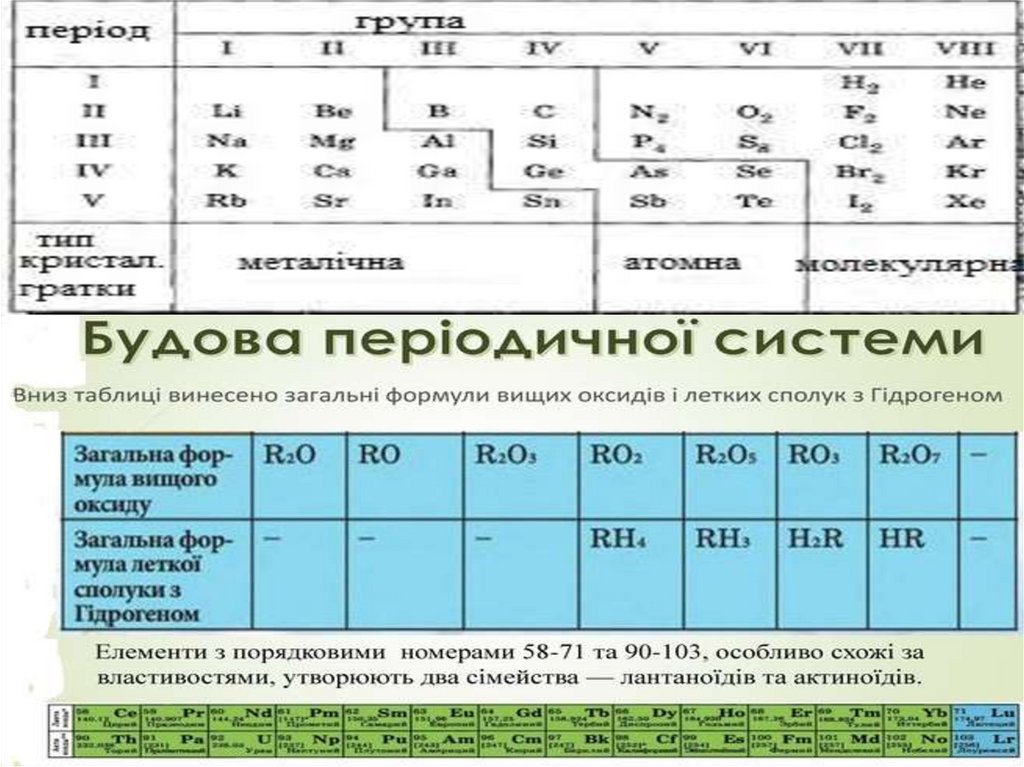
Таблиця 20.1.Формули та назви найпростіших бінарних сполук
Нn Е, E Нn.
неметалічних елементів з Гідрогеном2
Група
Періо
д
ІІІА
IVA
VA
VIA
VIIA
2
*В2Н61
дибора
н
CH4
метан
NH3
Н2O
вода,
HF
гідроген флуорид фтороводень
РН3
фосфі
н
H2S
гідроген
сульфід,
сірководе
нь
HCl
гідроген хлорид хлороводень
AsH3
арсин
H2Se
гідроген
селенід
селеново
день
НВr
гідроген бромід бромоводень
3
4
SiH4
силан
амоніа
к
Н2Те
гідроген
телурид
телурово
день
1 Найпростішої сполуки Бору ВН не виявлено.
3
5
НІ
гідроген йодид йодоводень
Для Карбону, існує багато сполук з Гідрогеном; їх загальна назва — вуглеводні.
2 Виокремлено ті назви та хімічні формули, які потрібно запам’ятати.
13.
Сполуки неметалічних елементів з Гідрогеном безбарвні,деякі мають характерний запах — неприємний, іноді різкий.
Багато цих речовин є токсичними.
Серед газоподібних речовин трапляються як добре
розчинні у воді, так і погано розчинні.
Гази, що погано розчиняються у воді, можна збирати способом
витіснення води (дивись мал., а).
• Добре розчинні у воді гази збирають лише способом
витіснення повітря. Якщо газ легший за повітря, то посудинуприймач (пробірку, колбу) тримають догори дном (дивись мал.,
б), якщо важчий — навпаки (дивись мал., в).
14.
ФІЗИЧНІ ВЛАСТИВОСТІГІДРОГЕН ХЛОРИДУ.
Гідрогенхлорид HCl — газ без
кольору, з різким запахом,
подразливо діє на дихальні
шляхи, «димить» на повітрі
через те, що з парами води, які
завжди присутні в повітрі,
утворює дрібні краплі
хлоридної кислоти. Гідроген
хлорид добре розчиняється у
воді (за температури 20 °С
приблизно 500 л гідроген
хлориду розчиняється в 1 л
води).
ФІЗИЧНІ ВЛАСТИВОСТІ
АМОНІАКУ.
Амоніак NH3 — газ без кольору,
з різким запахом, токсичний.
Вдихання його в малих дозах
допомагає вивести людину зі
стану непритомності. У дозах,
що перевищують гранично
допустимі (у повітрі 0,04 мг/м3),
спричинює ураження очей і
набряк легень, ушкоджує
нервову систему. Це
газоподібна речовина з
найбільшою серед відомих газів
розчинністю у воді (за
температури 20 °С близько 700
л амоніаку розчиняється в 1 л
води). Відомий у медичній
практиці нашатирний спирт
(мал. 38) є водним розчином
амоніаку з масовою часткою
розчиненої речовини 10 %.
15.
Будова. Сполуки неметалічних елементів з Гідрогеномскладаються з молекул (див.мал.); атоми в них сполучені
ковалентними зв’язками. Якщо електронегативності
елемента і Гідрогену однакові, то ці зв’язки неполярні
(наприклад, у молекулі РН3), а якщо різні — зв’язки полярні.
Мал. Масштабні моделі молекул НСІ,
H2S, NH3 і СН4
Якщо позитивні й негативні заряди, що виникли на атомах після
зміщення спільних електронних пар, рівномірно розподілені в
молекулі, то вона є неполярною (наприклад, молекула СН4). В
іншому випадку молекула в одній частині має невеликий
негативний заряд, а в протилежній — позитивний заряд. Така
молекула полярна; її називають диполем. Полярними є молекули
HF, Н2О, NH3 (див.мал.) і деякі інші.
16.
Водні розчини більшості летких сполук неметалічних елементів ізГідрогеном — це кислоти, амоніак і фосфін у водному розчині є
слабкими основами, а інші не виявляють кислотно-основні властивості
(див. мал.).
Мал. Леткі сполуки неметалічних елементів із Гідрогеном.
Кольором позначено кислотно-основний характер їх водних розчинів:
голубий — не виявляють кислотно-основні властивості,
слабкий рожевий — виявляють основні властивості,
ярко рожевий — виявляють кислотні властивості.
Залежно від кількості неспарених електронів на зовнішньому енергетичному
рівні, атоми неметалічних елементів утворюють ковалентні полярні зв'язки з
різною кількістю атомів Гідрогену. Елементи IV групи періодичної системи
утворюють чотири зв'язки, V — три, VI — два, VII групи — один зв'язок.
17.
ОСОБЛИВОСТІ ВОДНОГО РОЗЧИНУ ГІДРОГЕН ХЛОРИДУ.Механізм розчинення гідроген хлориду НСl.
Взаємодія гідроген хлориду з водою:
Атом Оксигену з більшою силою притягує атоми Гідрогену. Під час
розчинення йон Гідрогену відщеплюється від Хлору й завдяки наявності
вільної електронної пари приєднується до Оксигену.
Утворюється йон Гідроксонію Н3О+.
Оксиген на утворення зв'язку віддав електронну пару, тому є донором, а
йон Гідрогену — акцептором. Отже, механізм утворення ковалентного
зв'язку в цьому випадку є донорно - акцепторним.
Якщо розчин гідроген хлориду у воді випробувати
індикатором лакмусом, то забарвлення індикатора
зміниться на червоне. Це вказує на те, що утворилася кислота.
Хлоридна кислота є водним розчином гідроген
18.
1 л води за нормальних умов (0 °С, 760 мм рт. ст.) розчиняєтьсяприблизно 500 л газу хлороводню. Цьому сприяє утворення
водневих зв’язків між молекулами води і цих сполук, а
також дисоціація молекул галогеноводнів у водному
розчині.
Для підтвердження високої розчинності хлороводню у
воді й кислотних властивостей водного розчину цієї
сполуки демонструють ефектний дослід. У посудину з
водою додають кілька крапель розчину індикатора
лакмусу або метилоранжу. Хлороводнем наповнюють
колбу, додають у неї 1—2 краплі води, швидко
закривають пробкою, в яку вставлена скляна трубка, і
занурюють кінець трубки в посудину з розчином
індикатора (див.мал.). Під час розчинення газу тиск у
колбі знижується; рідина заповнює колбу, створюючи
фонтан, і набуває червоного забарвлення.
19.
Розчинення амоніаку у водіПід час розчинення, атом Нітрогену міцніше втримує атоми Гідрогену, ніж
атом Оксигену. Нітроген, який має вільну електронну пару, притягує йон
Гідрогену від Оксигену. Утворюється позитивно заряджений йон
амонію. Наявність у розчині гідроксид-іонів зумовлює лужне
середовище. Наявність лугу виявляють індикатором.
Розчин фенолфталеїну набуває малинового забарвлення. Зміна кольору
фенолфталеїну свідчить, що розчинення амоніаку супроводжується появою
в розчині гідроксид-іонів. Водний розчин амоніаку має лужне
середовище.
Водний розчин
амоніаку
(нашатирний спирт)
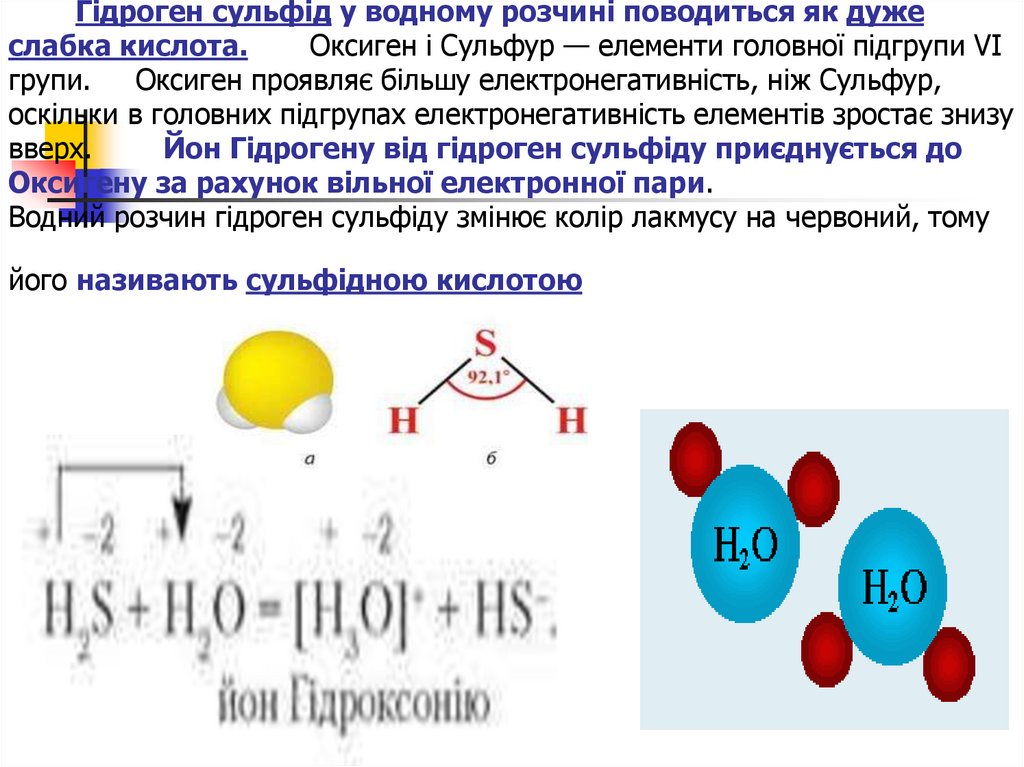
20. Гідроген сульфід у водному розчині поводиться як дуже слабка кислота. Оксиген і Сульфур — елементи головної підгрупи VI групи.
Оксиген проявляє більшу електронегативність, ніж Сульфур,оскільки в головних підгрупах електронегативність елементів зростає знизу
вверх.
Йон Гідрогену від гідроген сульфіду приєднується до
Оксигену за рахунок вільної електронної пари.
Водний розчин гідроген сульфіду змінює колір лакмусу на червоний, тому
його називають сульфідною кислотою
21.
Застосування гідроген хлориду, гідроген сульфіду,амоніаку зумовлено їхніми фізичними та хімічними
властивостями. У повсякденному житті трапляється
чимало хімічних реакцій за участі хлоридної кислоти.
Вона - складник шлункового соку, який сприяє
денатурації та набряканню білків, подальшому
перетравлюванню їжі. Аби нейтралізувати надмірну
кислотність шлункового соку, використовують
різноманітні антацидні препарати, які здебільшого
містять карбонати Кальцію, Магнію, гідроксиди
Магнію та Алюмінію.
Для очищення від шару оксидів поверхню металів
обробляють хлоридною кислотою. Реакцію між
хлоридною кислотою та карбонатами Кальцію та
Магнію геологи використовують для експресвиявлення карбонат-іонів у складі мінералів.
Сантехніки застосовують хлоридну кислоту для
видалення накипу - карбонатів Кальцію та Магнію під
час промивання системи парового опалення.
22.
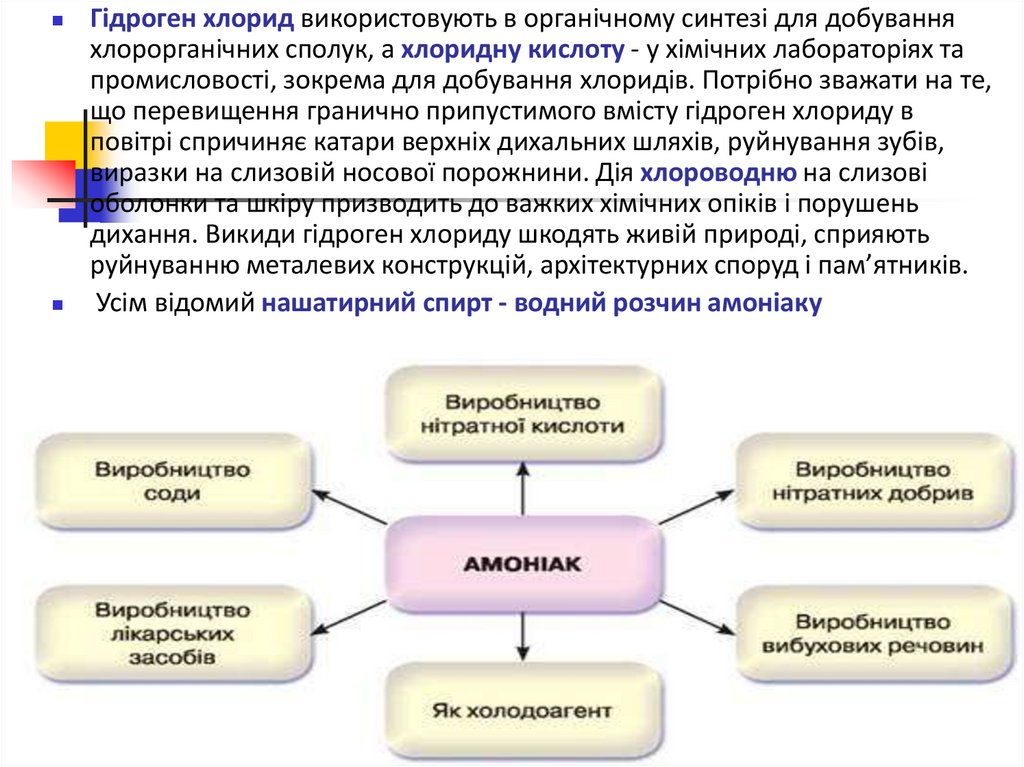
Гідроген хлорид використовують в органічному синтезі для добуванняхлорорганічних сполук, а хлоридну кислоту - у хімічних лабораторіях та
промисловості, зокрема для добування хлоридів. Потрібно зважати на те,
що перевищення гранично припустимого вмісту гідроген хлориду в
повітрі спричиняє катари верхніх дихальних шляхів, руйнування зубів,
виразки на слизовій носової порожнини. Дія хлороводню на слизові
оболонки та шкіру призводить до важких хімічних опіків і порушень
дихання. Викиди гідроген хлориду шкодять живій природі, сприяють
руйнуванню металевих конструкцій, архітектурних споруд і пам’ятників.
Усім відомий нашатирний спирт - водний розчин амоніаку
23.
ПРО ГОЛОВНЕСполуки неметалічних елементів з Гідрогеном молекулярні речовини з ковалентними полярними
зв’язками.
У найпростіших бінарних сполуках кількість
атомів Гідрогену навколо атома неметалічного
елемента дорівнює різниці між числом 8 і номером
групи періодичної системи.
Амоніак і гідроген хлорид добре розчиняються у
воді, а гідрогенсульфід - малорозчинна кислота.
У водному розчині амоніаку лужне середовище,
водний розчин гідроген сульфіду - слабка
сульфідна кислота, водний розчин гідроген
хлориду - сильна хлоридна кислота.
Бінарні сполуки неметалічних елементів з
Гідрогеном мають неабияке практичне значення.
24.
ПІДСУМОВУЄМО ВИВЧЕНЕ• Елементи IV—VII груп періодичної системи утворюють леткі сполуки
неметалічних елементів з Гідрогеном.
• Загальні формули летких сполук неметалічних елементів з
Гідрогеном: ЕН4, ЕН3, Н2Е, НЕ. Ступені окиснення елементів у цих
сполуках зростають від -4 до -1.
• Леткі сполуки неметалічних елементів з Гідрогеном
загалом проявляють здатність розчинятися у воді. У періодах зліва
направо властивості водних розчинів змінюються від основних до
кислотних. У групах, зі зростанням радіусів атомів зверху вниз, кислотні
властивості водних розчинів посилюються.
• Властивості водних розчинів летких сполук неметалічних елементів з
Гідрогеном змінюються так: гідроген хлорид у водному розчині —
сильна неорганічна кислота, гідроген сульфід — слабка кислота й
амоніак — нестійка слабка основа.
• Сполуки неметалічних елементів з Гідрогеном набули застосування в
різних галузях промислового виробництва України
ВИСНОВКИ
Майже всі неметалічні елементи, крім інертних, утворюють
сполуки з Гідрогеном. Їх загальна формула — НnE або ЕНn. Для
цих сполук найчастіше використовують тривіальні назви.
Сполуки неметалічних елементів із Гідрогеном мають молекулярну
будову. Галогеноводні та амоніак дуже добре розчиняються у
воді.
25.
Домашнє завдання.1. Загальна формула сполуки ЕН3.
До її складу входить Гідроген, масова частка якого становить 17,65 %.
Виведіть формулу сполуки.
2. Складіть формули сполук неметалічних елементів,
утворених атомами:
а) Карбону й Гідрогену; б) Йоду й Гідрогену.
Складіть рівняння їх одержання з простих речовин, розгляньте окисновідновні процеси.
3. Поясніть, чому: а) амоніак збирають витісненням повітря в суху пробірку,
розташовану отвором вниз, а гідроген хлорид - у суху пробірку, розташовану
отвором догори; б) одним із заходів долікарської допомоги ураженому
парою амоніаку є інгаляція слабким розчином лимонної або оцтової
кислоти; в) коли людину вкусила мурашка, слід прикласти до місця укусу
ватку, змочену водою, до якої добавлено трохи нашатирного спирту.
4.
Перетворіть розповідні речення рубрики ПРО ГОЛОВНЕ на питальні. Чи
можете ви відповісти на ці запитання без допомоги підручника?Які ваші
відповіді.
5. Уявіть, що вам доручено написати до шкільної газети інформаційну замітку
про практичне значення бінарних сполук неметалічних елементів з
Гідрогеном. Випробуйте себе в ролі журналіста чи журналістки й зробіть це.






















 Химия
Химия








