Похожие презентации:
Кинетика и равновесие. Основные понятия и определения
1.
ОСНОВНЫЕ ПОНЯТИЯИ ОПРЕДЕЛЕНИЯ
Химическая кинетика - раздел химии, изучающий
скорости и механизмы химических процессов, а также
зависимость их от различных факторов.
Механизм реакции – это последовательность отдельных
простейших (элементарных) стадий реакции, в результате
которых происходит образование конечных веществ.
Теоретическое значение кинетики: кинетика описывает
сущность механизма химического взаимодействия.
Прикладное значение кинетики: для практического
использования какой-либо реакции необходимо управлять
ею, т.е. знать скорость ее протекания в данных условиях и
способы изменения этой скорости.
2. классификация реакций
• по числу частиц, участвующих в элементарном актереакции (молекулярность)
• по числу фаз, участвующих в реакции
• по налиию катализаторов
• по степени сложности
• по механизму протекания
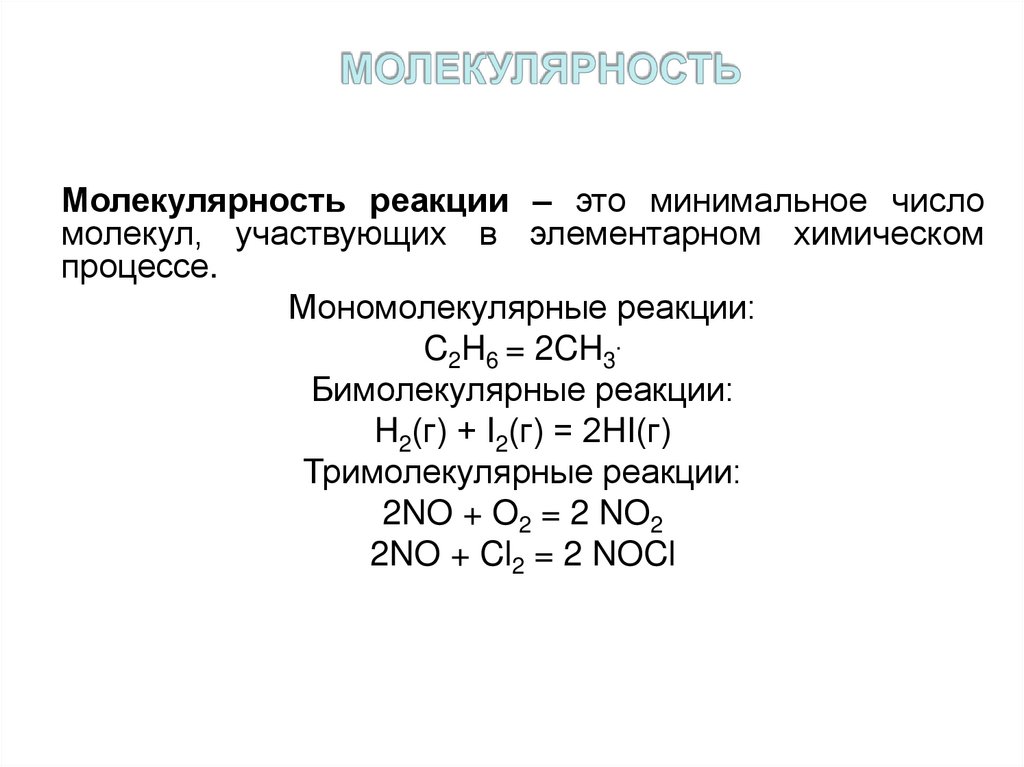
3. молекулярность
Молекулярность реакции – это минимальное числомолекул, участвующих в элементарном химическом
процессе.
Мономолекулярные реакции:
C2H6 = 2CH3.
Бимолекулярные реакции:
H2(г) + I2(г) = 2HI(г)
Тримолекулярные реакции:
2NO + O2 = 2 NO2
2NO + Cl2 = 2 NOCl
4. гомогенные и гетерогенные реакции
Гомогенные реакции – это реакции, протекающие в однороднойсреде ( в одной фазе). Например, в газообразной фазе или жидком
растворе. Гомогенные реакции протекают равномерно во всем объеме
реакционного пространства.
Na2CO3 (P)+2 НСl (P) = 2 NaСl +Н2O + CO2
Г1+Г2
Ж1+Ж2 СМЕШИВАЮЩИЕСЯ
Ж+Тв В Р-РЕ
Ж+Г В Р-РЕ
Тв1+Тв2 В Р-РЕ
Гетерогенные реакции – это реакции, протекающие в неоднородной
среде, т.е. между веществами, которые находятся в разных фазах
(твердой и жидкой, газообразной и жидкой и т.д.). Гетерогенные
реакции идут на границе раздела фаз.
Na2CO3(Tв)+2 НСl (Г) = 2 NaСl +Н2O + CO2
Ж1+Ж2 НЕСМЕШИВАЮЩИЕСЯ
Тв1+Тв2
Г+Т
Г+Ж
5. каталитические и автокаталитические реакции
Каталитические реакции – это реакции, протекающиепод действием катализаторов.
КАТ
А + В = АВ
Автокаталитические реакции – это реакции, в которых
катализатором является один из продуктов реакции.
Например, при разложении перманганата калия
образуется оксид марганца (IV), который является
катализатором для данного процесса:
MnO2
2KMnO4 = K2MnO4 + MnO2 + O2
6. простые и сложные реакции
Простые реакции - это реакции, протекающие в однустадию, в них участвуют только частицы, входящие в
уравнение реакции.
Сложные реакции – это реакции, идущие в несколько
стадий,
которые
идут
последовательно,
либо
параллельно, либо последовательно-параллельно.
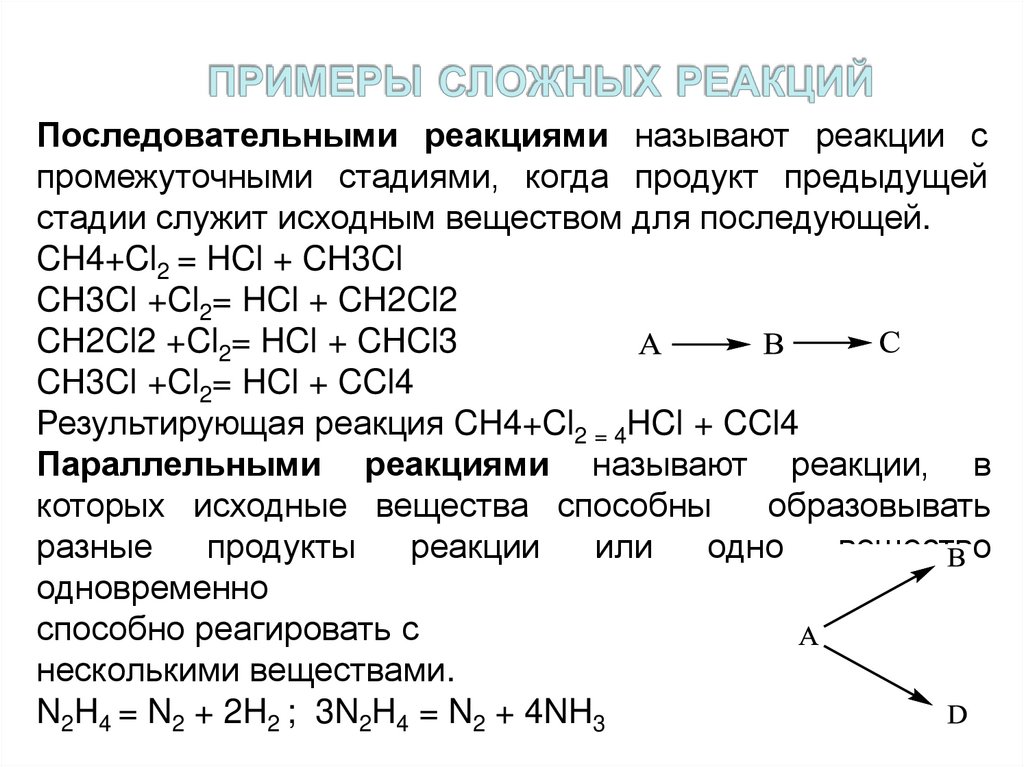
7. примеры сложных реакций
Последовательными реакциями называют реакции спромежуточными стадиями, когда продукт предыдущей
стадии служит исходным веществом для последующей.
CH4+Cl2 = HCl + CН3Cl
CН3Cl +Cl2= HCl + CН2Cl2
CН2Cl2 +Cl2= HCl + CНCl3
CН3Cl +Cl2= HCl + CCl4
Результирующая реакция CH4+Cl2 = 4HCl + CCl4
Параллельными реакциями называют реакции, в
которых исходные вещества способны
образовывать
разные
продукты
реакции
или
одно
вещество
одновременно
способно реагировать с
несколькими веществами.
N2H4 = N2 + 2H2 ; 3N2H4 = N2 + 4NH3
8. скорость химической реакции
Подскоростью
гомогенной
химической реакции ( ) понимают vгомоген
изменение количества вещества (∆n) за
единицу времени ( ) в единице объема
системы (V)
n
V
с
Скоростью
химической
реакции vго мо ген
называют
изменение
концентрации
реагирующего
вещества
в
единицу
времени.
Под
скоростью
гетерогенной
химической реакции ( ) понимают
n
vгетероген
изменение количества вещества (∆n)
S
за единицу времени ( ) на единице
поверхности раздела фаз (S)
9.
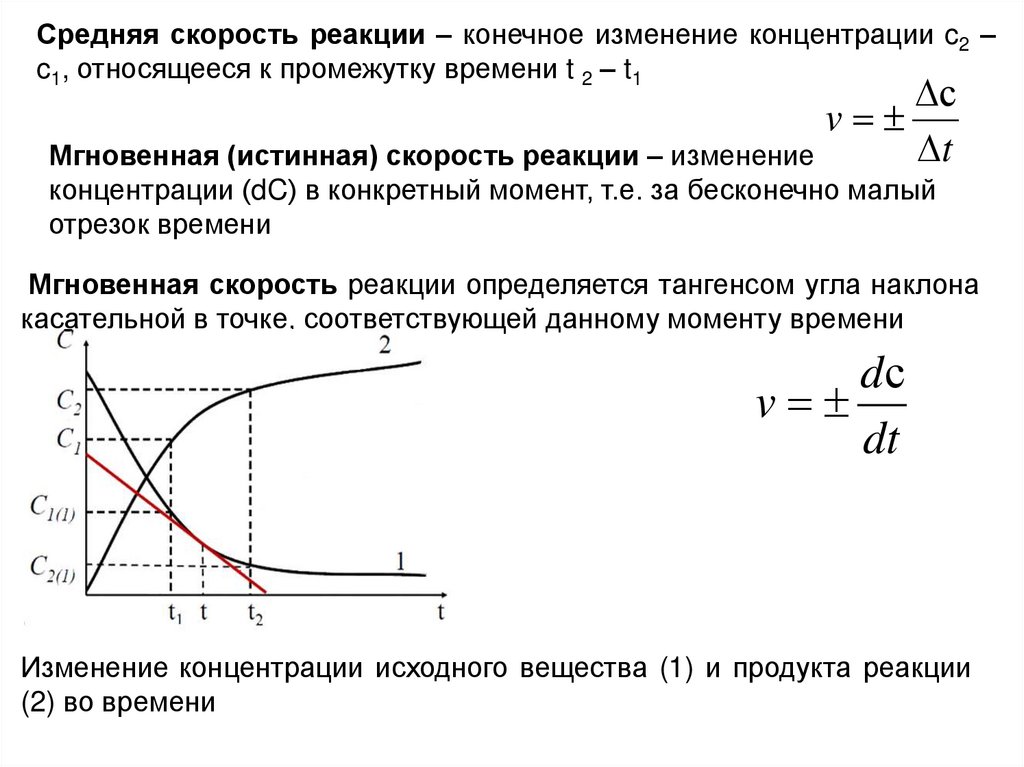
Средняя скорость реакции – конечное изменение концентрации c2 –c1, относящееся к промежутку времени t 2 – t1
с
v
t
Мгновенная (истинная) скорость реакции – изменение
концентрации (dC) в конкретный момент, т.е. за бесконечно малый
отрезок времени
Мгновенная скорость реакции определяется тангенсом угла наклона
касательной в точке, соответствующей данному моменту времени
dс
v
dt
Изменение концентрации исходного вещества (1) и продукта реакции
(2) во времени
10. факторы, влияющие на скорость реакции
• природа реагирующих веществ• концентрация реагирующих веществ
• физическое состояние веществ
• температура
• катализатор
• стерический фактор
11. закон действующих масс
Скорость химической реакции прямо пропорциональнапроизведению концентраций реагирующих веществ
в степенях их стехиометрических коэффициентов.
Кинетическое уравнение – это
математическое
выражение закона действующих масс, оно связывает
скорость реакции с концентрациями всех реагирующих
веществ.
Для реакции А + В = С
Вероятность нахождения молекул А и В в одной точке зависит от их
концентраций
ωA=α[A]
ωB = β[B]
Вероятность столкновения равна произведению вероятностей
ωAВ = ωA·ωВ = α[A]·β[B]
α·β = k
VAB = k [A] [B]
Для реакции в общем виде
Например: 3 H2(г) + N2(г) = 2NH3(г)
vпр k1 A B
a
b
=k [H2]3 [N2]
12. константа скорости реакции
k – коэффициент пропорциональности,константой скорости реакции
называемый
Физический смысл
Константа скорости реакции численно равна скорости
реакции, при концентрации реагирующих веществ равной
единице
Константа скорости реакции зависит от природы
реагирующих веществ, температуры и присутствия
катализаторов, но не зависит от концентрации веществ
13. правило вант-гоффа
При повышении температуры на 100 скоростьхимической реакции увеличивается в 2-4 раза
v2 v1
t 20 t10
10
v1
t
10
1 - скорость реакции при температуре t01;
2 - скорость реакции при температуре t02;
- температурный коэффициент, принимает значения
от 2 до 4
14. теория активных столкновений
Теория активных столкновений позволяет вывестиматематическое соотношение между скоростью реакции,
частотой столкновений и вероятность того, что энергия
молекул превосходит величину ЕА.
УРАВНЕНИЕ АРРЕНИУСА
ln k z e
Ea
RT
k – константа скорости реакции;
z – число столкновений;
R – универсальная газовая постоянная;
T – абсолютная температура;
Eа – энергия активации.
15. энергия активации
Энергия активации – минимальная энергия, котораянеобходима для химического взаимодействия.
Энергия активации - энергетический барьер, который
должны преодолеть сталкивающиеся молекулы, чтобы
между ними произошло химическое взаимодействие.
Распределение молекул по кинетической энергии
16. теория переходного состояния
17. катализатор
Катализатор – вещество увеличивающее скорость реакции, само невступает во взаимодействие.
Катализатор в равной степени ускоряет прямую и обратную реакции,
не смещает химическое равновесие, приводит к более быстрому его
достижению.
Количество катализатора значительно меньше, чем реагентов. В ходе
реакции катализатор не расходуется
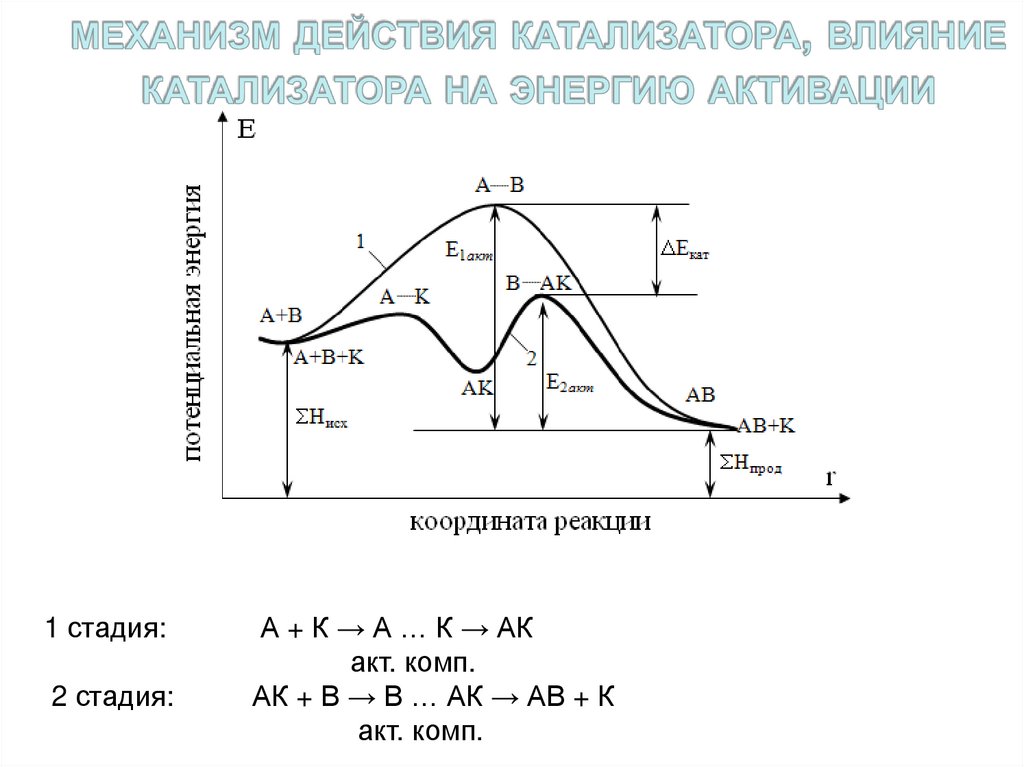
Катализатор изменяет путь реакции и тем самым влияет на энергию
активации.
Катализ – явление изменения скорости реакции под действием
катализаторов.
Катализ гомогенный (катализатор и реагенты в одной фазе) и
гетерогенный (в разных фазах).
18. механизм действия катализатора, влияние катализатора на энергию активации
1 стадия:2 стадия:
А + К → А … К → АК
акт. комп.
АК + В → В … АК → АВ + К
акт. комп.
19. типы катализаторов
При гомогенном катализе - катализатор и реагирующиевещества находятся в одной фазе
Iсхема реакции:
2H2O2 2H2O+O2
1. H2O2 + I- H2O + IO2. IO- + H2O2 H2O + I- + O2
При гетерогенном катализе – катализатор и реагенты
находятся в разных фазах
Pt
схема реакции:
CO + 1/2 O2 CO2
20. химическое равновесие
Состояние обратимой реакции, при котором скоростьпрямой реакции равна скорости обратной реакции,
называется химическим равновесием.
vпр kпр A B
a
b
vобр kобр C D
c
d
kпр A B kобр C D
a
b
c
d
21. константа химического равновесия
Константа химического равновесия - это отношениепроизведения равновесных концентраций продуктов
реакции к произведению равновесных концентраций
исходных веществ в степенях численно равных их
стехиометрическим коэффициентам.
c
d
C
D
kпр
p
p
Kp
a
b
kобр
A p B p
Для гомогенных реакций:
2SO2(г)+ O2(г) = 2SO3(г)
Для гетерогенных реакций:
ZnO(тв)+H2(г)=Zn(тв)+H2O(г)
2
SO3
Kр
SO2 2 O2
Kр
H 2O
H 2
22. принцип ле шателье
Если на равновесную систему оказать внешнеевоздействие, то равновесие смещается в сторону
той реакции (прямой или обратной), которая
противодействует этому воздействию.
Химическое равновесие является подвижным.
При изменении внешних условий скорости прямой и
обратной реакций могут стать неодинаковыми, что
обуславливает смещение (сдиг) равновесия.
23. факторы, влияющие на смещение химического равновесия
1. Концентрация. При увеличении (уменьшении)концентрации реагирующих веществ и при уменьшении
(увеличении)
концентрации
продуктов
реакции
химическое равновесие смещается вправо (влево).
2. Давление. При увеличении (уменьшении) давления
равновесие
смещается
в
сторону
уменьшения
(увеличения) числа молекул (молей) газообразных
веществ.
3. Температура. Повышение (понижение) температуры
приводит к смещению химического равновесия в сторону
эндотермической (экзотермической) реакции.



















 Химия
Химия








