Похожие презентации:
Азот и его свойства
1. Тема урока «Азот и его свойства».
Цель: узнать о строении атома и молекулы азота, оего физических и химических свойствах,
круговороте азота в природе, научиться составлять
уравнения реакций с участием азота.
2. История открытия азота:
В 1772 г. Англичанин Д. Резерфорд установил, что воздух,оставшийся под колоколом, где жила несколько дней мышь,
освобожденный от углекислоты, не поддерживает горения и
дыхания. Этот воздух он назвал «ядовитым воздухом». В том же
году Пристли Дж. получив «ядовитый воздух» иным путем,
назвал его «флогистированным» воздухом.
В 1773 году К.В. Шиле установил, что воздух состоит из двух газов.
Он назвал газ, не поддерживающий горения и дыхания
«дурным» или «испорченным» воздухом.
В 1776 г. Лавуазье, подробно исследуя
«ядовитый», «флогистированный» и
«дурной» воздух, установил тождество между
ними.
В 1787 г. Лавуазье предложил назвать этот
газ «азотом»
(от греч. слова «а»- отрицание и «зоэ»-жизнь).
3.
Строение атома азота:Шкала степеней окисления азота
-3 -2 -1 0 +1 +2 +3 +4 +5
восстановитель Окислитель
восстановитель
окислитель
4. Строение атома азота:
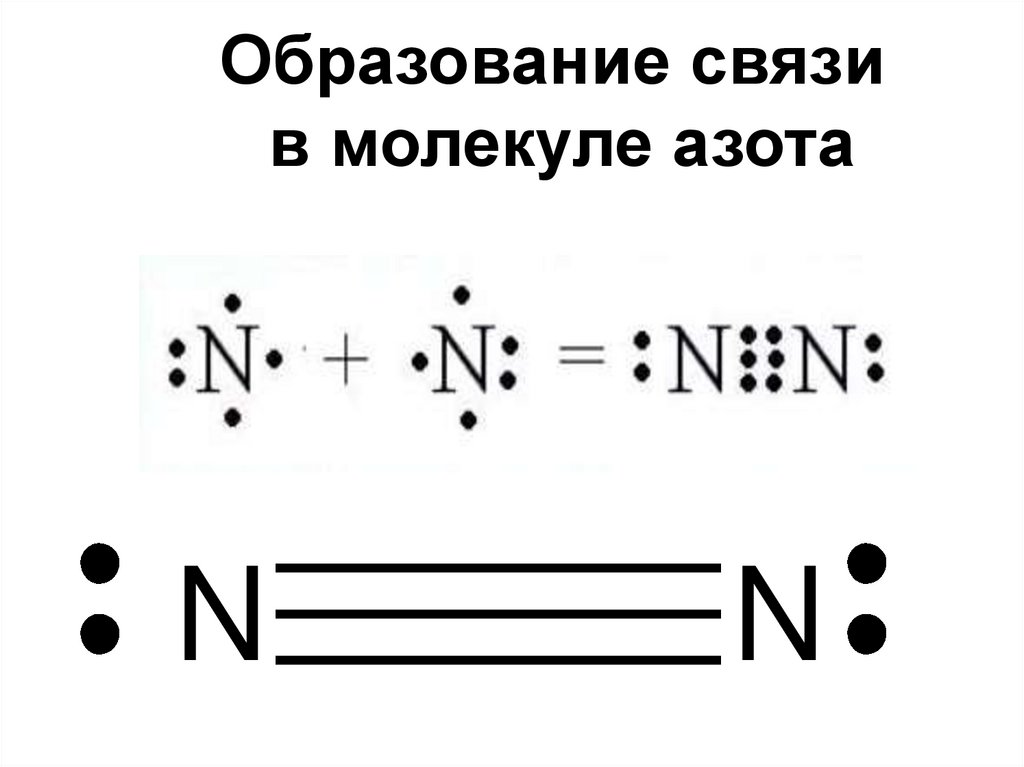
Образование связив молекуле азота
N
N
5.
6.
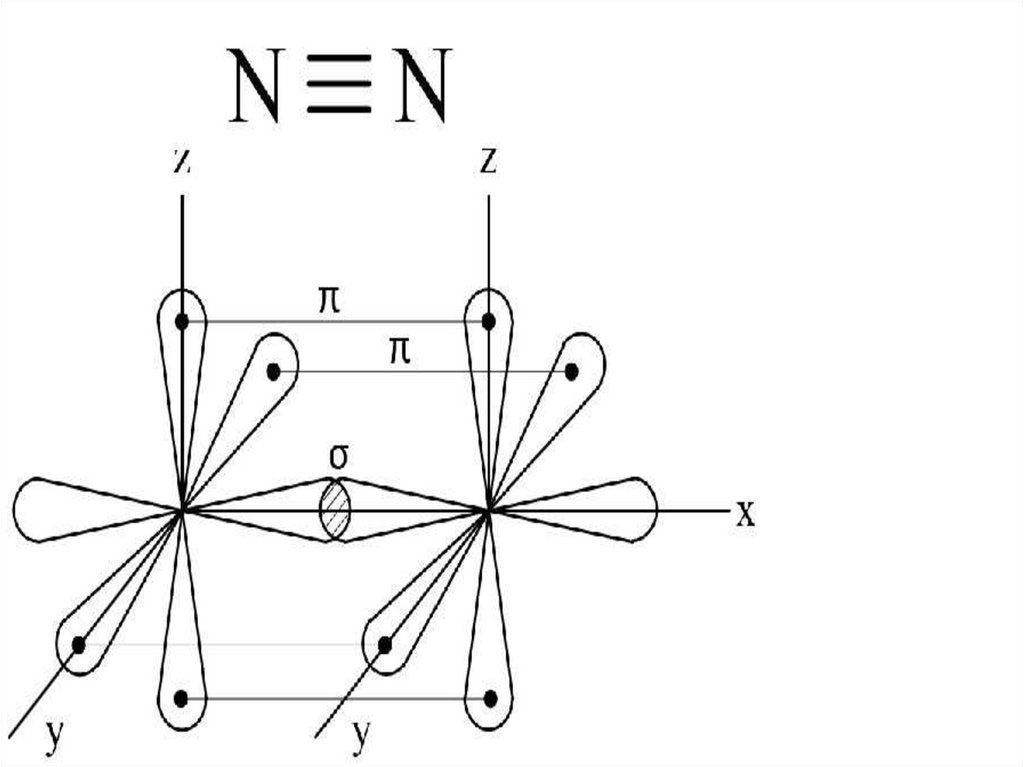
Образование химической связи вмолекуле азота
1.Ковалентная
2.Неполярная
3.Тройная
4.Сигма и две пи
5.МКР
6.Газ
7. Образование химической связи в молекуле азота
Каким образом можно объяснитьхимическую инертность молекулы азота?
2 атома азота соединены в молекулу
тройной ковалентной неполярной
связью, этим объясняется прочность
молекулы и как следствие её
химическая инертность.
8. Каким образом можно объяснить химическую инертность молекулы азота?
Физические свойстваТ кип (N2)= - 196 C
ГАЗ
БЕЗ ЦВЕТА
БЕЗ ЗАПАХА
малорастворим в воде
9. Физические свойства
Химические свойстваОкислитель
N2+Na=
N2+Ca=
N2+H2=
СОЭ АЗОТА
с металлами и водородом -3
Восстановитель
N2+O2= NO!!!
(ТОЛЬКО +2)
10. Химические свойства
Получение азота:11. Получение азота:
1.В промышленности – изжидкого воздуха
Т кип (О2) = - 183 C,
Т кип (N2)= - 196 C
2. Лабораторный
t
NH4NO2 = N2 + 2H2O
12.
Круговоротазота в природе:
А-ассимиляция
растениями,
F-фиксация
азотобактериями в
симбиозе с
растениями или
бактериями,
живущими в почве,
N-нитрификация,
D-денитрификация,
М-минерализация.










 Химия
Химия








