Похожие презентации:
Азот, строение, свойства. Круговорот Азота в природе
1.
УРОК ПО ТЕМЕ«АЗОТ, СТРОЕНИЕ, СВОЙСТВА.
КРУГОВОРОТ АЗОТА В ПРИРОДЕ»
«Жизнь учит только тех, кто ее изучает»
2.
Какой элемент объединяет эти рисунки?«В воздухе он главный газ,
Окружает всюду нас.
Угасает жизнь растений
Без него, без удобрений.
В наших клеточках живет
Важный элемент – …»
HNO3
HNO3
3.
4. План изучения элемента.
ИСТОРИЯ ОТКРЫТИЯСТРОЕНИЕ АТОМА
СТРОЕНИЕ МОЛЕКУЛЫ АЗОТА
ФИЗИЧЕСКИЕ СВОЙСТВА
ХИМИЧЕСКИЕ СВОЙСТВА
НАХОЖДЕНИЕ В ПРИРОДЕ
КРУГОВОРОТ АЗОТА В ПРИРОДЕ. БИОЛОГИЧЕСКОЕ
ЗНАЧЕНИЕ
ПРИМЕНЕНИЕ
5.
Слово «азот» алхимикисоставили из первой и
последних букв трех
алфавитов (латинского,
греческого и древнееврейского)
Генрих
Кавендиш
Кавендиш
Пристли
Джозеф
Одновременно
с РезерВ 1787 г Антуан Лавуазье
фордом
подробно
исследуя
«ядоВ 1772
- а,г.«мефитический
альфа,
в простом
алеф
витый»
«дурной»что
воздухи,
воздух»
получили
англичаопыте ипоказал,
что это
одно
неустановил,
Г. Кавендиш
исвечи
Дж. ив
после
горения
- зет
тоже вещество,
и предложил
Пристли,
а
такаже
швед
замкнутом
объеме
назвать его азотом,
что в
К.В.
Шееле.
Г.Кавендиш
закрытого
сосуда и
переводе
с греческого
назвал
«испорченный
означает
безжизненный.
-его
омега
поглощения
щелочью
Многие
современники
воздух»,
а К.В.газа
Шееле –
углекислого
Лавуазьевоздух».
считали название
«дурной
Но все
остается
некий
тов
нового элемента не очень
первооткрыватели
«мефи«мефитический
воздух»
удачным. Так, франц.
химик
тического
объ- в
(mephitic
–удушливый),
предложилвоздуха»
переименовать
Азот
–природы
«начало
и
яснение
проискотором
свеча не
горит,
азот в «нитроген»
(обраходящих
химических
зующий
Этомупреа мышьселитру).
гибнет.начал»
конец
всех
названию мы
обязаны
и
вращений
искали
в ошисимволом
азота – N.
бочной
теории
«флогистона».
6.
Строение атомар+ = 7
ПЕРИОД
2
ГРУППА
n0 = 7
VA
N
e = 7
7
2 5
14.0067
14
АЗОТ
Степени окисления:
-3; -2; -1; 0; +1; +2; +3; +4; +5
7.
СТРОЕНИЕ МОЛЕКУЛЫN2
СВЯЗЬ КВАЛЕНТНАЯ
НЕПЛЯРНАЯ
ТИП СВЯЗИ
0
N +
N
N
N
N
0
N
СВЯЗЬ ТРОЙНАЯ. МОЛЕКУЛА ОЧЕНЬ ПРОЧНАЯ. НИЗКАЯ
РЕАКЦИОННАЯ СПОСОБНОСТЬ
8.
ФИЗИЧЕСКИЕ СВОЙСТВАЦВЕТ
Mr(N2)
?<
Mr(воздух)
ЗАПАХ
ВКУС
ЯДОВИТОСТЬ
Ткип = -195,8 0С
Тпл = -210 0С
= 1,25 г/мл
ПЛОХО РАСТВОРЯЕТСЯ В
ВОДЕ (2л N2 В 100 л ВОДЫ)
9. ХИМИЧЕСКИЕ СВОЙСТВА
По отношению к М, Н; элементам с меньшей ЭО,чем N
окислитель
t
N0
?
N-3
1) Mg + N2
При комнатной t
2) Li + N2
t, P, кат.
3) N2 + H2
По отношению к F и О
N0
?
восстановитель
N+1, +2, +3,+4, +5
t
N2 + O2
Допишите уравнения химических реакций, назовите
полученные вещества, составьте электронный баланс
10. НАХОЖДЕНИЕ В ПРИРОДЕ
• В атмосфере – 78,084% (по объему) и 75,6% (помассе).
• В литосфере – 0,04% (по массе).
• В живых организмах - 0,3% (по массе).
Занимает V место по распространенности во Вселенной.
Среди природных минералов наиболее известны
селитры:
• чилийская NaNO3
• индийская KNO3
• норвежская Са(NO3)2
11.
КРУГОВОРОТ АЗОТА В ПРИРОДЕ12.
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕВ организме взрослого человека
содержится до 1,8 кг азота. Он входит в
состав белков (16-17%), ДНК, РНК.
Наряду с фосфором и калием относится к
основным элементам, обеспечивающим рост
и развитие растений.
с
«Азот более драгоценен с
н
о
N
Четыре элемента,
Воедино сливаясь,
Жизнь дают
И строят мир. (Шиллер)
общебиологической точки зрения, чем
самые редкие из благородных металлов»
(В.Л. Омелянский)
13.
БОЛЕЗНЬ ГЛУБИНЫНа глубине несколько десятков метров водолазы начинают испытывать нечто похожее на легкое опьянение. Во
рту ощущается металлический привкус сжатого азота,
обуревает беспричинное веселье. Это азотный наркоз,
состояние, часто называемое «болезнью глубины». Нужно большое самообладание, чтобы не потерять самоконтроль, не ринуться в глубину без оглядки. Причина здесь
такова: давление увеличивает концентрацию азота,
растворенного в крови, в жировых и белковых тканях
организма. При медленном подъеме избыток растворенного азота удаляется. Очень важно, чтобы он ушел из
организма через легкие. Но если подъем происходит быстро, азот выделяется
в кровь в виде пузырьков, не успевая дойти до
легких. Эти пузырьки закупоривают капилляры.
Тогда организму угрожают сильные боли и даже
смерть. Аналогичные процессы происходят и в
организме летчиков при быстром подъеме
самолета в верхние слои атмосферы.
14. ПРИМЕНЕНИЕ
Производство аммиака,минеральных удобрений
Соединения азота - в
производстве взрывчатых
веществ.
В медицине, химических
лабораториях.
В электролампах
В хранилищах музеев
В бензохранилищах
15.
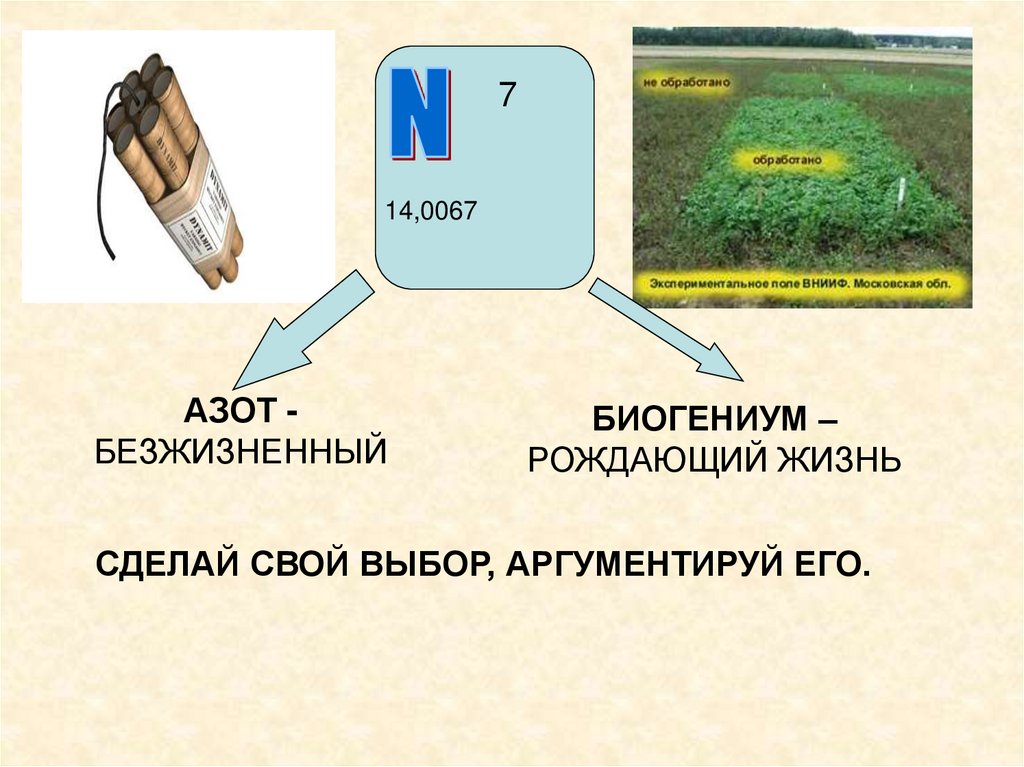
714,0067
АЗОТ БЕЗЖИЗНЕННЫЙ
БИОГЕНИУМ –
РОЖДАЮЩИЙ ЖИЗНЬ
СДЕЛАЙ СВОЙ ВЫБОР, АРГУМЕНТИРУЙ ЕГО.
16. Домашнее задание
§ 16, № 4 с. 89, решить задачу в тетрадиДля приготовления вязких строительных растворов используется процесс
CaO + H2O = Ca(OH)2 (гашёная известь)
Определите массу гашёной извести если в реакции участвовали 200г оксида
кальция и 800г воды.
Творческое задание:
составить сказку о путешествии азота.















 Химия
Химия








