Похожие презентации:
Кислотно-основные и окислительно-восстановительные свойства вещества
1.
Кислотно-основные иокислительно-восстановительные
свойства вещества
2.
Гидролиз солей – реакции обмена междуводой и растворенными в ней солями.
Гидролизу подвергаются растворимые соли,
образованные сильными кислотами и
слабыми основаниями (а); слабыми
кислотами и сильными основаниями (б);
слабыми кислотами и слабыми основаниями
(в):
а)
NH4Cl + H2O NH4OH + HCl
или в ионном виде:
NH4+ + Cl- + H2O NH4OH + H+ + Cl в сокращенном ионном виде:
NH4+ + H2O NH4OH + H+ (pH <7 – среда кислая)
константа равновесия этой системы:
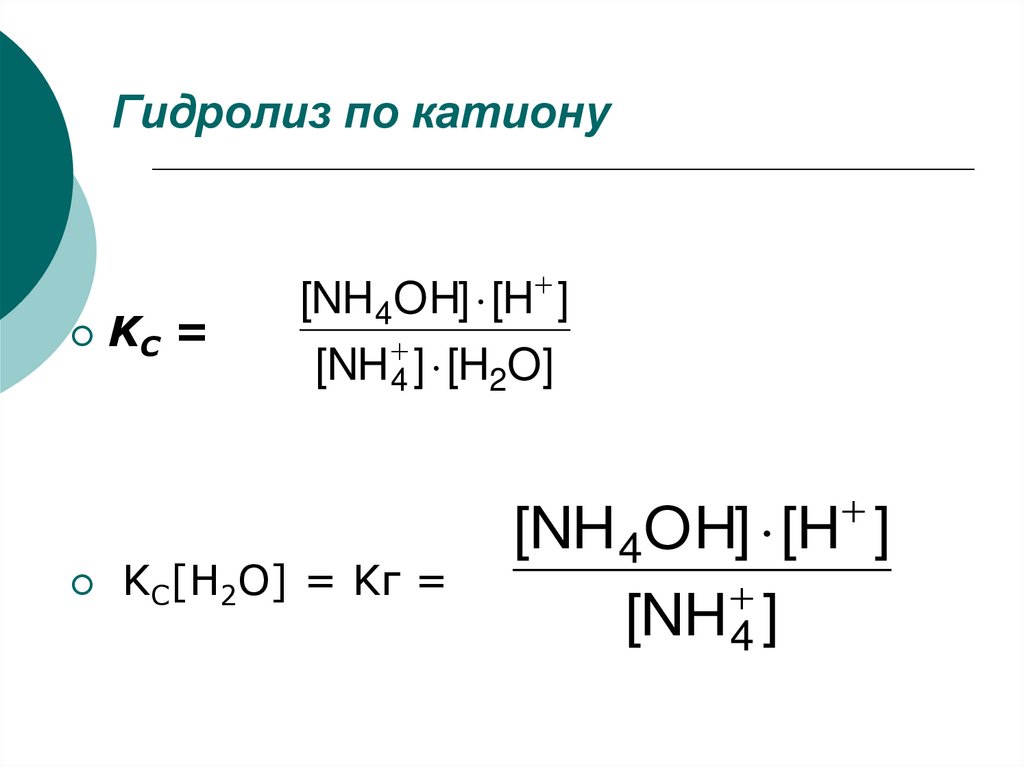
3. Гидролиз по катиону
KС =[NH4OH] [H ]
[NH 4 ] [H2O]
KС[H2O] = Kг =
[NH 4OH] [H ]
[NH 4 ]
4.
Умножим числитель и знаменательуравнения (8.1) на концентрацию
OH—ионов:
[
NH
OH
]
[
H
]
[
OH
]
К
4
W
KГ =
[ NH 4 ] [OH ]
КД
5. Константа и степень гидролиза
Константа гидролиза соли зависит от природы соли,температуры.
Показателем глубины протекания гидролиза является
степень гидролиза (β), которая представляет собой
отношение концентрации гидролизованных молекул к
исходной концентрации растворенных молекул
электролита:
β = Сгидр/С; (С = β∙Сгидр)
(8.3)
Степень гидролиза, как правило, невелика.
Например, 0,1 моль/дм3 CH3COONa при 298К β = 10-4.
Это связано с тем, что вода – слабый электролит и
равновесие смещается в сторону исходных веществ.
С увеличением температуры и снижением концентрации
соли степень гидролиза увеличивается (гидролиз –
эндотермический процесс).
Уравнение (8.1) с учетом (8.3) принимает вид:
6.
2КW
С
KГ =
КД
1
Если β << 1, то Kг = β2C
β=
KГ
С
7.
Используя последнее уравнениеможно найти концентрацию ионов
водорода, а, следовательно, и pH
раствора:
[H+] = βC = КГ С
pH = -lg
КГ С
8. Гидролиз по аниону
CH3COONa CH3COO- + OH+CH3COO- + H2O CH3COOH + OH- (pH 7 –
щелочная среда)
CH3COONa + H2O CH3COOH + NaOH
Степень гидролиза и константа гидролиза в
данном случае описываются теми же
уравнениями но в них входит константа
диссоциации слабой кислоты.
Равновесную концентрацию гидроксид ионов
рассчитывают по уравнению:
[OH-] = βC =
(8.8)
К С
Г
рH = pKw- pOH = pKw – lg
КГ С
9.
Если гидролизу подвергаетсямногоосновный анион, то гидролиз
протекает по стадиям:
CO32-+ H2O HCO3- + OH HCO3- + H2O H2CO3 + OH константа гидролиза по первой ступени
значительно выше, чем константа
гидролиза по последней ступени.
Например, для гидролиза CO32-, при 298 К:
КГ1 = 2∙10-4; К Г2 = 2,2∙10-8.
10.
Поэтому при расчете концентрациииона [ОН-] или [Н+], второй и третьей
ступенью обычно пренебрегают.
Для расчета константы гидролиза по
первой ступени входит константа
диссоциации слабого электролита по
второй ступени:
CO32-+ H2O HCO3-+ OH равна
КW
10 14
4
КГ
2
10
K Д2
4,8 10 11
11. Комбинированный гидролиз
гидролиз растворимой соли, образованнойслабой кислотой и слабым основанием:
NH4F + H2O NH4OH + HF
или в ионной форме
NH4+ + F- + H2O NH 4+ + OH- + H+ + F(pH7, среда нейтральная)
КW
КГ
K Д,К K Д,О
12.
Степень гидролиза и концентрацияионов водорода в этом случае не
зависит от исходной концентрации
соли:
КW
В КГ
К Д,К ,
К Д,О
H
КW
К Д,К ,
К Д,О
pH 0,5(pK pK Д,К pK Д,О )
13.
В зависимости от соотношенияpКД,К и pКД.О, среда может иметь как
слабокислую, так и слабоосновную
реакцию.
При гидролизе солей, образованных
слабыми кислотами или (и) основаниями,
происходит подщелачивание или
подкисление раствора, степень
гидролиза возрастает с разбавлением
раствора при увеличении температуры.
14. Теории кислот и оснований.
При объяснении кислотно-основныхвзаимодействий применяют различные
подходы: электролитической
диссоциации,
протонная теория кислот и оснований,
электронная теория кислот и оснований.
Согласно теории электролитической
диссоциации, применимой к водным
растворам, кислотой является электролит,
который диссоциирует с образованием ионов
Н+ (или гидроксония Н3О+).
Электролит, диссоциирующий с образованием
ОН-, называют основанием.
15.
Кислотно-основные равновесияв растворах
По Аррениусу:
- кислотой называют электролит,
диссоциирующий в растворах с
образованием ионов Н+ ;
- основанием называют электролит,
диссоциирующий в воде с
образованием гидроксид-ионов ОН– .
- амфолитом (амфотерным
гидроксидом) называют электролит,
диссоциирующий в воде с
образованием как ионов Н+, так и
ионов ОН– .
16.
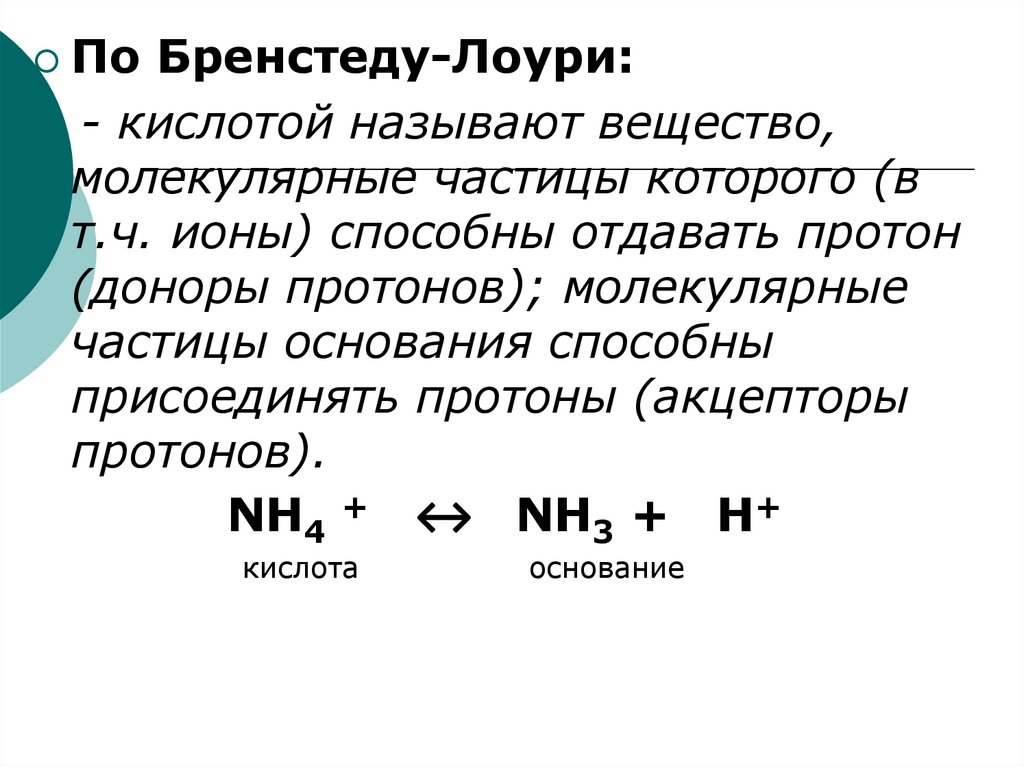
По Бренстеду-Лоури:- кислотой называют вещество,
молекулярные частицы которого (в
т.ч. ионы) способны отдавать протон
(доноры протонов); молекулярные
частицы основания способны
присоединять протоны (акцепторы
протонов).
NH4 + ↔ NH3 + H+
кислота
основание
17. Протонная теория кислот и оснований Д. Брендстеда (1923)
применима как к водным, так и неводнымсредам. Кислоту считают донором протона,
а основание – акцептором протонов. При
взаимодействии кислота отдает, а основание
принимает протон. Соотношение между
основанием и кислотой можно представить
схемой:
Основание + Протон Кислота
Основание и кислота, связанные данным
соотношением, называются сопряженными.
18.
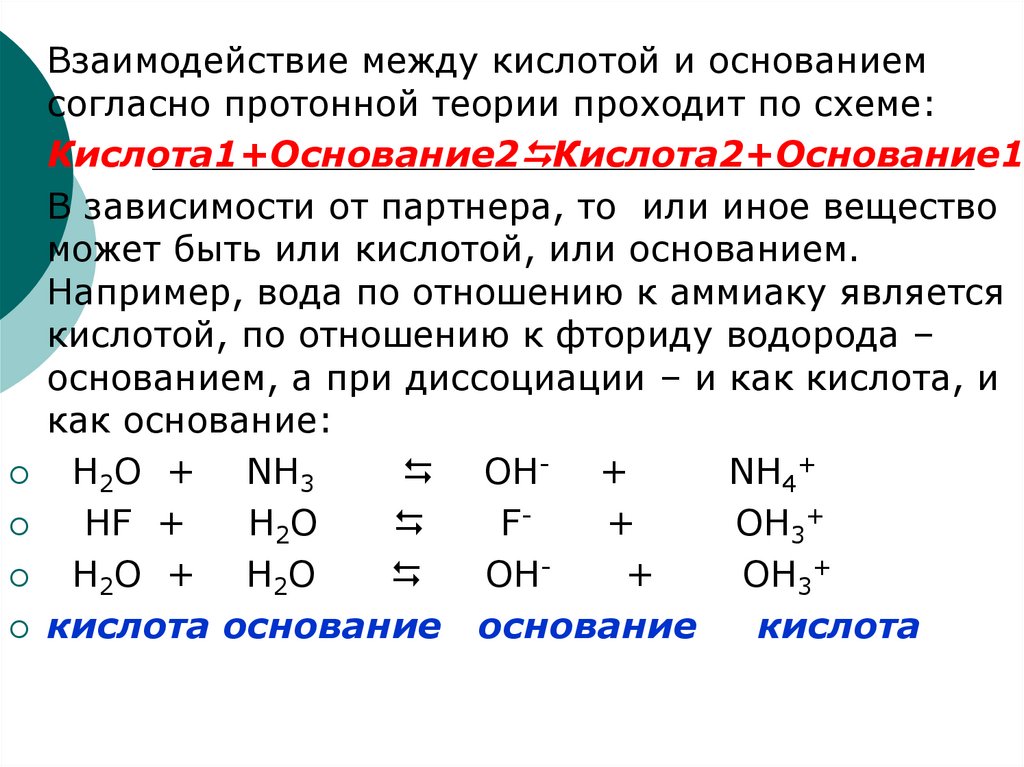
Взаимодействие между кислотой и основаниемсогласно протонной теории проходит по схеме:
Кислота1+Основание2 Кислота2+Основание1
В зависимости от партнера, то или иное вещество
может быть или кислотой, или основанием.
Например, вода по отношению к аммиаку является
кислотой, по отношению к фториду водорода –
основанием, а при диссоциации – и как кислота, и
как основание:
H2O + NH3
OH- +
NH4+
HF +
H2O
F+
OH3+
H2O + H2O
OH+
OH3+
кислота основание основание
кислота
19. Электронная теория кислот и оснований выдвинута Дж. Льюисом (1924).
Кислота является акцептором, аоснование – донором электронов.
Если в состав кислоты входит
водород, то она называется
водородной, а если не входит, то –
апротонной.
Взаимодействие кислоты и основания
по Льюису, приводит к образованию
ковалентной связи по донорноакцепторному механизму:
20.
H F H - FF
|
F B
|
F
Кислота
H
|
N H
|
H
F H
|
|
F B N H
|
|
F H
основание
продукт нейтрализации
Электронная теория охватывает более
широкий круг соединений, чем протонная
теория.
21. Окислительно-восстановительные реакции
При окислительно-восстановительных реакцияхпроисходит изменение степени окисления
вещества. Реакции можно разделить на те, которые
проходят в одном реакционном объеме
(например, в растворах) и разных
(электрохимические).
Под степенью окисления вещества (СО)
понимают условный заряд атома в соединении,
вычисленный, из предположения, что соединение
состоит из ионов.
22. Типы ОВР
Окисление – это процесс отдачи электронов веществом, т.е. повышение его степени окисления, вещество при этом
называют восстановителем. Восстановители Восстановление – это процесс присоединения электронов
к веществу, т. е. понижение его степени окисления и
вещество при этом называется окислителем. Окислители Окислительно-восстановительные реакции условно можно
разделить на четыре типа:
Межмолекулярные реакции: в них окислителем и
восстановителем являются разные вещества, простые и
сложные:
K2Cr2O7+ 3K2SO3 +4H2SO4 = Cr2(SO4)3 +4K2SO4 + 4H2O
В этой реакции окислителем является дихромат калия
(K2Cr2O7),
а восстановителем – сульфит калия (K2SO3).
23.
Внутримолекулярные реакции протекают сизменением степени окисления атомов в одной и
той же молекуле:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
Реакции диспропорционирования
(дисмутации), в которых атомы одного и того
же элемента в реагенте окисляются и
восстанавливаются:
4KClO3 = 3KClO4 + KCl
Реакции синпропорционирования
(конмутации), в которых атомы одного и того
же элемента разных реагентов в результате их
окисления и восстановления получают
одинаковую степень окисления:
2H2S + SО2 = 3S + 2H2О
24. Методы составления ОВР
Метод электронного баланса,рассматривающий переход электронов от
восстановителя к окислителю, не
позволяет непосредственно определить
коэффициенты в окислительновосстановительных уравнениях без
дополнительного использования приема
проб и ошибок.
Это достигается при использовании
электронно-ионного метода, или
метода полуреакций.
25. Алгоритм составления ОВР (МПР)
схемы реакции. ПАлгоритмсоставления ОВР ри этом сильные электролиты
следует записывать в виде ионов, а слабые
электролиты, осадки и газы – в виде молекул
(продукты реакции определяют опытным путем,
или на основании справочных данных);
2. Составление полуреакций, т.е. уравнивание
числа атомов в левой и правой частях уравнения
реакции :
а)Если исходные вещества содержат больше
кислорода, чем продукты реакции, то кислород
связывается в:
Кислых средах О-2+2Н+=Н2О
Нейтральных и щелочных: О-2+Н2О=2ОН 1. Составление
26.
б) Если исходные вещества содержатменьше кислорода, чем продукты
реакции, то недостаток кислород
восполняется в:
Кислых и нейтральных средах за счет
молекул воды Н2О= О-2+2Н+
Щелочных за счет гидроксогрупп:
2ОН- =О-2+Н2О
3) Уравнивание зарядов в полуреакции.
4) Суммирование полуреакций.
5) Составление молекулярного уравнения.
27.
Представленная схема более универсальна посравнению с методом электронного баланса при
составлении уравнений ОВР с органическими
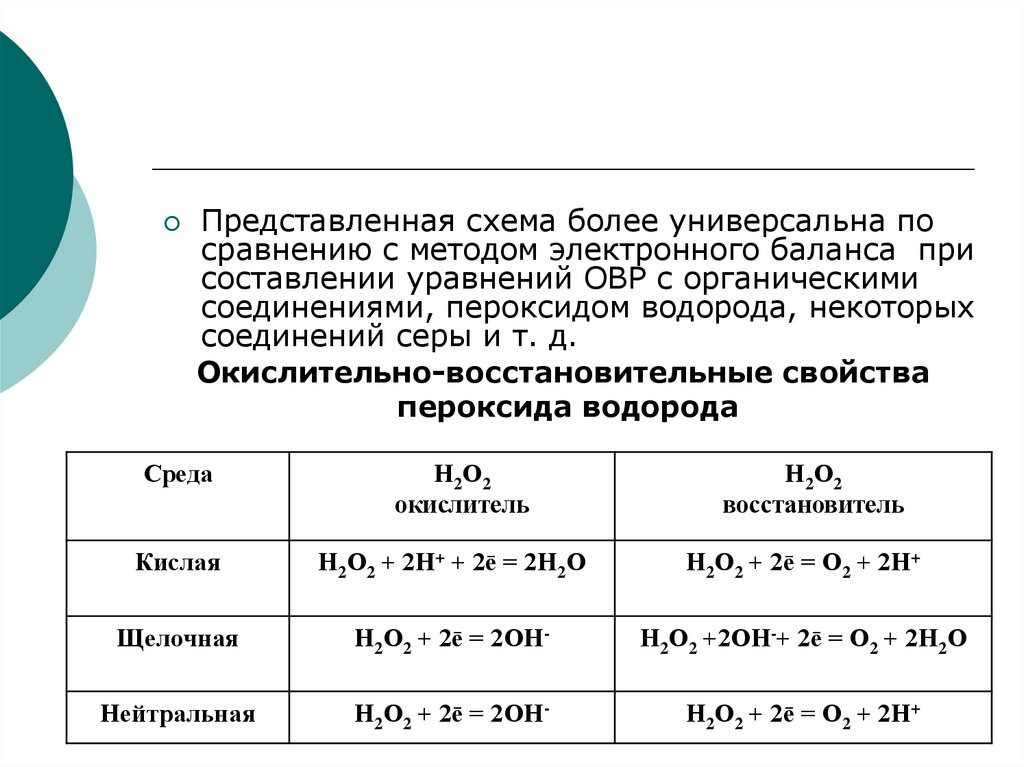
соединениями, пероксидом водорода, некоторых
соединений серы и т. д.
Окислительно-восстановительные свойства
пероксида водорода
Среда
Н2О2
окислитель
Н2О2
восстановитель
Кислая
Н2О2 + 2Н+ + 2ē = 2Н2О
Н2О2 + 2ē = О2 + 2Н+
Щелочная
Н2О2 + 2ē = 2ОН-
Н2О2 +2ОН-+ 2ē = О2 + 2Н2О
Нейтральная
Н2О2 + 2ē = 2ОН-
Н2О2 + 2ē = О2 + 2Н+
28. Направление ОВР
Можно предсказать, используя второй законтермодинамики. Если изменение энергии Гиббса
меньше нуля ( G 0), то реакция может
протекать в прямом направлении, а если
больше нуля ( G > 0), то возможна лишь
обратная реакция. Реальная скорость процессов
зависит от их кинетических констант и условий
проведения.
Можно рассмотреть ОВР как процесс
протекающий при работе гальванического
элемента, определив значения соответствующих
электродных потенциалов. ОКИСЛИТЕЛЕМ
является окисленная форма гальванической
пары, имеющая более высокий потенциал, а
ВОССТАНОВИТЕЛЕМ- восстановленная форма
пары с меньшим электродным потенциалом.
29.
Cr2(SO4)3+K2SO4+Na2SO4+H2O=K2Cr2O7+ Na2SO3 + H2SO4
Cr2O72–+ 14H++6e =2Cr3++ 7H2O Е=+1,36 В
SO42–+ 2H++2e = SO32–+H2O
Е=+0,20 В




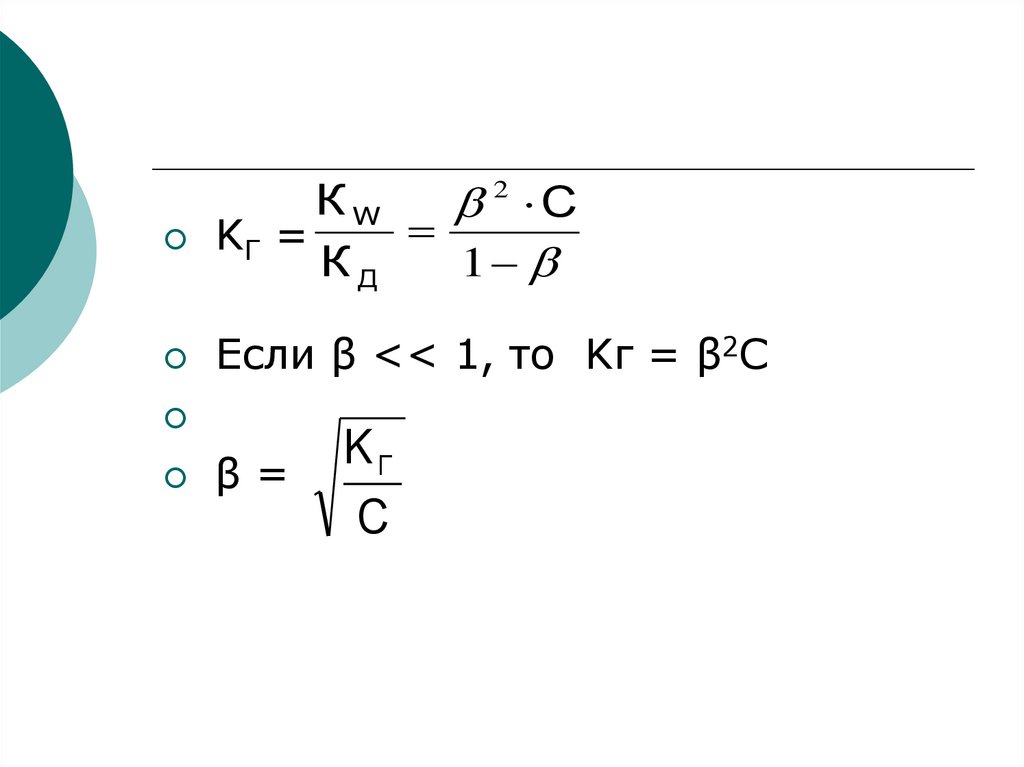



















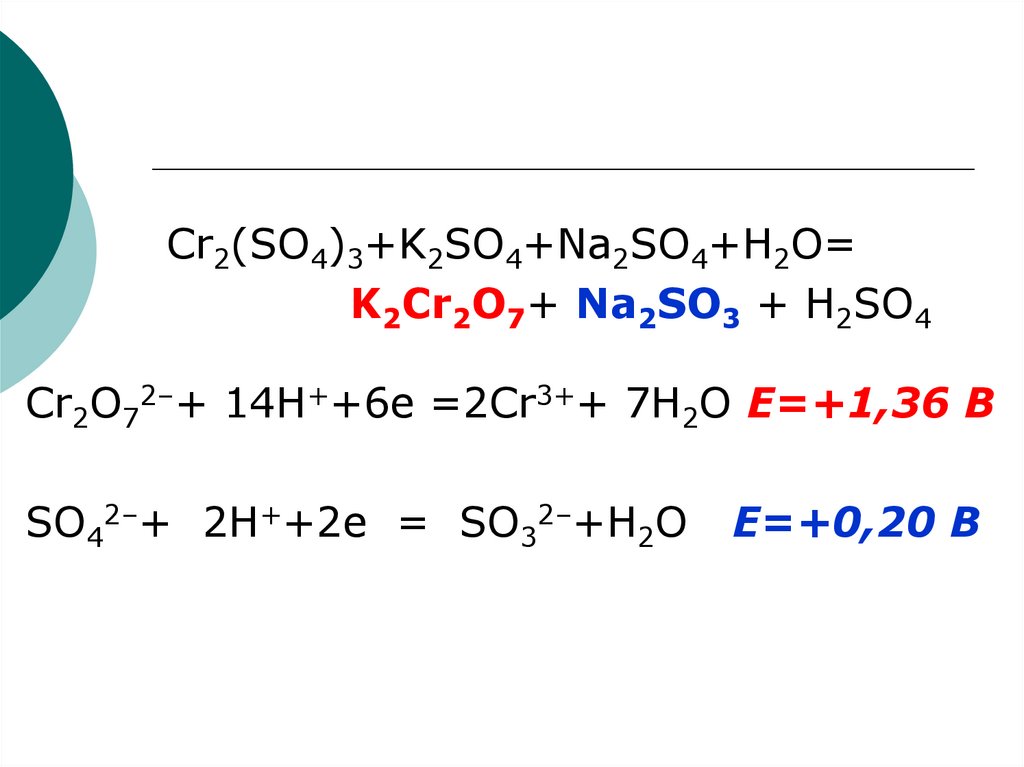
 Химия
Химия








