Похожие презентации:
Окислительно восстановительные свойства веществ
1.
Окислительно восстановительныесвойства веществ
2.
Примеры природных окислительновосстановительных процессовКолосс Родосский –
статуя из железа и бронзы
3.
4.
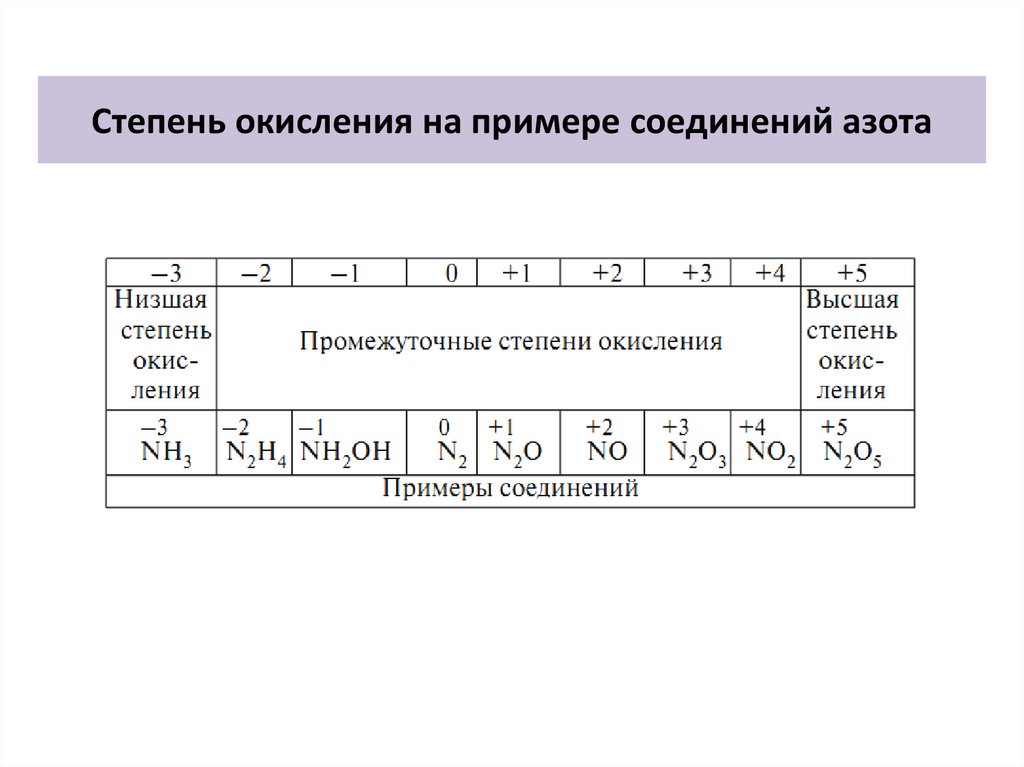
Знать наизусть!Степень окисления – число электронов, отданных или принятых атомом при
образовании химической связи. Принятые электроны показывают знаком минус
(-) перед числом, отданные – знаком плюс (+). Например, S+4O2 H2S-2 S0.
Степень окисления простых веществ равна 0.
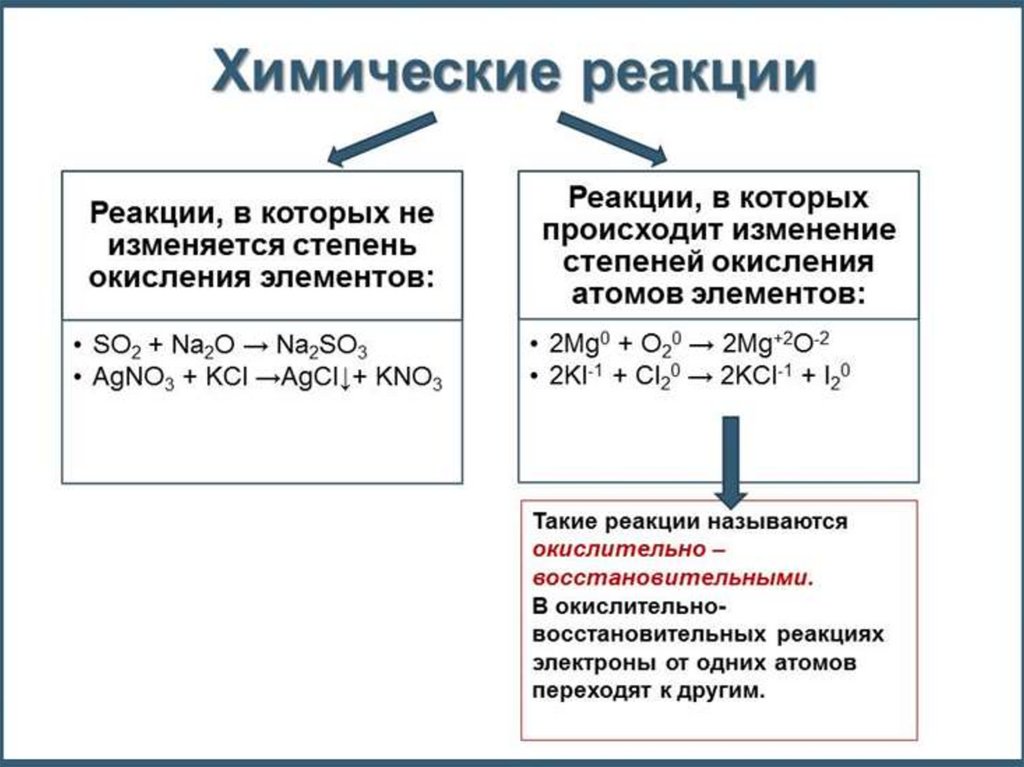
Окислительно-восстановительные реакции – реакции, в ходе которых
изменяются степени окисления элементов вследствие перехода
электронов к более электроотрицательному элементу (от
восстановителя к окислителю). H20 + Cl20 = 2H+1Cl-1
Окисление – процесс отдачи электронов атомом, молекулой или
ионом, степень окисления элемента повышается.
N-3 → N+2
Восстановление – процесс принятия электронов атомом, молекулой
или ионом, степень окисления элемента понижается. N+3 → N+2
Окислитель (ок-ль)– вещество, содержащее атомы или ионы,
принимающие электроны.
Восстановитель(в-ль) – вещество, содержащее атомы или ионы,
отдающие электроны.
5.
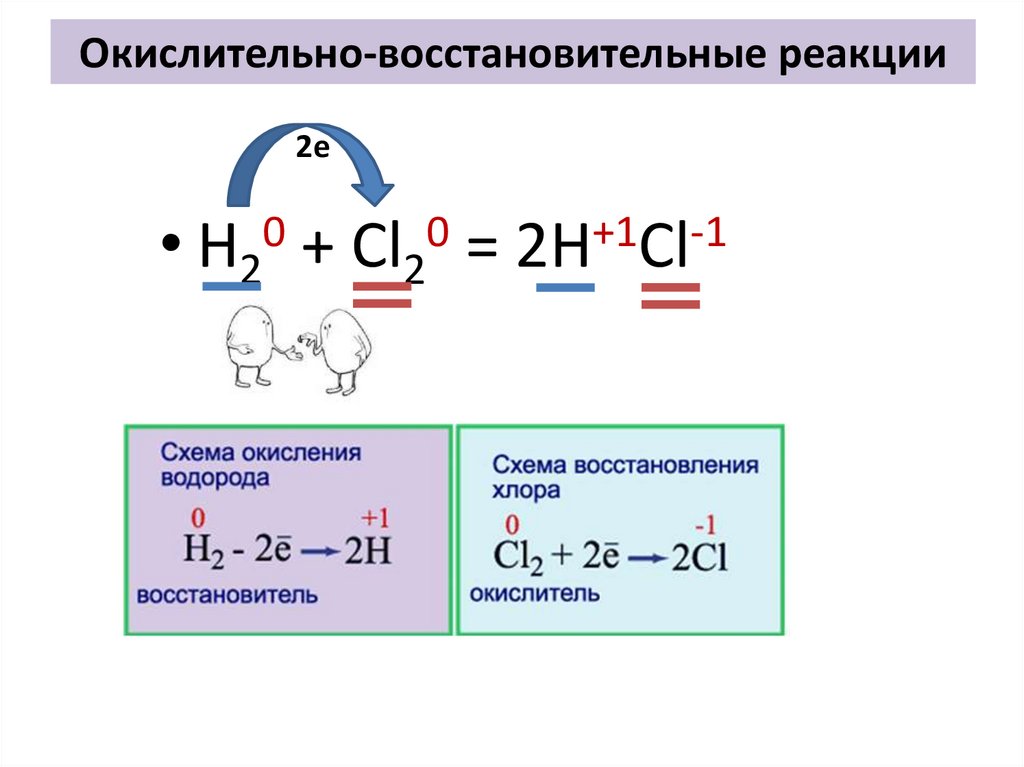
Окислительно-восстановительные реакции2е
0
H2
+
0
Cl2
=
+1
-1
2H Cl
6.
Правила определения степени окисленияЗнать наизусть!
• 1.У свободных атомов и у простых веществ СО равна 0.
O20, Cl20, Al0, Ca0, Mg0;
• 2.Металлы I и III группы во всех соединениях имеют положительную
СО (ее максимальное значение равно номеру группы):
А) у металлов I группы главной подгруппы СО= +1.
Na+1, K+1, Li+1;
Б) у металлов во II группы главной подгруппы СО= +2.
Ca+2, Mg+2, Ba+2;
В) у Al+3;
3. В соединениях кислород имеет СО= -2.
( исключение
O+2F2-1, H2+1O2-1, K2+1O2-1)
4. В соединениях водорода с неметаллами СО= +1.
H+1Cl-1, H2+1O-2, H2+1S-2;
а с металлами СО= -1.
Na+1H-1, K+1H-1;
• 5.В соединениях сумма степеней окисления всех атомов
равна 0.
7.
Степень окисления на примере соединений азота8.
Определите степень окисления• H2S, SO3, SO2, OF2, HF, H2O2, NaH,
MnSO4, KMnO4, Na2O, Na2O2, HCl,
KClO3, KClO4, KClO2, KClO, KCl, Cr2O3,
Na2CrO4, Na2Cr2O7 , Н2SO3, N2O, NO2,
N2O5, НNO2, НNO3
9.
Определите степени окисления атомов всоединениях
Вариант 1:
Вариант 2:
• а) PH3, P2O3, H3PO4, Mg3P2 , Р4
• а) CaS, SO3, H2SO3, S8
• б) СaBr2, HBrO, KBrO3, Br2O5, Br2
• б) SiO2 H2SiO3, SiCl4, Si
• в) Cr2O3, K2CrO4, H2Cr2O7, Cr(OH)3
• в) HClO4, HClO2, BaCl2, Cl2O7, Cl2
• г) MnO, KMnO4, MnCl2, K2MnO4
• г) Fe2O3, Fe2S3, FeSO4, H2FeO4
• д) HNO2, NH3, N2, Ca3N2, N2О
• д) HNO2, NH3, N2, Ca3N2, N2О
10.
11.
Окислительно-восстановительные реакции0
H2
+
0
Cl2
=
+1
-1
2H Cl
12.
13.
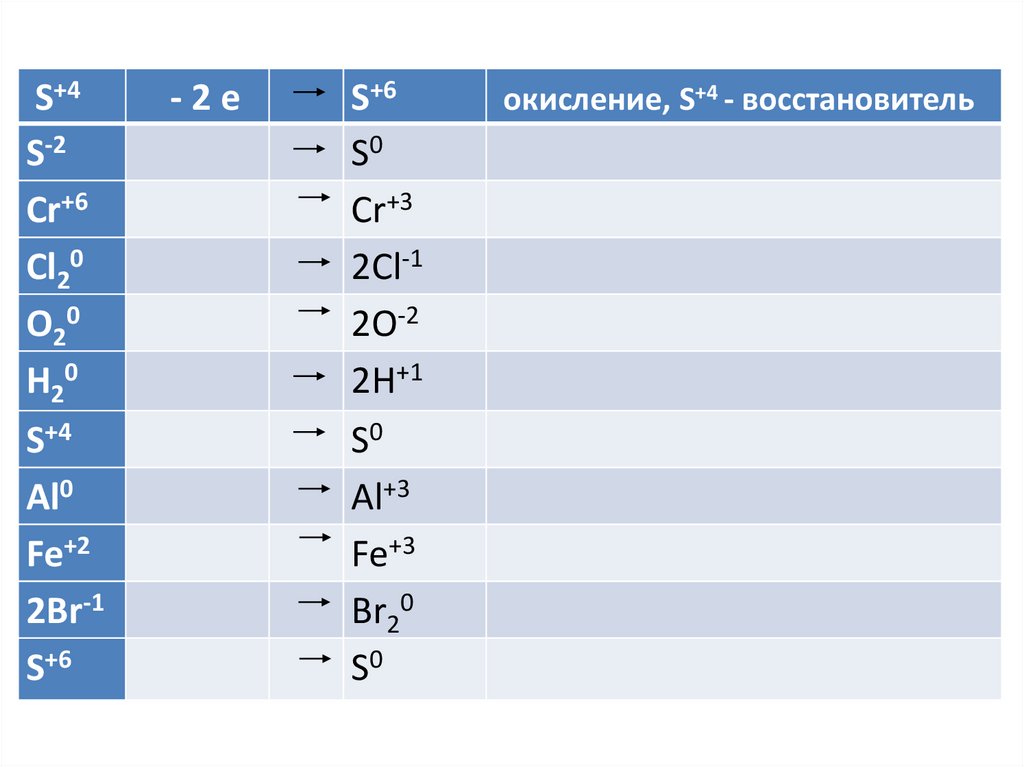
S+4S-2
Cr+6
Cl20
O20
H20
S+4
Al0
Fe+2
2Br-1
S+6
-2е
S+6
S0
Cr+3
2Cl-1
2O-2
2H+1
S0
Al+3
Fe+3
Br20
S0
окисление, S+4 - восстановитель
14.
Реакция, уравнение которой4NH3 +5O 2 → 4NO + 6H2O
соответствует схема превращения азота
• 1) N+3 → N+2
3) N+3 → N-3
• 2) N-3 → N-2
4) N-3 → N+2
15.
Установите соответствие между изменением степениокисления атома серы и схемой превращения
вещества.
СХЕМА ПРЕВРАЩЕНИЙ
A) H2S + O2 → SO2 + H2O
Б) H2SO4 + Na → Na2SO4 + H2S + H2O
В) SO2 + Br2 + H2O → H2SO4 + HBr
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ
1) Э+4 → Э+6
2) Э+6 → Э-2
3) Э+6 → Э+4
4) Э-2 → Э+6
5) Э-2 → Э+4
16.
Расстановка коэффициентов вуравнениях реакций методом
электронного баланса
Метод электронного баланса
17.
Смесь бертолетовой соли с красным фосфором подожгли.Взаимодействие идёт по схеме:
KClO3 + P → KCl + P2O5
1. Определяем степени окисления элементов до и
после реакции. Находим элементы её поменявшие:
• K+1Cl+5O-23 + P0 → K+1Cl-1 + P+52O-25
2. Для элементов, поменявших степень окисления, составляем уравнения
полуреакций процессов окисления и восстановления. Определяем
окислитель и восстановитель:
• Cl+5 + 6e → Cl-1 5 (Cl+5 - окислитель, восстановление)
• P0 -5e → P+5 6 (P0 - восстановитель, окисление)
3. Переносим дополнительные коэффициенты в уравнение реакции:
• 5 KClO3 + 6 P0 = 5 KCl + 3 P2O5
18.
Смесь бертолетовой соли с красным фосфоромподожгли:
KClO3 + P → KCl + P2O5
• K+1Cl+5O-23 + P0 → K+1Cl-1 + P+52O-25
• Cl+5 + 6e → Cl-1 5 (Cl+5 - окислитель, восстановление)
• P0 -5e → P+5 6 (P0 - восстановитель, окисление)
В итоге получаем:
• 5 KClO3 + 6 P0 = 5 KCl + 3 P2O5
19.
МЕТОД ЭЛЕКТРОННОГО БАЛАНСАЗаписать схему реакции
Определить СО элементов
Определить число отданных и принятых электронов
Составить электронный баланс
Определить коэффициенты
Перенести коэффициенты в уравнение реакции
20.
Расставьте коэффициенты в следующих схемах реакцийметодом электронного баланса:
• С + HNO3 → H2О + NO2 + СО2
• Cu + HNO3(разб) = Cu(NO3)2 + NO + H2O
• S + HNO3 → H2SO4 + NO
















 Химия
Химия








