Похожие презентации:
Сероводород. Сульфиды
1.
СероводородСульфиды
2.
H2S - сероводородНахождение в природе:
– в вулканических газах;
– в минеральных источниках;
– при гниении органических веществ.
3.
H2S - сероводородФизические свойства:
бесцветный газ,
с резким запахом (запах тухлых яиц),
сильно ядовит, растворим в воде.
4.
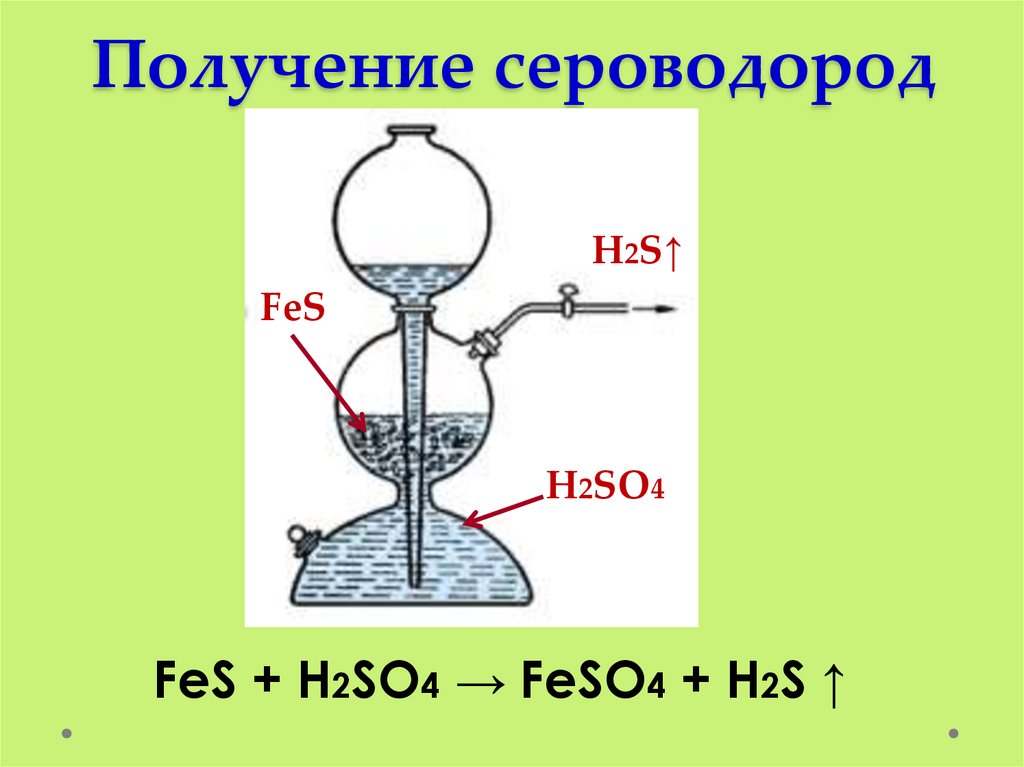
Получение сероводородH2S↑
FeS
H2SO4
FeS + H2SO4 → FeSO4 + H2S ↑
5.
Химические свойства сероводородаСероводород проявляет восстановительные
свойства,
т.к.
сера
проявляет
степень
окисления (-2).
взаимодействие с кислородом
2H2S + 3O2 избыток → 2H2O + 2SO2 ↑
2H2S + O2 недостаток → 2H2O + 2S ↓
взаимодействие с бромом
2H2S + Br2 → 2H2O + 2S ↓
6.
Химические свойства сероводородаОкисление сероводорода
взаимодействие с концентрированными
кислотами:
H2S + 8HNO3→ H2SO4 + 8NO2↑+ 4H2O
H2S + 3H2SO4 → 4SO2↑ + 4H2O
7.
Водный раствор сероводорода –слабая сероводородная кислота
H2S + KOHнедостаток KHS + H2O
гидросульфид калия
H2S + KOH избыток K2S + H2O
сульфид калия
Соли сероводородной кислоты сульфиды, гидросульфиды
8.
Получение сульфидовВзаимодействие простых веществ:
Fe + S → FeS
Получение с помощью реакцией обмена:
CuCl2 + K2S → CuS↓ + 2KCl
9.
Свойства сульфидов– не взаимодействуют со щелочами
– хорошо растворяются в серной кислоте
– обжиг сульфидов (промышленное
значение)
2CuS + 3O2 → 2CuO + 2SO2
Качественные реакции на сульфиды –
образование черных осадков с нитратами
меди (II) и свинца (II)
Na2S + Cu(NO3)2 → NaNO3 + CuS↓
10.
Области применениясероводорода
В химическом синтезе – получение серной кислоты,
сульфидов.
В медицине: в небольших количествах полезен, в
качестве сероводородных ванн
В аналитической химии для осаждения тяжелых
металлов
11.
Домашнее задание:параграф 19 изучить,
письменно выполнить
задания 3 стр. 70









 Химия
Химия








