Похожие презентации:
Молекулярная биофизика. Биологические макромолекулы в растворе, теория Дебая - Хюккеля
1. Молекулярная биофизика. Биологические макромолекулы в растворе, теория Дебая - Хюккеля
2.
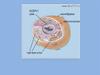
?Как синтезированная белковая цепь, изначально «одномерная», принимает
уникальную, только ей свойственную, пространственную укладку,
обеспечивающую выполнение назначенной этому белку функции?
3.
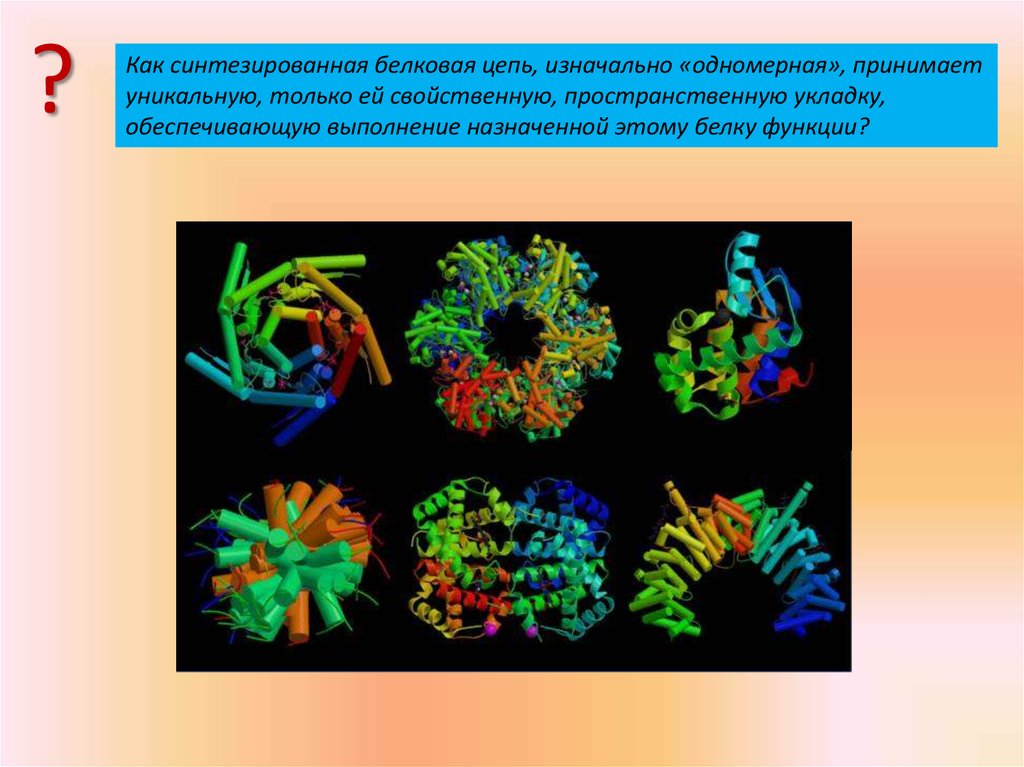
?Каким образом молекулы липидов, будучи смешаны с водой, образуют
пузырьки и другие структуры, очень напоминающие мембраны живых
клеток?
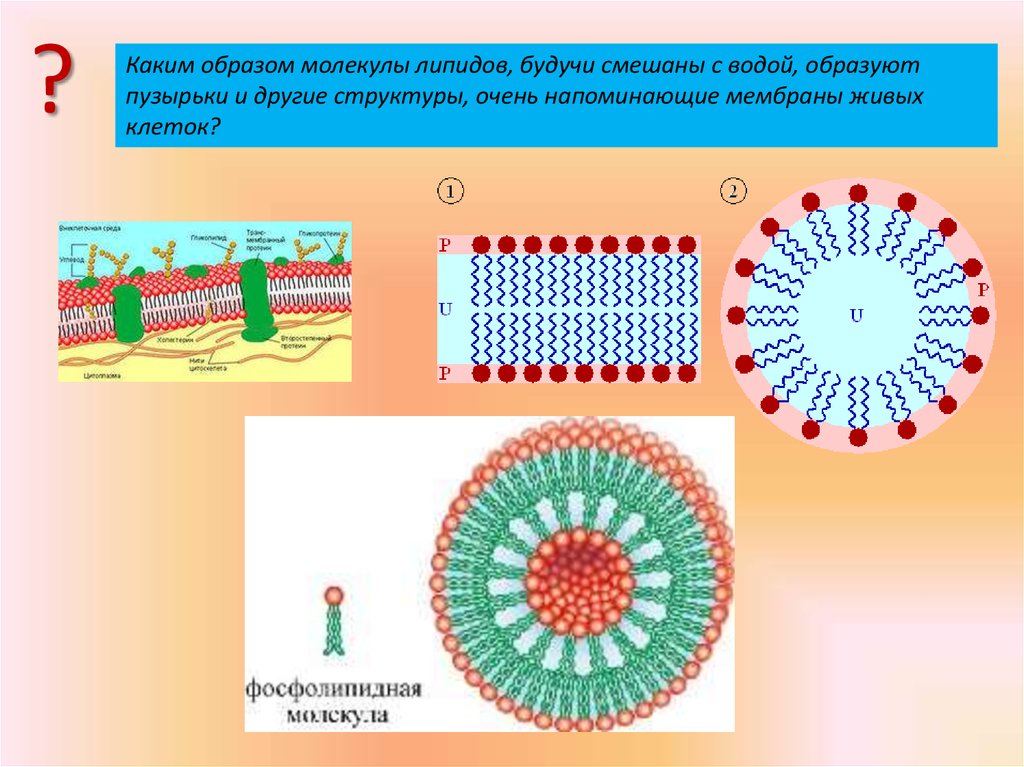
4. Основная «догма» молекулярной биофизики: структура, функция и динамика биологических макромолекул неразрывно связаны между собой
5.
Luigi Galvani1737—1798
Одним из первых биофизических экспериментов может считаться знаменитый
опыт Гальвани — во времена, когда не только о компьютерах никто не слыхивал,
но и до открытия молекул, как таковых, оставалось ещё минимум столетие
6.
(12.08.1887 - 4.01.1961)Одним из первых молекулярных биофизиков может считаться
Эрвин Шрёдингер, чья книга «Что такое жизнь с точки зрения физики?»,
написанная в 1944 году, и по сей день не утратила своей актуальности
7.
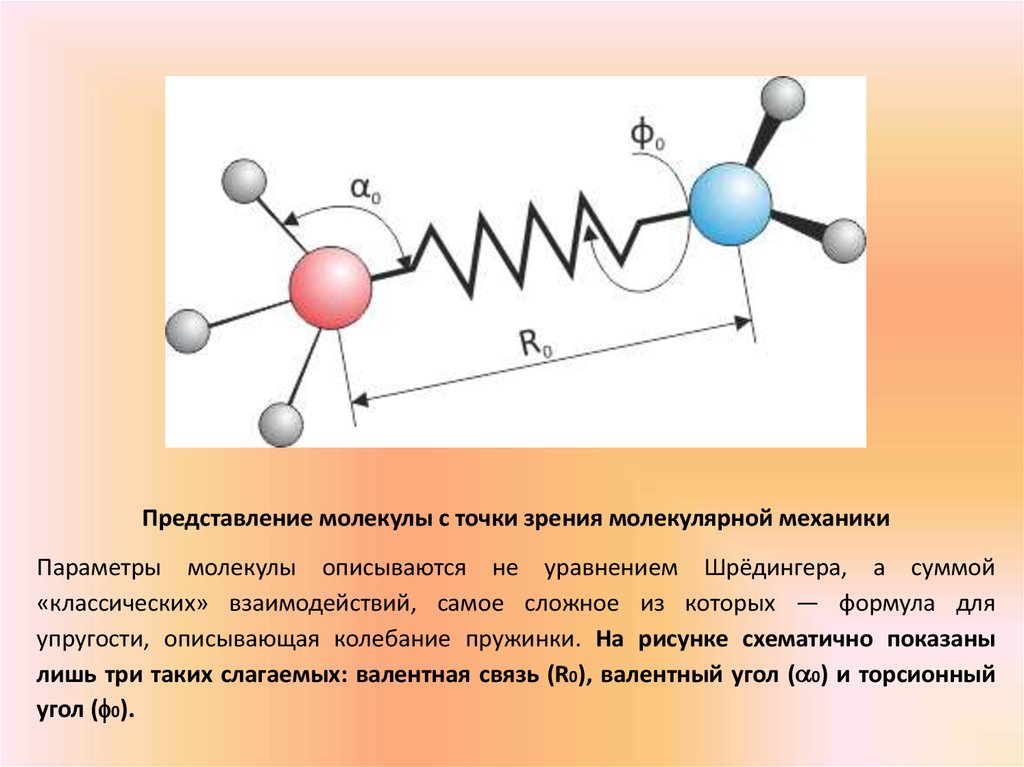
Представление молекулы с точки зрения молекулярной механикиПараметры молекулы описываются не уравнением Шрёдингера, а суммой
«классических» взаимодействий, самое сложное из которых — формула для
упругости, описывающая колебание пружинки. На рисунке схематично показаны
лишь три таких слагаемых: валентная связь (R0), валентный угол ( 0) и торсионный
угол ( 0).
8.
9.
10.
11.
12.
13.
14.
15.
16.
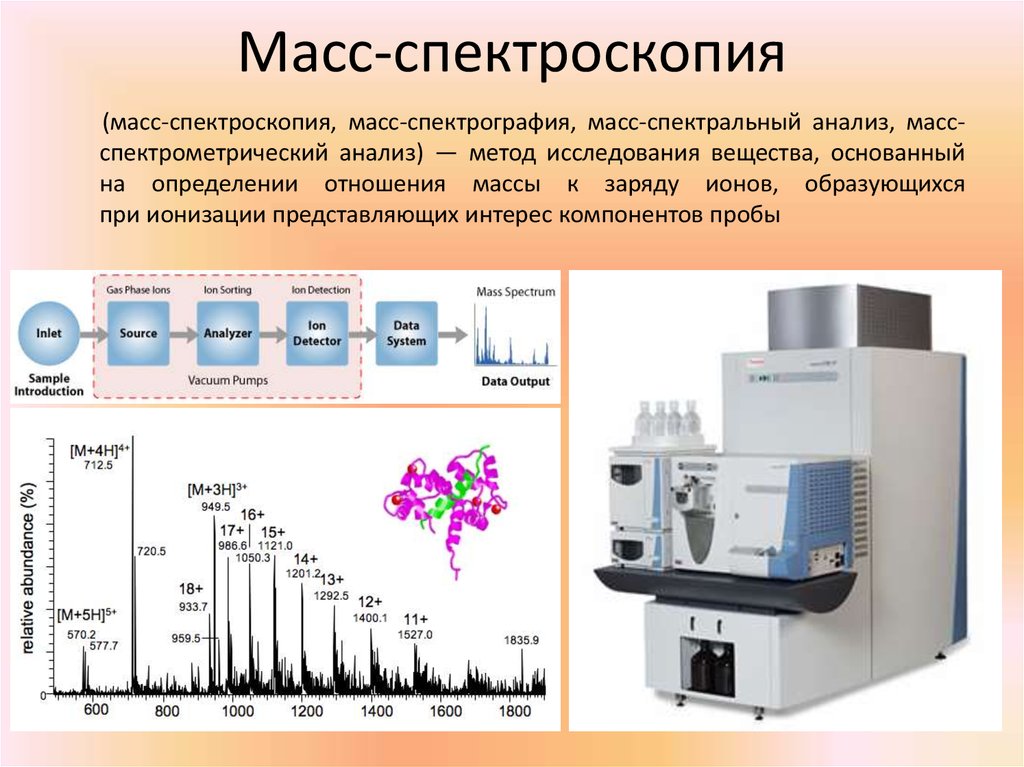
17. Масс-спектроскопия
(масс-спектроскопия, масс-спектрография, масс-спектральный анализ, массспектрометрический анализ) — метод исследования вещества, основанныйна определении отношения массы к заряду ионов, образующихся
при ионизации представляющих интерес компонентов пробы
18.
19.
20.
21.
22.
СПЕЦИФИКА БИОМАКРОМОЛЕКУЛ1. СТАТИСТИЧЕСКИЙ ХАРАКТЕР ПОВЕДЕНИЯ, Т.К.
БИОМАКРОМОЛЕКУЛЫ СОСТОЯТ ИЗ
БОЛЬШОГО ЧИСЛА ОДНОТИПНЫХ ЗВЕНЬЕВ –
МОНОМЕРОВ.
2. НАЛИЧИЕ НЕ ТОЛЬКО ХИМИЧЕСКИХ СВЯЗЕЙ,
НО И ДРУГИХ ВЗАИМОДЕЙСТВИЙ РАЗНОГО
ТИПА, ЧТО ОГРАНИЧИВАЕТ ЧИСЛО
ВОЗМОЖНЫХ КОНФОРМАЦИЙ.
23. Теория Дебая-Хюккеля
• Теория сильных электролитов (1923 г.)Основные положения:
Сильные электролиты в водных растворах практически
полностью ионизированы. Ионы – материальные точки с
зарядами;
При высокой концентрации ионов и малыми расстояниями
между ними ионы взаимодействуют между собой (кулоновские
взаимодействия);
Межионное взаимодействие приводит к тому, что каждый из
ионов становится кружен «роем» противоионов, так
называемой ионной атмосферой;
Межионное
взаимодействие
приводит
к
снижению
подвижности ионов и уменьшает степень их участия в
процессах, происходящих в растворах.
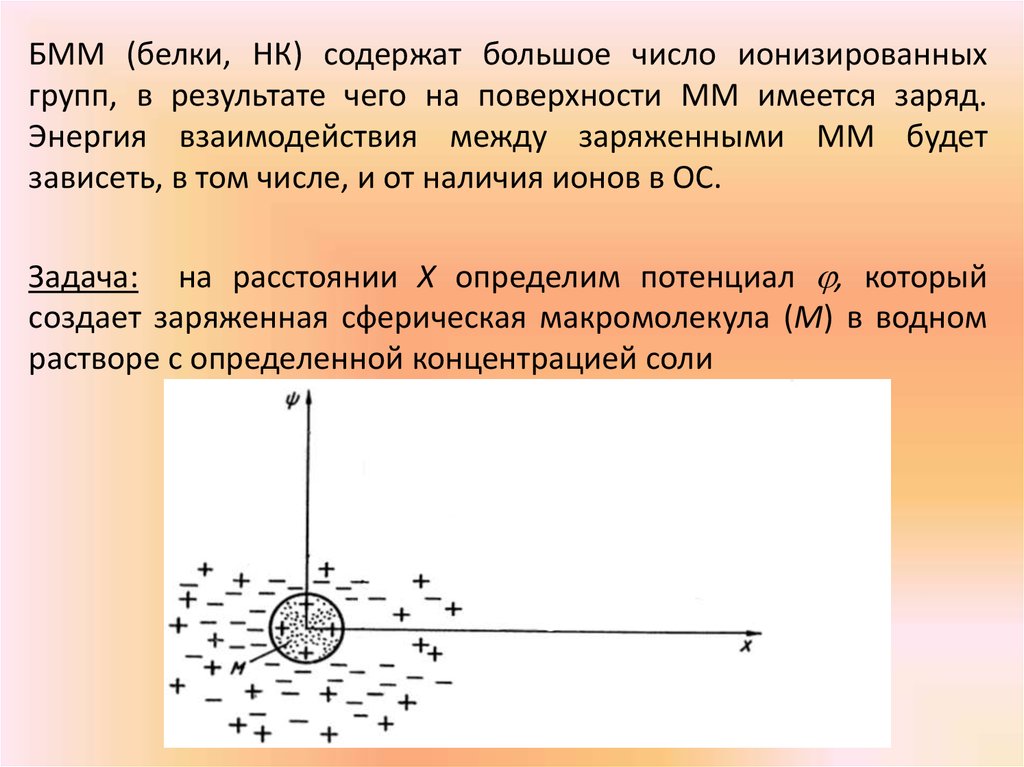
24.
БММ (белки, НК) содержат большое число ионизированныхгрупп, в результате чего на поверхности ММ имеется заряд.
Энергия взаимодействия между заряженными ММ будет
зависеть, в том числе, и от наличия ионов в ОС.
Задача: на расстоянии Х определим потенциал , который
создает заряженная сферическая макромолекула (М) в водном
растворе с определенной концентрацией соли
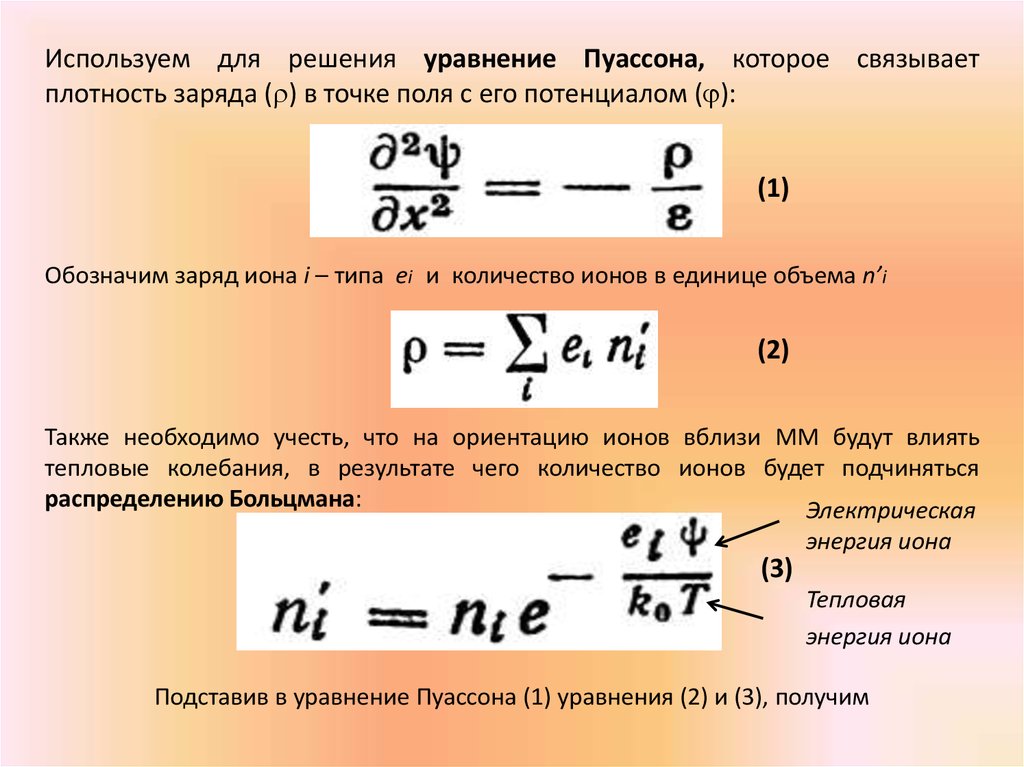
25.
Используем для решения уравнение Пуассона, которое связываетплотность заряда ( ) в точке поля с его потенциалом ( ):
(1)
Обозначим заряд иона i – типа ei и количество ионов в единице объема n’i
(2)
Также необходимо учесть, что на ориентацию ионов вблизи ММ будут влиять
тепловые колебания, в результате чего количество ионов будет подчиняться
распределению Больцмана:
Электрическая
энергия иона
(3)
Тепловая
энергия иона
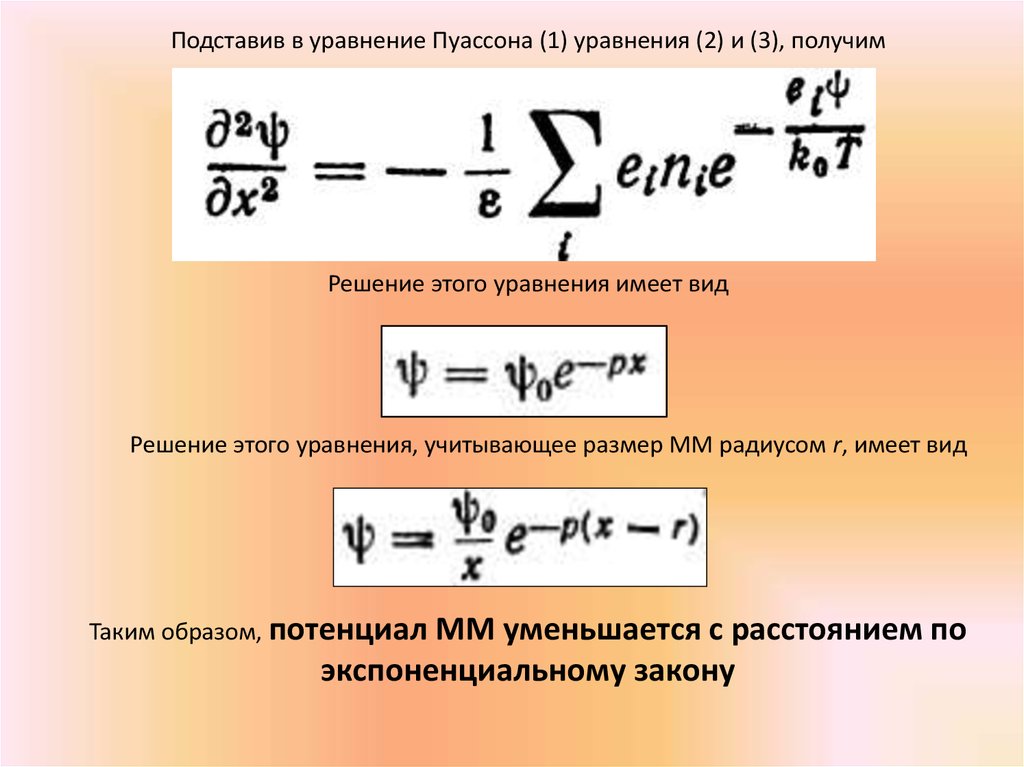
Подставив в уравнение Пуассона (1) уравнения (2) и (3), получим
26.
Подставив в уравнение Пуассона (1) уравнения (2) и (3), получимРешение этого уравнения имеет вид
Решение этого уравнения, учитывающее размер ММ радиусом r, имеет вид
Таким образом, потенциал ММ
уменьшается с расстоянием по
экспоненциальному закону
27.
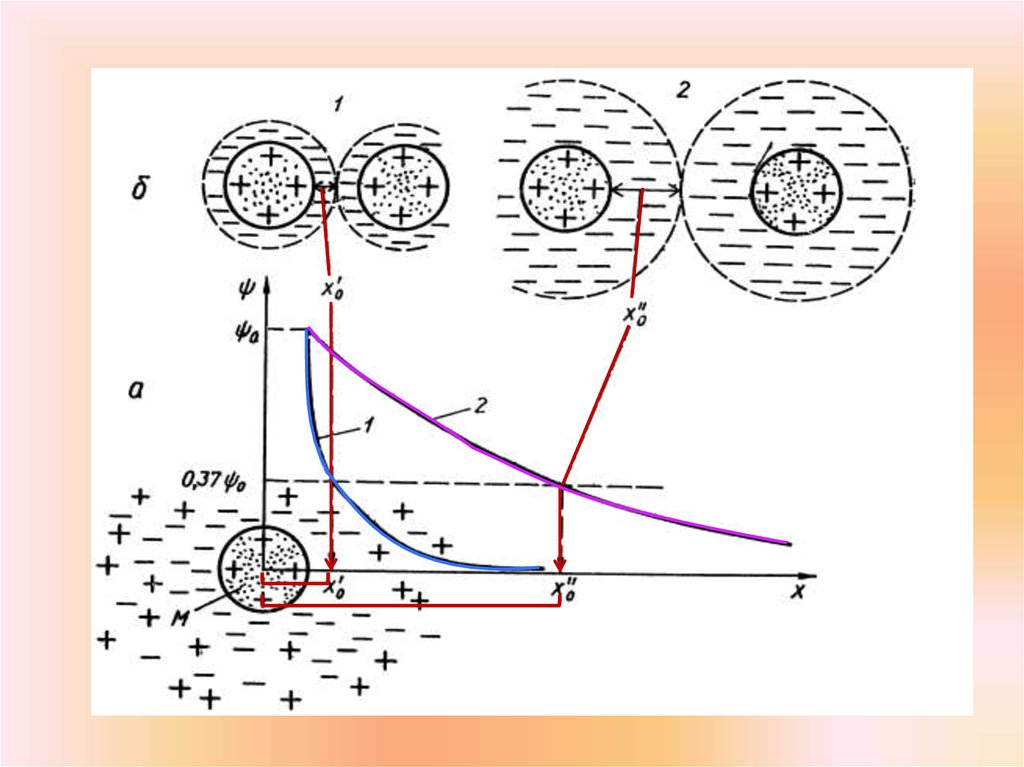
Зависимость электрического потенциала , создаваемого макромолекулой,от расстояния Х
28.
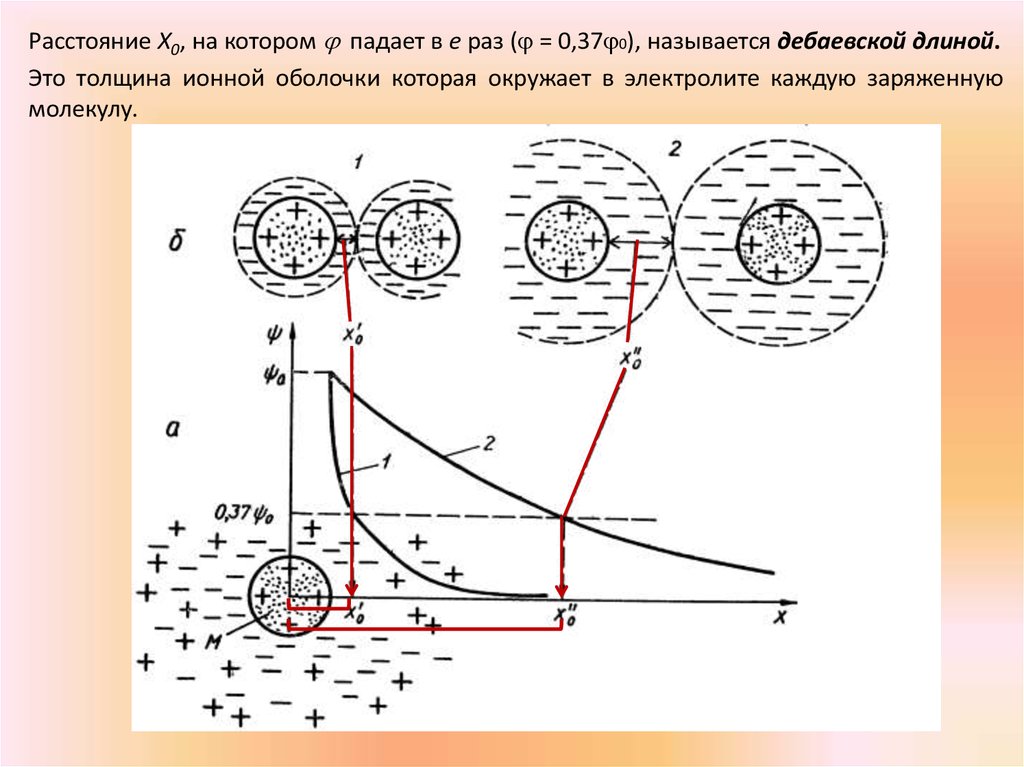
Расстояние Х0, на котором падает в е раз ( = 0,37 0), называется дебаевской длиной.Это толщина ионной оболочки которая окружает в электролите каждую заряженную
молекулу.
29.
Влияние концентрации ионов на взаимодействие заряженных ММ определяетсяионной силой раствора ( ):
Тогда толщина ионной оболочки Х0:
Т.е., при большой ионной силе раствора (высокой концентрации соли)
оболочка ионов становится меньше (тоньше) и все ионы прижимаются к
поверхности ММ
30.
31.
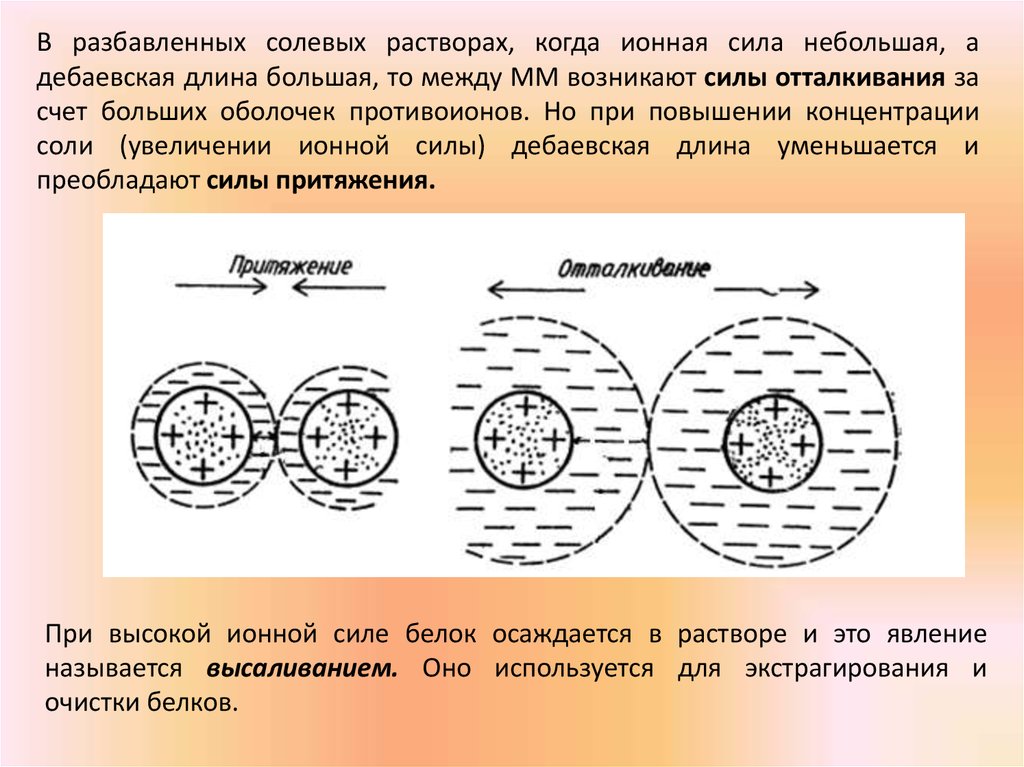
В разбавленных солевых растворах, когда ионная сила небольшая, адебаевская длина большая, то между ММ возникают силы отталкивания за
счет больших оболочек противоионов. Но при повышении концентрации
соли (увеличении ионной силы) дебаевская длина уменьшается и
преобладают силы притяжения.
При высокой ионной силе белок осаждается в растворе и это явление
называется высаливанием. Оно используется для экстрагирования и
очистки белков.
32.
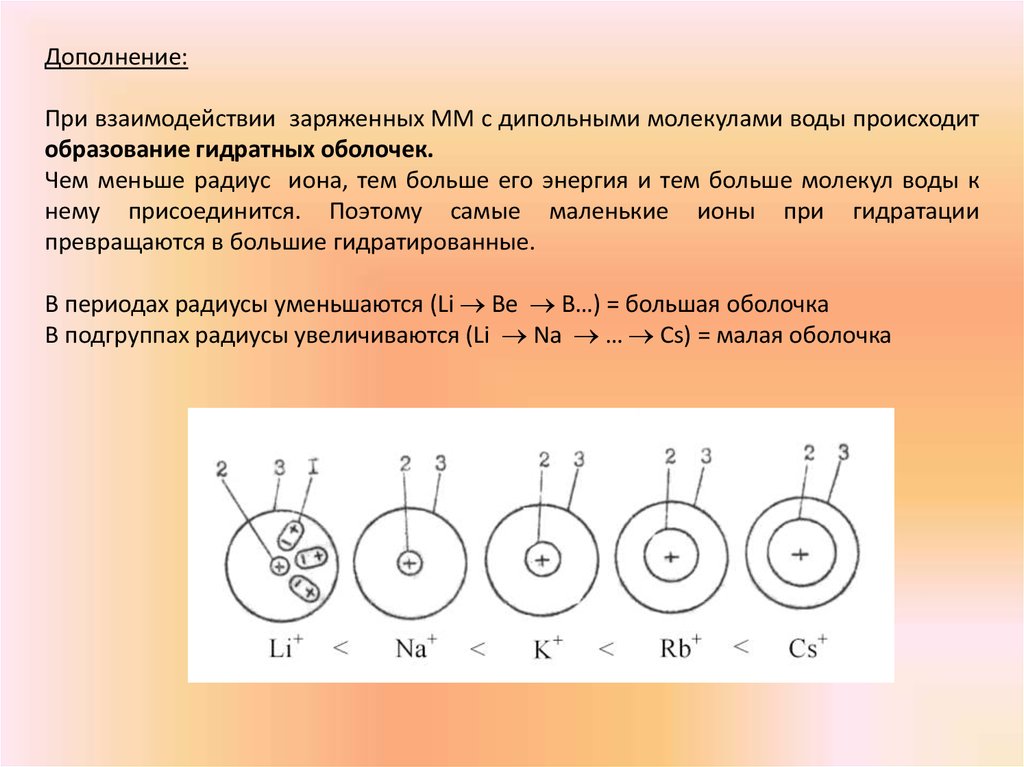
Дополнение:При взаимодействии заряженных ММ с дипольными молекулами воды происходит
образование гидратных оболочек.
Чем меньше радиус иона, тем больше его энергия и тем больше молекул воды к
нему присоединится. Поэтому самые маленькие ионы при гидратации
превращаются в большие гидратированные.
В периодах радиусы уменьшаются (Li Be B…) = большая оболочка
В подгруппах радиусы увеличиваются (Li Na … Cs) = малая оболочка
33.
Лекция №2«Конформация макромолекул.
Виды конформационных
перестроек»
16 февраля 2017 г. ауд. 205
13.50


















 Биология
Биология